Method Article
Yetişkin zebrafish kalp çalışması için intratorasik enjeksiyon
Bu Makalede
Özet
Bu yöntem, Yetişkin zebrafisinin toraks içine 0.5 − 3 μL solüsyonun enjekte edilmesine dayanır. Prosedür verimli organ zarar vermeden zebra balığı kalbin yakınlığı içine protein ve kimyasal bileşikler sunar. Yaklaşım, kalp çeşitli dokularda eksojen faktörlerin etkilerini test etmek için uygundur.
Özet
Yetişkin zebra balığı kalp kalp rejenerasyon araştırma güçlü bir model sağlar. Bu sistemin gücü transgenik yaklaşımlara dayalı olsa da, eksojen faktörlerin hızlı bir şekilde teslim edilmesi fonksiyonel çalışmalarda tamamlayıcı bir teknik sağlar. Burada, miyokard hasarına neden olmadan perikardial boşluğa birkaç mikrolitresindeki çözümün yönetimine dayanan bir yöntem sunuyoruz. İntrathoracic (It) enjeksiyonları verimli bir şekilde protein ve kimyasal bileşikler doğrudan kalp yüzeyine teslim edebilirsiniz. Enjekte edilen maddeler, altta yatan kardiyak dokulara Epikardiyuma aracılığıyla yayılır. İntraperitoneal (IP) enjeksiyonları ile karşılaştırıldığında, intratorasik enjeksiyonların ana avantajı hedef organ üzerinde test edilen faktörlerin odak yönetimi. Moleküllerin doğrudan perikardium içine teslim edilmesi, Yetişkin zebrafisinde kardiyak Önkoşullama ve rejenerasyon çalışmaları için uygun bir stratejidir.
Giriş
Omurates arasında, zebra balığı kalpleri1,2yeniden oluşturmak için dikkat çekici bir kapasiteye sahip. Bu yetenek çeşitli yaralanma modellerinde, yani ventriküler Apex rezeksiyon, kriyoyaralanma (CI) ve genetik kardiyomiyosit ablasyonu3,4,5,6,7' de bildirilmiştir. İnvaziv yaralanmalardan sonra, ventrikülün hasarlı duvarı, yeni Miyokardiyum8,9,10,11ile aşamalı olarak değiştirilen fibrotik doku ile sürekli olarak iyileşir. Erken yara şifa tepkisi Epikardiyuma aktivasyon ve bağışıklık hücrelerinin işe alma içerir12,13,14,15. Aynı şekilde, yaralı miyokard yakınlarındaki kardiyomiyositler aktif hale gelir, zarar görebilir, çoğalır ve 30 − 90 gün içinde16,17,18, 19. hücre-soy izleme analizi, indüklenebilir gen overexpression gibi genetik araçların mevcudiyeti sayesinde kardiyak rejenerasyonun moleküler ve hücresel mekanizmalarının deşifre edilmesi konusunda önemli gelişmeler elde edilmiştir. Floresan doku muhabiri hatları ve Crispr/Cas9 gen mutagenez20,21.
Geçenlerde torakotomi tarafından yetişkin zebra balığı kalp Önkoşullama bir model kurduk22,23. Önşartlandırma kardiyokoruyucu genlerin ifadesini arttırır ve yeniden girişini, bozulmamış ve yenileyici kalplerde hücre döngüsüne yükseltir. Bu süreçler bağışıklık hücrelerinin işe alma ile ilişkilidir ve matris remodeling22,24. Önşartlandırma mekanizmaları kötü anlaşılmalıdır ve bu araştırma alanını desteklemek için yeni tekniklerin kurulması gereklidir. Özellikle, salgılanmış sinyalizasyon proteinlerinin veya diğer kimyasal bileşiklerin optimize edilmiş yönetimi, bu konuyu daha fazla araştırmak için esastır.
Su hayvanları olmak, zebra balığı doğal olarak kendi solungaçları ve cilt yoluyla suda çözünmüş çeşitli maddeleri absorbe edebilir. Bu, farmakolojik inhibitörler, steroid hormonları, tamoksifen, BrdU ve antibiyotikler gibi çeşitli kimyasallar ile çözümlerde balık daldırma yoluyla non-invaziv ilaç teslimi için bir olasılık sunar. Gerçekten de, bizim25,26,27de dahil olmak üzere çeşitli laboratuvarlardan çok sayıda çalışmalar, özellikle rejeneratif biyoloji6 alanında değerli olan bu yöntem, faydalanıyor 28. Bu yaklaşım, ancak, PEPTITLER, DNA, RNA, morpholinos veya moleküllerin sınırlı bir doku geçirgenliği ile teslim etmek için uygun değildir. Bu durumlarda, vücudun içine mikroenjeksiyon ile daha verimli bir teslimat elde edilir, örneğin, kapiller Retro-orbital venöz sinüs içine ekleyerek, intraperitoneal veya İntraperikardiyal kavite içine29,30, 31' den itibaren. Burada, küçük bir miktar çözeltinin intrathoracik enjeksiyon bir prosedür tarif, uygun bir yöntem olarak kalp rejenerasyon ve yetişkin zebrafish Önkoşullama çalışma.
Protokol
Aşağıdaki protokolde açıklanan hayvan bakımı ve tüm hayvan prosedürleri, Isviçre Fribourg 'un Kanton veteriner ofisi tarafından onaylanmıştır.
1. enjeksiyon için araçlar ve çözümler
- Şekil 1a'ya göre iğne çektirme kullanarak mikroenjeksiyon adaptasyon borosilikat cam kapiller çekin. Mağaza model kil veya yapışkan bant raylar ile 9 cm Petri çanak kılcal çekti.
- Ortak makas kullanarak, bir sünger parçası (7 cm x 3 cm x 1 cm) kesmek ve ortasında bir balık gibi silüet bölmek.
- Test edilen proteinler veya diğer bileşikler ile enjeksiyon çözeltisi küçük plakaya hazırlayın. 1x Hanks dengeli tuz çözeltisi (HBSS)% 10 fenol kırmızı ile tamamlanan madde seyreltilerek tahlil üzerinde güvenilir bir şekilde konsantrasyon ayarlayın.
Not: Burada, test edilen protein konsantrasyonu 100 ng/mL idi. - Tamponlu tricaine anestezik bir stok çözüm hazırlamak için, 980 mL distile su içinde tricaine 4 g çözülür. 1 M Tris-HCl pH 9 kullanarak pH 'yi 7.0 − 7.4 olarak ayarlayın ve 1.000 mL 'ye kadar su ile doldurun. Çözümü 4 °C ' de karanlıkta saklayın.
- Anestezik çalışma konsantrasyonu elde etmek için, bir Beaker 50 mL balık suyu içine 1 − 2 mL tricaine stok çözüm ekleyin.
Not: Tricaine anestezik çalışma konsantrasyonu kullanmadan önce taze hazırlanmalıdır.
2. enjeksiyon ıstasyonunun hazırlanması
- Üstten ışık ile mikroskoptan açın ve 16X büyütme ayarlayın.
- Balık suyu ile sünger emmek, mikroskop aşamasında 9 cm Petri çanak üzerine yerleştirin ve odağı ayarlayın.
- Stereomikoscope altında, Şekil 1a'da gösterildiği gibi bir iridektomi makas kullanarak ~ 7 mm 'lik bir mikrokapiller sonunu kesebilir. İdeal uç çapı ~ 20 μm olacaktır.
Not: Kapiller ucunu eğik bir şekilde kesme dokuya eklemeler için idealdir. - Mikrokapiller mikroenjektör cihazının iğne tutucusuna yerleştirin.
- Microloader ipuçları kullanarak, 0,3 μL/s ve 0,5 μL/s arasında değişen uygun akışı elde etmek için enjeksiyon basıncını ayarlamak için bir kontrol çözümü (örneğin, 1x HBSS) yükleyin. iğneyi boşaltın.
- Enjeksiyon solüsyonunun seçilen hacmini (örn. 1x HBSS 'de seyreltilmiş siliyer nörotrofik faktör [CNTF]) kapiller ucunu (Şekil 1B) yükleyin. Kapiller içinde hava balonu olmamalı.
Not: Enjeksiyon çözeltisi maksimal hacmi balık boyutuna bağlıdır. 2.5 − 3 cm 'lik standart uzunlukta (burun 'tan kaudal pedalına kadar mesafe), fizyopatolojideki torasik şişlik ve kanamayı engelleyen maksimum enjeksiyon hacmi 5 μL (Şekil 1F) olarak belirlendi. Daha büyük hacimler daha büyük balıklara enjekte edilebilir.
3. Intrathoracic enjeksiyon için Balık hazırlanması
- Bir yetişkin zebra balığı (Danio rerio) bir net ile yakalamak ve anestezik çözüme aktarın.
- 1 − 2 dk sonra, balık yüzerken durur ve operculum 'un hareketi azalır, herhangi bir temas tepki vermez emin olmak için bir plastik kaşık ile balık dokunun.
- Hızlı ve dikkatle ıslak sünger oluk içine kaşık ile balık transfer, ventral yan yukarı. Balıkların kafası operatörün baskın eliyle uzağa işaret etmelidir.
4. Perikardium içine mikroenjeksiyon
- Stereomicroscope altında, dikkatle balık derisi altında dayak kalp hareketini gözlemlemek. Görsel olarak dayak kalbi üzerinde ve ventral kıkırdak plakaları tarafından tanımlanan üçgenin ortasında enjeksiyon noktasını belirleyin (Şekil 1D). Kapiller ucunu gövde eksenine göre 30 − 45 ° derece açıyla takın (Şekil 1E). Cildi yumuşak bir şekilde perikardium içine mikrokapiller ucu ile nüfuz eder (Şekil 1C). En iyi giriş noktası, karnına kafasından daha yakındır.
Not: Bu organ yaralanmasına neden olacak gibi, vücut ve kalp içine çok derin kapiller yerleştirmeyin. Kalp delinme durumunda, iğne genellikle kan ile doldurur. Bu durumda, kapiller çıkarın ve deneyden balık hariç. - İğne perikardium içinde olduğunda, mikroenjektör cihazının pedalına basarak tam enjeksiyon.
Not: Torasik boşluğa hava enjekte etmek için dikkatli olun. - Enjeksiyon sonra, yavaşça toraks gelen kapiller çekin ve hemen kurtarma için sistem suyu ile bir tank içine balık transfer.
- Anestezi toplam iyileşme kadar balık izleyin.
- İstenen zaman noktasında kalp toplayın ve daha fazla analiz için hazırlayın.
Not: Balık 30 s içinde operculum 'un hareketini devam etmez durumda, plastik bir pipet ile solungaçlara su sıkarak balık yeniden canlandırın.
Sonuçlar
İntratorasik (It) enjeksiyonları sonrasında, eksojen çözümün etkileri analiz edilebilir. Bu amaçla, balık ötenize edilmelidir ve kalpler toplanan, sabit ve histolojik olarak işlenen, önceden yayınlanmış protokoller göre32,33.
Yöntemi doğrulamak için, ilk olarak renk ve floresan boyalar enjekte ederek iki test deneyi gerçekleştirdik. İlk olarak, balık ve mortem ötenize 3 μL mürekkep toraks içine enjekte. Kalpleri 5 dakika sonra toplanan, fosfat-tamponlu tuz (PBS) yıkanmış,% 2 formalin sabit, PBS yıkanmış ve mikroskop altında fotoğraflandı. İkincisi, biz enjekte 3 μL 1 μg/mL 4 ′, 6-diamidino-2-phenylindole (DAPı) in vivo, ve sonra kalp sabit 2 h. Her iki konuda da, tüm montaj analizinde ventrikül, atriyum ve bulbus arteriozus da dahil olmak üzere tüm kalbin etiketlenmesi saptandı (Şekil 2a, B). Bu sonuçlar kalp yüzeyinde enjekte çözeltinin verimli yayılmasını ortaya çıkarır.
Eksojen maddelerin yetişkin balıklara teslim edilmesi için ortak bir protokol intraperitoneal (IP) enjeksiyonu olur. Kalp çalışmaları için BT karşı IP enjeksiyonları uygunluğu karşılaştırmak için, biz her iki yöntem kullanarak DAPı benzer bir miktar enjekte ve 5 dakika sonra kalpleri sabit ve 120 Min (Şekil 3A). Kalpler, phalloidin Alexa Fluor (AF) 568 ile lekelendiler ve kalp kaslarında F-actin etiketlerini oluşturmaktadır. Her iki zaman noktasında da IP enjeksiyonu sonrasında kalplerinde DAPı-pozitif hücreler görülmemiştir (Şekil 3B). Bunun aksine, BT enjeksiyonu miyokardiyumda DAPı etiketli çekirdeklerin varlığına neden oldu (Şekil 3B). Bu sonuçlar, It enjeksiyonu, IP enjeksiyonu ile karşılaştırıldığında, bileşik kalp için teslimat geliştirilmiş olduğunu göstermektedir.
Kalp rejenerasyon çalışmaları için bu yöntemin uygunluğu test etmek için, biz kriyoyaralı ventrikül8, ve yapılan It enjeksiyonları 3 μL 1 μg/ml DAPI ve 1 μg/ml phalloidin AF649 günde 3 ve 7 gün sonrası kriyoyaralanma (Dpci) (Şekil 4A). 1 h sonrası enjeksiyon, kalpleri toplanan, sabit, kesitli ve phalloidin ile lekelenmiş AF568 bozulmamış Miyokardiyum görselleştirmek için. Hem miyokard hem de yaralı dokuların çok sayıda DAPı pozitif hücresi içerdiğini, bu boyayı bozulmamış kalp ve fibrotik dokuya etkili bir şekilde nüfuz ettiğini tespit ettik (Şekil 4b). Ayrıca, enjekte edilen phalloidin AF649 de peri-yaralanma bölgesinin kardiyomiyositleri ve yaralı bölgenin bazı istihdam fibroblastları tarafından eklenmiştir. Bu deney ilaçlar Epikardiyuma çapraz ve altta yatan miyokard içine nüfuz olduğunu ortaya çıkarır.
Boya kullanarak BT enjeksiyonların verimliliğini test ettikten sonra, biz kalp enjekte proteinlerin etkilerini analiz. Biz bir sitokin sentezlenmiş, cntf denilen, hangi torakotomi sonra updüzenlenmiş24. Eksojen CNTF 'nin çeşitli süreçlerde etkilerini, yani kardiyomiyosit proliferasyonu, hücre dışı matris birikimi, bağışıklık hücresi alımı ve kardiyokoruyucu gen ifadesi araştırdık. Biz tüm bu biyolojik yönleri CNTF BT enjeksiyon tarafından aktif olduğunu bulundu, kontrol immünoglobulinler göre (Şekil 5)24. Bu sonuçlar, intratorasik enjeksiyon yönteminin çeşitli farklı kalp dokularında etkilerini incelemek için proteinlerin hedeflenen teslimat için uygun bir strateji sağladığını göstermektedir.
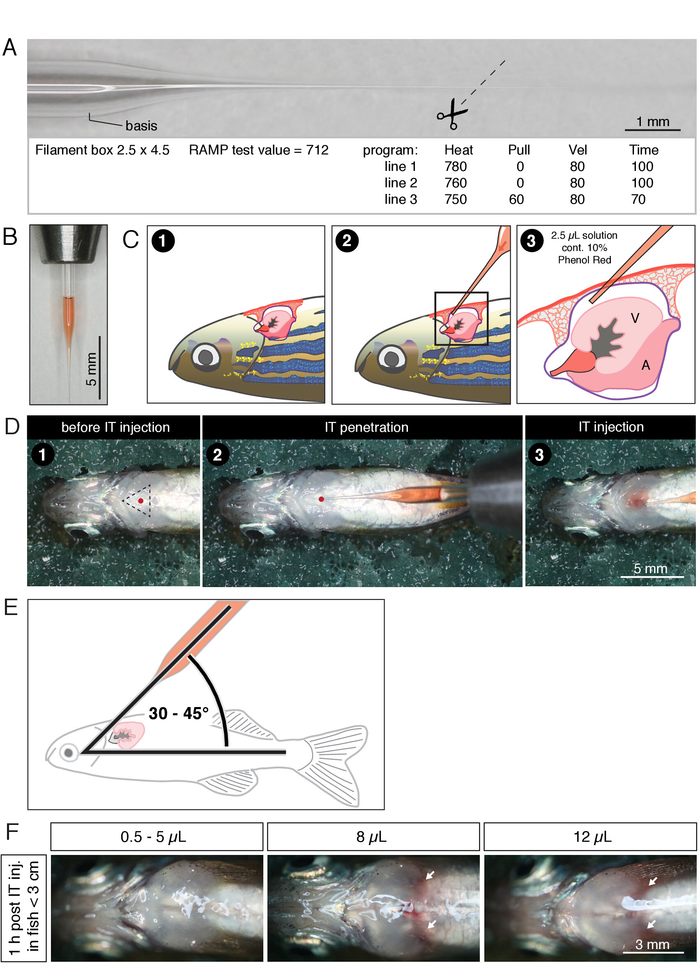
Şekil 1: yetişkin zebrafısında Intrathorascic (It) enjeksiyonu. (A) filament (6 ", 1,0 mm çapında) ve kullanılan iğne çektirme programının değerleri ile çekilen bir mikroenjeksiyon kapiller fotoğrafı. (B)% 10 fenol kırmızı Içeren 2,5 μL çözeltisi ile doldurulmuş, filament (6 ", 1,0 mm çapında) ile çekilen bir mikroenjeksiyon kapiller fotoğrafı. İğnenin çekilen ucu maksimum 7 mm uzunluğunda. (C) BT enjeksiyon prosedürün şematik temsili. (D) BT enjeksiyon prosedürün fotoğrafları. Bu rakam bise ve al.24' ten değiştirildi. C ve D panellerdeki sayılar prosedürün aynı adımlara karşılık gelir: (1) balık, nemlendirilmiş bir süngerle ventral tarafı yukarı yerleştirilir. Delinme sitesi (üçgen kırmızı nokta) solungaçlara yakın göğsünün merkezinde yer almaktadır. (2) iğne perikardium içine penetrasyon. Kırmızı nokta delinme sitesini gösterir. (3) enjeksiyon perikardial boşlukta kırmızı çözeltinin yayılması gözlemleyerek izlenir. (E) Bu enjeksiyon şeması. Enjeksiyon kapiller ve vücut ekseni arasındaki açı kalp delinme önlemek için 30 ° ve 45 ° arasında olmalıdır. (F) belirtilen HACIMLERIN BT enjeksiyonu sonrasında 1 saat içinde balık toraks fotoğrafları. Beyaz oklar, iç kanama gösterebilir, redish doku işaret ediyor. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
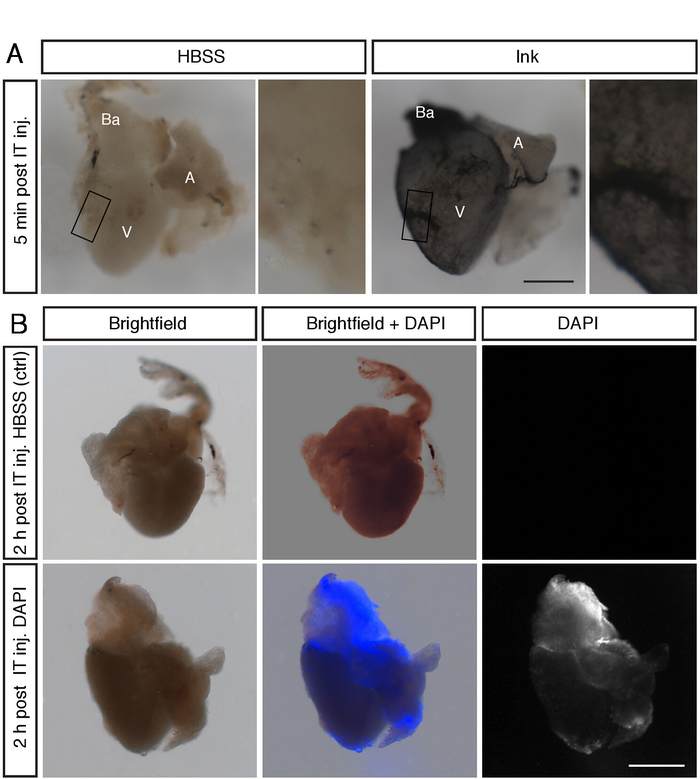
Şekil 2: It enjekte çözümleri kalp yüzeyine neredeyse eşit yayıldı. (A) 2,5 ΜL HBSS veya 2,5 μL mürekkepli Post-mortem It enjeksiyon maruz balık Tüm kalpleri stereomicroscope görüntüleri. Mürekkep ventrikül yüzeyi lekelenmiş (V), atriyum (A) ve bulbus arteriozus (BA). Ölçek çubuğu = 300 μm. (B) HBSS ve 3 μL 1 μg/ml dapi ile enjekte edilen balıkların tüm kalplerinin parlak alan ve floresan mikroskoptan görüntüleri. BT enjeksiyonu sonrasında kalp kısımlarında DAPı floresans tespit edilir. Ölçek çubuğu = 300 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .
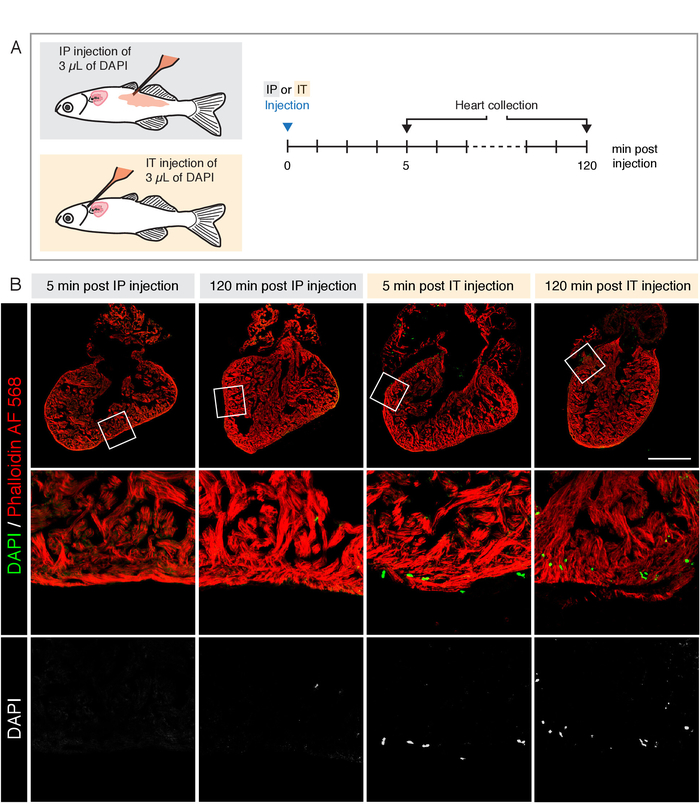
Şekil 3: DAPı 'nin kalbe teslimi için iki enjeksiyon yöntemin karşılaştırılması. (A) deneysel tasarım şeması. İntraperitoneal (IP) ve Intrathorascic (It) enjeksiyonları aynı miktarda 1 μg/mL DAPı (3 μL) ile yapılmıştır. Kalpler 5 ve 120 dk enjeksiyon sonra toplanır. (B) Floresan phalloidin (kırmızı) ile lekelenmiş kalp kısımlarının Konfokal mikroskopisi görüntüleri, kas liflerini bol miktarda Etiketler. Enjekte DAPı yeşil gösterilen uygun kanalda görselleştirildi. IP enjeksiyonu sonrasında, herhangi bir zaman noktasında DAPı kalp algılanmaz. It enjeksiyon sonra, DAPı pozitif hücreler ventrikül her iki zaman noktaları sonra mevcut. Ölçek çubuğu = 500 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .
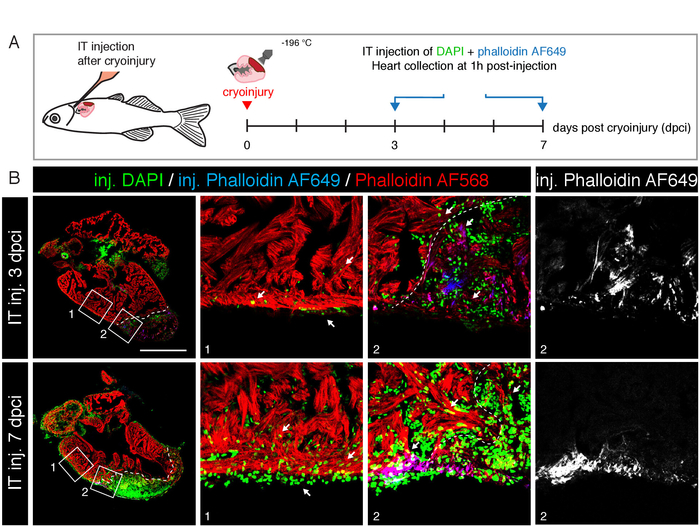
Şekil 4: kalp rejenerasyonunu incelemek IÇIN It enjeksiyonu. (A) deneysel tasarım şeması. Kriyoyaralanmanın ardından 3 ve 7 gün içinde DAPI ve phalloidin AF649 karışımı enjekte edildi (3 μL 1 μg/mL). Hearts, It enjeksiyon, sabit, kesitli ve phalloidin AF568 (kırmızı) ile lekelenmiş sonra 1 saat toplandı. (B) 3 ve 7 Dpci 'de uzunlamasına kalp kesitlerinin Konfokal mikroskopisi görüntüleri. Enjekte DAPı (yeşil) ve phalloidin AF649 (mavi) yaralı alanın etiket hücreleri (beyaz kesik çizgi ile sınırlandırılmış) ve bozulmamış Miyokardiyum (kırmızı boyama). Beyaz oklar DAPI (yeşil) dağılımı bozulmamış kompakt ve trabeküle miyokard ve epicardium aracılığıyla işaret ediyor. Ölçek çubuğu = 500 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .
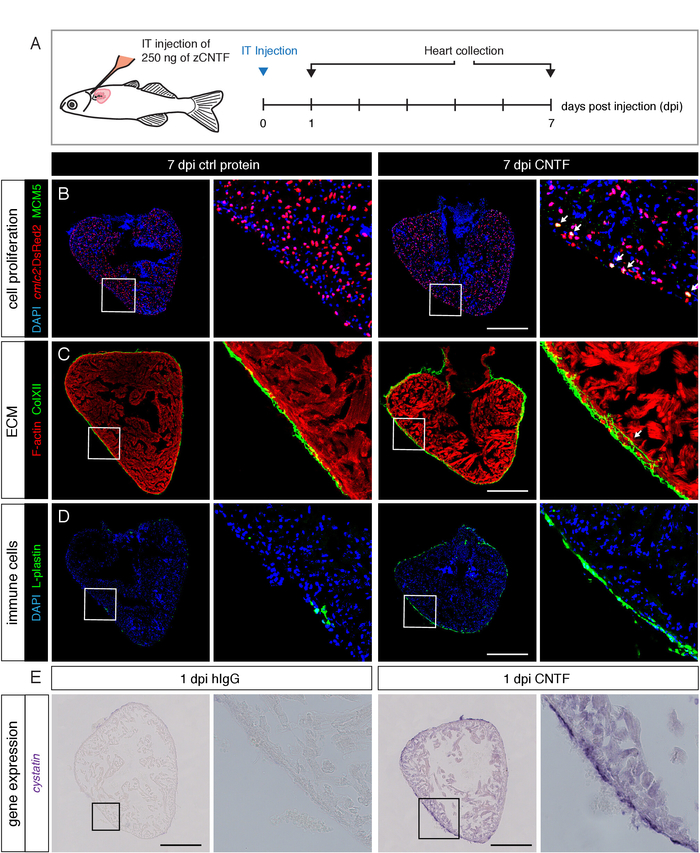
Şekil 5: eksojen It-enjekte CNTF kalp çeşitli biyolojik süreçleri uyarır. (A) deneysel tasarım şeması. İlk olarak, 2,5 mg zebra balığı cntf veya kontrol immunoglobulinler (Higg) 250 içeren bir solüsyonun μL 'sini, kardiyomiyositlerde nükleer DsRed2 ifade eden transjenik balıkların perikardyine enjekte edildi. Kalpler 7 ve 1 gün sonrası enjeksiyon (dpi) ve immünofluorescence ve situ hybridization tarafından analiz edildi, sırasıyla toplanır. (B-D) Kontrol ventriküler bölümleri ve CNTF-enjekte kalpleri Konfokal mikroskopisi görüntüleri. (B) bir hücre döngüsü işaretleyicisine karşı immünostasyon, minichromosome bakım kompleks bileşeni 5 (MCM5; yeşil), eksojen cntf 'ye yanıt olarak daha yüksek sayıda Proliferasyona kardiyomiyositler ortaya çıkarır. Ölçek çubuğu = 500 μm. (C) kollajen XII karşı immünostaj CNTF enjeksiyondan sonra miyokardiyumda kollajen XII birikimini artırdı gösterir. Kontrol kalp, kollajen XII Epikardiyuma34ile sınırlıdır. Ölçek çubuğu = 500 μm. (D) bağışıklık hücresi işaretleyicisine karşı Immünostatik, L-plastin, CNTF enjekte balık bağışıklık hücrelerinin gelişmiş bir işe algılamaktadır. Ölçek çubuğu = 500 μm. (E), kardiyokoruyucu bir faktör olan cystatin karşı bir antisens mRNA prob kullanarak situ hibridizasyon sonra ventriküler çapraz bölümlerin parlak alan mikroskop görüntüleri, kalp bu genin transkripsiyonel upregülasyonu görüntüler CNTF-enjekte balık. Ölçek çubuğu = 500 μm. Bu rakam bise ve al.24' ten değiştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Burada, Yetişkin zebrafish kalp üzerindeki etkilerini incelemek için perikardial boşluğa eksojen bileşikler ve proteinler sunmak için bir yöntem açıklanmaktadır. Prosedür intratorasik enjeksiyon dayanmaktadır, hangi organ çevresinde çözüm küçük bir hacim teslim sonuçlanır. Bu teknik, kardiyak Önkoşullama ve rejenerasyon eğitimi için geliştirilmiştir ve tanımlanmıştır.
Bu yordamdaki kritik adım, cam kapiller tarafından torasik boşluğa nüfuz etmektir. Bu adım, üç parametreye bağlıdır: kılcal ucunun sertlik ve keskinliği, penetrasyon açısı ve delinme alanı. Cilt üzerinden penetrasyon optimize etmek için, kapiller çekti parçası çok uzun olmamalıdır, bu tür iğneler çok esnek ve cilt ile temas Bend gibi. Bunu önlemek için, rijitlik iridektomi makas ile ucu boyutunu azaltarak uyarlanabilir. Penetrasyon açısı 30 ° ile 45 ° arasında farklılık gösterse de, ucun rijitliği ile adapte edilebilir. Nitekim, ince bir uç daha dar bir açı ile daha iyi cilt nüfuz edecektir.
İğne nüfuz optimize etmek için, ekleme sitesi dayak kalp hemen üzerinde olmalıdır. Kalp delinme riski genellikle% 5 ile% 8 arasında değişmektedir. Kalp arka iğne ekleme kalp delinme riskini artırır, gelişmiş kanama tarafından görüldüğü gibi. Bu gibi durumlarda, hayvanların deneylerden kaldırılması gerekir.
BT enjeksiyonu sırasında başka bir sorun kaynağı kapiller düzeyinde gerçekleşir. Aslında kapiller lateral kuvvetler üzerine uygulandığında kırabilir. Bunu önlemek için, iğne düz bir şekilde enjeksiyon ekseni boyunca hareket etmelidir. Bazen, kılcal sıvının akmasını engelleyen doku kalıntıları tarafından bloke edilebilir. İğne, enjekte ederken ucu hafifçe çekilerek bloke edilebilir. Bu akış artırmaz, biz tamamen toraks gelen iğne çekme ve iğne yerine öneririz.
Lezyonlar, perikardium 'da çok derinden takılan bir iğne ile kaynaklanabilir. Perikardial kesenin lezyonlarından kaçınmak için iğne, toraks içine çok fazla (1 − 2 mm) takılmalıdır. Enjeksiyon hacmi 8 μL 'den büyükse bazı sızıntılar gözlenmiştir.
Zebrafish 'de perikarkadran sıvısının tam bileşimi bilinmiyor. Ancak perikarkadran boşluğunun hacmi ~ 10 μL31olarak tahmin edilmektedir. Yetişkin zebra balığı ventrikül hacmi yaklaşık 1 − 2 mm3olduğu göz önüne alındığında, biz perikardial boşluğu buna göre küçük bir hacim olduğunu varsayalım, enjeksiyonları önce dikkate alınmalıdır. Ön çalışmalarımız sayesinde, enjekte edilen hacminin optimum yelpazesinin 0,5 ile 3 μL arasında, 2.5 − 2.8 cm (burun 'dan kaudal Pedaya kadar uzaklık) ölçümü için olduğunu tespit ettik. Bu hacim balık boyutuna bağlı olarak adapte edilebilir. 5 μL 'ye kadar enjeksiyon, bu büyüklükteki balıktaki herhangi bir lezyonu teşvik etmedi. Ancak 8 μL 'den gelen birimler Şekil 1F'de gösterildiği gibi şişkinlikte ve iç kanamaya neden olmak için yeterlidir. Bu verilere dayanarak, 3 μL 'den büyük bir çözüm miktarının organ üzerinde fiziksel ve fizyolojik strese neden olabileceğini tahmin ediyoruz. Bu sınırlama, enjekte edilen çözümün miktarını artırmak yerine moleküllerin daha yüksek bir konsantrasyon seçmek için ihtiyaç yorumlar.
Başka bir önemli faktör fizyolojik aralığında olmalıdır enjekte çözeltisi, osrotik özelliğidir. Nitekim, osrotik stres riskini önlemek için, enjeksiyon ortamı olarak HBSS öneririz.
Zebrafish 'de ilaçlar sunmak için kullanılan ortak Yöntemler su arıtma ve intraperitoneal enjeksiyon30,35. Bu tekniklerin her ikisi de birçok uygulama için uygun olmasına rağmen, BT enjeksiyonları istenmeyen sistemik yan etkilerin risklerini azaltarak ve pahalı moleküllerin kullanımını azaltarak deneysel ve ekonomik avantajlar sağlar. Bu yöntem, Cell Lineage izleme analizi için kullanılan CRE-ERT2 transgenik sistemi aktive etmek için tamoksifen teslimi için uygun olabilir ve rejenerasyon araştırmalarında fonksiyonel çalışmalar için modifiye Rnas Kılavuzu.
Zebra balığı 'teki It-enjeksiyon yöntemi daha önce31,36. Bu raporlarda intratorasik enjeksiyonlar, ön taraftan Delinen insülin iğnesi ile yapılmıştır. Buna karşılık, protokolün posterior yönde yerleştirilen çekilen cam kapiller ile alternatif bir strateji sunar. Özellikle, bizim yaklaşım dikkate balık perikardium anatomisi kalp delinme düşük risk ile enjeksiyon optimize etmek için alır. Ayrıca, prosedür sırasında, balık metalik forseps tarafından tutulmaz, ancak bir nemli ve yumuşak sünger, hangi balık herhangi bir dış yaralanma önlemek için daha uygun bir yöntemdir. Böylece, sunulan yöntem daha iyi kardiyak homeostaz çalışmaları için uygun olabilir, Önkoşullama ve yetişkin zebrafish rejenerasyon.
It enjeksiyonları zaten memeli model organizmalarda kurulmuştur. Gerçekten de bu yöntem, insanlarda37,38, domuz ve klinik çalışmalar ile deneyler de uygulandı. Farelerde, ultrasonlar tarafından yönlendirilen transtorasik intramilokarkadran enjeksiyonları kalp39meydan okumak için kullanılmıştır. Bu makalede biz zebrafish için BT enjeksiyon kullanımını kolaylaştırmak için ayrıntılı bir protokol öneriyoruz. Bu, kardiyak homeostasis, önşartlandırma ve rejenerasyon araştırmalarında genetik yaklaşımların tamamlayıcı olması amacıyla, özellikle alan için değerli olacaktır.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
V. Zimmermann 'a mükemmel teknik yardım ve balık bakımı için teşekkür ederiz, D. König (Fribourg Üniversitesi) el yazması kritik okuma için, D. Kressler (Fribourg Üniversitesi) zCNTF protein sentezi ile yardım için, F. Ruggiero (Institut de Génomique Fonctionnelle de Lyon) ColXII antikor sağlamak için, ve P. Martin (Bristol Üniversitesi) L-plastin antikor için. Fribourg Üniversitesi 'nde görüntüleme çekirdeği tesisi ve proteomik platformuna teşekkür ederiz. Bu çalışma Isviçre Ulusal Bilim Vakfı, Grant numarası 310030_179213 ve Schweizerische Herzstiftung (Swiss Heart Foundation) tarafından destekleniyordu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hanks Balanced Salt Solution | Gibco by Life technology | 14065-056 | |
| Iridectomy scissor | Roboz Surgical Instruments Co | RS-5602 | |
| Macroscope (binocular) | M400 | with Apozoom | |
| Micro-injector femtojet | Eppendorf | 5247 0034 77 | |
| Microloaders femtotips | Eppendorf | 5242 956.003 | |
| Micropipette glass needles type C | WPI | TW100F-6 | thin-wall capillary |
| Micropipette puller model P-87 | Flaming/Brown | 20081016 | filament box 2.5 mm x 4.5 mm |
| Sponge | any | any | dim. carved sponge 7cm x 3 cm x 1 cm |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | Company | Catalog Number | Comments |
| anti-Chicken Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Guinea pig Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Rabbit Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| Chicken l-plastin | gift from P. Martin, Bristol | Concentration: 1/1,000 | |
| DAPI | Sigma | 10236276001 | Concentration: 1/2,000 (1µg/ml); 1/100 IT injected |
| Guinea pig anti-ColXII | gift from Florence Ruggerio, Lyon | Concentration: 1/500 | |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1/500 |
| Phalloidin-Atto-647 (F-actin) | Sigma | 95906 | Concentration: 1/50 IT injected |
| Rabbit anti-MCM5 | gift from Soojin Ryu, Heidelberg | Concentration: 1/500 | |
| Stamping Ink 4K | Pelikan | 1 4k 351 197 | Concentration: 1/1 |
| ISH probe primers | |||
| Cystatin | gene number: ENSDARG00000074425 fw primer: GATTCACTGTCGGGTTTGGG Rev primer: ATTGGGTCCATGGTGACCTC |
Referanslar
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Iismaa, S. E., et al. Comparative regenerative mechanisms across different mammalian tissues. npj Regenerative Medicine. 3 (1), (2018).
- Xiang, M. S. W., Kikuchi, K. Endogenous Mechanisms of Cardiac Regeneration. Int Rev Cell Mol Biol. 326, 67-131 (2016).
- González-Rosa, J. M., Burns, C. E., Burns, C. G. Zebrafish heart regeneration: 15 years of discoveries. Regeneration. 4 (3), 105-123 (2017).
- Jazwinska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. The Journal of Pathology. 238 (2), 233-246 (2016).
- Sehring, I. M., Jahn, C., Weidinger, G. Zebrafish fin and heart: what's special about regeneration?. Current Opinion in Genetics & Development. 40, 48-56 (2016).
- Rubin, N., Harrison, M. R., Krainock, M., Kim, R., Lien, C. L. Recent advancements in understanding endogenous heart regeneration-insights from adult zebrafish and neonatal mice. Seminars in Cell and Developmental Biology. 58, 34-40 (2016).
- Chablais, F., Veit, J., Rainer, G., Jazwinska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nature Reviews Cardiology. 15 (10), 631-647 (2018).
- Andres-Delgado, L., Mercader, N. Interplay between cardiac function and heart development. Biochim Biophys Acta. 1863, 1707-1716 (2016).
- Richardson, R. J. Parallels between vertebrate cardiac and cutaneous wound healing and regeneration. npj Regenerative Medicine. 3, 21 (2018).
- Lai, S. -. L., Marín-Juez, R., Stainier, D. Y. R. Immune responses in cardiac repair and regeneration: a comparative point of view. Cellular and Molecular Life Sciences. , (2018).
- Kikuchi, K., et al. Primary contribution to zebrafish heart regeneration by gata4(+) cardiomyocytes. Nature. 464 (7288), 601-605 (2010).
- Jopling, C., et al. Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature. 464 (7288), 606-609 (2010).
- Pfefferli, C., Jaźwińska, A. The careg element reveals a common regulation of regeneration in the zebrafish myocardium and fin. Nature Communications. 8, 15151 (2017).
- Sánchez-Iranzo, H., et al. Tbx5a lineage tracing shows cardiomyocyte plasticity during zebrafish heart regeneration. Nature Communications. 9 (1), (2018).
- Wang, J., Poss, K. D. Methodologies for Inducing Cardiac Injury and Assaying Regeneration in Adult Zebrafish. Methods In Molecular Medicine. 1451, 225-235 (2016).
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97 (3), 889-938 (2017).
- de Preux Charles, A. S., Bise, T., Baier, F., Marro, J., Jazwinska, A. Distinct effects of inflammation on preconditioning and regeneration of the adult zebrafish heart. Open Biology. 6 (7), (2016).
- de Preux Charles, A. S., Bise, T., Baier, F., Sallin, P., Jazwinska, A. Preconditioning boosts regenerative programmes in the adult zebrafish heart. Open Biology. 6 (7), (2016).
- Bise, T., de Preux Charles, A. S., Jazwinska, A. Ciliary neurotrophic factor stimulates cardioprotection and the proliferative activity in the zebrafish adult heart. npj Regenerative Medicine. 4, (2019).
- Thorimbert, V., Konig, D., Marro, J., Ruggiero, F., Jazwinska, A. Bone morphogenetic protein signaling promotes morphogenesis of blood vessels, wound epidermis, and actinotrichia during fin regeneration in zebrafish. The FASEB Journal. 29 (10), 4299-4312 (2015).
- König, D., Page, L., Chassot, B., Jaźwińska, A. Dynamics of actinotrichia regeneration in the adult zebrafish fin. Developmental Biology. 433 (2), 416-432 (2018).
- Sallin, P., Jaźwińska, A. Acute stress is detrimental to heart regeneration in zebrafish. Open Biology. 6 (3), 160012 (2016).
- Mokalled, M. H., Poss, K. D. A Regeneration Toolkit. Developmental Cell. 47 (3), 267-280 (2018).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital Injection in Adult Zebrafish. Journal of Visualized Experiments. (34), e1645 (2009).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal Injection into Adult Zebrafish. Journal of Visualized Experiments. (42), (2010).
- Xiao, C., et al. Nanoparticle-mediated siRNA Gene-silencing in Adult Zebrafish Heart. Journal of Visualized Experiments. (137), (2018).
- Chablais, F., Jazwinska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), (2012).
- Gonzalez-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7 (4), 782-788 (2012).
- Marro, J., Pfefferli, C., de Preux Charles, A. S., Bise, T., Jazwinska, A. Collagen XII Contributes to Epicardial and Connective Tissues in the Zebrafish Heart during Ontogenesis and Regeneration. PLoS One. 11 (10), e0165497 (2016).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A Doxorubicin-induced Cardiomyopathy Model in Adult Zebrafish. Journal of Visualized Experiments. (136), (2018).
- Diao, J., et al. PEG-PLA nanoparticles facilitate siRNA knockdown in adult zebrafish heart. Developmental Biology. 406 (2), 196-202 (2015).
- Lloyd, L. C., Etheridge, J. R. The pathological and serological response induced in pigs by parenteral inoculation of Mycoplasma hyopneumoniae. Journal of Comparative Pathology. 91 (1), 77-83 (1981).
- Zhou, A., Guo, L., Tang, L. Effect of an intrathoracic injection of sodium hyaluronic acid on the prevention of pleural thickening in excess fluid of tuberculous thoracic cavity. Clinical and Experimental Pharmacology and Physiology. 30 (3), 203-205 (2003).
- Prendiville, T. W., et al. Ultrasound-guided Transthoracic Intramyocardial Injection in Mice. Journal of Visualized Experiments. (90), (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır