Method Article
Интраторакальная инъекция для изучения взрослого сердца рыбы данио
В этой статье
Резюме
Этот метод опирается на инъекцию 0,5 − 3 мкл раствора в грудную клетку взрослой рыбы данио. Процедура эффективно доставляет белки и химические соединения в близость рыбьего сердца данио без повреждения органа. Подход подходит для тестирования воздействия экзогенных факторов на различные ткани сердца.
Аннотация
Сердце для взрослых рыб-данио является мощной моделью в исследованиях сердечной регенерации. Хотя прочность этой системы основывается на трансгенных подходах, быстрая доставка экзогенных факторов обеспечивает дополнительную технику в функциональных исследованиях. Здесь мы представляем метод, который опирается на введение нескольких микролитров раствора в перикардиальную полость, не вызывая повреждений миокарда. Внутриторакальные (IT) инъекции могут эффективно доставлять белки и химические соединения непосредственно на сердечную поверхность. Вводные вещества диффундируют через эпикардиум в глубинные ткани сердца. По сравнению с инъекциями интраперитонеальная (IP) основным преимуществом интраторакальных инъекций является координационное управление тестированных факторов на целевом органе. Доставка молекул непосредственно в перикард является подходящей стратегией для исследований сердечной подготовленности и регенерации у взрослых рыбок данио.
Введение
Среди позвоночных, данио рыбы обладают замечательной способностью к регенерации их сердцах1,2. Эта способность была сообщены в нескольких моделях травм, а именно: резекция желудочка, криатравма (CI) и генетическая кардиелоцитарную абляции3,4,5,6,7. После инвазивных травм поврежденная стена желудочка переходит в невременное исцеление фиброзных тканей, которые постепенно заменяются новым миокард8,9,10,11. Раннее заживление ран ответ включает эпикардия активации и набора иммунных клеток12,13,14,15. Параллельно, кардиомиоциты возле травмированного миокардия активируются, деразличают, размножаются и постепенно заменяют раненую область в течение 30 − 90 дней16,17,18, 19. значительный прогресс в расшифровке молекулярных и клеточных механизмов регенерации сердца был достигнут благодаря наличию генетических средств, таких как анализ трассировки клеток, индуцирующий экспрессию генов, линии флуоресцентной ткани репортер, и криср/Cas9 гена мутагенеза20,21.
Недавно мы установили модель сердечной предварительной подготовки во взрослой рыбе данио, торакотомии22,23. Preconditioning увеличивает экспрессию кардиопротективных генов и поднимает повторный вход в клеточный цикл в неповрежденными и восстанавливающих сердцах. Эти процессы связаны с набором иммунных клеток и матричных ремоделирования22,24. Механизмы предварительной подготовки плохо изучены, и для содействия этой области исследований требуется создание новых методов. В частности, оптимизированное управление секретируемых сигнальных белков или других химических соединений имеет важное значение для дальнейшего изучения этой темы.
Будучи водными животными, рыба данио может естественным образом поглощать различные вещества, растворенные в воде через их жабры и кожу. Это дает возможность для неинвазивной доставки лекарств через погружение рыбы в растворах с различными химическими веществами, такими как фармакологические ингибиторы, стероидные гормоны, тамоксифен, BrdU и антибиотики. Действительно, многочисленные исследования из различных лабораторий, в том числе наши25,26,27, воспользовались этим методом, который является особенно ценным в области регенеративной биологии6, 28. Однако этот подход не подходит для доставки пептидов, ДНК, РНК, морфолинос или молекул с ограниченной проницаемостью тканей. В этих случаях более эффективная доставка достигается путем микроинъекции в организм, например, путем вставки капилляра в ретроорбитальный венозный пазух, в интраперитонеальная или интрапермикардиальной полости29,30, 31. Здесь мы описываем процедуру внутриторакальной инъекции небольшого количества раствора, в качестве подходящего метода для изучения регенерации сердца и предкондиционирования у взрослых рыб данио.
протокол
Уход за животными и все ветеринарные процедуры, описанные в следующем протоколе, были одобрены кантональной ветеринарной службой в Фрибурге, Швейцария.
1. инструменты и решения для инъекций
- Потяните микроинъекции-адаптированный боросиликатного стекла капилляров использованием иглы съемник в соответствии с фигурой 1A. Магазин вытащил капилляры в 9 см чашку Петри с рельсами моделирования глины или клейкой лентой.
- Используя общие ножницы, вырезать кусок губки (7 см х 3 см х 1 см) и вырезать рыбы, как силуэт в его середине.
- Подготовьте малые аликвотов раствор впрыска с испытано протеинами или другими соединениями. Отрегулируйте их концентрацию зависимо от анализа путем разбавления вещества в 1x Хэнкс сбалансированное солевой раствор (ГБСС) дополняется 10% фенола красный.
Примечание: Здесь концентрация протестированных белков составила 100 нг/мл. - Для подготовки фондового решения в буфером обезболивающих препаратов, растворить 4 г трик в 980 мл дистиллированной воды. Отрегулируйте рН до 7 − 7,4 с использованием 1 м рис-совместимого рН 9, и залить водой до 1 000 mL. Храните раствор в темноте при температуре 4 °C.
- Для получения рабочей концентрации анестетиков, добавьте 1 − 2 мл раствора триколейна в 50 мл рыбы воды в стакане.
Примечание: Рабочая концентрация триками анестетиков должны быть подготовлены свежезаваренным перед использованием.
2. Подготовка станции впрыска
- Включите стереомикроскопов светом сверху и отрегулируйте увеличение до 16x.
- Замочите губку с рыбой воды, поместите его на 9 см чашку Петри на стадии микроскопа и корректировать фокус.
- Под стереомикроскопов, вырезать конце микрокапилляра на ~ 7 мм от основания с помощью ножниц иридетомии, как показано на рисунке 1A. Идеальный диаметр наконечника будет ~ 20 мкм.
Примечание: Резка кончик капилляра в косой путь является оптимальным для вставки в ткани. - Вставьте микрокапилляры в держатель иглы микроинжектор аппарата.
- С помощью микропогрузчиков, загрузите Контрольное решение (например, 1x ГБСС), чтобы настроить давление инъекций, для того чтобы получить соответствующий поток в диапазоне от 0,3 мкл/с и 0,5 мкл/с. опорожнить иглу.
- Загрузите выбранный объем раствора инъекции (например, килиарный нейротрофический фактор [CNTF], разбавленный в 1x ГБСС) в кончик капилляра (рис. 1x). В капилляра не должно быть воздушного пузыря.
Примечание: Максимальный объем раствора инъекций зависит от размера рыбы. Для стандартной длины 2,5 − 3 см (расстояние от морды до хвостового педункул) максимальный объем впрыска, который предотвращает избыточно грудной отек и кровотечение, определяется как 5 мкл (Рисунок 1F). Большие тома можно было бы впрыснуть к более большой рыбе.
3. приготовление рыбы для Внутриторакальной инъекции
- Поймать взрослого рыбуданио рерио) с сеткой и передать его в анестезирующее раствор.
- После 1 − 2 мин, когда рыба перестает плавать и движение Оперкулум уменьшается, прикоснуться к рыбе с пластиковой ложкой, чтобы убедиться, что она не реагирует на любой контакт.
- Быстро и осторожно перенести рыбу с ложкой в паз мокрой губкой, с брюшной стороной вверх. Головка рыб должна указать далеко от доминантной руки оператора.
4. микроинъекции в перикард
- Под стереомикроскопов внимательно наблюдайте за движением бьющееся сердце под кожей рыбы. Визуально определить точку инъекции выше бьющееся сердце и в середине треугольника определяется брюшной хрящевой пластины (рис. 1D). Вставьте кончик капилляра при температуре 30 − 45 ° градусов по отношению к оси тела (рис.1E). Аккуратно проникнуть в кожу с кончика микрокапилляра в перикард (рис. 1C). Оптимальная точка входа ближе к животу, чем к голове.
Примечание: Не вставляйте капилляры слишком глубоко в тело и сердце, так как это вызовет повреждение органа. В случае прокола сердца игла обычно наполняется кровью. Если это произойдет, удалите капилляры и исключить рыбу из эксперимента. - После того как игла находится внутри перикард, завершите инъекцию, нажав педаль устройства микроинжектор.
Примечание: Будьте осторожны, чтобы не вводить воздух в грудной полости. - После инъекции аккуратно вывести капилляры из грудной клетки и немедленно перевести рыбу в бак с системой воды для восстановления.
- Наблюдение за рыбой до полного выздоровления от анестезии.
- Соберите сердце в нужную точку времени и подготовьте его для дальнейшего анализа.
Примечание: В случае, если рыба не возобновляет движение оперкулума в течение 30-х годов, реанимировать рыбу, сжимая воду в жабры с пластиковой пипеткой.
Результаты
После интраторакальных (ИТ) инъекций, эффекты экзогенного решения могут быть проанализированы. Для этого рыба должна быть умерщвлены, а сердца собраны, исправлены и гистологически обработаны, согласно ранее опубликованным протоколам32,33.
Для подтверждения метода сначала мы провели два тестовых эксперимента, вводя цветные и флуоресцентные красители. Сначала мы усыпляли рыбу и посмертные вводили 3 мкл чернил в грудную клетку. Сердца были собраны после 5 минут, промывают в фосфат-буферизованные физиологический раствор (PBS), фиксируется в 2% формалин, промывают в PBS и сфотографировали под микроскопом. Во-вторых, мы вводили 3 мкл 1 мкг/мл 4 ', 6-диамидино-2-фенилиндоле (DAPI) в естественных условиях, и установил сердце после 2 ч. В обоих анализов, весь-гора анализ показал маркировки всего сердца, включая желудочка, атриум и бульбус артериальный (рис.2A, B). Эти результаты показывают эффективное распространение инъекцию раствора на сердечную поверхность.
Общим протоколом для поставки экзогенного вещества в взрослую рыбу является инъекция интраперитонеальная (IP). Чтобы сравнить пригодность ИТ против инъекций IP для исследования сердца, мы вводили аналогичное количество DAPI с использованием обоих методов и фиксированной сердца после 5 минут и 120 мин (Рисунок 3A). Сердца были секционные и окрашенных Фаллоидин Alexa Fluor (AF) 568, что этикетки F-Actin в сердечной мышце. Нет DAPI-положительных клеток наблюдались в сердцах после инъекции IP в обоих точках времени (рисунок 3B). В противоположность этому, инъекция в ИТ привела к наличию ядер маркированные DAPI в миокард (рисунок 3B). Эти результаты показывают, что инъекция в ИТ улучшила доставку соединения к сердцу, по сравнению с инъекцией IP.
Для проверки пригодности этого метода для исследований регенерации сердца, мы криотравмированных желудочков8, и выполнил его инъекции 3 мкл 1 мкг/мл DAPI и 1 мкг/мл Фаллоидин AF649 на 3 и 7 дней после-Криноповреждения (рис. 4A). В 1 ч после инъекции, сердца были собраны, фиксированные, секционные и окрашивали с фалалидин AF568 визуализировать нетронутыми миокард. Мы обнаружили, что и миокард и травмированных тканей, содержащихся многочисленные DAPI положительных клеток, что указывает на эффективное проникновение этого красителя в неповрежденном сердце и фиброзных тканей (рис. 4B). Кроме того, введенный Фаллоидин AF649 также был включен кардиомиоцитами зоны, находящейся в зоне поражения, и некоторыми завербованных фибробласты из зоны ранения. Этот эксперимент показывает, что наркотики могут пересечь эпикардиум и проникнуть в основной миокард.
После тестирования эффективности ИТ-инъекций с использованием красителей, мы проанализировали эффекты инъекций белков на сердце. Мы синтезировали цитокинов, называемый CNTF, который upregulated после торакотомии24. Мы исследовали влияние экзогенных CNTF на различные процессы, а именно: кардиогенного распространения, внеклеточной матрицы осаждения, иммунного набора клеток и кардиопротективные экспрессии генов. Мы обнаружили, что все эти биологические аспекты были активированы ИТ-инъекцией CNTF, по сравнению с контролем иммуноглобуллинов (рис. 5)24. Эти результаты показывают, что метод интраторакальной инъекции обеспечивает подходящую стратегию для целенаправленной доставки белков для изучения их воздействия на различные ткани сердца в различных анализов.
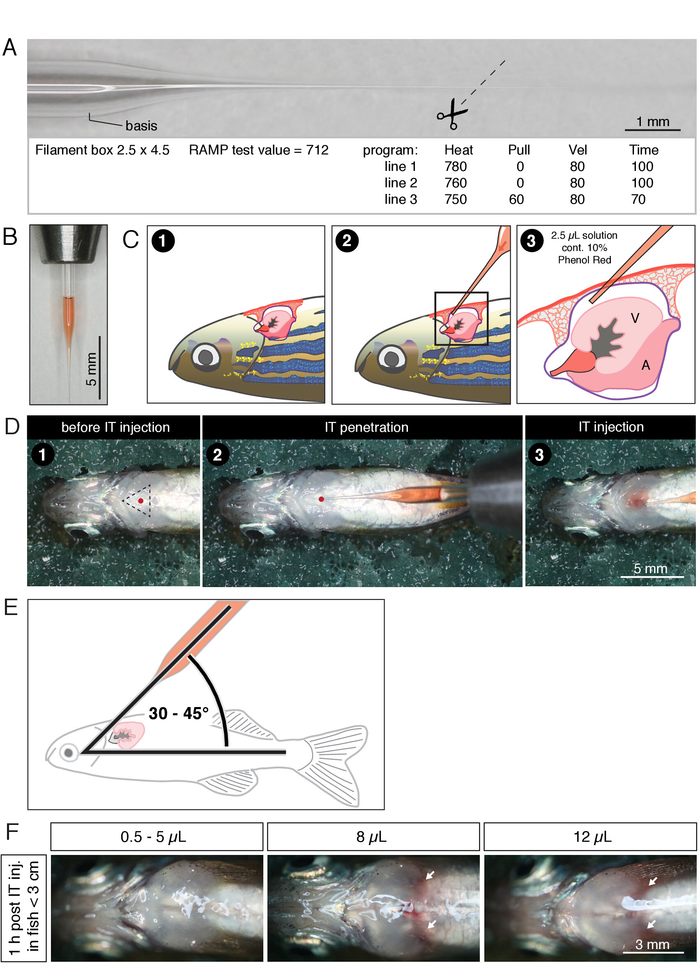
Рисунок 1: Интраторацовая (IT) инъекция у взрослых рыб данио. A) фотография тянутого микроинъекции капилляра с нитью (6 ", 1,0 мм в диаметре) и значениями используемой программы для иглы съемника. (B) фотография вытащил микроинъекции капилляра с нитью (6 ", 1,0 мм в диаметре) заполнены с 2,5 мкл раствора, содержащего 10% фенола красный. Вытягивается кончик иглы максимально 7 мм длиной. C) схематическое представление процедуры внедрения ИТ-инъекций. D) фотографии процедуры внедрения ИТ-инъекций. Эта цифра была изменена с Bise et al.24. Числа в панелях C и D соответствуют тем же ступеням процедуры: (1) рыба помещается в брюшной сторону на увлажненный губкой. Место прокола (красная точка в треугольнике) расположено в центре грудной клетки рядом с жабрами. (2) проникновение иглы в перикард. Красная точка указывает на место прокола. (3) инъекция контролируется путем наблюдения за распространением Красного раствора в перикариральной полости. (E) схема его инъекции. Угол между инъекцией капилляров и оси тела должен быть между 30 ° и 45 °, чтобы избежать прокола сердца. F) фотографии с торакса рыбы в течение 1 часа после введения ИТ указанных объемов. Белые стрелки указывают на ткань, которая может указывать на внутреннее кровотечение. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
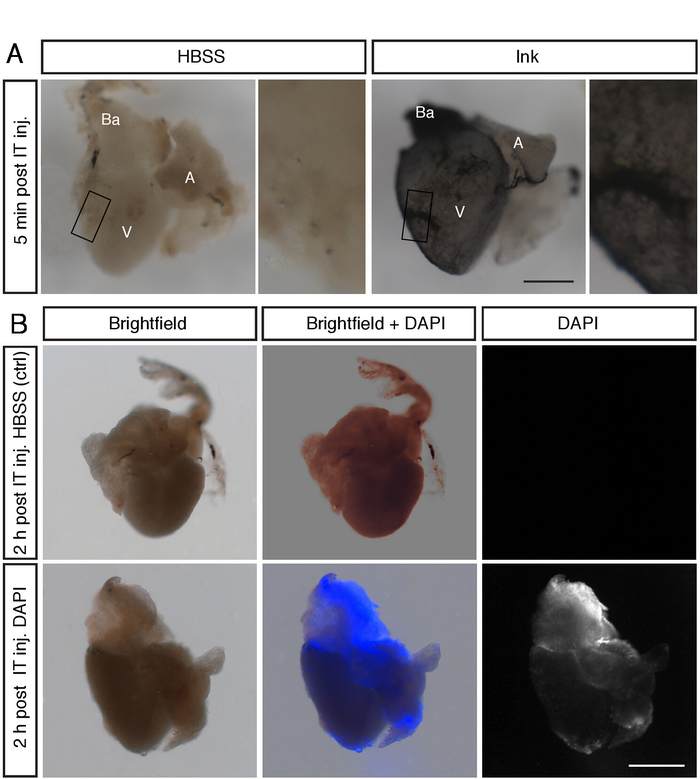
Рисунок 2: IT-инъекции растворы распространяются почти равномерно на сердечную поверхность. (A) стереомикроскопов изображения целых сердец рыб, подвергшихся ПОСМЕРТНОЕ ИТ-инъекции с 2,5 мкл ГБСС или 2,5 мкл чернил. Чернила окрашивали поверхность желудочка (V), предсердия (A) и бульбус артериальный (BA). Шкала планка = 300 мкм.b) ярко-полевые и флуоресцентные стереомикроскопов изображения целых сердец рыб, ПОДВЕРГАНЫХ ИТ-инъекции с ГБСС и 3 мкл 1 мкг/мл DAPI. Флуоресценция DAPI обнаруживается на частях сердца вскоре после инъекции. Шкала планка = 300 мкм. пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
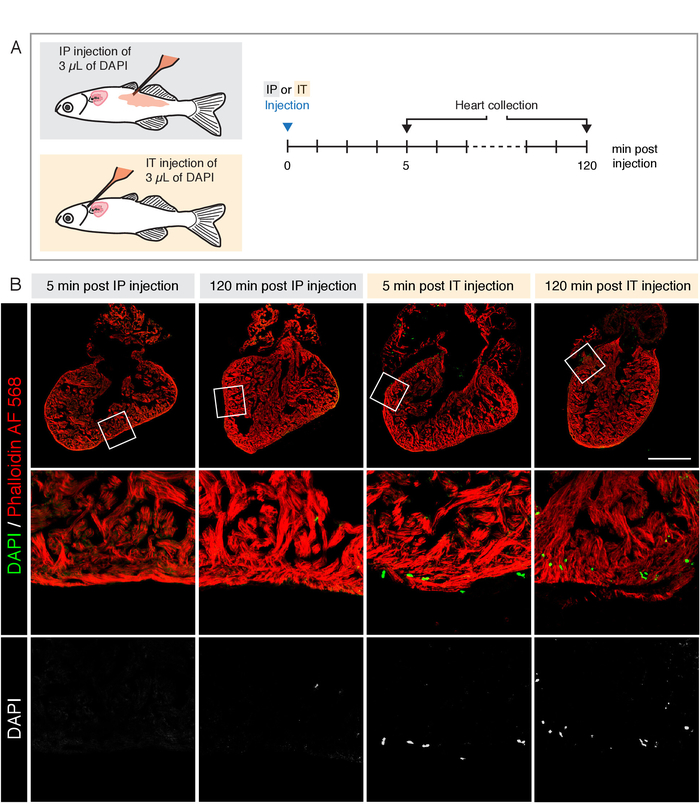
Рисунок 3: сравнение двух методов инъекции для доставки DAPI в сердце. А) схема экспериментального проектирования. Интраперитонеальная (IP) и Интратораскаты (ИТ) инъекции проводились с одинаковым объемом 1 мкг/мл DAPI (3 мкл). Сердца были собраны в 5 и 120 мин после инъекции. (B) кофокальная микроскопия изображения разделов сердца, окрашенных люминесцентными фалиддин (красный), что обильно этикетки мышечных волокон. Введенный DAPI был визуализирован в соответствующем канале, показаном зеленым цветом. После инъекции IP, DAPI не обнаруживается в сердце в любой момент времени. После ИТ-инъекции, DAPI положительные клетки присутствуют в желудочке после обоих точек времени. Шкала планка = 500 мкм. пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
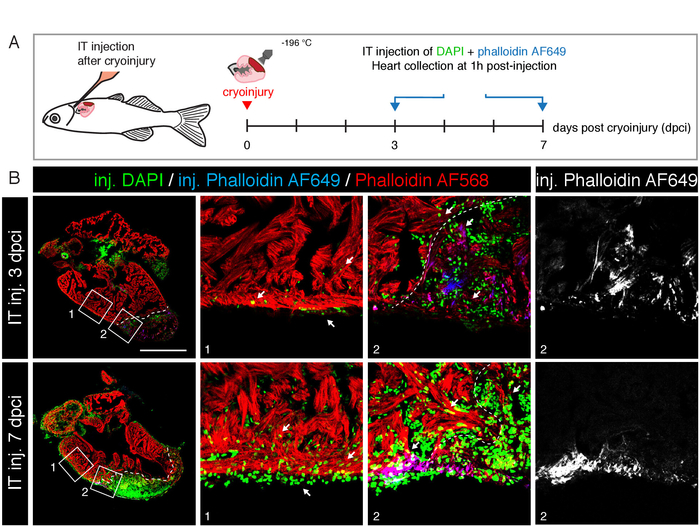
Рисунок 4: ИТ-инъекция для изучения регенерации сердца. А) схема экспериментального проектирования. На 3 и 7 дней после криоповреждения, смесь DAPI и AF649 был он-впрыснуто (3 мкл 1 мкг/мл). Сердечки собирали через 1 час после инъекции, фиксировались, секционные и окрашивали Фаллоидин AF568 (красный). B) изображения конфокальной микроскопии продольных отделов сердца в 3 и 7 ддки. Вводят DAPI (зеленый) и Фаллоидин AF649 (синий) Метки клетки травмированных области (delimited белой пунктирной линией) и нетронутыми миокард (красное окрашивание). Белые стрелки указывают на DAPI (зеленое) распределение через неповрежденными компактной и трабецированных миокарда и эпикардия. Шкала планка = 500 мкм. пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
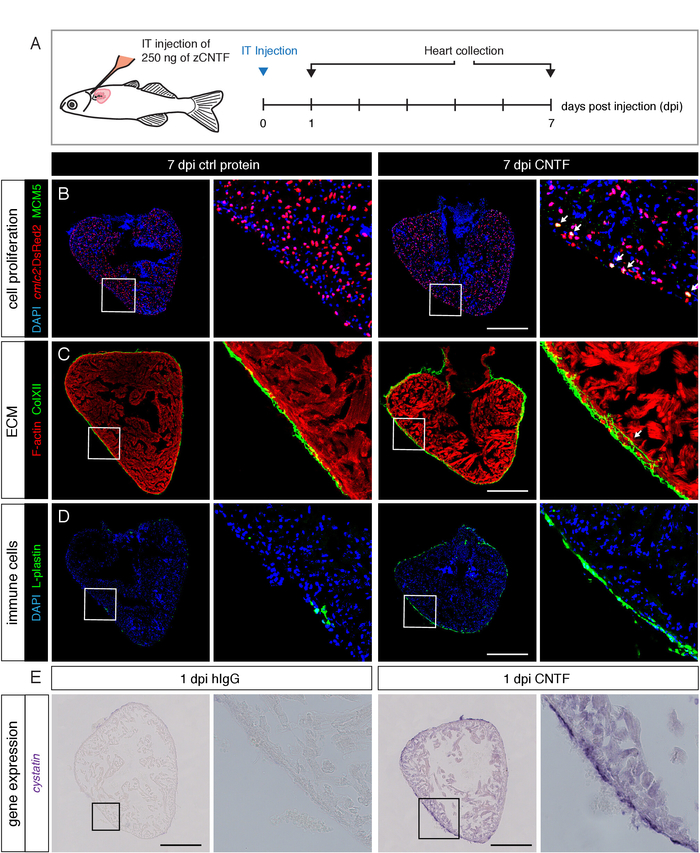
Рисунок 5: экзогенные IT-инъекции CNTF стимулирует несколько биологических процессов в сердце. А) схема экспериментального проектирования. Во-первых, 2,5 мкл раствора, содержащего 250 нг рыбы данио СЦФ или контроля иммуноглобуллинов (hIgG) вводили в перикард трансгенных рыб, выражающих ядерное DsRed2 в кардиомиоцитами. Сердца были собраны в 7 и 1 дней после инъекции (ДОИ) и проанализированы иммунофлуоресценции и на месте гибридизации, соответственно. (B-D) Кофокальная микроскопия изображения желудочковых разделов управления и CNTF-вводили сердца. (B) иммуноокрашивания против маркера клеточного цикла, комплекс минихромосомы технического обслуживания компонента 5 (MCM5; зеленый), показывает большее количество пролиферирующих кардиомиоцитов в ответ на экзогенных CNTF. Шкала планка = 500 мкм. (C) иммуноокрашивания против коллагена XII показывает повышенное осаждение коллагена XII в миокард после инъекции. В управлении сердце, коллаген XII ограничивается эпикардия34. Шкала планка = 500 мкм. (D) иммуноокрашивания против маркера иммунной ячейки, L-пластин, обнаруживает расширение набора иммунных клеток в CNTF вводили рыбу. Шкала планка = 500 мкм. (E) ярко-полевой Микроскоп изображения желудочковой поперечными секциями после на месте гибридизации с использованием антисоматогенного мРНК зонда против Цистатин, кардиопротекторного фактора, отображает транскрипционную упрегляции этого гена в сердце из CNTF-впрыснутой рыбы. Шкала планка = 500 мкм. Эта цифра была изменена с Bise et al.24. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
Обсуждение
Здесь мы описываем метод для доставки экзогенных соединений и белков в перикардиральной полости для того, чтобы изучить их влияние на сердце у взрослых рыб данио. Процедура основана на внутриторакальной инъекции, что приводит к поставке небольшого объема раствора в непосредственной близости от органа. Этот метод был разработан и описан для изучения сердечной предкондиционирования и регенерации.
Важнейшим этапом в этой процедуре является проникновение стеклянных капилляров в грудные полости. Этот шаг зависит от трех параметров: жесткость и резкость наконечника капилляра, угол проникновения и место прокола. Для оптимизации проникновения через кожу, вытягивается часть капилляра не должна быть слишком длинной, так как такие иглы слишком гибки и сгибаются в контакте с кожей. Чтобы избежать этого, жесткость может быть адаптирована путем уменьшения размера наконечника с иридетомии ножницами. Хотя угол проникновения может варьироваться от 30 ° до 45 °, он может быть адаптирован к жесткости наконечника. Действительно, тонкий наконечник будет проникать в кожу лучше с более узким углом.
В целях оптимизации проникновения иглы, участок вставки должен быть непосредственно над бьющееся сердце. Риск сердечного пункции, как правило, низкий, колеблется от 5% до 8%. Включение иглы задний к сердцу увеличивает риск сердечного пункции, как видно по усиленное кровотечение. В таких случаях животные должны быть удалены из экспериментов.
Еще один источник неприятностей во время инъекции ИТ происходит на уровне капилляров. Действительно, капилляры могут сломаться, когда на него оказывают боковые силы. Чтобы избежать этого, игла должна двигаться по оси инъекции прямым путем. Иногда капилляры могут быть заблокированы остатками ткани, которые мешают жидкости течь. Игла может быть разблокирована, осторожно снимая наконечник в то время как инъекции. Если это не улучшит поток, мы рекомендуем полностью снять иглу с грудной клетки и заменить иглу.
Поражения могут быть вызваны слишком глубоко вставленной иглой в перикард. Чтобы избежать поражения в периоколикой, игла не должна быть вставлена в грудную клетку слишком сильно (1 − 2 мм). Некоторые утечки наблюдались, когда объем инъекций был больше 8 мкл.
В рыбе данио, точный состав перизаторской жидкости неизвестен. Однако объем периноральной полости оценивается в ~ 10 мкл31. С учетом того, что объем взрослого рыбного желудочка в зебрае составляет примерно 1 − 2 мм3, мы предполагаем, что в перизаральной полости соответственно имеется крошечный объем, который должен быть рассмотрен перед инъекциями. Из наших предварительных исследований мы определили, что оптимальный диапазон впрыснутого объема составляет от 0,5 до 3 мкл для рыб размером 2,5 − 2,8 см (расстояние от морды до хвостового педункул). Этот объем может быть адаптирован в зависимости от размера рыбы. Инъекции до 5 мкл не вызывают поражения в рыбе такого размера. Однако объемы от 8 мкл были достаточными для того, чтобы вызвать выпуклые и внутренние кровотечения, как показано на рисунке 1F. Основываясь на этих данных, мы оцениваем, что количество раствора больше 3 мкл может вызвать физическое и физиологическое напряжение на органе. Это ограничение выводит необходимость выбора более высокой концентрации молекул вместо увеличения количества введенного раствора.
Другим важным фактором является осмотическое свойство введенного раствора, которое должно быть в физиологическом диапазоне. В самом деле, чтобы избежать риска осмотического стресса, мы рекомендуем ГБСС как инъекционное средство.
В рыбе данио, распространенных методов, используемых для доставки наркотиков через обработку воды и интраперитонеальная инъекций30,35. Хотя оба эти метода подходят для многих применений, ИТ-инъекции обеспечивают экспериментальные и экономические преимущества, уменьшая риски нежелательных системных побочных эффектов и уменьшая использование дорогостоящих молекул, соответственно. Этот метод может быть пригоден для доставки тамоксифена для активации трансгенной системы КРР-ERT2, используемой для анализа трассировки клеточной линии, и руководства модифицированными РНК для функциональных исследований в области регенерации.
Метод его впрыска в рыбе данио был описан ранее31,36. В этих отчетах, интраторакальные инъекции проводились с инсулиновой иглой, проколов с передней стороны. В отличие от этого, наш протокол представляет альтернативную стратегию с вытянутой стеклянной капилляра вставляется из заднего направления. В частности, наш подход учитывает анатомию рыбы перикард для оптимизации инъекций с уменьшенное риск сердечного пункции. Кроме того, во время процедуры рыба не удерживана металлическими щипцами, а влажной и мягкой губкой, которая является более подходящим методом, чтобы избежать любой внешней травмы рыбы. Таким образом, представленный метод может быть лучше подходит для исследования сердечного гомеостаза, предкондиционирования и регенерации у взрослых рыб данио.
ИТ-инъекции уже были установлены в млекопитающих модели организмов. Действительно, этот метод был также применен в экспериментах со свиньями и клинических исследованиях у людей37,38. У мышей, транракальных интракаркардиных инъекций руководствоваться ультразвуков были использованы, чтобы бросить вызов их сердца39. В этой статье мы предлагаем подробный протокол для облегчения использования ИТ-инъекции для рыб данио. Это будет особенно ценно для области, в целях дополнения генетических подходов в кардиостаза, предкондиционирования и регенерации исследований.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим в. Циммерманна за отличную техническую помощь и заботу о рыбе, д. Кёниг (Университет Фрибурга) за критическое чтение рукописи, д. Кресслер (Университет Фрибурга) за помощь в синтезе белка zCNTF, ф. Руджеро (Институт Fonctionnelle де Лион) для обеспечения ColXII антитела, и P. Martin (университет Бристоля) для L-пластин антитела. Мы благодарим центр визуализации и платформу протеомики в Университете Фрибурга. Эта работа была поддержана Швейцарский Национальный научный фонд, Грант номер 310030_179213, и в Швейцерское (Швейцарский фонд сердца).
Материалы
| Name | Company | Catalog Number | Comments |
| Hanks Balanced Salt Solution | Gibco by Life technology | 14065-056 | |
| Iridectomy scissor | Roboz Surgical Instruments Co | RS-5602 | |
| Macroscope (binocular) | M400 | with Apozoom | |
| Micro-injector femtojet | Eppendorf | 5247 0034 77 | |
| Microloaders femtotips | Eppendorf | 5242 956.003 | |
| Micropipette glass needles type C | WPI | TW100F-6 | thin-wall capillary |
| Micropipette puller model P-87 | Flaming/Brown | 20081016 | filament box 2.5 mm x 4.5 mm |
| Sponge | any | any | dim. carved sponge 7cm x 3 cm x 1 cm |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | Company | Catalog Number | Comments |
| anti-Chicken Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Guinea pig Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| anti-Rabbit Cy5 | Jackson ImmunoResearch Laboratories | Concentration: 1/500 | |
| Chicken l-plastin | gift from P. Martin, Bristol | Concentration: 1/1,000 | |
| DAPI | Sigma | 10236276001 | Concentration: 1/2,000 (1µg/ml); 1/100 IT injected |
| Guinea pig anti-ColXII | gift from Florence Ruggerio, Lyon | Concentration: 1/500 | |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1/500 |
| Phalloidin-Atto-647 (F-actin) | Sigma | 95906 | Concentration: 1/50 IT injected |
| Rabbit anti-MCM5 | gift from Soojin Ryu, Heidelberg | Concentration: 1/500 | |
| Stamping Ink 4K | Pelikan | 1 4k 351 197 | Concentration: 1/1 |
| ISH probe primers | |||
| Cystatin | gene number: ENSDARG00000074425 fw primer: GATTCACTGTCGGGTTTGGG Rev primer: ATTGGGTCCATGGTGACCTC |
Ссылки
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Iismaa, S. E., et al. Comparative regenerative mechanisms across different mammalian tissues. npj Regenerative Medicine. 3 (1), (2018).
- Xiang, M. S. W., Kikuchi, K. Endogenous Mechanisms of Cardiac Regeneration. Int Rev Cell Mol Biol. 326, 67-131 (2016).
- González-Rosa, J. M., Burns, C. E., Burns, C. G. Zebrafish heart regeneration: 15 years of discoveries. Regeneration. 4 (3), 105-123 (2017).
- Jazwinska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. The Journal of Pathology. 238 (2), 233-246 (2016).
- Sehring, I. M., Jahn, C., Weidinger, G. Zebrafish fin and heart: what's special about regeneration?. Current Opinion in Genetics & Development. 40, 48-56 (2016).
- Rubin, N., Harrison, M. R., Krainock, M., Kim, R., Lien, C. L. Recent advancements in understanding endogenous heart regeneration-insights from adult zebrafish and neonatal mice. Seminars in Cell and Developmental Biology. 58, 34-40 (2016).
- Chablais, F., Veit, J., Rainer, G., Jazwinska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Cao, J., Poss, K. D. The epicardium as a hub for heart regeneration. Nature Reviews Cardiology. 15 (10), 631-647 (2018).
- Andres-Delgado, L., Mercader, N. Interplay between cardiac function and heart development. Biochim Biophys Acta. 1863, 1707-1716 (2016).
- Richardson, R. J. Parallels between vertebrate cardiac and cutaneous wound healing and regeneration. npj Regenerative Medicine. 3, 21 (2018).
- Lai, S. -. L., Marín-Juez, R., Stainier, D. Y. R. Immune responses in cardiac repair and regeneration: a comparative point of view. Cellular and Molecular Life Sciences. , (2018).
- Kikuchi, K., et al. Primary contribution to zebrafish heart regeneration by gata4(+) cardiomyocytes. Nature. 464 (7288), 601-605 (2010).
- Jopling, C., et al. Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature. 464 (7288), 606-609 (2010).
- Pfefferli, C., Jaźwińska, A. The careg element reveals a common regulation of regeneration in the zebrafish myocardium and fin. Nature Communications. 8, 15151 (2017).
- Sánchez-Iranzo, H., et al. Tbx5a lineage tracing shows cardiomyocyte plasticity during zebrafish heart regeneration. Nature Communications. 9 (1), (2018).
- Wang, J., Poss, K. D. Methodologies for Inducing Cardiac Injury and Assaying Regeneration in Adult Zebrafish. Methods In Molecular Medicine. 1451, 225-235 (2016).
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97 (3), 889-938 (2017).
- de Preux Charles, A. S., Bise, T., Baier, F., Marro, J., Jazwinska, A. Distinct effects of inflammation on preconditioning and regeneration of the adult zebrafish heart. Open Biology. 6 (7), (2016).
- de Preux Charles, A. S., Bise, T., Baier, F., Sallin, P., Jazwinska, A. Preconditioning boosts regenerative programmes in the adult zebrafish heart. Open Biology. 6 (7), (2016).
- Bise, T., de Preux Charles, A. S., Jazwinska, A. Ciliary neurotrophic factor stimulates cardioprotection and the proliferative activity in the zebrafish adult heart. npj Regenerative Medicine. 4, (2019).
- Thorimbert, V., Konig, D., Marro, J., Ruggiero, F., Jazwinska, A. Bone morphogenetic protein signaling promotes morphogenesis of blood vessels, wound epidermis, and actinotrichia during fin regeneration in zebrafish. The FASEB Journal. 29 (10), 4299-4312 (2015).
- König, D., Page, L., Chassot, B., Jaźwińska, A. Dynamics of actinotrichia regeneration in the adult zebrafish fin. Developmental Biology. 433 (2), 416-432 (2018).
- Sallin, P., Jaźwińska, A. Acute stress is detrimental to heart regeneration in zebrafish. Open Biology. 6 (3), 160012 (2016).
- Mokalled, M. H., Poss, K. D. A Regeneration Toolkit. Developmental Cell. 47 (3), 267-280 (2018).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital Injection in Adult Zebrafish. Journal of Visualized Experiments. (34), e1645 (2009).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal Injection into Adult Zebrafish. Journal of Visualized Experiments. (42), (2010).
- Xiao, C., et al. Nanoparticle-mediated siRNA Gene-silencing in Adult Zebrafish Heart. Journal of Visualized Experiments. (137), (2018).
- Chablais, F., Jazwinska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), (2012).
- Gonzalez-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7 (4), 782-788 (2012).
- Marro, J., Pfefferli, C., de Preux Charles, A. S., Bise, T., Jazwinska, A. Collagen XII Contributes to Epicardial and Connective Tissues in the Zebrafish Heart during Ontogenesis and Regeneration. PLoS One. 11 (10), e0165497 (2016).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A Doxorubicin-induced Cardiomyopathy Model in Adult Zebrafish. Journal of Visualized Experiments. (136), (2018).
- Diao, J., et al. PEG-PLA nanoparticles facilitate siRNA knockdown in adult zebrafish heart. Developmental Biology. 406 (2), 196-202 (2015).
- Lloyd, L. C., Etheridge, J. R. The pathological and serological response induced in pigs by parenteral inoculation of Mycoplasma hyopneumoniae. Journal of Comparative Pathology. 91 (1), 77-83 (1981).
- Zhou, A., Guo, L., Tang, L. Effect of an intrathoracic injection of sodium hyaluronic acid on the prevention of pleural thickening in excess fluid of tuberculous thoracic cavity. Clinical and Experimental Pharmacology and Physiology. 30 (3), 203-205 (2003).
- Prendiville, T. W., et al. Ultrasound-guided Transthoracic Intramyocardial Injection in Mice. Journal of Visualized Experiments. (90), (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены