Method Article
Sağlam, fonksiyonel membran proteinlerine bağlanan nükleotidin gerçek zamanlı olarak ölçülmesi
Bu Makalede
Özet
Bu protokol, hücresel bir ortamda reseptörlere gerçek zamanlı olarak adenin nükleotid bağlanmasını ölçmek için bir yöntem sunar. Bağlanma, trinitrofenil nükleotid türevleri ile kanonik olmayan, floresan amino asit ile etiketlenmiş protein arasındaki Förster rezonans enerji transferi (FRET) olarak ölçülür.
Özet
Adenin nükleotidlerinin hücresel veya membran ortamında bozulmamış, fonksiyonel transmembran reseptörlerine bağlanmasını ölçmek için bir yöntem geliştirdik. Bu yöntem, floresan kanonik olmayan amino asit ANAP ile etiketlenmiş proteinlerin ekspresyonunu ve ANAP ile floresan (trinitrofenil) nükleotid türevleri arasındaki FRET'i birleştirir. Çatısız plazma membranlarında ölçülen ANAP etiketli KATP iyon kanallarına nükleotid bağlanma örneklerini ve voltaj kelepçesi altında eksize edilmiş, içten dışa membran yamalarını sunuyoruz. İkincisi, ligand bağlanması ve kanal akımının eşzamanlı ölçümlerine, protein fonksiyonunun doğrudan okunmasına izin verir. Veri işleme ve analizi, potansiyel tuzaklar ve eserlerle birlikte kapsamlı bir şekilde tartışılmaktadır. Bu yöntem, KATP kanallarının ligand-bağımlı geçidine zengin mekanik anlayışlar sağlar ve diğer nükleotid düzenlenmiş proteinlerin veya uygun bir floresan ligandın tanımlanabileceği herhangi bir reseptörün çalışmasına kolayca uyarlanabilir.
Giriş
Birkaç önemli protein sınıfı, ligand bağlanması ile doğrudan düzenlenir. Bunlar çözünür enzimlerden, reseptör tirozin kinazlar, G proteinine bağlı reseptörler (GPCR'ler) ve iyon kanalları dahil olmak üzere membrana gömülü proteinlere kadar uzanır. GPCR'ler ve kanallar, mevcut tüm ilaç hedeflerinin sırasıyla ~% 34'ünü ve ~% 15'ini, 1,2'yi oluşturmaktadır. Bu nedenle, ligand-reseptör etkileşimlerine mekanik bakış açısı sağlayan yöntemler geliştirmeye yönelik önemli bir biyokimyasal ve tıbbi ilgi vardır. Fotoaffinite etiketleme ve radyoligand bağlama çalışmaları da dahil olmak üzere ligand bağlanmasını ölçmek için geleneksel yöntemler, büyük miktarlarda kısmen saflaştırılmış protein gerektirir ve tipik olarak fizyolojik olmayan koşullar ve zaman ölçekleri altında gerçekleştirilir. İdeal bir yöntem sadece az miktarda protein gerektirir, hücresel veya membran ortamında eksprese edilen bozulmamış proteinler üzerinde gerçekleştirilebilir, gerçek zamanlı olarak izlenebilir ve protein fonksiyonunun doğrudan okumalarıyla uyumlu olacaktır.
Förster rezonans enerji transferi (FRET), floresan olarak etiketlenmiş iki molekül arasındaki yakınlığı tespit eden bir yöntemdir3. FRET, uyarılmış bir donör florofor, enerjiyi ışınımsal olmayan bir şekilde bir alıcı moleküle (tipik olarak başka bir florofor) aktardığında ortaya çıkar. Enerji transferi, donör floresan emisyonunun söndürülmesi ve alıcı emisyonun hassaslaştırılması ile sonuçlanır (alıcı bir florofor ise). Transfer verimliliği, donör ile alıcı arasındaki mesafenin 6.gücüne bağlıdır. Ayrıca, FRET'in gerçekleşmesi için donör ve alıcı yakın olmalıdır (genellikle 10 nm'den az). Bu nedenle, FRET, floresan olarak etiketlenmiş bir protein reseptörü ile bir floresan ligand arasındaki doğrudan bağlanmayı ölçmek için kullanılabilir.
Birkaç farklı protein, hücre içi veya hücre dışı adenin nükleotidlerinin (ATP, ADP, AMP, cAMP) bağlanmasıyla düzenlenir veya aktive edilir. Birçok taşıyıcı protein, ATP bağlayıcı kaset taşıyıcılar ve Na + / K + pompa 4,5 gibi P tipi ATPazlar dahil olmak üzere reaksiyon döngüleri için ATP hidrolizine ihtiyaç duyar. ATP'ye duyarlı K+ (KATP) kanalları, kistik fibroz transmembran iletkenlik regülatörü (CFTR) ve siklik nükleotid regüle kanalları, hücre içi adenin nükleotidlerinin bağlanmasıyla kapılı olan ve onları hücresel metabolizma ve sinyal iletimindeki değişikliklere karşı hassas hale getiren iyon kanallarıdır 6,7,8 . Pürinerjik P2X ve P2Y reseptörleri, bir nörotransmitter olarak veya doku hasarının bir sonucu olarak salınabilen hücre dışı ATP'deki değişikliklere cevap verir9. Membran proteinlerine bağlanan adenin nükleotidinin gerçek zamanlı olarak ölçülmesi için FRET tabanlı bir test geliştirdik. Bu yöntemi daha önce KATP kanalları10,11'e nükleotid bağlanmasını incelemek için uygulamıştık.
FRET yoluyla nükleotid bağlanmasını ölçmek için, ilgilenilen bir protein önce bir florofor ile etiketlenmelidir. Floresan etiketi, özellikle ilgili proteine, FRET'in oluşması için ligand bağlanma bölgesine yeterince yakın olacak şekilde, etiketin proteinin genel yapısını ve işlevini etkilememesini sağlamak için özel dikkat gösterilecek şekilde yerleştirilmelidir. Bunu başarmak için, Chatterjee ve ark. tarafından geliştirilen bir tekniği kullanıyoruz, floresan kanonik olmayan bir amino asit (l-3-(6-asetilnaftalin-2-ylamino)-2-aminopropiyonik; ANAP) istenilen yerde12. ANAP etiketli protein ve floresan, trinitrofenil (TNP) nükleotid türevleri arasında FRET olarak nükleotid bağlanmasını ölçüyoruz (Şekil 1A). ANAP için emisyon spektrumu, FRET'in gerçekleşmesi için gerekli bir koşul olan TNP-nükleotidlerin absorbans spektrumu ile örtüşmektedir (Şekil 1B). Burada iki farklı bağlama deneyi türünü özetliyoruz. Birincisinde, ANAP etiketli KATP kanallarının hücre içi tarafına bağlanan nükleotid, bir cam kapak kayması10,11,13,14 üzerinde plazma zarının yapışkan parçalarını bırakarak sonikasyon ile çatısı açılmış hücrelerde ölçülür.
İkinci yöntemde, ANAP etiketli KATP kanallarına bağlanan nükleotid, voltaj kelepçesi altındaki bir membran yamasında ölçülür ve iyonik akımların ve floresanın aynı anda ölçülmesine izin verir. Bu iki deneysel yaklaşımı birleştirerek, bağlanmadaki değişiklikler kanal fonksiyonu11'deki değişikliklerle doğrudan ilişkilendirilebilir. Tipik sonuçlar, potansiyel tuzaklar ve veri analizi tartışılmaktadır.
Protokol
1. Kapak fişlerinin hazırlanması
NOT: Bu adımlar steril doku kültürü başlığında gerçekleştirilmelidir. 10 yemeğin hazırlanması için miktarlar verilir.
- On otoklavlanmış, 30 mm borosilikat kapak camı kaymalarını ayrı ayrı on adet 35 mm işlenmemiş steril tabağa yerleştirin ve 2 mL steril, damıtılmış su ile bir kez durulayın.
- 1 mL'lik %0,1'lik w/v poli-L-lizin çözeltisini steril, damıtılmış suya toplam 10 mL hacme kadar seyreltin (%0,01 w/v nihai konsantrasyon). İyice karıştırın, ardından her bir kapak kaymasına 1 mL pipet yapın ve oda sıcaklığında 20 dakika boyunca inkübe edin.
- Poli-L-lizini aspire edin ve her kapak kaymasını en az 2 mL steril damıtılmış su ile iki kez yıkayın. Tamamen kuruyana kadar, yani en az 3 saat bekletin.
2. HEK-293T hücrelerinin tohumlanması
NOT: Bu adımlar bir doku kültürü başlığında gerçekleşmelidir. HEK-293T hücreleri, düşük akımlı arka planları ve kültürde büyüme kolaylığı nedeniyle seçildi. Bu protokol diğer hücre tiplerine uyarlanabilir.
- 2-5 dakika boyunca 2 mL tripsin ile inkübe etmeden önce veya hücreler tamamen ayrılana ve neredeyse tamamen ayrışana kadar 12 mL fosfat tamponlu salin (PBS) ile% 80-90 oranında birleşen bir T75 HEK-293T hücresi şişesini durulayın.
- % 10 fetal sığır serumu, 100 U / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş 10 mL Dulbecco'nun Modifiye Kartal Ortamı (DMEM) ekleyerek hücreleri yeniden askıya alın. Kalan hücre kümelerini parçalamak için şişenin dibine nazikçe pipet yapın.
- Kaplamalı kapak fişleri içeren istenen sayıda 35 mm'lik tabağa 2 mL takviyeli DMEM ekleyin. Her çanağa 100 μL yeniden askıya alınmış hücre ekleyin. Gece boyunca 37 ° C'de inkübe edin.
3. Transfeksiyon
NOT: Bu adımlar bir doku kültürü başlığında gerçekleşmelidir. 10 yemeğin transfeksiyonu için miktarlar verilir. Bölgeye özgü ANAP birleştirme için, etiketleme için amaçlanan konumdaki DNA kodonu amber (TAG) durdurma kodonu ile değiştirilmelidir. Bu yapı iki plazmid ile birlikte transfekte edilir: pANAP ve peRF1-E55D12,15. pANAP, ANAP'a özgü bir tRNA / tRNA sentetaz çiftinin birkaç kopyasını kodlar. ANAP varlığında, bu plazmidin transfeksiyonu, amber stop kodonunu tanıyan ANAP yüklü tRNA üretir. peRF1-E55D, tam uzunlukta, ANAP etiketli proteinin verimini artıran baskın bir negatif ribozomal salınım faktörünü kodlar.
- ANAP ile etiketlemeye yönelik yapı için 10 μg pANAP, 10 μg peRF1-E55D ve DNA içeren 1,5 mL'lik bir tüp hazırlayın. Takviye edilmemiş DMEM ile 500 μL'lik son bir hacme getirin.
- Ayrı bir tüpte, her 1 μg DNA için 3 μL lipit bazlı transfeksiyon reaktifi ( Malzeme Tablosuna bakınız) hazırlayın ve takviye edilmemiş DMEM ile 500 μL'lik son bir hacme getirin.
- DNA ve transfeksiyon reaktif karışımlarını tek bir tüpte birleştirin ve oda sıcaklığında 20 dakika inkübe edin.
- 20 μM ANAP'ın nihai konsantrasyonu için 20 mL takviyeli DMEM'e 1 mM ANAP stoğunun 400 μL'sini (30 mM NaOH'da trifloroasetat tuzu) ekleyin. Kaplama hücrelerdeki eski ortamı, çanak başına 2 mL ANAP içeren ortamla değiştirin.
- DNA transfeksiyonunun% 10'unu pipet her bir kabın üzerine karıştırır. Deneylerden önce 2-4 gün boyunca 33 ° C'de inkübe edin. 33 ° C'de inkübasyon, hücre bölünmesini yavaşlatır ve hücre başına protein verimini arttırır16.
4. Çatısız membran deneyleri
- Transfekte hücrelere sahip bir kapak kaymasını daha küçük parçalara ayırmak için bir çift forseps kullanın.
- Çatı hücrelerini açmak için aşağıdaki prosedürlerden birini izleyin.
- Önceden kaplanmış kapak kaymaları kullanıyorsanız, bir parçayı PBS ile durulayın, ardından 2 mL PBS içeren 35 mm'lik bir kabın altına yerleştirin. Çatı hücrelerini açmak ve yapışkan plazma membran parçalarını geride bırakmak için numunenin 3-5 mm yukarısına yerleştirilmiş bir prob sonikatör (50 W,% 20 -% 40 genlik, 3 mm prob) kullanarak kısaca sonikleştirin (Şekil 2A, C).
NOT: Numunenin üzerindeki Sonicator gücü, süresi ve prob yüksekliği, kapak kaymasını tamamen reddetmeden yüksek miktarda çatısız membran elde etmek için değiştirilebilir. - Önceden kaplanmış kapak fişleri kullanmıyorsanız, bir kapak kayma parçasını PBS ile durulayın, daha sonra çatıdan arındırmak ve çatısız / kısmen çatısız plazma membran parçalarını geride bırakmak için kısaca sonikasyon yapmadan önce (adım 4.2.1'de olduğu gibi) ~ 30 s boyunca% 0.1 w / v poli-L-lizin içeren bir tüpe daldırın (Şekil 2A, C, D). Poli-L-lizine kısa süreli maruz kalmaların, kapak kayması13'e yapışmayı arttırdığı gösterilmiştir.
- Önceden kaplanmış kapak kaymaları kullanıyorsanız, bir parçayı PBS ile durulayın, ardından 2 mL PBS içeren 35 mm'lik bir kabın altına yerleştirin. Çatı hücrelerini açmak ve yapışkan plazma membran parçalarını geride bırakmak için numunenin 3-5 mm yukarısına yerleştirilmiş bir prob sonikatör (50 W,% 20 -% 40 genlik, 3 mm prob) kullanarak kısaca sonikleştirin (Şekil 2A, C).
- Sonikasyonlu parçayı 2 mL banyo çözeltisi içeren bir kapak cam tabanlı 35 mm tabağa yerleştirin ve yüksek NA, 60x suya daldırma hedefi ile donatılmış ters çevrilmiş bir mikroskopa monte edin. Mikroskobun kamera portu, yüksek hassasiyetli bir CCD kamera ile seri olarak bir spektrografa bağlanır. Banyo odasını (0,5 – 1 mL/dak) peristaltik bir pompa kullanarak tamponla perfüze edin. Tamponun bileşimi, incelenen proteine bağlı olarak değişecektir.
NOT: Kullanıcının uzun çalışma mesafesine sahip bir hedefe erişimi yoksa, kapak kaymasının ekstra yüksekliği nedeniyle çatısız membran parçalarına odaklanmak imkansız olabilir. Bir alternatif, hücreleri doğrudan poli-L-lizin cam tabanlı tabaklara tohumlamaktır (bir örnek için Malzeme Tablosuna bakınız). Bu aynı zamanda iki cam parçasından odaklama ile ilişkili görüntüdeki potansiyel sapmaları da azaltacaktır. Bu sapmalar, elde edilen spektrumların şeklini etkilemez. - Kanal floresansını arayarak ANAP etiketli kanalı ifade eden çatısız membran parçalarını tanımlayın (Şekil 2C,D).
NOT: İlgilenilen proteini içeren çatısız membranların tanımlanmasına yardımcı olmak için ek bir floresan etiket (emisyon spektrumunun ANAP emisyon spektrumundan ayırt edilebildiği yerlerde) kullanılması önerilir. Şekil 2C,D'deki deneyler ANAP etiketli kanallarda C-terminal floresan protein etiketleri ile gerçekleştirilmiştir. - Spektrometre maskesini mikroskop üzerindeki kamera portu ile spektrograf arasında kısmen devreye sokun. Maskenin gölgesi kamera görüntüsünde görünecektir. Mikroskop aşamasını ayarlayarak çatısız membranı spektrometre maskesiyle hizalayın. Çatısız membranın parlak bir alan ve floresan görüntüsünü elde edin. Bunlar, analiz için ilgilenilen bir bölgeyi seçmek için kullanılacaktır.
- Mikrohacim perfüzyon sisteminin ucunu çatısız membrana yaklaştırın.
NOT: Arka plan floresansını azaltmak için, perfüzyon sisteminin çıkışı borosilikat camdan yapılmış özel bir uçla değiştirildi. - Floresan spektrumlarını görüntülemek için, 390/18 nm bant geçişli uyarma filtresi ve 416 nm kenar dikroik aracılığıyla 385 nm LED ile membranı heyecanlandırın. Yayılan ışığı 400 nm uzun geçirgen emisyon filtresinden toplayın (Şekil 2B).
- Spektrometre maskesini takın ve yayılan ışığın içinden geçtiğinden emin olun. Spektrometre ızgaralarını (300 oluk/mm) takın. Izgaralar yerleştirildiğinde, spektrometre tarafından kırılan ışık, spektral görüntüler üretmek için CCD kameranın çipine yansıtılacaktır (Şekil 3A). Bu görüntüler uzamsal bilgileri y boyutunda tutar. X boyutu dalga boyu ile değiştirilir.
- İsteğe bağlı olarak, ilgilenilen protein bir floresan proteini ile etiketlenmişse, uygun filtre setini kullanarak floresan proteininin spektral bir görüntüsünü elde edin.
- Nükleotid içermeyen tampon çözeltisini perfüzyon ederken deneyin başında bir veya daha fazla 0.1-10 s pozlama alın. Bunlar, denemenin geri kalanı boyunca verileri düzeltmek ve normalleştirmek için kullanılacaktır (aşağıdaki bölüm 5'e bakın).
NOT: Pozlama süresinin seçimi, elde edilen ifade seviyesine, floroforun parlaklığına ve optiklere bağlı olacaktır. Maruz kalma süresi, sinyali en üst düzeye çıkarmak ve gözlemlenen ağartma oranını en aza indirmek için seçilmelidir. 4.10'da verilen maruz kalma süresi aralığı, denge bağlama ölçümleri için uygundur, ancak daha yavaş kinetik değişiklikleri ölçmek için yararlı olabilir10. Daha hızlı kinetiği izlemek için kısa pozlama sürelerini kullanma yeteneği, donanımdan ziyade protein ekspresyon seviyeleri ve fotobeyazlatma ile sınırlı olacaktır. - Bir konsantrasyon-tepki eğrisi oluşturmak için bir dizi TNP-ATP konsantrasyonu (genellikle banyo çözeltisinde hazırlanır) uygulayın. Sabit bir duruma ulaşıldığından emin olmak için her çözeltiyi en az 1 dakika perfüze edin ve her konsantrasyonu en az 1 dakika boyunca banyo çözeltisi ile yıkayın.
NOT: Perfüzyon sisteminin hızlı bir şekilde dengeye ulaşabilmesini (Şekil 2E) ve TNP-ATP'nin doğru yerel konsantrasyonunu (Şekil 2F) elde edebilmesini sağlamak önemlidir. - Her konsantrasyonda ve her yıkamanın sonunda bir pozlama yapın (adım 4.10'da kullanılanla aynı sürede).
5. Spektral analiz
NOT: Bu talimatlar, GitHub'da bulunan "pcf.m" analiz koduyla kullanılmak üzere yazılmıştır. https://github.com/mpuljung/spectra-analysis10. Ek ve alternatif kod https://github.com/smusher/KATP_paper_201911'de bulunabilir. Yazılım tarafından gerçekleştirilen işlemleri burada açıkladık, böylece kullanıcı kendi kodunu oluşturabilir veya verileri manuel olarak analiz etmeyi seçebilir.
- Komut satırına programın adını ("pcf") yazarak analiz programını başlatın.
- "ROI için dosyaları seç" istemiyle açık bir dosya/klasör iletişim kutusu açıldığında, çatısız membranın parlak alan ve floresan görüntüleriyle ilişkili dosya adlarını seçin. Komut satırında çıktı dosyasının adını yazmak için bir istem görüntülenir.
- Dosya adını yazın ve enter tuşuna basın.
- Yazılım parlak alan ve floresan görüntüleri görüntülediğinde, yazılım istemlerini izleyerek çatısız membran parçasının veya eksize edilmiş yamanın konumuna karşılık gelen spektral görüntüde bir ilgi alanı (ROI) seçin (bkz. bölüm 6). Aynı spektral görüntüde (ROI'deki ile aynı dalga boyu aralığını temsil eden) bir arka plan bölgesi seçin, kapak kaymasının veya çanağın membran takılı olmayan bir bölümüne karşılık gelir (Şekil 3A). Yazılım, YG'nin Üst Kısmına tıklamanızı ve Enter tuşuna basmanızı, YG'nin altına tıklamanızı ve Enter tuşuna basmanızı ve ardından arka plan bölgesi için bu işlemi tekrarlamanızı isteyecektir.
- Açık bir dosya/klasör iletişim kutusu "FP Spektrumu için Dosya Seç" istemiyle açıldığında, floresan protein (FP) spektrumuyla ilişkili dosya adını seçin (isteğe bağlı adım 4.9). FP spektrumu alınmamışsa, farklı bir spektrum dosyası seçin. FP spektrumu, etiketli protein ve arka plan floresansı arasında ayrım yapmak için kalite kontrol görevi görür.
- "Select Files for Analyisis" istemiyle açık bir dosya/klasör iletişim kutusu açıldığında, ağartıcı düzeltmesi için gereken dosyalar da dahil olmak üzere ANAP spektrumlarına karşılık gelen tüm dosyaları (4.10 ila 4.12 arası adımlardan) seçin.
- "Ağartma Toplama için Dosyaları Seç" istemiyle açık bir dosya/klasör iletişim kutusu açıldığında, deneyin başında nükleotid içermeyen çözeltide elde edilen ilk spektrumlara karşılık gelen adım 5.6'daki dosyaların alt kümesini veya düzeltme için kullanılacak nükleotid içermeyen çözeltideki yıkamalar sırasında elde edilen spektrumları seçin (4.10'dan 4.12'ye kadar).
- Spektrum üretmek için her görüntünün çizgi ortalaması, yani her dalga boyundaki bir ROI veya arka plan bölgesinin y boyutundaki tüm piksellerin yoğunluğunun ortalaması. (Şekil 3B). Arka plan floresansını ve floresansını bağlanmamış TNP-ATP'den çıkarmak için ROI'den elde edilen ortalama arka plan spektrumunu ROI'den elde edilen ortalama spektrumdan çıkarın (Şekil 3C). Bu adımlar yazılım tarafından otomatik olarak gerçekleştirilir.
- Çıkarılan spektrumun ANAP zirvesi etrafında ortalanmış 5 nm'lik bir pencerenin yoğunluğunun ortalamasını alarak her pozlama için ANAP yoğunluğunu belirleyin (tipik olarak ~ 470 nm, ancak ANAP kalıntısının yerel mikro ortamına bağlı olarak değişebilir).
NOT: Şekil 3D , ANAP etiketli kanalları ifade eden çatısız bir membran parçasının ardışık 10 s pozlamalarından elde edilen 6 spektrumu göstermektedir. İç kısım, her spektrumun zirvesinin ortalama yoğunluğunu gösterir. Yazılım, elde edilen ilk spektrumdaki tepe dalga boyunu otomatik olarak bulacak ve bu değeri baştan sona kullanacaktır. Yoğunluk yazılım tarafından otomatik olarak hesaplanacaktır. - Belirli bir maruziyetin (F) ANAP yoğunluğunu, adım 4.10'da (Fmax) atılan zaman serisindeki ilk maruziyetin ANAP yoğunluğuna bölerek her deney için ANAP yoğunluklarını normalleştirin. Yine, yazılım bu hesaplamaları otomatik olarak gerçekleştirir.
- Veri elde etmek için aşağıdaki adımları uygulayın.
- ANAP fotobeyazlatmayı düzeltmek için, önce tek bir üstel bozunum, (F / Fmax) = A * exp (-t / τ) + (1-A), burada t kümülatif maruz kalma süresidir, τ zaman sabitidir ve A genliktir) TNP-ATP uygulamaları arasındaki ara yıkama adımlarına veya TNP-ATP'de yıkamadan önce alınan çoklu ilk maruziyetlere (Şekil 3D, girinti).
NOT: Yazılım bu uyumu görüntüleyecek ve kabul etmenizi veya reddetmenizi isteyecektir. Uyum reddedilirse, ağartma düzeltmesi için dosyaları seçmek için başka bir fırsat sağlanacaktır. - Normalleştirilmiş (adım 5.10'da) ANAP spektrumlarını, her zaman noktasında adım 5.11.1'den üstel uyumun tahmin edilen değerine bölün (Şekil 3E).
NOT: Gösterilen örnek için, 50 sn'de gözlenen normalleştirilmiş tepe floresanı 0.65'tir ve üstel uyumdan tahmin edilen floresan 0.64'tür. Ağartmayı düzeltmek için, düzeltilmiş değeri (~1, Şekil 3E girişi, renkli daire) üretmek için gözlemlenen değeri (0,65, Şekil 3E girişi, boş daire) tahmin edilen değere (0,64, Şekil 3E girişi, kesikli çizgi) bölün. Beyazlatma düzeltmesi yeterliyse, nükleotidlerin yokluğunda elde edilen tüm maruziyetlerden ANAP yoğunluğu yaklaşık olarak eşit olmalıdır (Şekil 3E). Bu hesaplamalar yazılım tarafından otomatik olarak gerçekleştirilir. - Çıktıyı, verileri çizen bir görüntü olarak ve ham spektrumları, çıkarılmış spektrumları, fotobeyazlatma için düzeltilmiş spektrumları ve her dosya için tepe verilerini içeren sekmeli bir elektronik tablo olarak elde edin, böylece daha fazla analiz yapılabilir.
- ANAP fotobeyazlatmayı düzeltmek için, önce tek bir üstel bozunum, (F / Fmax) = A * exp (-t / τ) + (1-A), burada t kümülatif maruz kalma süresidir, τ zaman sabitidir ve A genliktir) TNP-ATP uygulamaları arasındaki ara yıkama adımlarına veya TNP-ATP'de yıkamadan önce alınan çoklu ilk maruziyetlere (Şekil 3D, girinti).
6. Yama-kelepçe florometri deneyleri
- Yama pipetlerini kalın cidarlı borosilikat cam kılcal damarlardan pipet çözeltisi ile doldurulduğunda 1,5 MΩ ila 2,5 MΩ direnç gösterecek şekilde çekin. Pipet çözeltisinin bileşimi, incelenen proteine bağlı olarak değişecektir.
- Transfekte hücrelere sahip bir kapak kaymasını, 2 mL banyo çözeltisi içeren bir kapak camı tabanlı 35 mm'lik bir kabın üzerine aktarın ve yüksek NA, 60x suya daldırma hedefi ile donatılmış ters çevrilmiş bir mikroskopa monte edin. Banyo odasını (0,5 – 1 mL/dak) peristaltik bir pompa kullanarak banyo solüsyonu ile perfüze edin. Pipet çözeltisine gelince, banyo çözeltisi incelenen proteine bağlı olarak değişecektir.
- Hücre zarında floresan arayarak ANAP etiketli kanalları eksprese eden bir hücreyi tanımlayın.
- Bir yama pipetini pipet çözeltisiyle doldurun. Pipete hafif pozitif basınç uygulayın ve banyo odasına yerleştirin. Pipetinizi hücrenin zarına bastırın ve GΩ sızdırmazlığı elde etmek için nazik emme uygulayın (Şekil 4A).
- Pipet tutucuyu hücreden hızla uzaklaştırarak yamayı tüketin (Şekil 4A).
NOT: Yamanın bu şekilde eksize edilmesi, proteinin sitozolik alanları perfüzyon sistemine maruz kalacak şekilde içten dışa bir yama oluşturmalıdır. İncelenen nükleotid bağlanma bölgesinin yeri sitosolik değilse, PCF deneylerini gerçekleştirmek için dışardan dışarıya yamalar veya tüm hücre kayıtları kullanmak gerekecektir. - Yama pipetinin ucunu perfüzyon sisteminin ucuna yaklaştırın ve yamanın spektrometre maskesinin yarığı içinde olup olmadığını kontrol edin (Şekil 4A).
- TNP-ATP ve görüntü spektrumlarını 4.10-4.12 adımlarındaki gibi uygularken, aynı anda nükleotid uygulamasına iyonik akım tepkisini kaydedin.
NOT: Pipet camı, elde edilen görüntülerde uzamsal sapmalara ve yansımalara neden olabilir. Bununla birlikte, bu sapmalar elde edilen spektrumların şeklini etkilemeyecektir ve yansıyan uyarma ışığı, spektrograf veya uzun geçişli bir emisyon filtresi kullanılarak floresandan kolayca ayrılır. - Spektrumları analiz edin. Eksize edilmiş yamalardan görüntülenen spektrumlar, TNP-ATP'nin yama pipetinin camından dışlanması nedeniyle bağlanmamış TNP-ATP floresansının aşırı çıkarılmasını gösterebilir (Şekil 4C-E). Bu aşırı çıkarma ANAP emisyon spektrumunu etkilemez ve bu nedenle göz ardı edilebilir.
NOT: Eksize edilmiş yamalardaki floresan sinyali, çatısız membranlardan daha düşük olacağından, ANAP'ı çok hızlı bir şekilde ağartmadan yeterince yüksek sinyal-gürültü veren bir maruz kalma süresi kullanmak önemlidir.
Sonuçlar
Şekil 2, sonikasyon ile elde edilen çatısız membran parçalarındaki floresan proteinlerine nükleotid bağlanmasını ölçmek için temel deney düzeneğini göstermektedir (Şekil 2A, B). Çatısız membranlar elde etmek için iki farklı yaklaşım kullanıldı, poli-L-lizin kaplı örtü kaymaları üzerindeki hücreleri doğrudan kültüre almak veya işlenmemiş cam üzerindeki hücreleri kültürlemek ve çatıyı açmadan önce kısa bir süre poli-L-lizine (suda% 0.1) maruz bırakmak. Şekil 2C, turuncu floresan proteini (OFP) ile etiketlenmiş KATP kanallarını eksprese eden bir HEK-293T hücresinden tipik bir çatısız membran parçasını göstermektedir. Çatısız membranlar parlak alan görüntülerinde neredeyse görünmezdi ve etiketli membran proteinlerinin floresansı veya oktadesil rhodamine B13 gibi bir membran boyası ile karşı boyama ile tanımlandı. Çatısız membranlara ek olarak, HEK-293T hücrelerinin sonikasyonu da kısmen çatısız hücre parçaları üretti (Şekil 2D) 10,17. Bu parçalar parlak alanda görülebiliyordu. Bu, sadece kapak camına zayıf bir şekilde yapışan karıştırılmış plazma membranlarının bir sonucu olabilir. Alternatif olarak, bu fragmanlar hücre içi organellerden veziküller ve zarlar içerebilir. Bu nedenle, sadece "gerçek" çatısız membranlardan görüntü elde etmek tercih edilir, çünkü hücre içi membranlarla ilişkili etiketli hedef protein, çeviri sonrası işlem ve montajın ara aşamalarını yansıtabilir. Poli-L-lizin kaplı cam üzerindeki hücrelerin kültürlenmesi, sonikasyon üzerine "gerçek" çatısız membranların daha yüksek bir verimi ile sonuçlandığı için tavsiye edilir.
Tipik bir deneyde ihtiyaç duyulan miktarları en aza indirmek için floresan nükleotidlere bir mikrohacim perfüzyon sistemi uygulandı (Şekil 2B). Sağlanan poliimid kaplı cam uç, perfüzyon kurulumumuzda elle çekilmiş bir borosilikat cam uç ile değiştirildi ve bu da floresan arka planını azalttı. Görüntülenen çatısız membranların etrafındaki nükleotid birikimini en aza indirmek için, tüm banyo odası yavaşça tamponla perfüze edildi. Bu nedenle, mikrohacim perfüzyon sistemimizden çözelti değişim oranını ölçmek ve ilgilendiğimiz bölgede amaçlanan ligand konsantrasyonuna ulaşabildiğimizi, yani perfüzyon sistemimizdeki ligandın çatısız membrana ulaşmadan önce doğrudan banyo ortamına seyreltilmediğini doğrulamak istedik. Bu olasılıkları kontrol etmek için, mikrohacimli perfüzyon sistemimizden 50 μM'lik bir tetrametilrhodamine-5-maleimid (TMRM) çözeltisinin, su ile perfüze edilmiş cam tabanlı bir kabın yüzeyine yönlendirilmiş yıkama ve yıkama işlemi ölçülmüştür (Şekil 2E). Çözelti değişim kinetiği tekrarlanabilirdi ve hem yıkama hem de yıkama için zaman sabitleri 1 s'den az olan tek bir üstel bozunma ile iyi tanımlandı. Bu tür çözüm değişim süreleri, mevcut kurulumumuzda ligand bağlanma ve bağlanmama kinetiğini ölçme yeteneğimizi sınırlar. Kapak kaymasının yüzeyinde istenen ligand konsantrasyonunu elde edebildiğimizi doğrulamak için, mikrohacim perfüzyon sistemimiz tarafından kapak fişine verilen 50 μM TMRM'nin floresan yoğunluğunu hareketsiz bir banyoda 50 μM TMRM ile karşılaştırdık (Şekil 2F). Yoğunlukta herhangi bir fark gözlenmedi, bu da banyo perfüze edildiğinde bile mikro hacimli perfüzyon sistemimizle kapak kaymasının yüzeyindeki uygun ligand konsantrasyonlarının elde edilebildiğini doğruladı.
Şekil 3A , 5 μM TNP-ATP'ye maruz kalan bir HEK-239T hücresinden çatısız bir membranda ANAP etiketli KATP kanallarından elde edilen spektral bir görüntüyü göstermektedir. Bu tür görüntüleri elde etmek için, çatısız membrandan yayılan ışık, bir CCD kamera ile seri olarak bir spektrometreden yönlendirildi. Yayılan floresan ızgaralardan kırıldı ve kamera çipine yansıtılarak spektrumlar üretildi. Elde edilen görüntüler uzamsal bilgiyi y boyutunda tutar, ancak x boyutu dalga boyu ile değiştirilmiştir. Çatısız membrana karşılık gelen ilgi alanı (ROI) turuncu renkle özetlenmiştir. Görüntüde, ANAP ve TNP-ATP'nin tepe emisyonuna karşılık gelen iki yüksek yoğunluklu bölge belirgindir. Bu, Şekil 3B'de gösterilen dalga boyu dalga boyu ortalaması (tüm ROI üzerinden) spektrumunda en iyi şekilde takdir edilmiştir. Tepe ~ 470 nm, KATP'ye dahil edilen ANAP'ye karşılık gelir; tepe ~ 535 nm TNP-ATP'ye karşılık gelir. Çözeltideki TNP-ATP'nin arka plan floresansını ve doğrudan uyarılmasını düzeltmek için, her görüntüden bir arka plan bölgesi (Şekil 3A, gri) seçilmiştir. Ortalama arka plan spektrumu Şekil 3B'de gösterilmiştir. Son spektrum, ortalama arka plan spektrumunun ortalama ROI spektrumundan çıkarılmasıyla elde edildi (Şekil 3C).
ANAP, fotobeyazlatma artefaktlarına eğilimlidir. Şekil 3D , çoklu maruziyetlerden sonra pik ANAP floresanındaki azalmayı göstermektedir. TNP-ATP'nin yokluğunda (veya TNP-ATP konsantrasyonları arasındaki yıkamalardan) çeşitli maruziyetlerden kaynaklanan pik floresan, tek üstel bir bozunmaya takıldı ve bu, fotobeyazlatma artefaktlarını düzeltmek için kullanıldı (Şekil 3E). Hem düşükten yükseğe hem de yüksekten düşüğe nükleotid konsantrasyonlarından konsantrasyon-yanıt deneyleri yapılması önerilir. Beyazlatma düzeltmesi herhangi bir ek artefakt getirmezse, sonuçlar karşılaştırılabilirolmalıdır 11.
Şekil 5A, TNP-ATP'nin yokluğunda ve varlığında ANAP etiketli KATP kanallarını eksprese eden bir hücreden elde edilen çatısız bir membrandan elde edilen temsili spektral görüntüleri göstermektedir. Düzeltilmiş spektrumlar Şekil 5B'de gösterilmiştir. Emisyon spektrumlarını gözlemleyerek, donör ve alıcı floresan emisyonu arasında net bir ayrım vardı. TNP-ATP'nin transfekte edilmemiş HEK-293T hücrelerinden naif plazma membranlarına spesifik olmayan bir şekilde bağlandığı gözlendiğinden, FRET'in donör (ANAP) floresansı10,11'de bir azalma olarak ölçülmesi önerilir. Bu zirve, etiketli reseptöre özgüydü.
Reseptörlerinde konformasyonel bir değişikliğe neden olan ligandlar için, izolasyondaki bağlanma çalışmaları, ligand bağlanma süreci hakkında doğrudan, mekanik olarak anlamlı bilgi sağlamaz18. Ligand bağlanması için konsantrasyon-yanıt ilişkisi sadece içsel bağlanma afinitesine değil, aynı zamanda ligand bağlanması ile indüklenen konformasyonel değişikliğe ve reseptörün ligand yokluğunda konformasyonu değiştirme eğilimine de bağlıdır. Ligand-reseptör etkileşimlerini vurgulayan süreçleri daha iyi anlamak için, bağlanma ölçümleri protein fonksiyonunun okunmasını sağlayan deneylerle eşleştirilebilir. Bu amaçla, iyon kanalları ideal bir model sistemdir, çünkü akımları voltaj kelepçesi kullanılarak tek molekül seviyesine kadar ms altı zaman çözünürlüğü ile ölçülebilir. Tarihsel olarak, eşleştirilmiş akım ve floresan ölçümleri, voltaj ve ligand kapılı iyon kanallarının 19,20,21 açılması ve kapanması (geçitleme) hakkında önemli bilgiler sağlamıştır. İyonik akımları ve floresan siklik nükleotidi çeşitli siklik nükleotid regüle kanallarına bağlanmayı eşzamanlı olarak ölçmek için deneyler yapılmıştır22,23,24. Bu çalışmalar, bağlanma üzerine kuantum verimini artıran bir ligand kullandı. Yamanın yakınındaki çözelti hacmindeki bağlanmamış liganddan floresan, konfokal mikroskopi22,23 kullanılarak yamaların görüntülenmesiyle çıkarılabilir. Çalışmalarımızda bağlanma, ANAP floresansındaki azalma kullanılarak ölçülmüştür. Bu sinyal kanala özgü olduğundan ve ANAP ile TNP-ATP arasındaki FRET güçlü bir şekilde mesafeye bağımlı olduğundan (~ 43 Å'de yarı maksimum), sinyalimizin spesifik olarak bağlanmamış ve bağlanmamış nükleotitler tarafından kirlenmesinden kaçınılmıştır.
Şekil 4A , tipik bir yama-kelepçe florometri (PCF) deneyini göstermektedir. Tuzlu su dolu bir borosilikat cam pipet (voltaj kelepçesi amplifikatörüne bağlı) ile ANAP etiketli KATP'yi ifade eden bir hücre arasında yüksek dirençli (GΩ) bir conta oluşturulmuştur. Sızdırmazlık oluşumundan sonra, pipet hücreden uzaklaştırıldı ve hücre içi nükleotid bağlanma bölgelerine erişim sağlandı. Pipet daha sonra mikroskop hedefinin üzerine yerleştirildi, spektrometre maskesinin yarığına ortalandı ve mikrohacim perfüzyon sisteminin çıkışı (borosilikat cam ucu ile modifiye edilmiş) pipete yaklaştırıldı (Şekil 4D). Voltaj kontrol edildi ve yamadaki kanallardan akımlar ölçüldü. ANAP etiketli KATP kanallarından gelen temsili akımlar ve spektrumlar, spektrumları akımlarla eşleştirmek için renk kodlu Şekil 4B'de gösterilmiştir. Emisyon spektrumları, çatısız membranlarda olduğu gibi arka plan ve ağartma için düzeltildi.
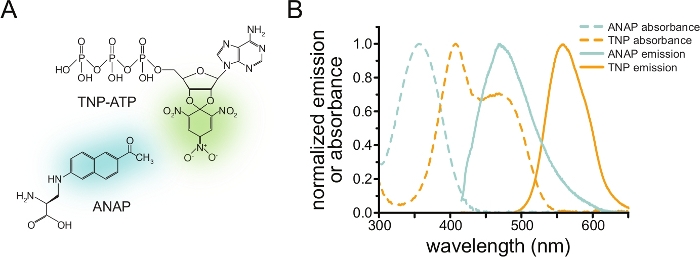
Resim 1: ANAP ve TNP-ATP uygun bir FRET çifti oluşturur. (A) ANAP ve TNP-ATP'nin yapıları. Floresan moieties vurgulanır. (B) ANAP ve TNP-ATP'nin absorbans ve floresan emisyon spektrumları. FRET için ANAP emisyonu ile TNP-ATP absorbansı arasında örtüşme gereklidir. Puljung et al. (Creative Commons Atıf Lisansı altında yayınlanmıştır, https://creativecommons.org/licenses/by/4.0/)10'dan uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
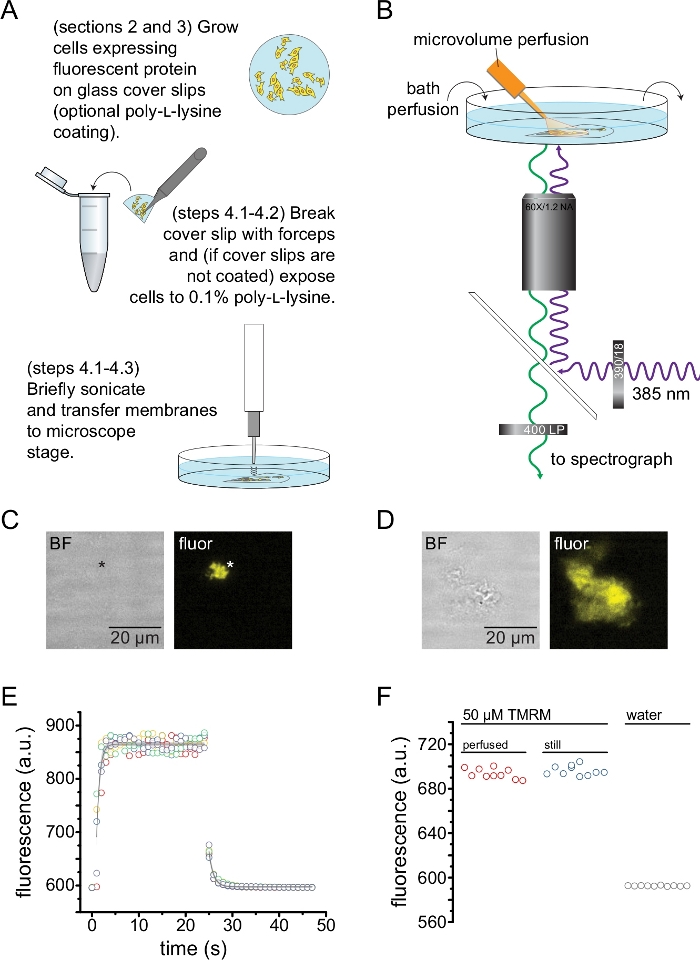
Şekil 2: Çatısız plazma membranlarında nükleotid bağlanmasının ölçülmesi. (A) Bir floresan membran proteinini eksprese eden yapışkan hücrelerden çatısız plazma membranlarının hazırlanması için şematik. Poli-L-lizin kaplı veya işlenmemiş kapak kaymalarında yetiştirilen hücreler için talimatlar verilmiştir. (B) Çatısız membranlarda nükleotid bağlanmasını ölçmek için deneysel düzenek. (C) Turuncu floresan proteini (OFP) eksprese eden bir hücreden türetilen tamamen çatısız bir plazma zarının parlak alan ve floresan görüntüleri, KATP kanallarını etiketlemiştir. Yıldız işareti, parlak alan görüntüsünde neredeyse görünmez olan membranın konumunu işaretler. OFP, 531/40 nm bant geçiş filtresinden geniş bir 565 nm LED ile uyarıldı ve 562 nm kenar dikroik ve yayılan ışık 593/40 nm bant geçiş filtresinden toplandı. (D) Turuncu floresan proteini (OFP) ifade eden bir hücreden türetilen kısmen çatısız bir membran parçasının parlak alan ve floresan görüntüleri, etiketli KATP kanalları. (E) B. Beş teknik kopyada açıklanan kurulum kullanılarak elde edilen çözüm değişim süresi kursu gösterilir. Mikrovolümlü perfüzyon sistemi 50 μM tetrametilrhodamine-5-maleimid (TMRM) ile yüklendi. Banyo ~ 0.5 mL / dak oranında su ile perfüze edildi. Yıkama (artan floresan) ve yıkama (azalan floresan) zaman kurslarından elde edilen veriler, F = A * exp (-x / τ) + y0 formunun tek bir üstel bozunumuna uyuyordu. Yıkama için zaman sabiti (τ) ~0.6 s idi. TMRM, 540/25 nm bant geçişli bir filtreden geçen geniş bir 565 nm LED ile uyarıldı ve 605/55 nm bant geçişli bir filtreden 565 nm kenar dikroik ve yayılan ışık toplandı. (F) B'de olduğu gibi mikrohacim perfüzyon sistemi kullanılarak uygulanan 50 μM'lik bir TMRM çözeltisinin floresan yoğunluğunun ve 50 μM TMRM içeren bir hareketsiz banyonun karşılaştırılması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
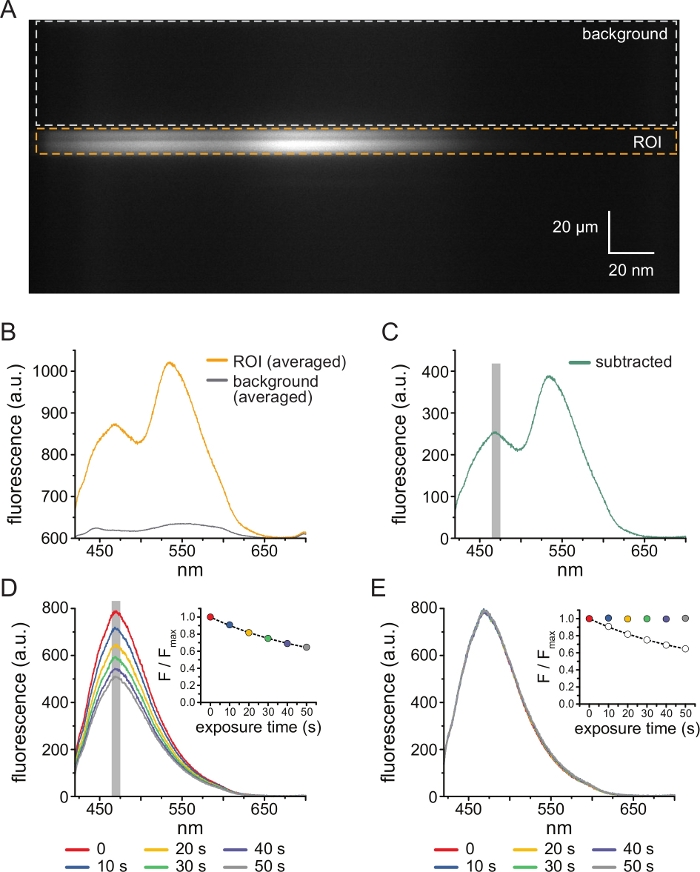
Şekil 3: Arka plan çıkarma ve ağartma düzeltmesi. (A) ANAP etiketli KATP kanallarını ifade eden bir hücreden çatısız bir plazma zarının spektral görüntüsü (y boyutunda uzamsal bilgi, x boyutunda dalga boyu). 5 μM TNP-ATP, Şekil 2B'de açıklanan kurulum kullanılarak uygulanmıştır. Turuncu kutu, çatısız membrana karşılık gelen ilgi alanını (ROI) gösterir. Gri kutu, spektrumu düzeltmek için kullanılan arka plan bölgesini gösterir. (B) A'daki ROI ve arka plan bölgelerinin dalga boyu ortalamalarından elde edilen emisyon spektrumları. (C) Ortalama arka plan spektrumunun B'deki ortalama ROI spektrumundan çıkarılmasıyla elde edilen spektrum. Ortalama yoğunluğu belirlemek için kullanılan ANAP zirvesinin etrafındaki 5 nm pencere, gri gölgeli bir alan olarak gösterilir. (D) ANAP etiketli KATP kanallarını eksprese eden bir hücreden çatısız bir plazma zarının altı ardışık 10-s maruziyetinden elde edilen spektrumlar. Fotobeyazlatmadan kaynaklanan floresandaki azalmaya dikkat edin. İç kısım, normalleştirilmiş tepe floresansının F/Fmax = A*exp(-t/τ) + (1-A) biçimindeki tek bir üstel bozunumla uyumunu gösterir. İç kısımdaki semboller spektrumlarla eşleşecek şekilde renk kodludur. (E) Fotobeyazlatma için düzeltilmiş D'deki spektrumun aynısı. İç kısım, D'den normalleştirilmiş tepe floresansını açık daireler olarak gösterirken, düzeltilmiş tepe floresansı dolu daireler kullanılarak gösterilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Yama-kelepçeli florometri (PCF) kullanılarak nükleotid bağlanma ve kanal akımlarının eşzamanlı ölçümleri. (A) Nükleotid bağlanma ve iyonik akımları ölçmek için deney düzeneğini gösteren şematik. (B) ANAP etiketli KATP kanallarını eksprese eden bir hücreden eksize edilen bir membran yamasından elde edilen örnek akımlar (solda) ve spektrumlar (sağda). Akımlar -60 mV'luk bir tutma potansiyelinde kaydedildi, 20 kHz'de sayısallaştırıldı ve 5 kHz'de filtrelendi. Gri gölgeli alan, ANAP yoğunluğunun ölçüldüğü dalga boyu aralığına karşılık gelir. Usher et al. (Creative Commons Atıf Lisansı altında yayınlanmıştır, https://creativecommons.org/licenses/by/4.0/)11. (C) 1 mM TNP-ATP'ye maruz kalan ANAP etiketli KATP kanallarını eksprese eden bir hücreden eksize edilen bir membran yamasından elde edilen spektrum. TNP-ATP floresansının gözlendiği dalga boyu aralığına karşılık gelen negatif tepeye dikkat edin. Gri gölgeli alan, ANAP floresansını ölçmek için kullanılan dalga boyu aralığını gösterir. B. Usher ve ark.'dan uyarlanmıştır (Creative Commons Atıf Lisansı, https://creativecommons.org/licenses/by/4.0/) 11. (D) 1 mM TNP-ATP'ye maruz kalan bir yama pipetinin parlak alan ve floresan görüntüleri. Yıldız işareti pipetin ucunu işaretler. (E) Aynı yama pipetinin 1 mM TNP-ATP cinsinden spektral görüntüsü. Yıldız işareti pipetin konumunu gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
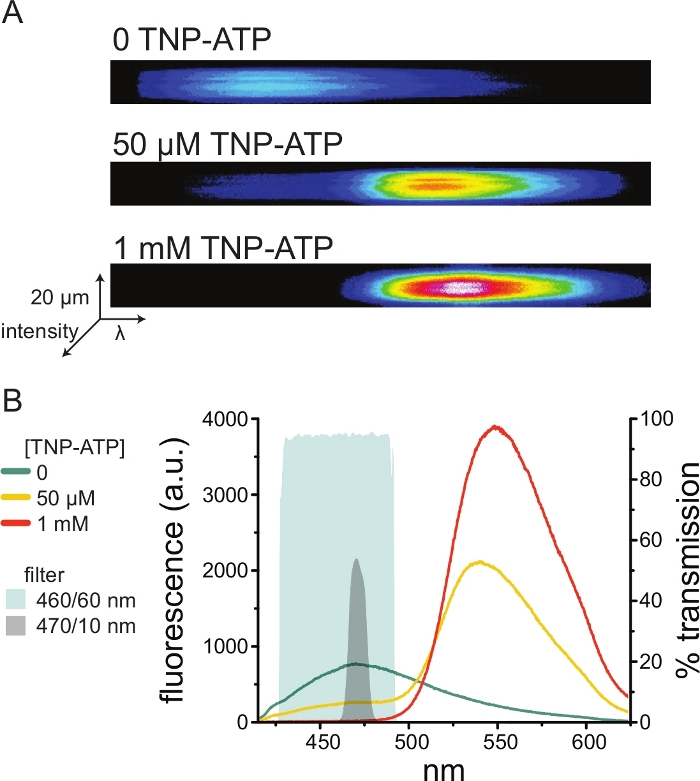
Şekil 5: ANAP etiketli K ATP kanallarınaTNP-ATP bağlanması. (A) TNP-ATP'nin yokluğunda veya 50 μM veya 1 mM TNP-ATP varlığında ANAP etiketli KATP kanallarını eksprese eden bir hücreden çatısız plazma zarının spektral görüntüleri. Yoğunluklar ısı haritası olarak gösterilir. (B) TNP-ATP tarafından ANAP floresansının söndürülmesini gösteren A'daki görüntülerden dalga boyu dalga boyu ortalaması alınmış spektrumlar. Gölgeli alanlar, bir spektrometre mevcut değilse ANAP söndürmeyi ölçmek için kullanılabilecek iki farklı bant geçişli filtreyi temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
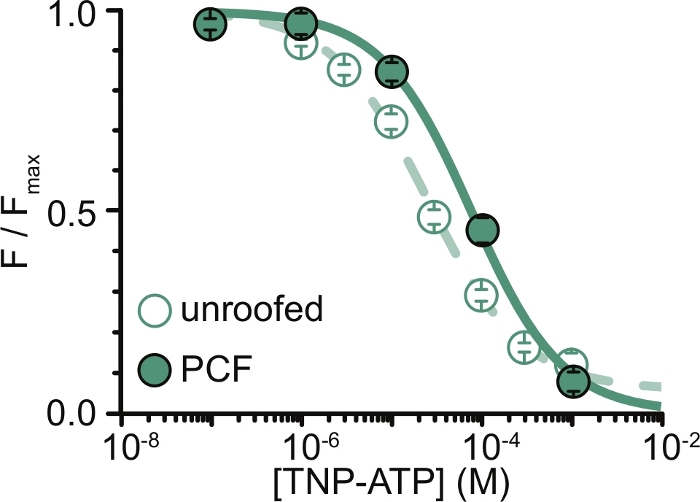
Şekil 6: ANAP etiketli K ATP kanallarınınTNP-ATP ile çatısız membranlarda ve PCF'de söndürülmesi. Usher ve ark. (Creative Commons Atıf Lisansı altında yayınlanmıştır, https://creativecommons.org/licenses/by/4.0/)11. Veriler Hill denklemine uyuyordu: F / F max = E max + (1 – E max) / (1 + 10 (EC50 –[TNP-ATP])*h). F, ölçülen floresandır, F max, nükleotid yokluğunda maksimum floresandır, Emax, doygun nükleotid konsantrasyonlarında maksimum söndürmedir ve h, Hill eğimidir. EC50, (söndürmenin yarı maksimumda olduğu nükleotid konsantrasyonu) ve [TNP-ATP] log değerleridir. Çatısız membranlar: EC50 = -4,59 (25,7 μM), h = 0,82, Emax = 0,93. PCF: EC50 = -4,11 (77,6 μM), h = 0,87, Emax = 1,00. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Adenin nükleotidinin bozulmamış membran proteinlerine gerçek zamanlı olarak bağlanmasını ölçmek için bir yöntem geliştirdik. Yöntemimiz, amber stop kodon bastırma12, hücre çatısı açma 14 ve voltaj kelepçeli florometri / PCF19,20,21,22,23,24,25 kullanılarak proteinlerin ANAP ile etiketlenmesi de dahil olmak üzere diğer birçok yerleşik tekniğe dayanmaktadır. Bu yaklaşımların sentezi, nükleotid bağlanmasının yüksek uzamsal ve zamansal çözünürlükle ölçülmesine izin verir. Nitekim, önceki çalışmamızda, bu yaklaşımı kullanarak aynı protein kompleksi üzerindeki farklı bağlanma bölgeleri arasında ayrım yapabildik10,11. Önemli olarak, bu teknik, protein fonksiyonunu koruyan koşullar altında hücresel bir ortamda az miktarda proteine doğrudan uygulanabilir. Bağlama yöntemimizi iyon kanal akımlarının doğrudan, elektrofizyolojik okuması ile birlikte kullanmak, kanal geçidi11'in moleküler temelleri hakkında zengin bilgiler edinmemizi sağlar.
Spektrometreler standart olmayan bir laboratuvar ekipmanı parçası olduğundan, ANAP yoğunluğu, bant geçişli filtreler kullanılarak göreceli izolasyonda da izlenebilir. Şekil 5B , bu tür iki filtrenin spektral özelliklerini göstermektedir. 470/10 nm bant geçişli filtre, TNP-ATP'den gelen floresan sinyalini etkili bir şekilde tarar ve tepe ANAP floresansı ile iyi örtüşür. Bununla birlikte, bu filtrenin tepe geçirgenliği sadece% 50 civarındadır, bu da loş membranlardan (veya voltaj kelepçesi altındaki eksize edilmiş membran yamalarında) iyi sinyaller elde etmeyi zorlaştırabilir. Diğer bir seçenek ise 460/60 nm bant geçiş filtresidir. 460/60 nm filtre ile TNP-ATP emisyon zirvesinin ayağı arasında 470/10 nm filtreye kıyasla biraz daha fazla örtüşme vardır. Bununla birlikte, 460/60 nm bant geçişi, floresan emisyon sinyalini artırması beklenen geniş bir ANAP zirvesi aralığında% 90-95'lik bir geçirgenliğe sahiptir.
ANAP çevreye duyarlı bir florofordur 12,26,27. En yüksek emisyon ve kuantum verimi, ilgilenilen proteinin dahil olduğu yere bağlı olarak değişir ve protein konformasyonu değiştikçe değişebilir. Bu tür değişiklikler emisyon spektrumlarından hemen belli olur, ancak ANAP yoğunluğu filtreler kullanılarak ölçüldüğünde o kadar belirgin olmaz. Her durumda, nükleotid bağlanmasından sonra ANAP çevresindeki yerel ortamdaki değişiklikler nedeniyle floresan sinyalinin değişmediğini göstermek için uygun kontroller gereklidir. Etiketlenmemiş nükleotidlerle yapılan kontrol deneyleri, ANAP yoğunluğundaki herhangi bir değişikliğin ANAP ve TNP-nükleotitleri arasındaki FRET'in sonucu olduğunu doğrulamaya yardımcı olabilir. TNP-nükleotidleri, transfekte edilmemiş hücrelerden türetilen membranlara spesifik olmayan bir şekilde bağlanabilir (plazma zarına veya doğal membran proteinlerine)10. Bağlanmayı donör floresansında bir azalma olarak ölçüyoruz, çünkü bu sinyal etiketli kanala özgüdür. Bununla birlikte, her agonist / reseptör çifti için ek kontrol deneyleri yapmanızı, örneğin donör floresanındaki değişikliğin gerçekten etiketli reseptör11'e doğrudan bağlanmanın sonucu olduğunu doğrulamak için biliniyorsa nükleotid bağlanma bölgesini mutasyona uğratmanızı öneririz. Son olarak, ANAP etiketine ek olarak floresan protein etiketi içeren yapılarla çalışılması önerilir. Bu, etiketli reseptör floresansını arka plan / otofloresandan ayırt etmeye yardımcı olur. Arka plan floresansı, ANAP'den emisyon spektrumları10'un zirvesi ve şekli ile ayırt edilebilir, ancak yalnızca filtre setleri kullanıldığında bu tür belirlemeler çok zor olabilir. Ek olarak, floresan reseptörlerini eksprese eden hücreler ve çatısız membranlar, ANAP'ı uyarmak ve aşırı fotobeyazlatma riski olmadan floresan protein etiketi kullanılarak tanımlanabilir.
PCF kayıtlarımızın çoğunda, spektrumlarımızda yüksek TNP-ATP konsantrasyonlarında güçlü bir negatif tepe gözlemledik (Şekil 4C). Bu negatif zirve, arka plan çıkarma protokolümüzün bir eseridir. Şekil 4D , 1 mM TNP-ATP'ye maruz kalan bir yama pipetinin parlak alan ve floresan görüntülerini göstermektedir. TNP-ATP'nin pipet duvarlarının hacminden dışlanmasından kaynaklanan pipet ucundaki bir gölge belirgindir ve bu gölge en çok odak düzleminde belirgindir. Şekil 4E'deki spektral görüntü, bu gölgeye karşılık gelen karanlık bir bant göstermektedir. Bu karanlık bandın üstündeki veya altındaki bir bölge arka plan çıkarma işlemi için kullanıldığında, negatif bir tepe noktası oluşturur. Önemli olarak, bu zirve TNP-ATP emisyonuna karşılık gelen bir dalga boyu aralığında meydana geldi ve ANAP söndürme ölçümlerimizi etkilemedi.
Deneylerimizin en büyük sınırlaması, floresanı ölçmek için ANAP etiketli yapıların yeterli plazma membranı ekspresyonunu elde etmekti. Çatısız membranlardan yüksek kaliteli spektrumlar elde etmek genellikle PCF'den daha kolaydı, çünkü daha büyük boyutları ve yamaların her seferinde yalnızca bir tane elde edilebildiği PCF'nin aksine, çatısız membranların tamamını hızlı bir şekilde tarama yeteneğimiz vardı. Deneylerimizde, çatısız membranlardan ve PCF deneylerinden elde edilen veriler benzerdi ancak eşdeğer değildi (Şekil 6)11. Bununla birlikte, bunun evrensel bir gözlem olması için a priori bir neden yoktur, çünkü bir yama pipetindeki proteinler çatısız membranlardakilerden farklı bir işlevsel durumda olabilir.
Burada, ANAP etiketli yapılarımızın ekspresyonunu en üst düzeye çıkarmak, özellikle hücre kültürü sıcaklığını 33 ° C10,11,16'ya düşürmek için girişimlerde bulunulmuştur. Deneyimlerimize göre, ANAP'ın konservatif bir ikame olacağı proteindeki bölgeleri tanımlamaya çalışmak, tutarlı bir şekilde iyi ifade edilen yapılarla sonuçlanmadı. ANAP birleşme bölgeleri için tüm protein bölgelerini sistematik olarak taramada ve yüzey ekspresyonu10 için adayları taramada daha başarılı olduk. ANAP etiketleme sistemi ayrıca Xenopus laevis oositlerinde de çalışır, bu da çok daha büyük membran yamalarının eksize edilmesine izin verir, böylece sinyali gürültüye26,27,28 arttırır.
Daha büyük ifade seviyelerinin daha parlak sinyallerle sonuçlanması beklenirken, floresanı ölçmek için gereken minimum kanal sayısı, floroforun parlaklığı, fotobeyazlatma derecesi, uyarma ışığının yoğunluğu ve odak düzlemi dahil olmak üzere çeşitli faktörlere bağlıdır. Teorik olarak, daha önce28,29 gösterildiği gibi floresan yoğunluğu ve kanal akımı arasında korelasyon kurularak tahminler yapılabilir. Bununla birlikte, bu tür tahminlerin güvenilirliği, tek kanallı iletkenlik ve kanalın açık olasılığı hakkında biraz bilgi gerektirir. Yukarıda listelenen faktörlere ek olarak, floresan sinyali, veziküllerle ilişkili kanallardan veya pipet camına yapışmış plazma zarının voltaj kelepçesi altında olmayan bölümlerinden de etkilenecektir.
Bu yöntem, diğer nükleotid duyarlı iyon kanallarının çalışmasına kolayca uyarlanmıştır. CFTR yapısal olarak KATP30,31'in aksesuar sülfonilüre reseptör alt ünitesine benzer. KATP CFTR geçidi gibi, nükleotid bağlanması ile kontrol edilir ve bu da onu yöntem7'mizin gelecekteki açık bir hedefi haline getirir. Pürinerjik P2X reseptörleri, hücre dışı ATP9 tarafından kapılanan iyon kanallarıdır. TNP-ATP, P2X reseptörleri32,33 için bir antagonist görevi görür. Bu nedenle, P2X aktivasyonunu incelemek için yararlı olmayacaktır, ancak P2X agonistleri ile rekabet tahlillerinde kullanılabilir. Alternatif olarak, aktivasyonu incelemek için ANAP emisyonu ile yeterli spektral örtüşmeye sahip diğer floresan ATP türevleri kullanılabilir. Alexa-647-ATP, floresan P2X agonisti34'tür. Alexa-647 ve ANAP arasında hesaplanan R0 ~ 85 Å'dır, bu da P2X'e doğrudan bağlanmanın kanala dahil edilen ANAP'ın önemli ölçüde söndürülmesine neden olması gerektiği anlamına gelir. Bununla birlikte, bu kadar uzun bir R0, komşu alt birimlere bağlı Alexa-647-ATP'den söndürme ile sonuçlanacak ve spesifik olmayan nükleotid bağlanmasının FRET ile sonuçlanma olasılığını artıracaktır. P2X reseptörlerindeki ligand bağlanma bölgesi hücre dışı olduğundan, bağlanma ölçümleri sağlam hücrelerde, tüm hücre voltaj kelepçesinde veya dış-dış membran yamalarında gerçekleştirilecektir. Yöntemimiz ayrıca, reaksiyon döngüleri için ATP'ye bağımlı olan elektrojenik ve elektrojenik olmayan taşıyıcıların ve pompaların yanı sıra G proteini bağlı P2Y reseptörlerinin bağlanması ve aktivasyonunu incelemek için de genişletilebilir. Son olarak, adenin nükleotid bağlanmasını (TNP-ATP, TNP-ADP, TNP-AMP) ölçmek için bu yöntemi geliştirmiş olsak da, aynı yaklaşım, uygun, floresan ligandın tanımlandığı hemen hemen her reseptöre bağlanmayı incelemek için kullanılabilir.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Raul Terron Exposito'ya mükemmel teknik yardım için teşekkür ederiz. Bu çalışma Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi (BB/R002517/1; MCP ve FMA) ve Wellcome Trust (203731/Z/16/A; SGU)
Malzemeler
| Name | Company | Catalog Number | Comments |
| T75 tissue-culture treated flask | StarLab | CC7682-4875 | |
| 0.1% w/v poly-L-lysine | Sigma-Aldrich | P8920 | |
| 30 mm borosilicate cover glass slips | VWR | 631-0174 | |
| 35 mm non-treated sterile dishes | CytoOne | CC7672-3340 | |
| 35 mm cover glass bottom dish | WPI | FD35-PDL-100 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 31966021 | |
| Foetal bovine serum (FBS) | Gibco | 10500-064 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| TrypLE select (tryosin) | Gibco | 12563-011 | Trypsin/EDTA reagent |
| Phosphate buffered saline (PBS) | Gibco | 14040-091 | |
| UltraPure distilled water | Invitrogen | 10977-035 | |
| HEK293T cells | ATTC | CRL-3216 | Used between passages 5-30 |
| ANAP-TFA | AsisChem | ASIS-0014 | Reconstituted in 30 mM NaOH to a final concentration of 1 mM |
| pANAP expression plasmid | Addgene | Plasmid #48696 | Encodes tRNA/tRNA synthetase pair for expression of ANAP-tagged protein |
| peRF1-E55D | Chin Lab (MRC Laboratory of Molecular Biology, Cambridge, UK) | Jason Chin: DOI: 10.1021/ja5069728 | Encodes dominant-negative eukaryotic ribosomal release factor |
| TransIT-LT1 | Mirus Bio | MIR 2300 | Lipopolyplex transfection reagent |
| Thick-walled borosilicate glass capillaries | Harvard Apparatus | GC150F-15 | |
| Tetramethylrhodamine-5-maleimide | Sigma-Aldrich | 94506 | |
| TNP-ATP | Jena Bioscience | NU-221L | Delivered at 10 mM in water |
| Nikon Eclipse TE2000-U inverted microscope microscope | Nikon | ||
| 60x water immersion objective (1.4 NA) | Nikon | MRD07602 | |
| 4-Wavelength High-Power LED Head | ThorLabs | LED4D245 | 385/490/565/625 nm LEDs |
| Four-Channel LED Driver | ThorLabs | DC4100 | |
| 390/18 nm band-pass excitation filter | ThorLabs | MF390-18 | For ANAP excitation |
| 400 nm long-pass emission filter | ThorLabs | FEL0400 | For imaging ANAP spectra |
| 416 nm edge dichroic | ThorLabs | MD416 | For imaging ANAP spectra |
| 460/60 nm band-pass emission filter | ThorLabs | MF460-60 | Suggested wide band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 470/10 nm band-pass emission filter | ThorLabs | FB470-10 | Suggested narrow band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 531/40 band-pass excitation filter | Brightline | FF01-531/40-25 | For orange fluorescent protein (OFP) excitation |
| 540/25 nm band-pass excitation filter | Chroma | D540/25X | For tetramethylrhodamine-5-maleimide (TMRM) excitation |
| 562 nm edge dichroic | Semrock | FF562-Di03 | For imaging OFP fluorescence |
| 565 nm edge dichroic | Chroma | 565DC | For imaging TMRM fluorescence |
| 593/40 nm band-pass excitation filter | Brightline | FF01-387/11-25 | For imaging OFP fluorescence |
| 605/55 nm band-pass emission filter | Chroma | D605/55M | For imaging TMRM fluorescence |
| IsoPlane-160 Imaging Spectrometer | Princeton Instruments | IsoPlane-160 | |
| PIXIS 400BR_eXcelon Camera | Princeton Instruments | PIXIS: 400BR_eXcelon | |
| Axopatch 200B amplifier | Molecular Devices | Axopatch 200B-2 | |
| Digidata 1440A digitizer | Molecular Devices | Digidata 1440A | |
| Probe sonicator | Sonics & Materials | VC-50 | For unroofing |
| REGLO digital peristaltic pump | Ismatec | ISM 832 | For bath perfusion |
| Microvolume perfusion system | ALA Scientific Instruments | ALA μFlow-8 | For TNP-ATP perfusion |
| pClamp 10.6.2 | Molecular Devices | Recording and analysing currents | |
| Lightfield 5.20.1507 | Princeton Instruments | Acquisition software for images and spectra | |
| Matlab | Mathworks | For data analysis | |
| Python 3.8.1 | Python Software Foundation | For data analysis |
Referanslar
- Garcia, M. L., Kaczorowski, G. J. Ion channels find a pathway for therapeutic success. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5472-5474 (2016).
- Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B., Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nature Reviews Drug Discovery. 16 (12), 829-842 (2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Higgins, C. F., Linton, K. J. The ATP switch model for ABC transporters. Nature Structural & Molecular Biology. 11 (10), 918-926 (2004).
- Toyoshima, C., Cornelius, F. New crystal structures of PII-type ATPases: excitement continues. Current Opinion in Structural Biology. 23 (4), 507-514 (2013).
- Craven, K. B., Zagotta, W. N. CNG and HCN channels: two peas, one pod. Annual Review of Physiology. 68, 375-401 (2006).
- Csanady, L., Vergani, P., Gadsby, D. C. Strict coupling between CFTR's catalytic cycle and gating of its Cl- ion pore revealed by distributions of open channel burst durations. Proceedings of the National Academy of Sciences of the United States of America. 107 (3), 1241-1246 (2010).
- Vedovato, N., Ashcroft, F. M., Puljung, M. C. The Nucleotide-Binding Sites of SUR1: A Mechanistic Model. Biophysical Journal. 109 (12), 2452-2460 (2015).
- Burnstock, G. Introduction to the Special Issue on Purinergic Receptors. Advances in Experimental Medicine and Biology. 1051, 1-6 (2017).
- Puljung, M., Vedovato, N., Usher, S., Ashcroft, F. Activation mechanism of ATP-sensitive K(+) channels explored with real-time nucleotide binding. Elife. 8, 41103(2019).
- Usher, S. G., Ashcroft, F. M., Puljung, M. C. Nucleotide inhibition of the pancreatic ATP-sensitive K+ channel explored with patch-clamp fluorometry. Elife. 9, 52775(2020).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. Journal of the American Chemical Society. 135 (34), 12540-12543 (2013).
- Gordon, S. E., Senning, E. N., Aman, T. K., Zagotta, W. N. Transition metal ion FRET to measure short-range distances at the intracellular surface of the plasma membrane. Journal of General Physiology. 147 (2), 189-200 (2016).
- Heuser, J. The production of 'cell cortices' for light and electron microscopy. Traffic. 1 (7), 545-552 (2000).
- Schmied, W. H., Elsasser, S. J., Uttamapinant, C., Chin, J. W. Efficient multisite unnatural amino acid incorporation in mammalian cells via optimized pyrrolysyl tRNA synthetase/tRNA expression and engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Lin, C. Y., et al. Enhancing Protein Expression in HEK-293 Cells by Lowering Culture Temperature. PloS One. 10 (4), 0123562(2015).
- Usukura, J., et al. Use of the unroofing technique for atomic force microscopic imaging of the intra-cellular cytoskeleton under aqueous conditions. Journal of Electron Microscopy. 61 (5), 321-326 (2012).
- Colquhoun, D. Binding, gating, affinity and efficacy: the interpretation of structure-activity relationships for agonists and of the effects of mutating receptors. British Journal of Pharmacology. 125 (5), 924-947 (1998).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Science's STKE. 2003 (176), 7(2003).
- Biskup, C., et al. Relating ligand binding to activation gating in CNGA2 channels. Nature. 446 (7134), 440-443 (2007).
- Kusch, J., et al. Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron. 67 (1), 75-85 (2010).
- Wu, S., et al. State-dependent cAMP binding to functioning HCN channels studied by patch-clamp fluorometry. Biophysical Journal. 100 (5), 1226-1232 (2011).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proceedings of the National Academy of Sciences of the United States of America. 110 (20), 8272-8277 (2013).
- Kalstrup, T., Blunck, R. S4-S5 linker movement during activation and inactivation in voltage-gated K(+) channels. Proceedings of the National Academy of Sciences of the United States of America. 115 (29), 6751-6759 (2018).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nature Structural & Molecular Biology. 26 (8), 686-694 (2019).
- Liu, C., et al. Patch-clamp fluorometry-based channel counting to determine HCN channel conductance. Journal of General Physiology. 148 (1), 65-76 (2016).
- Hwang, T. C., et al. Structural mechanisms of CFTR function and dysfunction. Journal of General Physiology. 150 (4), 539-570 (2018).
- Puljung, M. C. Cryo-electron microscopy structures and progress toward a dynamic understanding of KATP channels. Journal of General Physiology. 150 (5), 653-669 (2018).
- Kasuya, G., et al. Structural insights into the competitive inhibition of the ATP-gated P2X receptor channel. Nature Communications. 8 (1), 876(2017).
- Virginio, C., Robertson, G., Surprenant, A., North, R. A. Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1, P2X3, and heteromeric P2X2/3 receptors. Molecular Pharmacology. 53 (6), 969-973 (1998).
- Bhargava, Y., Nicke, A., Rettinger, J. Validation of Alexa-647-ATP as a powerful tool to study P2X receptor ligand binding and desensitization. Biochemical and Biophysical Research Communications. 438 (2), 295-300 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır