Method Article
Измерение связывания нуклеотидов с интактными функциональными мембранными белками в режиме реального времени
В этой статье
Резюме
В этом протоколе представлен метод измерения связывания адениновых нуклеотидов с рецепторами в режиме реального времени в клеточной среде. Связывание измеряется как резонансный перенос энергии Фёрстера (FRET) между производными тринитрофенилнуклеотидов и белком, меченным неканонической флуоресцентной аминокислотой.
Аннотация
Мы разработали метод измерения связывания адениновых нуклеотидов с интактными функциональными трансмембранными рецепторами в клеточной или мембранной среде. Этот метод сочетает в себе экспрессию белков, меченных флуоресцентной неканонической аминокислотой ANAP, и FRET между ANAP и производными флуоресцентных (тринитрофенил) нуклеотидов. Мы представляем примеры связывания нуклеотидов с ионными каналами K ATP, меченнымиANAP , измеренными в непокрытых плазматических мембранах и иссеченных, вывернутых наизнанку мембранных пятнах под зажимом напряжения. Последний позволяет одновременно измерять связывание лиганда и ток канала, прямое считывание функции белка. Подробно обсуждаются обработка и анализ данных, а также потенциальные подводные камни и артефакты. Этот метод обеспечивает богатое механистическое понимание лиганд-зависимого стробирования каналов KАТФ и может быть легко адаптирован для изучения других белков, регулируемых нуклеотидами, или любого рецептора, для которого может быть идентифицирован подходящий флуоресцентный лиганд.
Введение
Несколько важных классов белка напрямую регулируются связыванием лигандов. Они варьируются от растворимых ферментов до белков, встроенных в мембрану, включая рецепторные тирозинкиназы, рецепторы, связанные с G-белком (GPCR), и ионные каналы. GPCR и каналы составляют ~ 34% и ~ 15% всех текущих мишеней для лекарств, соответственно 1,2. Таким образом, существует значительный биохимический, а также медицинский интерес к разработке методов, которые обеспечивают механистическое понимание взаимодействия лиганд-рецептор. Традиционные методы измерения связывания лигандов, включая фотоаффинную маркировку и исследования связывания радиолигандов, требуют большого количества частично очищенного белка и обычно выполняются в нефизиологических условиях и временных масштабах. Идеальный метод требовал бы только небольших количеств белка, мог бы быть выполнен на интактных белках, экспрессируемых в клеточной или мембранной среде, мог бы контролироваться в режиме реального времени и был бы совместим с прямыми показаниями функции белка.
Резонансный перенос энергии Фёрстера (FRET) — это метод, который обнаруживает близость между двумя флуоресцентно меченными молекулами3. FRET возникает, когда возбужденный донорный флуорофор передает энергию безызлучательным образом молекуле-акцептору (обычно другому флуорофору). Перенос энергии приводит к гашению донорного флуоресцентного излучения и сенсибилизации акцепторного излучения (если акцептором является флуорофор). Эффективность переноса зависит от6-й степени расстояния между донором и акцептором. Кроме того, донор и акцептор должны находиться в непосредственной близости (обычно менее 10 нм) для возникновения FRET. Таким образом, FRET может быть использован для измерения прямого связывания между флуоресцентно меченным белковым рецептором и флуоресцентным лигандом.
Несколько различных белков регулируются или активируются путем связывания внутриклеточных или внеклеточных адениновых нуклеотидов (АТФ, АДФ, АМФ, цАМФ). Многие белки-транспортеры требуют гидролиза АТФ для своего реакционного цикла, включая АТФ-связывающие кассетные транспортеры и АТФазы P-типа, такие как насос Na+/K+ 4,5. АТФ-чувствительные К+ (КАТФ) каналы, трансмембранный регулятор проводимости муковисцидоза (CFTR) и циклично-нуклеотидные регулируемые каналы — все это ионные каналы, которые управляются связыванием внутриклеточных адениновых нуклеотидов, что делает их чрезвычайно чувствительными к изменениям клеточного метаболизма и сигнальной трансдукции 6,7,8 . Пуринергические рецепторы P2X и P2Y реагируют на изменения внеклеточного АТФ, который может высвобождаться в виде нейротрансмиттера или в результате повреждения тканей9. Мы разработали анализ на основе FRET для измерения связывания адениновых нуклеотидов с мембранными белками в режиме реального времени. Ранее мы уже применяли этот метод для изучения связывания нуклеотидов с каналами КАТФ 10,11.
Чтобы измерить связывание нуклеотидов через FRET, интересующий белок должен быть сначала помечен флуорофором. Флуоресцентная метка должна быть вставлена в интересующий белок таким образом, чтобы она находилась достаточно близко к сайту связывания лиганда для возникновения FRET, с особой осторожностью, чтобы гарантировать, что метка не влияет на общую структуру и функцию белка. Для этого мы используем метод, разработанный Чаттерджи и др., с использованием подавления янтарного стоп-кодона для вставки флуоресцентной неканонической аминокислоты (l-3- (6-ацетилнафталин-2-иламино)-2-аминопропионовая; ANAP) на нужном участке12. Мы измеряем связывание нуклеотидов как FRET между меченным ANAP белком и флуоресцентными производными тринитрофенила (TNP) нуклеотида (рис. 1A). Спектр излучения для ANAP перекрывается со спектром поглощения TNP-нуклеотидов, что является условием, необходимым для возникновения FRET (рис. 1B). Здесь мы опишем два разных типа эксперимента по связыванию. Во-первых, связывание нуклеотидов с внутриклеточной стороной меченых ANAP каналов KATP измеряется в клетках, которые были открыты ультразвуком, оставляя адгезивные фрагменты плазматической мембраны на стеклянном покровном листке10,11,13,14.
Во втором методе связывание нуклеотидов с мечеными ANAP каналами KATP измеряется в мембранном пластыре под зажимом напряжения, что позволяет одновременно измерять ионные токи и флуоресценцию. Комбинируя эти два экспериментальных подхода, изменения в связывании могут быть напрямую коррелированы с изменениями в функцииканала 11. Обсуждаются типичные результаты, потенциальные подводные камни и анализ данных.
протокол
1. Подготовка покровных листов
ПРИМЕЧАНИЕ: Эти этапы должны выполняться в стерильном колпаке для культивирования тканей. Количество дается на приготовление 10 блюд.
- Поместите десять автоклавных боросиликатных покровных стекол диаметром 30 мм по отдельности в десять необработанных стерильных блюд диаметром 35 мм и один раз промойте 2 мл стерильной дистиллированной воды.
- Разбавьте 1 мл 0,1% мас./об. раствора поли-L-лизина в стерильной дистиллированной воде до общего объема 10 мл (конечная концентрация 0,01% мас./об.). Хорошо перемешайте, затем нанесите пипеткой по 1 мл на каждое покровное стекло и выдержите при комнатной температуре в течение 20 минут.
- Аспирируйте поли-L-лизин и дважды промойте каждый покровный лист не менее чем 2 мл стерильной дистиллированной воды. Оставить до полного высыхания, т.е. не менее 3 ч.
2. Посев клеток HEK-293T
ПРИМЕЧАНИЕ: Эти этапы должны выполняться в вытяжке для культивирования тканей. Клетки HEK-293T были выбраны из-за их низкого токоточного фона и простоты выращивания в культуре. Этот протокол может быть адаптирован к другим типам клеток.
- Промойте 80-90% сливающуюся колбу T75 с клетками HEK-293T один раз 12 мл фосфатного буферного физиологического раствора (PBS) перед инкубацией с 2 мл трипсина в течение 2-5 минут или до тех пор, пока клетки полностью не отделятся и почти полностью не диссоциируют.
- Ресуспендируйте клетки, добавив 10 мл модифицированной среды Dulbecco Eagle Medium (DMEM) с добавлением 10% эмбриональной бычьей сыворотки, 100 ЕД / мл пенициллина и 100 мкг / мл стрептомицина. Пипеткой аккуратно прижмите ко дну колбы, чтобы разбить оставшиеся скопления клеток.
- Добавьте 2 мл дополненного ДМЭМ к желаемому количеству 35-миллиметровых посуд, содержащих покровные шликеры с покрытием. Добавьте 100 мкл ресуспендированных клеток в каждую чашку. Инкубировать в течение ночи при температуре 37 °C.
3. Трансфекция
ПРИМЕЧАНИЕ: Эти этапы должны выполняться в вытяжке для культивирования тканей. Количества приведены для трансфекции 10 блюд. Для сайт-специфического включения ANAP кодон ДНК в положении, предназначенном для маркировки, должен быть заменен стоп-кодоном янтарного (TAG). Эта конструкция котрансфицируется двумя плазмидами: pANAP и peRF1-E55D12,15. pANAP кодирует несколько копий ANAP-специфической пары тРНК/тРНК-синтетазы. В присутствии ANAP трансфекция этой плазмиды продуцирует тРНК, заряженную ANAP, которая распознает янтарный стоп-кодон. peRF1-E55D кодирует доминирующий отрицательный фактор высвобождения рибосомы, который увеличивает выход полноразмерного белка, меченного ANAP.
- Подготовьте пробирку объемом 1,5 мл с 10 мкг pANAP, 10 мкг peRF1-E55D и ДНК для конструкции, предназначенной для мечения ANAP. Доведите до конечного объема 500 мкл с ДМЭМ без добавок.
- В отдельной пробирке готовят 3 мкл реагента для трансфекции на основе липидов (см. Таблицу материалов) на каждый 1 мкг ДНК и доводят до конечного объема 500 мкл с недополненным ДМЭМ.
- Смешайте смеси ДНК и реагентов для трансфекции в одной пробирке и инкубируйте в течение 20 минут при комнатной температуре.
- Добавьте 400 мкл 1 мМ запаса ANAP (трифторацетатная соль в 30 мМ NaOH) к 20 мл дополненного DMEM для конечной концентрации 20 мкМ ANAP. Замените старую среду из гальванических ячеек на 2 мл носителя, содержащего ANAP, на чашку.
- Пипеткой нанесите 10% смеси для трансфекции ДНК на каждое блюдо. Инкубировать при 33 °C в течение 2-4 дней перед экспериментами. Инкубация при 33 °C замедляет деление клеток и увеличивает выход белка на клетку16.
4. Эксперименты с мембраной без крыши
- Используйте пару щипцов, чтобы разорвать покровное полотно с трансфицированными клетками на более мелкие фрагменты.
- Выполните одну из приведенных ниже процедур, чтобы снять крышу с клеток.
- При использовании защитного стекла с предварительно нанесенным покрытием промойте фрагмент PBS, затем поместите его на дно 35-миллиметровой посуды, содержащей 2 мл PBS. Кратко обработайте ультразвуком с помощью зондового ультразвукового аппарата (50 Вт, амплитуда 20-40%, зонд 3 мм), расположенного на высоте 3-5 мм над образцом, чтобы разблокировать клетки и оставить после себя прилипшие фрагменты плазматической мембраны (рис. 2A, C).
ПРИМЕЧАНИЕ: Мощность, продолжительность и высота зонда над образцом могут варьироваться для получения высокого выхода непокрытых мембран без полного оголения покровного стекла. - Если вы не используете предварительно покрытые покровные листы, промойте фрагмент покровного листа PBS, затем окуните в пробирку, содержащую 0,1% по массе / об. поли-L-лизина в течение ~ 30 с, прежде чем кратковременно обработать ультразвуком (как на шаге 4.2.1), чтобы разблокировать клетки и оставить после себя непокрытые / частично непокрытые фрагменты плазматической мембраны (рис. 2A, C, D). Было продемонстрировано, что кратковременное воздействие поли-L-лизина улучшает адгезию к покровному стеклу13.
- При использовании защитного стекла с предварительно нанесенным покрытием промойте фрагмент PBS, затем поместите его на дно 35-миллиметровой посуды, содержащей 2 мл PBS. Кратко обработайте ультразвуком с помощью зондового ультразвукового аппарата (50 Вт, амплитуда 20-40%, зонд 3 мм), расположенного на высоте 3-5 мм над образцом, чтобы разблокировать клетки и оставить после себя прилипшие фрагменты плазматической мембраны (рис. 2A, C).
- Поместите обработанный ультразвуком фрагмент в 35-миллиметровую чашку со стеклянным дном, содержащую 2 мл раствора для ванны, и установите на инвертированный микроскоп, оснащенный объективом с высоким NA, 60-кратным погружением в воду. Порт камеры микроскопа соединен со спектрографом последовательно с высокочувствительной ПЗС-камерой. Перфузируйте камеру ванны (0,5 – 1 мл / мин) буфером с помощью перистальтического насоса. Состав буфера будет варьироваться в зависимости от исследуемого белка.
ПРИМЕЧАНИЕ: Если пользователь не имеет доступа к объективу с большим рабочим расстоянием, может быть невозможно сфокусироваться на фрагментах мембраны без крышки из-за дополнительной высоты покровного стекла. Альтернативой является посев клеток непосредственно на чашки со стеклянным дном из поли-L-лизина (см. Таблицу материалов для примера). Это также уменьшит потенциальные аберрации в изображении, связанные с фокусировкой через два куска стекла. Эти аберрации не влияют на форму полученных спектров. - Идентификация фрагментов мембраны без крыши, экспрессирующих канал, меченный ANAP, путем поиска флуоресценции канала (рис. 2, C, D).
ПРИМЕЧАНИЕ: Рекомендуется использовать дополнительную флуоресцентную метку (где спектр излучения отличается от спектра излучения ANAP), чтобы помочь идентифицировать непокрытые мембраны, содержащие интересующий белок. Эксперименты, показанные на рисунке 2C,D, проводились на ANAP-меченных каналах с С-концевыми флуоресцентными белковыми метками. - Частично зажмите маску спектрометра (подъем ~ 10%) между портом камеры на микроскопе и спектрографом. Тень маски появится на изображении камеры. Совместите непокрытую мембрану с маской спектрометра, отрегулировав столик микроскопа. Получите яркое поле и флуоресцентное изображение непокрытой мембраны. Они будут использоваться для выбора интересующего региона для анализа.
- Поднесите наконечник микрообъемной перфузионной системы близко к непокрытой мембране.
ПРИМЕЧАНИЕ: Чтобы уменьшить фоновую флуоресценцию, отток перфузионной системы был заменен специальным наконечником, изготовленным из боросиликатного стекла. - Чтобы получить изображение спектров флуоресценции, возбуждайте мембрану с помощью светодиода с длиной волны 385 нм через полосовой фильтр возбуждения 390/18 нм и дихроичный край 416 нм. Соберите излучаемый свет через фильтр длинных частот 400 нм (рис. 2B).
- Включите маску спектрометра и убедитесь, что излучаемый свет пропускается. Задействуйте решетки спектрометра (300 канавок/мм). Когда решетки установлены, свет, рассеиваемый спектрометром, будет проецироваться на чип ПЗС-камеры для получения спектральных изображений (рис. 3A). Эти изображения сохраняют пространственную информацию в измерении Y . Измерение x заменяется длиной волны.
- Необязательно, если интересующий белок помечен флуоресцентным белком, получают спектральное изображение флуоресцентного белка с использованием соответствующего набора фильтров.
- Сделайте одно или несколько 0,1-10 с воздействия в начале эксперимента при перфузии буферного раствора без нуклеотидов. Они будут использоваться для корректировки и нормализации данных на протяжении остальной части эксперимента (см. раздел 5 ниже).
ПРИМЕЧАНИЕ: Выбор времени экспозиции будет зависеть от достигнутого уровня экспрессии, яркости флуорофора и оптики. Время воздействия должно быть выбрано таким образом, чтобы максимизировать сигнал и свести к минимуму наблюдаемую скорость обесцвечивания. Диапазон времени экспозиции, приведенный в 4.10, подходит для измерений равновесной связи, но может быть полезен для измерения более медленных кинетических изменений10. Возможность использовать короткое время экспозиции для отслеживания более быстрой кинетики будет ограничена уровнями экспрессии белка и фотообесцвечиванием, а не аппаратным обеспечением. - Применяют диапазон концентраций ТНП-АТФ (обычно приготовленного в растворе ванны), чтобы установить кривую концентрации-реакции. Перфузируйте каждый раствор в течение не менее 1 мин, чтобы обеспечить достижение устойчивого состояния, и смывайте каждую концентрацию раствором для ванны в течение не менее 1 мин.
ПРИМЕЧАНИЕ: Важно убедиться, что перфузионная система может быстро достичь равновесия (рис. 2E) и достичь правильной локальной концентрации TNP-АТФ (рис. 2F). - Подвергайте воздействию (с той же продолжительностью, что и на шаге 4.10) при каждой концентрации и в конце каждого смыва.
5. Спектральный анализ
ПРИМЕЧАНИЕ: Эти инструкции написаны для использования с кодом анализа "pcf.m", который можно найти на GitHub. https://github.com/mpuljung/spectra-analysis10. Дополнительный и альтернативный код можно найти на https://github.com/smusher/KATP_paper_201911. Здесь мы описали операции, выполняемые программным обеспечением, чтобы пользователь мог создать свой собственный код или проанализировать данные вручную.
- Запустите программу анализа, введя имя программы («pcf») в командной строке.
- Когда откроется диалоговое окно открытия файла/папки с запросом: «Выбрать файлы для ROI», выберите имена файлов, связанные с изображениями светлого поля и флуоресценции непокрытой мембраны. В командной строке появится запрос на ввод имени выходного файла.
- Введите имя файла и нажмите Enter.
- Когда программное обеспечение отображает изображения светлого поля и флуоресценции, выберите область интереса (ROI) в спектральном изображении, соответствующую расположению фрагмента мембраны без крыши или вырезанного участка (см. раздел 6), следуя подсказкам программного обеспечения. Выберите фоновую область на том же спектральном изображении (представляющую тот же диапазон длин волн, что и в ROI), соответствующую участку покровного стекла или тарелки без прикрепленной мембраны (рис. 3A). Программное обеспечение предложит щелкнуть верхнюю часть ROI и нажать Enter, щелкнуть нижнюю часть ROI и нажать Enter, а затем повторить этот процесс для фоновой области.
- Когда откроется диалоговое окно открытия файла/папки с запросом: «Выберите файл для FP Spectrum», выберите имя файла, связанное со спектром флуоресцентного белка (FP) (необязательный шаг 4.9). Если спектр FP не был получен, выберите другой файл спектра. Спектр FP служит для контроля качества, чтобы различать меченый белок и фоновую флуоресценцию.
- Когда откроется диалоговое окно открытия файла/папки с запросом: «Выбрать файлы для анализа», выберите все файлы, соответствующие спектрам ANAP (от шагов 4.10 до 4.12), включая файлы, необходимые для коррекции отбеливания.
- Когда откроется диалоговое окно открытия файла/папки с запросом: «Выбрать файлы для сбора отбеливания», выберите подмножество файлов из шага 5.6, соответствующее исходным спектрам, полученным в безнуклеотидном растворе в начале эксперимента, или спектрам, полученным во время промывки в безнуклеотидном растворе, которые будут использоваться для коррекции (от шагов 4.10 до 4.12).
- Линейное усреднение каждого изображения для получения спектров, т. е. усреднение интенсивности для всех пикселей в измерении y ROI или фоновой области на каждой длине волны. (Рисунок 3В). Вычтите полученный усредненный фоновый спектр из усредненного спектра, полученного из ROI, чтобы удалить фоновую флуоресценцию и флуоресценцию из несвязанного TNP-ATP (рис. 3C). Эти шаги выполняются программным обеспечением автоматически.
- Определите интенсивность ANAP для каждого воздействия, усреднив интенсивность окна 5 нм, сосредоточенного вокруг пика ANAP вычитаемых спектров (обычно ~ 470 нм, но может варьироваться в зависимости от местного микроокружения остатка ANAP).
ПРИМЕЧАНИЕ: На рисунке 3D показаны 6 спектров, полученных в результате последовательных 10-секундных экспозиций фрагмента мембраны без крыши, экспрессирующего каналы, помеченные ANAP. На врезке показана усредненная интенсивность пика каждого спектра. Программное обеспечение автоматически найдет пиковую длину волны в первом полученном спектре и будет использовать это значение повсюду. Интенсивность будет автоматически рассчитана программным обеспечением. - Нормализуйте интенсивность ANAP для каждого эксперимента, разделив интенсивность ANAP данного воздействия (F) на интенсивность ANAP первого воздействия во временном ряду, который был взят на шаге 4.10 (Fmax). Опять же, программное обеспечение выполняет эти вычисления автоматически.
- Для получения данных выполните следующие действия.
- Чтобы скорректировать фотообесцвечивание ANAP, сначала установите один экспоненциальный распад (F / Fmax) = A * exp (-t / τ) + (1-A), где t - кумулятивное время экспозиции, τ - постоянная времени и A - амплитуда) либо к промежуточным этапам промывки между применениями TNP-ATP, либо к многократным начальным воздействиям, предпринятым перед промывкой на TNP-ATP (рис. 3D, врезка).
ПРИМЕЧАНИЕ: Программное обеспечение отобразит эту подгонку и предложит принять или отклонить ее. Если подгонка будет отклонена, будет предоставлена еще одна возможность выбрать файлы для коррекции отбеливанием. - Разделите нормализованные (на шаге 5.10) спектры ANAP на предсказанное значение экспоненциального соответствия из шага 5.11.1 в каждый момент времени (рис. 3E).
ПРИМЕЧАНИЕ: Для показанного примера наблюдаемый нормализованный пик флуоресценции при 50 с составляет 0,65, а прогнозируемая флуоресценция от экспоненциального соответствия составляет 0,64. Чтобы исправить обесцвечивание, разделите наблюдаемое значение (0,65, вставка на рисунке 3E, пустой круг) на прогнозируемое значение (0,64, вставка на рисунке 3E, пунктирная линия), чтобы получить скорректированное значение (~1, вставка на рисунке 3E, цветной круг). Если коррекция отбеливания адекватна, интенсивность ANAP от всех воздействий, приобретенных в отсутствие нуклеотидов, должна быть примерно одинаковой (рис. 3E). Эти расчеты выполняются программным обеспечением автоматически. - Получите выходные данные в виде изображения, отображающего данные, и электронную таблицу с вкладками, содержащую необработанные спектры, вычитаемые спектры, спектры, скорректированные для фотообесцвечивания, и пиковые данные для каждого файла, чтобы можно было провести дальнейший анализ.
- Чтобы скорректировать фотообесцвечивание ANAP, сначала установите один экспоненциальный распад (F / Fmax) = A * exp (-t / τ) + (1-A), где t - кумулятивное время экспозиции, τ - постоянная времени и A - амплитуда) либо к промежуточным этапам промывки между применениями TNP-ATP, либо к многократным начальным воздействиям, предпринятым перед промывкой на TNP-ATP (рис. 3D, врезка).
6. Эксперименты по флуорометрии с патч-зажимом
- Вытащите пластырные пипетки из толстостенных капилляров из боросиликатного стекла до сопротивления от 1,5 МОм до 2,5 МОм при заполнении раствором пипетки. Состав раствора пипетки будет варьироваться в зависимости от исследуемого белка.
- Перенесите покровное стекло с трансфицированными клетками на 35-миллиметровую чашку со стеклянным дном, содержащую 2 мл раствора для ванны, и установите на инвертированный микроскоп, оснащенный объективом с высоким NA, 60-кратным погружением в воду. Перфузируйте камеру ванны (0,5 – 1 мл/мин) раствором для ванны с помощью перистальтического насоса. Что касается раствора для пипетки, то раствор для ванны будет варьироваться в зависимости от исследуемого белка.
- Идентификация клетки, экспрессирующей каналы, меченные ANAP, путем поиска флуоресценции на клеточной мембране.
- Наполните пластырную пипетку раствором для пипетки. Слегка надавите на пипетку и поместите в камеру ванны. Прижмите пипетку к мембране клетки и аккуратно отсосите для достижения уплотнения GΩ (рис. 4A).
- Иссеките пластырь, быстро отодвинув держатель пипетки от ячейки (рис. 4A).
ПРИМЕЧАНИЕ: Иссечение пластыря таким образом должно образовывать вывернутый наизнанку пластырь, при этом цитозольные домены белка подвергаются воздействию перфузионной системы. Если местоположение исследуемого сайта связывания нуклеотидов не является цитозольным, для проведения экспериментов с PCF необходимо будет использовать наружные патчи или записи целых клеток. - Поднесите наконечник пластыря к кончику перфузионной системы и убедитесь, что пластырь находится в щели маски спектрометра (рис. 4A).
- Применяйте ТНП-АТФ и спектры изображения, как показано на этапах 4.10-4.12, одновременно регистрируя реакцию ионного тока на применение нуклеотидов.
ПРИМЕЧАНИЕ: Стекло пипетки может создавать пространственные аберрации и отражения на полученных изображениях. Однако эти аберрации не повлияют на форму полученных спектров, и отраженный возбуждающий свет легко отделяется от флуоресценции с помощью спектрографа или длиннопроходного эмиссионного фильтра. - Проанализируйте спектры. Спектры, полученные с иссеченных участков, могут демонстрировать чрезмерное вычитание несвязанной флуоресценции TNP-АТФ из-за исключения TNP-АТФ из стекла пластыря-пипетки (рис. 4C-E). Это чрезмерное вычитание не влияет на спектр излучения ANAP и поэтому может быть проигнорировано.
ПРИМЕЧАНИЕ: Поскольку сигнал флуоресценции в вырезанных участках будет ниже, чем в мембранах без крыши, важно использовать время экспозиции, которое дает достаточно высокое соотношение сигнал/шум без слишком быстрого обесцвечивания ANAP.
Результаты
На рисунке 2 изображена базовая экспериментальная установка для измерения связывания нуклеотидов с флуоресцентными белками в непокрытых мембранных фрагментах, полученных с помощью ультразвука (рис. 2A, B). Для получения непокрытых мембран использовались два различных подхода: непосредственно культивирование клеток на покрытых поли-L-лизином покровных стеклах или культивирование клеток на необработанном стекле и кратковременное воздействие на них поли-L-лизина (0,1% в воде) перед снятием крыши. На рисунке 2C изображен типичный фрагмент мембраны без крыши из клетки HEK-293T, экспрессирующей каналы K ATP, помеченные оранжевым флуоресцентным белком (OFP). Непокрытые мембраны были практически невидимы на изображениях яркого поля и были идентифицированы флуоресценцией меченых мембранных белков или встречным окрашиванием мембранным красителем, таким как октадецилродродамин B13. В дополнение к непокрытым мембранам, обработка ультразвуком клеток HEK-293T также произвела частично непокрытые фрагменты клеток (рис. 2D) 10,17. Эти фрагменты были видны в светлом поле. Это может быть результатом взъерошенных плазматических мембран, которые плохо прилипают к покровному стеклу. Альтернативно, эти фрагменты могут содержать везикулы и мембраны из внутриклеточных органелл. Таким образом, предпочтительно получать изображения только с «истинных» непокрытых мембран, поскольку меченый белок-мишень, связанный с внутриклеточными мембранами, может отражать промежуточные стадии посттрансляционной обработки и сборки. Рекомендуется культивирование клеток на стекле с поли-L-лизин-покрытием, так как это привело к более высокому выходу «истинных» непокрытых мембран при обработке ультразвуком.
Микрообъемная перфузионная система была применена к флуоресцентным нуклеотидам, чтобы свести к минимуму количества, необходимые в типичном эксперименте (рис. 2B). Прилагаемый стеклянный наконечник с полиимидным покрытием был заменен наконечником из боросиликатного стекла, вытянутым вручную, в нашей перфузионной установке, что уменьшило фон флуоресценции. Чтобы свести к минимуму накопление нуклеотидов вокруг непокрытых мембран, вся камера ванны медленно перфузировалась буфером. Таким образом, мы хотели измерить скорость изменения раствора из нашей микрообъемной перфузионной системы и убедиться, что мы смогли достичь желаемой концентрации лиганда в интересующей нас области, т. е. что лиганд из нашей перфузионной системы не был разбавлен непосредственно в среде для купания до того, как достигнет непокрытой мембраны. Чтобы контролировать эти возможности, были измерены промывка и вымывание 50 мкМ раствора тетраметилродамина-5-малеимида (TMRM) из нашей микрообъемной перфузионной системы, направленной на поверхность стеклянной посуды, перфузированной водой (рис. 2E). Кинетика обмена раствора была воспроизводима и хорошо описывалась одним экспоненциальным распадом с временными константами менее 1 с как для промывки, так и для вымывания. Такое время обмена растворами ограничивает нашу способность измерять кинетику связывания и несвязывания лигандов в нашей текущей установке. Чтобы убедиться, что нам удалось достичь желаемой концентрации лиганда на поверхности покровного стекла, мы сравнили интенсивность флуоресценции 50 мкМ TMRM, подаваемого на покровное стекло нашей микрообъемной перфузионной системой, с 50 мкМ TMRM в неподвижной ванне (рис. 2F). Никакой разницы в интенсивности не наблюдалось, что подтверждает, что соответствующие концентрации лиганда на поверхности покровного стекла с помощью нашей микрообъемной перфузионной системы могут быть достигнуты даже при перфузии ванны.
На рисунке 3A показано спектральное изображение, полученное из каналов K ATP, помеченныхANAP , в непокрытой мембране из ячейки HEK-239T, подвергшейся воздействию 5 мкМ ТНП-АТФ. Для получения таких изображений излучаемый свет от непокрытой мембраны направлялся через спектрометр последовательно с ПЗС-камерой. Испускаемая флуоресценция дифрагировала от решеток и проецировалась на чип камеры, создавая спектры. Полученные изображения сохраняют пространственную информацию в измерении y , но измерение x было заменено длиной волны. Область интереса (ROI), соответствующая непокрытой мембране, обведена оранжевым цветом. На изображении видны две области высокой интенсивности, соответствующие пиковому выбросу ANAP и TNP-ATP. Лучше всего это было оценено в спектре, усредненном по длине волны (по всей рентабельности инвестиций), показанном на рисунке 3B. Пик ~470 нм соответствует ANAP, включенному в KATP; пик ~535 нм соответствует ТНП-АТФ. Для коррекции фоновой флуоресценции и прямого возбуждения ТНП-АТФ в растворе из каждого изображения была выбрана фоновая область (рис. 3А, серый цвет). Усредненный фоновый спектр показан на рисунке 3B. Окончательный спектр был получен путем вычитания усредненного фонового спектра из усредненного спектра ROI (рис. 3C).
ANAP склонен к фотообесцвечиванию артефактов. На рисунке 3D показано снижение пиковой флуоресценции ANAP после многократного воздействия. Пиковая флуоресценция от нескольких воздействий в отсутствие ТНП-АТФ (или от промывок между концентрациями ТНП-АТФ) была подогнана к однократному экспоненциальному распаду, и это использовалось для коррекции артефактов фотообесцвечивания (рис. 3E). Рекомендуется проводить эксперименты «концентрация-реакция» как от низких до высоких, так и от высоких до низких концентраций нуклеотидов. Если коррекция отбеливанием не приводит к появлению каких-либо дополнительных артефактов, результаты должны быть сопоставимы11.
На рисунке 5A показаны репрезентативные спектральные изображения с непокрытой мембраны, полученные из клетки, экспрессирующей ANAP-меченные каналы KATP в отсутствие и присутствие TNP-АТФ. Скорректированные спектры показаны на рисунке 5B. Наблюдая за спектрами излучения, наблюдалось четкое разделение между донорным и акцепторным флуоресцентным излучением. Поскольку наблюдалось некоторое неспецифическое связывание TNP-АТФ с наивными плазматическими мембранами из нетрансфицированных клеток HEK-293T, рекомендуется количественно определить FRET как снижение флуоресценции донора (ANAP)10,11. Этот пик был специфичен для меченого рецептора.
Для лигандов, которые индуцируют конформационное изменение в их рецепторе, исследования связывания изолированно не дают прямой, механистически значимой информации о процессе связывания лиганда18. Соотношение концентрация-реакция при связывании лиганда зависит не только от собственного сродства связывания, но и от конформационных изменений, вызванных связыванием лиганда, и от присущей рецептору склонности к изменению конформации в отсутствие лиганда. Чтобы лучше понять процессы, лежащие в основе взаимодействия лиганд-рецептор, измерения связывания могут быть сопряжены с экспериментами, которые обеспечивают считывание функции белка. С этой целью ионные каналы являются идеальной модельной системой, поскольку их токи могут быть измерены с временным разрешением менее чем мс вплоть до уровня одной молекулы с помощью зажима напряжения. Исторически сложилось так, что парные измерения тока и флуоресценции дали значительное представление об открытии и закрытии (стробировании) потенциал-зависимых и лиганд-управляемых ионных каналов 19,20,21. Проведены эксперименты по одновременному измерению ионных токов и связывания флуоресцентных циклических нуклеотидов с различными циклическими нуклеотидно-регулируемыми каналами22,23,24. В этих исследованиях использовался лиганд, который увеличивал его квантовый выход при связывании. Флуоресценцию от несвязанного лиганда в объеме раствора вблизи пластыря можно вычесть путем визуализации пластырей с помощью конфокальной микроскопии22,23. В наших исследованиях связывание измерялось с использованием снижения флуоресценции ANAP. Поскольку этот сигнал специфичен для канала, а FRET между ANAP и TNP-ATP сильно зависит от расстояния (половина максимума при ~ 43 Å), было предотвращено загрязнение нашего сигнала неспецифически связанными и несвязанными нуклеотидами.
На рисунке 4A показан типичный эксперимент по флуорометрии с патч-зажимом (PCF). Между пипеткой из боросиликатного стекла, заполненной физиологическим раствором (подключенной к усилителю напряжения), и ячейкой, экспрессирующей K ATP с меткойANAP, было сформировано уплотнение с высоким сопротивлением (GΩ). После образования уплотнения пипетку оттягивали от клетки, открывая доступ к местам внутриклеточного связывания нуклеотидов. Затем пипетку располагали над объективом микроскопа, центрировали в щели маски спектрометра, а поток системы микрообъемной перфузии (модифицированной наконечником из боросиликатного стекла) приближали к пипетке (рис. 4D). Напряжение контролировалось, а токи измерялись из каналов в пластыре. Репрезентативные токи и спектры из каналов KАТФ , помеченных ANAP, показаны на рисунке 4B с цветовой кодировкой для соответствия спектров токам. Спектры излучения были скорректированы на фон и обесцвечивание, как и для непокрытых мембран.
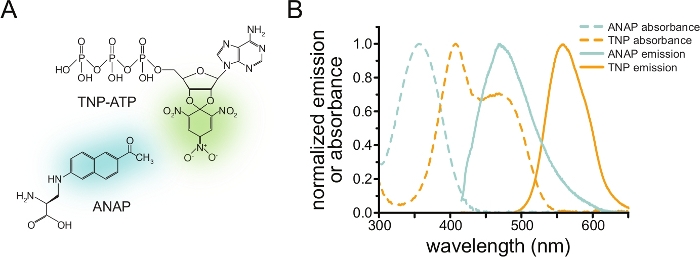
Рисунок 1: ANAP и TNP-ATP образуют подходящую пару FRET. а) Структуры ANAP и TNP-ATP. Флуоресцентные фрагменты выделены. (B) Спектры поглощения и флуоресценции излучения ANAP и TNP-ATP. Перекрытие между излучением ANAP и поглощением TNP-ATP требуется для FRET. Адаптировано из Puljung et al. (опубликовано под лицензией Creative Commons Attribution License, https://creativecommons.org/licenses/by/4.0/)10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
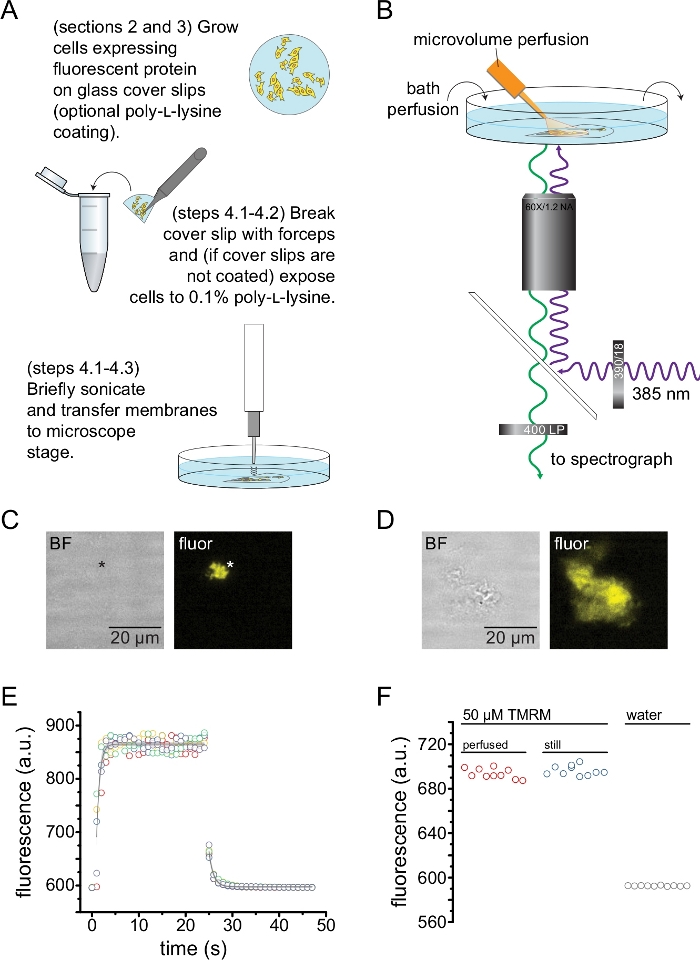
Рисунок 2: Измерение связывания нуклеотидов в непокрытых плазматических мембранах. (A) Схема получения непокрытых плазматических мембран из адгезивных клеток, экспрессирующих флуоресцентный мембранный белок. Инструкции приведены для клеток, выращенных на покрытых поли-L-лизином или необработанных покровных листах. (B) Экспериментальная установка для измерения связывания нуклеотидов в непокрытых мембранах. (C) Яркое поле и флуоресцентные изображения полностью непокрытой плазматической мембраны, полученной из клетки, экспрессирующей оранжевый флуоресцентный белок (OFP), меченные каналами KATP. Звездочка отмечает положение мембраны, которое почти невидимо на изображении в светлом поле. OFP возбуждали широким светодиодом 565 нм через полосовой фильтр 531/40 нм и дихроичным краем 562 нм, а излучаемый свет собирался через полосовой фильтр 593/40 нм. (D) Яркое поле и флуоресцентные изображения частично непокрытого фрагмента мембраны, полученного из клетки, экспрессирующей оранжевый флуоресцентный белок (OFP), меченные каналами KATP. (E) Ход времени обмена решениями, полученный с помощью установки, описанной в B. Показаны пять технических копий. Микрообъемная перфузионная система была загружена тетраметилродамин-5-малеимидом (ТМРМ) 50 мкМ. Ванну перфузировали водой со скоростью ~0,5 мл / мин. Данные временных циклов промывки (увеличение флуоресценции) и вымывания (уменьшение флуоресценции) соответствовали одному экспоненциальному распаду вида F = A*exp(-x/τ) + y0. Постоянная времени (τ) для промывки составила ~0,6 с. Постоянная времени для вымывания составляла ~ 1,0 с. TMRM возбуждали широким светодиодом 565 нм через полосовой фильтр 540/25 нм и дихроичным краем 565 нм, а излучаемый свет собирался через полосовой фильтр 605/55 нм. (F) Сопоставление интенсивности флуоресценции раствора ТМРМ с массой 50 мкМ, применяемого с использованием микрообъемной перфузионной системы, как в случае В, и неподвижной ванны, содержащей 50 мкМ ТМРМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
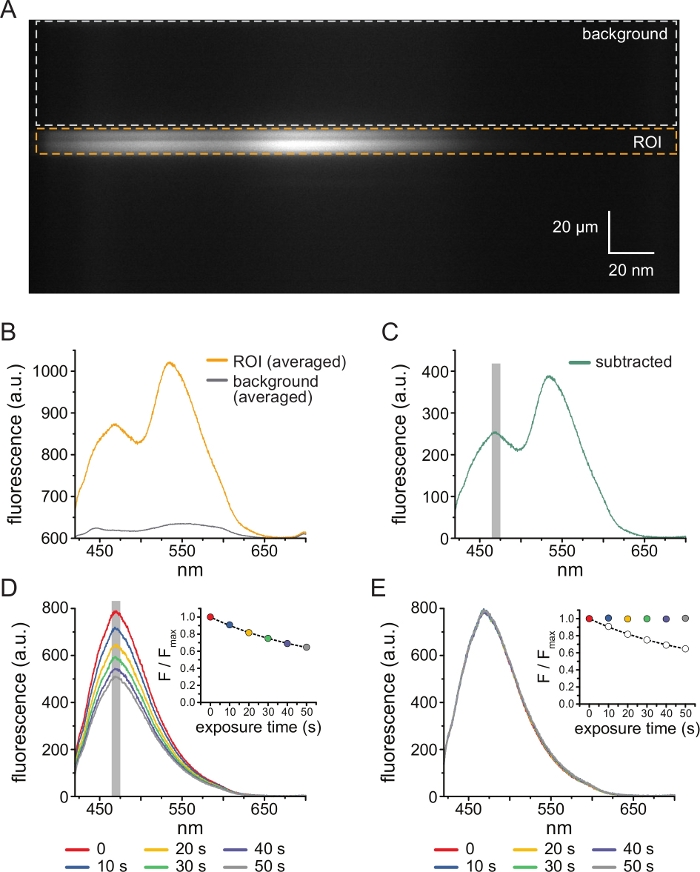
Рисунок 3: Вычитание фона и коррекция обесцвечивания. (A) Спектральное изображение (пространственная информация в измерении y, длина волны в измерении x) непокрытой плазматической мембраны из клетки, экспрессирующей меченные ANAP каналы KATP. 5 мкМ TNP-ATP применяли с помощью установки, описанной на рисунке 2B. Оранжевая рамка обозначает область интереса (ROI), соответствующую непокрытой мембране. Серая рамка обозначает фоновую область, используемую для коррекции спектра. (B) Спектры излучения, полученные на основе средних значений длин волн для областей ROI и фоновых областей в A. (C) Спектр, полученный путем вычитания усредненного фонового спектра из усредненного спектра ROI в B. Окно 5 нм вокруг пика ANAP, используемое для определения средней интенсивности, показано в виде серой заштрихованной области. (D) Спектры, полученные в результате шести последовательных 10-секундных воздействий непокрытой плазматической мембраны из клетки, экспрессирующей меченные ANAP каналы KATP. Обратите внимание на снижение флуоресценции в результате фотообесцвечивания. На врезке показано сближение нормализованного пика флуоресценции с единичным экспоненциальным распадом вида F/Fmax = A*exp(-t/τ) + (1-A). Символы на вставке имеют цветовую маркировку в соответствии со спектрами. (E) Те же спектры, что и в D, с поправкой на фотообесцвечивание. На врезке показан нормализованный пик флуоресценции от D в виде разомкнутых кругов, а скорректированный пик флуоресценции показан с использованием заполненных кругов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Одновременные измерения нуклеотидных связывающих и канальных токов с помощью флуорометрии с патч-зажимом (PCF). (A) Схема, показывающая экспериментальную установку для измерения нуклеотидной связи и ионных токов. (B) Примеры токов (слева) и спектров (справа), полученных из мембранного пластыря, удаленного из клетки, экспрессирующей меченные ANAP каналы KATP . Токи регистрировались при удерживающем потенциале -60 мВ, оцифровывались на частоте 20 кГц и фильтровались на частоте 5 кГц. Серая заштрихованная область соответствует диапазону длин волн, из которого была определена интенсивность ANAP. Адаптировано из Usher et al. (опубликовано под лицензией Creative Commons Attribution, https://creativecommons.org/licenses/by/4.0/)11. (C) Спектр, полученный из мембранного пластыря, удаленного из клетки, экспрессирующей меченные ANAP каналы KATP , подвергшиеся воздействию 1 мМ TNP-ATP. Обратите внимание на отрицательный пик, соответствующий диапазону длин волн, в котором наблюдается флуоресценция ТНП-АТФ. Серая заштрихованная область обозначает диапазон длин волн, используемый для количественной оценки флуоресценции ANAP, как в B. Адаптировано из Usher et al. (опубликовано в соответствии с лицензией Creative Commons Attribution, https://creativecommons.org/licenses/by/4.0/)11. (D) Яркое поле и флуоресцентные изображения пластырной пипетки, подвергшейся воздействию 1 мМ ТНП-АТФ. Звездочкой отмечен кончик пипетки. (E) Спектральное изображение той же пластырной пипетки в 1 мМ TNP-ATP. Звездочкой отмечено положение пипетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
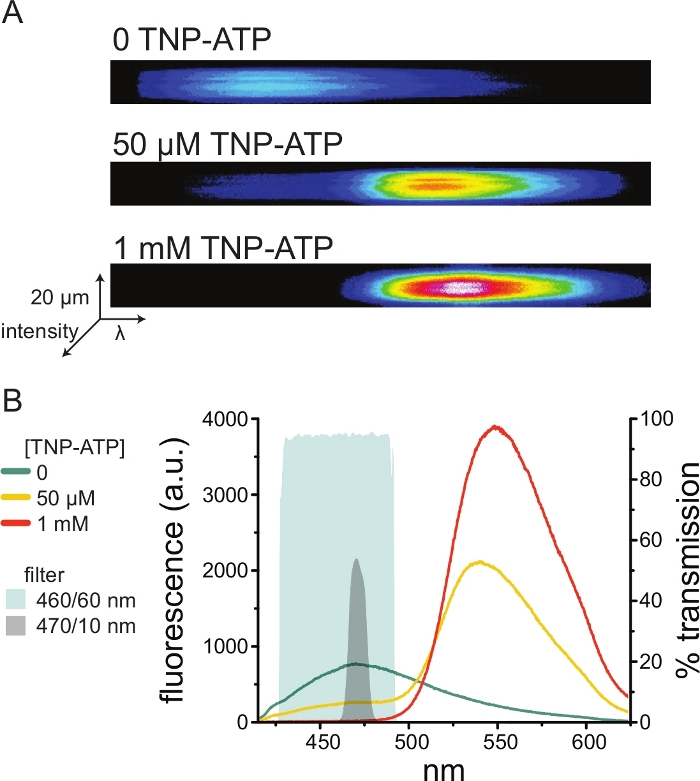
Рисунок 5: Связывание TNP-АТФ с мечеными ANAP каналами KATP . (A) Спектральные изображения непокрытой плазматической мембраны из клетки, экспрессирующей меченные ANAP каналы KATP в отсутствие TNP-АТФ или в присутствии 50 мкМ или 1 мМ TNP-ATP. Интенсивности отображаются в виде тепловой карты. (B) Спектры, усредненные по длине волны на основе изображений в А, показывающие гашение флуоресценции ANAP TNP-АТФ. Затененные области представляют собой два разных полосовых фильтра, которые можно использовать для измерения гашения ANAP, если спектрометр недоступен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
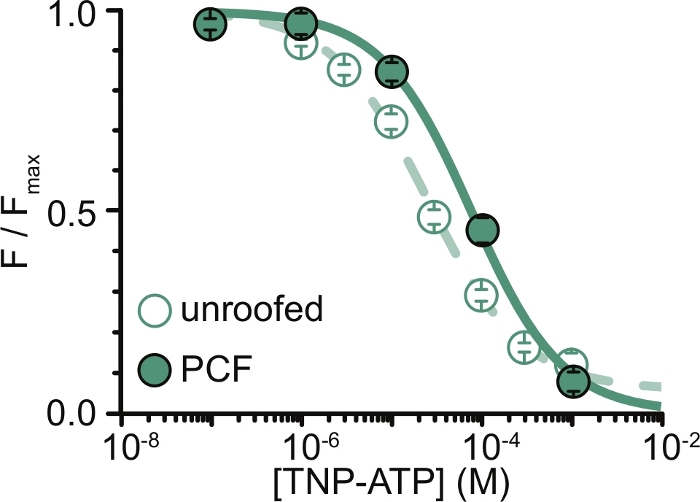
Рисунок 6: Закалка меченных ANAP каналов KATP TNP-ATP в непокрытых мембранах и PCF. Наложение данных из Usher et al. (опубликовано в соответствии с лицензией Creative Commons Attribution License, https://creativecommons.org/licenses/by/4.0/)11. Данные соответствовали уравнению Хилла: F / F max = E max + (1 - E max) / (1 + 10 (EC50 - [TNP-ATP]) * h). F - измеренная флуоресценция, F max - максимальная флуоресценция в отсутствие нуклеотида, Emax - максимальное гашение при насыщающих концентрациях нуклеотидов, h - наклон Хилла. EC50 (концентрация нуклеотидов, при которой гашение наполовину максимальна) и [TNP-АТФ] являются логарифмическими значениями. Мембраны без крышки: EC50 = -4,59 (25,7 мкМ), h = 0,82, Emax = 0,93. PCF: EC50 = -4,11 (77,6 мкМ), h = 0,87, Emax = 1,00. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Мы разработали метод измерения связывания адениновых нуклеотидов в режиме реального времени с интактными мембранными белками. Наш метод основан на нескольких других известных методах, включая маркировку белков с помощью ANAP с использованием подавления янтарного стоп-кодона 12, раскрытие клеток 14 и флуорометрию с зажимом напряжения / PCF 19,20,21,22,23,24,25 . Синтез этих подходов позволяет измерять связывание нуклеотидов с высоким пространственным и временным разрешением. Действительно, в нашей предыдущей работе мы смогли различать разные сайты связывания на одном и том же белковом комплексе, используя этот подход10,11. Важно отметить, что этот метод может быть непосредственно применен к небольшим количествам белка в клеточной среде в условиях, которые сохраняют функцию белка. Использование нашего метода связывания в сочетании с прямым электрофизиологическим считыванием токов ионных каналов позволяет нам получить богатое представление о молекулярных основах стробированияканалов 11.
Поскольку спектрометры являются нестандартным лабораторным оборудованием, интенсивность ANAP также можно контролировать в относительной изоляции с помощью полосовых фильтров. На рисунке 5B показаны спектральные свойства двух таких фильтров. Полосовой фильтр 470/10 нм эффективно отсеивает флуоресцентный сигнал от TNP-ATP и хорошо перекрывается с пиковой флуоресценцией ANAP. Однако пиковый коэффициент пропускания этого фильтра составляет всего около 50%, что может затруднить получение хороших сигналов от тусклых мембран (или в вырезанных мембранных пятнах под напряжением). Другой вариант — полосовой фильтр 460/60 нм. По сравнению с фильтром 470/10 нм между фильтром 460/60 нм и нижней частью пика излучения TNP-ATP наблюдается несколько большее перекрытие. Однако полоса пропускания 460/60 нм имеет коэффициент пропускания 90-95% в широком диапазоне пика ANAP, что, как ожидается, усилит сигнал флуоресцентного излучения.
ANAP является экологически чувствительным флуорофором 12,26,27. Пиковое излучение и квантовый выход варьируются в зависимости от места включения в интересующий белок и могут изменяться по мере изменения конформации белка. Такие изменения будут сразу видны из спектров излучения, но не будут столь очевидными при измерении интенсивности ANAP с использованием фильтров. В любом случае, необходимы соответствующие средства контроля, чтобы продемонстрировать, что сигнал флуоресценции не изменяется из-за изменений в локальной среде вокруг ANAP после связывания нуклеотидов. Контрольные эксперименты с немечеными нуклеотидами могут помочь проверить, что любые изменения интенсивности ANAP являются результатом FRET между ANAP и TNP-нуклеотидами. TNP-нуклеотиды могут неспецифически связываться с мембранами, полученными из нетрансфицированных клеток (либо с плазматической мембраной, либо с нативными мембранными белками)10. Мы количественно определяем связывание как уменьшение флуоресценции донора, поскольку этот сигнал специфичен для меченого канала. Тем не менее, мы рекомендуем проводить дополнительные контрольные эксперименты для каждой пары агонист/рецептор, например, мутировать сайт связывания нуклеотидов, если он известен, чтобы убедиться, что изменение донорской флуоресценции действительно является результатом прямого связывания с меченым рецептором11. Наконец, рекомендуется работать с конструкциями, содержащими флуоресцентную белковую метку в дополнение к метке ANAP. Это помогает дифференцировать флуоресценцию меченого рецептора от фоновой/автофлуоресценции. Фоновую флуоресценцию можно отличить от ANAP по пику и форме спектровизлучения 10, но такие определения могут быть очень затруднены, когда используются только наборы фильтров. Кроме того, клетки и непокрытые мембраны, экспрессирующие флуоресцентные рецепторы, могут быть идентифицированы с помощью флуоресцентной белковой метки без необходимости возбуждать ANAP и подвергаться риску чрезмерного фотообесцвечивания.
Во многих наших записях PCF мы наблюдали сильный отрицательный пик в наших спектрах при высоких концентрациях TNP-ATP (рис. 4C). Этот отрицательный пик является артефактом нашего протокола фонового вычитания. На рисунке 4D показаны яркопольные и флуоресцентные изображения патч-пипетки, подвергшейся воздействию 1 мМ ТНП-АТФ. На кончике пипетки видна тень, возникающая в результате исключения ТНП-АТФ из объема стенок пипетки, что наиболее заметно в плоскости фокуса. Спектральное изображение на рисунке 4E показывает темную полосу, соответствующую этой тени. Когда область выше или ниже этой темной полосы используется для вычитания фона, она дает отрицательный пик. Важно отметить, что этот пик произошел в диапазоне длин волн, соответствующем излучению TNP-ATP, и не повлиял на наши измерения гашения ANAP.
Основным ограничением наших экспериментов было получение адекватной экспрессии плазматической мембраны конструкций, меченных ANAP, для измерения флуоресценции. Как правило, было легче получить высококачественные спектры из непокрытых мембран, чем в PCF, из-за их большего размера и нашей способности быстро сканировать всю тарелку непокрытых мембран, в отличие от PCF, где патчи могут быть получены только по одному. В наших экспериментах данные из непокрытых мембран и экспериментов с PCF были аналогичными, но не эквивалентными (рис. 6)11. Тем не менее, нет априорной причины, по которой это должно быть универсальным наблюдением, поскольку белки в пластырной пипетке могут находиться в другом функциональном состоянии, чем белки в непокрытых мембранах.
Здесь были предприняты попытки максимизировать экспрессию наших ANAP-меченных конструкций, в частности, понизить температуру клеточной культуры до 33 ° C10,11,16. По нашему опыту, попытка идентифицировать участки в белке, на которых ANAP был бы консервативной заменой, не всегда приводила к конструкциям, которые хорошо экспрессировались. Мы добились большего успеха в систематическом сканировании целых белковых областей на наличие сайтов включения ANAP и скрининге кандидатов на поверхностную экспрессию10. Система маркировки ANAP также работает в ооцитах Xenopus laevis, что позволяет иссекать гораздо большие мембранные участки, тем самым увеличивая соотношение сигнал/шум26,27,28.
В то время как ожидается, что более высокие уровни экспрессии приведут к более ярким сигналам, минимальное количество каналов, необходимых для измерения флуоресценции, зависит от нескольких факторов, включая яркость флуорофора, степень фотообесцвечивания, интенсивность возбуждающего света и плоскость фокусировки. Теоретически оценки могут быть сделаны путем корреляции интенсивности флуоресценции и тока канала, как было показано ранее28,29. Однако надежность таких оценок требует определенных знаний об одноканальной проводимости и открытой вероятности канала. В дополнение к факторам, перечисленным выше, на сигнал флуоресценции также будут влиять каналы, связанные с везикулами или участками плазматической мембраны, прилипшими к стеклу пипетки, которые не находятся под напряжением.
Этот метод легко адаптируется для изучения других нуклеотид-чувствительных ионных каналов. CFTR структурно сходен с субъединицей вспомогательного рецептора сульфонилмочевины KATP30,31. Как и KATP, CFTR стробирование контролируется связыванием нуклеотидов, что делает его очевидной будущей мишенью нашего метода7. Пуринергические P2X-рецепторы представляют собой ионные каналы, управляемые внеклеточным АТФ9. TNP-ATP действует как антагонист рецепторов P2X32,33. Следовательно, он не будет полезен для изучения активации P2X, хотя его можно использовать в конкурентных анализах с агонистами P2X. В качестве альтернативы для изучения активации могут быть использованы другие флуоресцентные производные АТФ с достаточным спектральным перекрытием с излучением ANAP. Alexa-647-ATP является флуоресцентным агонистом P2X34. Расчетный R0 между Alexa-647 и ANAP составляет ~ 85 Å, что означает, что прямое связывание с P2X должно привести к существенному гашению ANAP, включенного в канал. Однако такой длинный R0 также приведет к гашению Alexa-647-АТФ, связанного с соседними субъединицами, и увеличивает вероятность того, что неспецифическое связывание нуклеотидов приведет к FRET. Поскольку сайт связывания лиганда в рецепторах P2X является внеклеточным, измерения связывания будут выполняться на интактных клетках, в зажиме напряжения всей клетки или в наружных мембранных пятнах. Наш метод также может быть расширен для изучения связывания и активации электрогенных и неэлектрогенных транспортеров и насосов, которые зависят от АТФ для своего реакционного цикла, а также P2Y-рецепторов, связанных с G-белком. Наконец, несмотря на то, что мы разработали этот метод для измерения связывания адениновых нуклеотидов (TNP-ATP, TNP-ADP, TNP-AMP), тот же подход может быть использован для изучения связывания практически с любым рецептором, для которого был идентифицирован подходящий флуоресцентный лиганд.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы хотели бы поблагодарить Рауля Террона Экспосито за отличную техническую помощь. Эта работа финансировалась Научно-исследовательским советом по биотехнологии и биологическим наукам (BB/R002517/1; MCP и FMA) и Wellcome Trust (203731/Z/16/A; СГУ)
Материалы
| Name | Company | Catalog Number | Comments |
| T75 tissue-culture treated flask | StarLab | CC7682-4875 | |
| 0.1% w/v poly-L-lysine | Sigma-Aldrich | P8920 | |
| 30 mm borosilicate cover glass slips | VWR | 631-0174 | |
| 35 mm non-treated sterile dishes | CytoOne | CC7672-3340 | |
| 35 mm cover glass bottom dish | WPI | FD35-PDL-100 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 31966021 | |
| Foetal bovine serum (FBS) | Gibco | 10500-064 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| TrypLE select (tryosin) | Gibco | 12563-011 | Trypsin/EDTA reagent |
| Phosphate buffered saline (PBS) | Gibco | 14040-091 | |
| UltraPure distilled water | Invitrogen | 10977-035 | |
| HEK293T cells | ATTC | CRL-3216 | Used between passages 5-30 |
| ANAP-TFA | AsisChem | ASIS-0014 | Reconstituted in 30 mM NaOH to a final concentration of 1 mM |
| pANAP expression plasmid | Addgene | Plasmid #48696 | Encodes tRNA/tRNA synthetase pair for expression of ANAP-tagged protein |
| peRF1-E55D | Chin Lab (MRC Laboratory of Molecular Biology, Cambridge, UK) | Jason Chin: DOI: 10.1021/ja5069728 | Encodes dominant-negative eukaryotic ribosomal release factor |
| TransIT-LT1 | Mirus Bio | MIR 2300 | Lipopolyplex transfection reagent |
| Thick-walled borosilicate glass capillaries | Harvard Apparatus | GC150F-15 | |
| Tetramethylrhodamine-5-maleimide | Sigma-Aldrich | 94506 | |
| TNP-ATP | Jena Bioscience | NU-221L | Delivered at 10 mM in water |
| Nikon Eclipse TE2000-U inverted microscope microscope | Nikon | ||
| 60x water immersion objective (1.4 NA) | Nikon | MRD07602 | |
| 4-Wavelength High-Power LED Head | ThorLabs | LED4D245 | 385/490/565/625 nm LEDs |
| Four-Channel LED Driver | ThorLabs | DC4100 | |
| 390/18 nm band-pass excitation filter | ThorLabs | MF390-18 | For ANAP excitation |
| 400 nm long-pass emission filter | ThorLabs | FEL0400 | For imaging ANAP spectra |
| 416 nm edge dichroic | ThorLabs | MD416 | For imaging ANAP spectra |
| 460/60 nm band-pass emission filter | ThorLabs | MF460-60 | Suggested wide band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 470/10 nm band-pass emission filter | ThorLabs | FB470-10 | Suggested narrow band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 531/40 band-pass excitation filter | Brightline | FF01-531/40-25 | For orange fluorescent protein (OFP) excitation |
| 540/25 nm band-pass excitation filter | Chroma | D540/25X | For tetramethylrhodamine-5-maleimide (TMRM) excitation |
| 562 nm edge dichroic | Semrock | FF562-Di03 | For imaging OFP fluorescence |
| 565 nm edge dichroic | Chroma | 565DC | For imaging TMRM fluorescence |
| 593/40 nm band-pass excitation filter | Brightline | FF01-387/11-25 | For imaging OFP fluorescence |
| 605/55 nm band-pass emission filter | Chroma | D605/55M | For imaging TMRM fluorescence |
| IsoPlane-160 Imaging Spectrometer | Princeton Instruments | IsoPlane-160 | |
| PIXIS 400BR_eXcelon Camera | Princeton Instruments | PIXIS: 400BR_eXcelon | |
| Axopatch 200B amplifier | Molecular Devices | Axopatch 200B-2 | |
| Digidata 1440A digitizer | Molecular Devices | Digidata 1440A | |
| Probe sonicator | Sonics & Materials | VC-50 | For unroofing |
| REGLO digital peristaltic pump | Ismatec | ISM 832 | For bath perfusion |
| Microvolume perfusion system | ALA Scientific Instruments | ALA μFlow-8 | For TNP-ATP perfusion |
| pClamp 10.6.2 | Molecular Devices | Recording and analysing currents | |
| Lightfield 5.20.1507 | Princeton Instruments | Acquisition software for images and spectra | |
| Matlab | Mathworks | For data analysis | |
| Python 3.8.1 | Python Software Foundation | For data analysis |
Ссылки
- Garcia, M. L., Kaczorowski, G. J. Ion channels find a pathway for therapeutic success. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5472-5474 (2016).
- Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B., Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nature Reviews Drug Discovery. 16 (12), 829-842 (2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Higgins, C. F., Linton, K. J. The ATP switch model for ABC transporters. Nature Structural & Molecular Biology. 11 (10), 918-926 (2004).
- Toyoshima, C., Cornelius, F. New crystal structures of PII-type ATPases: excitement continues. Current Opinion in Structural Biology. 23 (4), 507-514 (2013).
- Craven, K. B., Zagotta, W. N. CNG and HCN channels: two peas, one pod. Annual Review of Physiology. 68, 375-401 (2006).
- Csanady, L., Vergani, P., Gadsby, D. C. Strict coupling between CFTR's catalytic cycle and gating of its Cl- ion pore revealed by distributions of open channel burst durations. Proceedings of the National Academy of Sciences of the United States of America. 107 (3), 1241-1246 (2010).
- Vedovato, N., Ashcroft, F. M., Puljung, M. C. The Nucleotide-Binding Sites of SUR1: A Mechanistic Model. Biophysical Journal. 109 (12), 2452-2460 (2015).
- Burnstock, G. Introduction to the Special Issue on Purinergic Receptors. Advances in Experimental Medicine and Biology. 1051, 1-6 (2017).
- Puljung, M., Vedovato, N., Usher, S., Ashcroft, F. Activation mechanism of ATP-sensitive K(+) channels explored with real-time nucleotide binding. Elife. 8, 41103(2019).
- Usher, S. G., Ashcroft, F. M., Puljung, M. C. Nucleotide inhibition of the pancreatic ATP-sensitive K+ channel explored with patch-clamp fluorometry. Elife. 9, 52775(2020).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. Journal of the American Chemical Society. 135 (34), 12540-12543 (2013).
- Gordon, S. E., Senning, E. N., Aman, T. K., Zagotta, W. N. Transition metal ion FRET to measure short-range distances at the intracellular surface of the plasma membrane. Journal of General Physiology. 147 (2), 189-200 (2016).
- Heuser, J. The production of 'cell cortices' for light and electron microscopy. Traffic. 1 (7), 545-552 (2000).
- Schmied, W. H., Elsasser, S. J., Uttamapinant, C., Chin, J. W. Efficient multisite unnatural amino acid incorporation in mammalian cells via optimized pyrrolysyl tRNA synthetase/tRNA expression and engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Lin, C. Y., et al. Enhancing Protein Expression in HEK-293 Cells by Lowering Culture Temperature. PloS One. 10 (4), 0123562(2015).
- Usukura, J., et al. Use of the unroofing technique for atomic force microscopic imaging of the intra-cellular cytoskeleton under aqueous conditions. Journal of Electron Microscopy. 61 (5), 321-326 (2012).
- Colquhoun, D. Binding, gating, affinity and efficacy: the interpretation of structure-activity relationships for agonists and of the effects of mutating receptors. British Journal of Pharmacology. 125 (5), 924-947 (1998).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Science's STKE. 2003 (176), 7(2003).
- Biskup, C., et al. Relating ligand binding to activation gating in CNGA2 channels. Nature. 446 (7134), 440-443 (2007).
- Kusch, J., et al. Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron. 67 (1), 75-85 (2010).
- Wu, S., et al. State-dependent cAMP binding to functioning HCN channels studied by patch-clamp fluorometry. Biophysical Journal. 100 (5), 1226-1232 (2011).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proceedings of the National Academy of Sciences of the United States of America. 110 (20), 8272-8277 (2013).
- Kalstrup, T., Blunck, R. S4-S5 linker movement during activation and inactivation in voltage-gated K(+) channels. Proceedings of the National Academy of Sciences of the United States of America. 115 (29), 6751-6759 (2018).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nature Structural & Molecular Biology. 26 (8), 686-694 (2019).
- Liu, C., et al. Patch-clamp fluorometry-based channel counting to determine HCN channel conductance. Journal of General Physiology. 148 (1), 65-76 (2016).
- Hwang, T. C., et al. Structural mechanisms of CFTR function and dysfunction. Journal of General Physiology. 150 (4), 539-570 (2018).
- Puljung, M. C. Cryo-electron microscopy structures and progress toward a dynamic understanding of KATP channels. Journal of General Physiology. 150 (5), 653-669 (2018).
- Kasuya, G., et al. Structural insights into the competitive inhibition of the ATP-gated P2X receptor channel. Nature Communications. 8 (1), 876(2017).
- Virginio, C., Robertson, G., Surprenant, A., North, R. A. Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1, P2X3, and heteromeric P2X2/3 receptors. Molecular Pharmacology. 53 (6), 969-973 (1998).
- Bhargava, Y., Nicke, A., Rettinger, J. Validation of Alexa-647-ATP as a powerful tool to study P2X receptor ligand binding and desensitization. Biochemical and Biophysical Research Communications. 438 (2), 295-300 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены