Method Article
Yetişkin Zebra Balıklarında Cisplatin tarafından İndüklenen Akut Böbrek Yaralanması Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, cisplatin'i nefrotoksik ajan olarak kullanarak yetişkin zebra balıklarında Akut Böbrek Yaralanmasına (AKI) neden olacak prosedürleri açıklar. Renal dokuda inflamasyon ve hücre ölümünü analiz etmek için tekniğin tekrarlanabilirliğini ve iki tekniği değerlendirme adımlarını, akış sitometrisini ve TUNEL'i ayrıntılı olarak detaylandırdık.
Özet
Cisplatin genellikle kemoterapi olarak kullanılır. Kanser tedavisi gören bireylerde olumlu etkileri olmasına rağmen, cisplatin düşük moleküler ağırlığı nedeniyle böbrekte kolayca birikebilir. Bu birikim tübüler hücrelerin ölümüne neden olur ve böbrek fonksiyonlarında hızlı bir azalma, doku hasarı ve bağışıklık hücreleri infiltişi ile karakterize edilen Akut Böbrek Yaralanması (AKI) gelişimini sağlayabilir. Belirli dozlarda uygulanırsa cisplatin, hayvan modellerinde AKI indükleyicisi olarak yararlı bir araç olabilir. Zebra balığı böbrek fonksiyonu, böbrek yenilenmesi ve yaralanmayı incelemek için ilginç bir model olarak ortaya çıkmıştır, çünkü böbrek yapıları memeliler ile fonksiyonel benzerlikleri korur. Cisplatin enjekte edilen yetişkin zebra balığı, enjeksiyon sonrası 24 saat (hpi) sonra sağkalımda azalma, böbrek hücre ölümü ve iltihap belirteçlerindeki artışı gösterir. Bu modelde immün hücre infiltişi ve hücre ölümü akış sitometrisi ve TUNEL tahlili ile değerlendirilebilir. Bu protokol, yetişkin zebra balıklarında intraperitoneal cisplatin enjeksiyonu ile AKI'yi teşvik etme prosedürlerini açıklar ve daha sonra akış sitometrisi işleme ve hücre ölümü TUNEL tahlili için böbrek dokusunun nasıl toplanır olduğunu gösterir. Bu teknikler, cisplatinin nefrotoksik bir ajan olarak etkilerini anlamak için yararlı olacak ve yetişkin zebra balıklarında AKI modellerinin genişlemesine katkıda bulunacaktır. Bu model ayrıca böbrek yenilenmesini incelemek, böbrek hasarını tedavi eden veya önleyen bileşiklerin araştırılmasında ve AKI'deki iltihabı incelemek için de kullanılabilir. Ayrıca, bu protokolde kullanılan yöntemler, böbrekle ilişkili komorbiditelerde terapötik hedefler olan doku hasarı ve iltihabının karakterizasyonunu artıracaktır.
Giriş
Böbrekler, kan filtrasyonu, fazla kalıntıların giderilmesi ve iyon konsantrasyonlarının düzenlenmesi gibi homeostazı koruyan birkaç önemli fizyolojik işlevden sorumludur1. Böbrek dokusunun hasarı Akut Böbrek Hasarı (AKI) adı verilen heterojen bir duruma yol açabilir, bu da klinik olarak tübüler epitel hücrelerinin tahrip edilmesi ve ölümü, endotel hücre yaralanması ve lökosit infiltrasyonunun neden olduğu böbrek fonksiyonunda hızlı bir azalma olarak tanımlanır 2,3. AKI, yoğun bakım ünitesinde (yoğun bakım) %20 ila%50arasında değişen yüksek ölüm oranı ile hastaneye kabulün %8-16'sında gerçekleşmesi öngörülen bir durumdur4. Bu rahatsızlık, hastanede kalış süresinin artması ve finansal kaynakların önemli ölçüde kullanılması ile ilişkilidir5. Etiyolojik faktörler arasında dehidratasyon, şok, enfeksiyonlar, sepsis, kardiyovasküler hastalık ve nefrotoksik ilaçlar6bulunur. Nefrotoksisite, ilaçlar tarafından indüklenen, AKI, tübülpatiler ve glomerülopatiler olarak etkilere neden olan bir renal yaralanma olarak tanımlanır7. Nefrotoksisite yoğun bakım hastalarının üçte ikisini etkiler, çünkü yoğun bakımda reçete edilen ilaçların yaklaşık% 20'si nefrotoksik olarak kabul edilir8,9 , bu nonsteroidal antienflamatuar ilaçları (NSAID'ler), vankoksisin ve aminoglikozitler gibi antibiyotikleri ve metotreksat ve cisplatin7gibi kemoterapötik ajanları içerir. Cisplatin, baş ve boyun, testis, yumurtalık ve mesane10gibi katı tümörlerin tedavisinde kullanılan en güçlü ve yaygın kemoterapi ilaçlarından biridir. Böbrekte cisplatin, organik katyonik taşıyıcı 2 (OCT-2) aracılığıyla proksimal dolambaçlı tüpte (PCT) içselleştirilir ve yüksek konsantrasyonlarda hücre ölüm yollarını tetikleyenDNA'yabağlanır 7,10,11,12. Bu ilacın böbrekte birikmesi ölüm ve iltihaplanma ile nefrotoksisiteye katkıda bulunur13. Bu zararlı yan etki, cisplatin tedavisi gören kanser hastalarının üçte birinin hayatını ve prognozlarını muazzam derecede etkiler, bu nedenle kanser hücreleri üzerindeki öldürme etkisini kaybetmeden nefrotoksisi azaltabilecek yeni tedavilerin araştırılması zorunludur10.
Bu nefrotoksik etki nedeniyle cisplatin, ileriye doğru açıklandığı gibi deneysel hayvan modellerinde AKI'nin indüktörü olarak yaygın olarak kullanılmaktadır. Kemirgenlerde, cisplatin tarafından indüklenen ilk AKI modeli 197114'te bildirilmiştir, ancak şu anda, cisplatin15'indoza bağımlı ve kümülatif etkileri kullanılarak birçok farklı protokol ortaya çıkmıştır. Böylece, dozaj ve uygulama sayısına bağlı olarak, böbrek hasarının farklı şiddet dereceleri16 , 17,18,19,20,21indüklenebilir. En sık kullanılan yöntem, ilerleyen günlerde bir doz cisplatin ve ardından ötanazinin intraperitoneal (yani) enjeksiyonundan oluşur. Bu klasik protokolde, cisplatin enjeksiyonundan birkaç gün sonra, tek bir yüksek nefrotoksik cisplatin dozu (farelerde 10-13 mg / kg ve / veya sıçanlarda 3-8 mg / kg) fırça kenarlığı ve tübüler lümenin içindeki hücre kalıntılarının kaybı gibi ciddi histolojik değişikliklere neden olur. Histolojik değişikliklerin şiddeti doza bağlıdır ve cisplatin enjeksiyonundan 7 gün sonra rejenerasyon belirtileri gözlenir16,17.
Kemirgen modelleri iyi kurulmuş olsa da, çalışmalarımızı zebra balığına(Danio rerio)odaklaarak başka bir omurgalının özelliklerinden yararlanmaya karar verdik. Bu balık, küçük boyutu, dış döllenmesi, yüksek üreme oranları, hızlı gelişimi, embriyoların ve larvaların şeffaflığı, düşük bakım maliyeti, memeliler ile benzer anatomi (bazı istisnalar dışında), yüksek doku rejenerasyon kapasitesi, sosyal davranış, insanlarla genetik benzerliğin% 70'i ve insan hastalıkları ile ilişkili genlerle% 84'ü nedeniyle insan hastalıklarının modellenmesi için yaygın olarak kullanılmıştır22. Streisinger ve ark.23,24,25, omurgalı gelişimin genetik analizi için bu model organizmanın kullanılabilmesini doğrulayan zebra balığı ile çalışmalara başladı. Böbrek araştırmalarında zebra balığı sadece gelişimsel çalışmalarda değil, böbrek rahatsızlıklarına bağlı yeni genlerin araştırılmasında genetik bir araç olarak ortaya çıkmıştır26. Ayrıca, yara izi oluşumu olmadan yenilenme kapasitesi ve neonephrogenesis adı verilen yaşamları boyunca nefron üretme yeteneği, zebra balığını rejenerasyon araştırması için anahtar bir hayvan modeli haline getirir27,28. Ayrıca, akut ve kronik böbrek hasarı da dahil olmak üzere farklı böbrek hastalıkları için deneysel modellerin mevcudiyeti, bu deneysel organizmanın çok yönlülüğünü göstermektedir26,29. Memelilerde olduğu gibi, zebra balıklarının renal ataları ara mezodermden türetilir. Bu tür renal alerjenler, daha sonra yetişkinliğe kadar olgun bir organ olarak korunacak olan mezonephros'a gelişecek pronephrosları üretir29,30.
Yetişkin zebra balığı böbreği, vücudun sırt duvarında, yüzme mesanesi ve omurga arasında bulunur29. Ventral bir görünümden, zebra balığı üç bölgeye bölünebilir (Şekil 1A): baş (H), gövde (Tr) ve kuyruk (Ta)29. Memeliler gibi zebra balığı da tübüle segmentlerine ayrılan böbreğin fonksiyonel birimleri olarak nefronlara sahiptir (Şekil 1A): renal korpuskül (RC), proksimal dolambaçlı tübül (PCT), proksimal düz tübül (PST), distal erken (DE), geç distal (DL) ve toplama kanalı (CD)29. Zebra balığı insan nefronları ile genetik koruma ve yapısal benzerlikleri paylaşır (Şekil 1B) ancak Henle (LH) döngüsü olarak da bilinen ara tübül gibi bazı konformasyonlardan yoksundur29,31. Zebra balığı gibi tatlı su balıkları normalde çok düşük ozmolariteye sahip bir ortamla çevrilidir, bu nedenle hiperosmotik olma eğilimindedirler ve solungaçlara, erken aşamalardaki cilde ve ozmolariteyi ve su atılımını düzenlemek için böbreğe bağımlıdırlar32. Pronephros tarafından dorsal aorttan kan filtrasyonu yaklaşık 48 saat döllenme sonrası başlar (hpf)33,34. Zebra balığının böbreği sadece metabolik atık atılım organı değil, aynı zamanda döllenme sonrası (dpf) 4 günden yetişkinliğe kadar hematopoetik bir organ olarak çalışır ve memelilerde kemik iliğine eşdeğerdir35. Geliştirme sırasında, hematopoetik kök hücreler (HSC' ler) böbreği tohumlayacak, kendi kendini yenileyecek ve miyeloid, eritroid ve lenfoid hücre soyları üretecek, transkripsiyon faktörlerini koruyacak, molekülleri ve memelilerle yüksek oranda korunmuş genetik programlaroluşturacak 36,37. Çalışmalar, insan bağışıklık sisteminin eritroid, trombositik, miyeloid ve lenfoid hücrelerinin çoğunun zebra balığında mevcut olduğunu ortaya koydu37,38. Bu hayvanın benzersiz özellikleri ve insan böbreği ile korunan özellikleri, bu model organizmayı böbrek fonksiyonu, yaralanma ve yenilenme araştırmalarında avantajlı hale getirdi.
Zebra balığının böbreği iyi çalışılmış olmasına ve bazı AKI modelleri larva ve yetişkin zebra balığı28'de mevcut olmasına rağmen, bu protokolün kurulduğu sırada yetişkin zebra balıklarında kimyasal olarak indüklenmiş antibiyotik olmayan bir AKI modeline dair bir kanıt yoktu. Bunun yanı sıra laboratuvarımız, rejenerasyon ve böbrek hasarını incelemek için probiyotik bakterileri ve mikrobiyota türevi bileşikleri test etmeye odaklanmaktadır, bu nedenle çabalarımızı yetişkin balıklarda yeni bir cisplatin kaynaklı AKI modeli oluşturmaya yoğunlaştırmış olduk. Bu makalede sunulan video makalesi, g hayvan başına 120 ug cisplatin (120 μg/ g) enjeksiyonu kullanılarak yeni bir AKI indüksiyon modeli için prosedürleri göstermektedir(Şekil 2A). Bu doz başlangıçta 10 mg / kg (10 μg / g'ye eşdeğer) 14 ,15,16,17civarında giden murine modellerinde cisplatin tarafından indüklenen AKI çalışmalarına dayanıyordu, ancak bu doz nefrotoksisite ile ilgili böbrek hasarına neden olmak için yeterli değildi (veriler gösterilmedi). Böylece dozu bu çalışmada kullanılanlara arttırdık (Şekil 2B). Çalışmamız, böbrek dokusu hasarının indüksiyonu ile enjeksiyondan sonra sağkalım oranında cisplatinin doza bağımlı bir etkisini ortaya koydu 24 hpi tübüler yapı kaybı, artan inflamatuar infiltrat ve yüksek hücre ölüm oranı ile gösterildiği gibi. Burada cisplatin kaynaklı AKI'nin gelişimini analiz etmek için iki teknik açıklıyoruz: hücre infiltrasyonunu analiz etmek için akış sitometrisi ve hücre ölümünü ölçmek için TUNEL. Akış sitometrisi, hücrelerin fiziksel (boyut ve taneciklilik) ve kimyasal (floresan bileşikler) özelliklerini ölçen bir teknolojidir. Sitometrenin içinde hücre süspansiyonu, hücreleri tek bir çizgide düzenleyen bir kılım sıvısı aracılığıyla çalışır ve bir lazer ışını üzerinden her seferinde bir hücre geçmelerini sağlar (Şekil 3A). Işık huzmesi önündeki bir dedektör, hücre boyutuyla ilişkili olan İleri Saçılım'ı (FSC) ölçecek ve yan taraftaki dedektörler, hücrelerin tanecikleriyle ilişkili Olan Yan Dağılımını (SSC) ölçecektir. Diğer dedektörler, parçacıklardan, floresan proteinlerden veya antikor etiketli hücrelerden gelenfloresanları ölçecektir 39,40. Zebra balıkları için ticari antikorlar günümüzde az olduğundan, hayvan muhabirlerinin ve floresan biyobelirteçlerin kullanımı bu analizi iyileştirmeye ve çeşitli hücre popülasyonlarını tanımlamaya izin verir41,42,43. Bu protokolde kullanılan bir diğer araç da Terminal deoxynucleotidyl transferase (TdT) dUTP Nick End Labeling (TUNEL) tahlilleriydi. TUNEL testi, TdT'nin parçalanmış DNA'yı tanımlama ve daha sonra mikroskopi44 (Şekil 3B) ile görselleştirilebilen ve ölçülebilen floresan işaretleyici ile etiketlenmiş deoksinükleotitlerle etiketleme yeteneğine dayanan geç aşama bir apoptoz tespit yöntemidir. AKI'nin en çarpıcı özelliklerinden birinin tübüler böbrek hücrelerinde apoptozun indüksiyonu olduğu düşünülürse3, akış sitometrisi ve/veya mikroskopi ile analiz edilebildiği için bu teknik son derece avantajlıdır.
Bu makalede sunulan yaklaşımlar, AKI durumunun gözlemlenmesine olanak tanır ve cisplatin ile ilgili AKI'de yeni terapötik hedeflerin araştırılmasında yararlı olabilecek AKI bozukluklarını incelemek için yeni bir akut model sunar.
Protokol
Bu protokolde açıklanan prosedürlerin zebra balığı modelinde kullanılması daha önce São Paulo Üniversitesi Biyomedikal Bilimler Enstitüsü Hayvan Kullanımı Etik Komitesi tarafından onaylanmıştır.
1. Cisplatin Intraperitoneal Enjeksiyon ile AKI İndüksiyonu
- Stok çözeltisini % 0,9 NaCl'de 850 μg / mL'ye seyrelterek cisplatin çalışma çözeltisi hazırlayın. Oda sıcaklığında tutun, ışıktan koruyun.
DİkKAT: İmalatçı, cisplatin'in gözlük, eldiven ve laboratuvar önlüğü de dahil olmak üzere kişisel koruyucu ekipman (KKD) ile manipülesini önerir. Stok çözeltisini ışıktan korunarak oda sıcaklığında saklayın. - Sistem suyunda 150 mg/L MS-222 (Tricaine) anestezi hazırlayın45. Yetişkin zebra balıklarını (5-9 ay) yaklaşık 1-2 dakika daldırarak uyuşturmak.
NOT: Etkili bir şekilde uyuşturulan balık dokunmak için sorumsuz olmalıdır. Etkili anesteziyi test etmek için, reaksiyon gözlemlemek için kaudal yüzgeci hafifçe bastırın.
DİkKAT: Trikain cilt ve gözler için tahriş edicidir, manipüle etmek için KKD kullanın. - Plastik kaşık kullanarak, vücuttaki fazla suyu gidermek için balığı kağıt havlu gibi emici bir yüzeye aktarın. Daha sonra, plastik kaşıkla balığı bir tartı üzerinde bir Petri kabına aktarın ve balığı tartın. Doz hesaplamaları için gerekli olacağı için balığın ağırlığını not alın.
NOT: Balıktan fazla suyu emmek, hayvanın ağırlığını abartmayı önler, balık için önyargılı olduğu için aşırı kurumayın. - 120 μg/g ağırlığın son dozunu elde etmek için, cisplatin çalışma çözeltisinin (850 μg) μg'si başına son dozun μg'sini (120 μg) bölün ve 120 μg cisplatin (141.2 μL) hacmini elde etmek için bu sayıyı 1000'e çarparak mikrolitrelere (μL) dönüştürün. Daha sonra enjekte edilecek son hacmi elde etmek için balığın ağırlığı (g) için bu sayıyı (141,2 μL) çarpın.
- Plastik bir kaşıkla, balığı ıslak bir süngerin üzerine, ventral tarafı yukarıda olacak şekilde tutmak için küçük bir kesikle aktarın. Sünger sistem suyunda anestezi ile ıslatılmalıdır.
- 31 G 1.0 mL insülin şırınnasını hesaplanan cisplatin çalışma çözeltisihacmi ile doldurun.
- İğneyi, iç organların delinmesine karşı sığ bir açıyla, pelvik yüzgecin yakınındaki hayvanın intraperitoneal kısmına yerleştirin (Şekil 2A). Sonra yavaşça çözeltiyi enjekte edin.
- Enjeksiyondan sonra balıkları anesteziden kurtulmak için bir tanka yerleştirin. Normal iyileşme belirtileri için balıkları izleyin(örneğin, yüzme hareketleri, opera hareketleri).
NOT: Hayvan sonraki 3-5 dakika içinde iyileşmelidir. Gerekirse, balığı plastik bir kaşık, pasteur plastik pipetle hareket ettirerek veya kabarcıklı bir hortuma yaklaştırdırarak uyarın. - Balık kontrolü için,% 0.9 NaCl çözeltisi enjekte ederek aynı prosedürü uygulayın. Vücut ağırlığının oranını takip eden aynı hesaplamayı kullanın: enjekte edilecek hacim, balığın ağırlığı (g) ile çarpılarak 141 μL olacaktır.
- İlerleyen günlerde günde en az iki kez balıkların hayatta kalmasını izleyin(Şekil 2B).
2. Bağışıklık Hücrelerinin Akış Sitometrisi için Böbrek İzolasyonu ve Doku İşleme
- Bu işlem için immün hücre floresan işaretli transgenik hayvanlar kullanın (örneğin,Tg (mpo:GFP)).
- 120 μg/g cisplatin 24 hpi sonra, hipotermal şok (hızlı soğutma) ile hayvanları ötenazi.
NOT: Hipotermal şokun ötanazi yöntemi olarak MS-222 aşırı dozdan daha etkili olduğu gösterilmiştir. Hipotermal şok, personel için MS-222 kullanımından daha az stresli, hızlı, tutarlı ve daha güvenlidir, daha önce46,47. - Bir dış geçiş tankında, sistem suyuna 5:1 oranında buz suyu hazırlayın, iç tankı buzun üzerine bir ekranla koyun, su 2-4 ° C'ye ulaşana kadar bekleyin.
NOT: Balıklar buzla doğrudan temas halinde olmamalıdır, çünkü bu termal yanıklara ve ağrıya neden olabilir. - Hayvanı buzlu suya aktarın, oryantasyon kaybı ve operaküler hareket olmayana kadar en az 10 dakika bekleyin.
- Plastik bir kaşıkla, fazla suyu kurutmak için balığı kağıt havlulara yerleştirin.
- Balığı% 3 agarose diseksiyon plakasına aktarın ve üst ışıklı bir stereoskop altına alın. Makasla, gözlerin hemen arkasında hızlı bir kesim yapan balıkların kafasını koparın ve başı çıkarın.
- İnce makasla açık taraftan kloacaya bir kesik açın ve iç organları ince önpslerle çıkarın.
- Karkası açmak ve omurgaya bağlı böbreği ortaya çıkarmak için vücut duvarlarının kenarlarını sıkıştırmak için böcek pimleri kullanın.
- Böbreği ince forseps ile ayırın ve organı 1x PBS / 2% FBS soğuk bir çözelti ile 6 kuyu plakasına yerleştirin. Buzda kal.
- Pasteur plastik pipet ile dokuyu alın ve dokuyu 50 mL'lik bir tüp üzerinde 40 μm hücre süzgecinden geçirin, hafifçe bir şırındı pistonu ile maceralaştırın.
- 1 mL 1x PBS/% 2 FBS ile iki kez yıkayın ve hücreleri 50 mL'lik bir tüpte toplayın.
- 4 °C'de 5 dakika boyunca 400 × g'da santrifüj hücreleri.
- Tüm süpernatantı 1 mL mikropipette dikkatlice alın ve atın. Hücreleri yeniden sterilize etmek ve 5 mL akış sitomemetri tüplerine yerleştirmek için 500 μL soğuk 1x PBS ekleyin. Buzda kal.
- Neubauer odasındaki hücreleri Trypan Blue'da 1:10 seyreltme yaparak sayın(örneğin,numunenin 10 μL'sini alın ve 90 μL Trypan Blue ile karıştırın). Bir Neubauer odasına 10 μL karışım ekleyin ve mikroskop altındaki hücreleri sayın.
NOT: 1-5 x 10 6 hücre/mL ve%80 canlılık > optimum sonuçlar beklenir.
DİkKAT: Trypan mavisi kanserojen bir ajandır, işlemek için KKD kullanın. - Hücreleri bir sitometre ile okunacak şekilde alın. Ardından, ilgi popülasyonu seçerek sonuçları analiz edin.
3. TUNEL Tahlil için Yetişkin Zebra Balığı Böbrek Dokusunun İşlenerek İşlensin
- Bu prosedür için, benzer floresan TUNEL'in analizini engelleyebileceğinden, vahşi tip hayvanlar(örneğin,AB, Tübingen, vb.) veya TUNEL kitinden farklı floresan renge sahip transgenik bir hayvan kullanın.
- 120 μg/g cisplatin 24 hpi sonra, hipotermal şok (hızlı soğutma) ile hayvanları ötenazi. Bkz. 2.3-2.4.
- Balıkları 2.5-2.6'da açıklandığı gibi parçalara ayrıştırın; böbreğin fiksasyon prosedürü sırasında omurgaya bağlı kalması gerekir (aşağıda açıklanmıştır).
- Böcek pimleri kullanarak, karkası açmak için vücut duvarlarının kenarlarını kıstırın ve böbreği açık tutmak için bir mantar yüzeyine sabitleyin.
NOT: Bu prosedür, böbreğin daha sonraki analizler için doğru pozisyonda kalmasını sağlar. - Daha sonra mantar yüzeyini böbreği aşağı bakacak şekilde 6 kuyu plakasına% 4 paraformaldehit (PFA) taze yapılmış bir çözelti üzerine yerleştirin. Gece boyunca 4 °C'de tutun.
DİkKAT: PFA cilt ve mukoza yüzeyleri için kanserojen ve tahriş edicidir. Pfa çözümlerini göz koruma ekipmanı da dahil olmak üzere KKD kullanarak kimyasal bir başlık altında hazırlayın. - Ertesi gün, böbrekleri 2.8'deki gibi parçalara ayrıştırın. Böbrekleri 1x PBS'li 60 mm Petri kabına yerleştirin ve 1x PBS'de iki kez durulayın.
- Doku için bir destek matrisi oluşturmak için% 2 agarose hazırlayın.
- Petri kabından kalan tüm 1x PBS'yi atın ve tüm organı örtmek için% 2 agarose yavaşça dökün. Daha sonra böbreğin katlanmasını önlemek için stereomikroskop altında ince tokmaklar kullanarak böbreği konumlandırın. Agarose oda sıcaklığında katılanın.
NOT: Bu işlem, organın yaprak benzeri şekli destekleyici bir matrisin içinde değilse katlama eğilimine neden olduğundan, histolojik işlem yoluyla organın yönünü ve şeklini koruyacaktır. - Agarose katılaşmasından sonra, doku etrafındaki agaroseyu kesmek, küçük küpler oluşturmak ve doku etrafındaki agarose fazlalığını gidermek için bir neşter kullanın.
- Agarose küplerini histolojik işlemeye uygun bir kasete yerleştirin.
NOT: Aşağıdaki adımlar manuel olarak veya otomatik doku işlemcisinde yapılabilir. - İlk olarak, kasetteki dokuyu oda sıcaklığında her biri 45 dakika boyunca takip ederek işleyin: bir banyo% 50 etanol, bir banyo% 70 etanol, iki ardışık banyo% 95 etanol ve üç ardışık banyo% 100 etanol. Daha sonra, dokuyu iki ardışık Xylene banyosunda ve üç ardışık parafin banyosunda işleyin; ikincisi 60 ° C'de her biri 1 saat sürer.
DİkKAT: Kimyasal bir başlık altında değişiklik yapın, etanol ve ksilenden kaynaklanan buharlar tahriş edici ve toksiktir. - Parafin blokları hazırlamak için parafin mercimeklerini 60 °C'ye eritin.
- Plastik kaseti içindeki doku ile açın ve ılık bir tabakta tutun. Parafin için ısınma metal kalıpları.
- Cımbızla dokuyu metal bir kalıbın üzerine yerleştirin, böylece böbrek uzunluğu küf tabanına paraleldir. Parafin ekleyin, gerekirse dokuyu yeniden tahsis edin.
- Kalıbı kasetin tabanıyla örtün ve ızgara kaplanana kadar parafin ekleyin. Oda sıcaklığında katılaşmaya bırakın ve daha hızlı bir katılaştırma işlemi için -20 °C'ye yerleştirin.
- Parafin bloğunu metal kalıptan yaklaşık 20-30 dakika sonra serbest bırakın.
- Bir mikrotom ile, parafin gömülü dokuyu 5 μm kalınlıkta bölümler. Dokuyu toplamak için silanize veya pozitif yüklü cam slaytlar kullanın.
4. TUNEL tahlil
NOT: Aşağıdaki protokolde In Situ Hücre Ölüm Tespit Kiti (Malzeme Tablosu) yalım uzaması yalım.
- Dewax doku slaytları 5 dakika boyunca iki ardışık ksilen banyosuna yerleştirir. Daha sonra dokuyu dereceli bir etanol serisi ile yeniden sulendir: her biri 5 dakika boyunca% 100-% 95- % 70- % 50.
- Etanolden durulamak için akan soğuk musluk suyuna slaytlar yerleştirin. Slaytları damıtılmış suda tutun.
- Koyu renkli bir inkübatör odası hazırlayın. Kuluçka adımları sırasında nemi korumak için tabana ıslak kağıt havlular ekleyin.
NOT: Kuluçka odası eksikliğinde, altta nemli kağıtlı bir Petri kabı ve slaydı yerleştirmek için iki kürdan kullanmak mümkündür. - Taze Proteinaz K çalışma çözeltisihazırlayın: 10 mM Tris / HCl'de 10 μg / mL, pH 7.4-8.
NOT: Proteinaz K, imalatçı tarafından önerildiği gibi permeabilizasyon maddesi olarak kullanılır. - Slaytları koyu inkübatör odasına yerleştirin ve numuneleri kaplayana kadar Proteinaz K çalışma çözeltisi ekleyin. 37 °C'de 30 dakika kuluçkaya yaslanın.
- Numuneler inkübasyon yaparken TUNEL reaksiyon karışımınıhazırlayın: 450 μL Etiket Çözeltisine 50 μL Enzim Çözeltisi ekleyin. Işıktan kork.
NOT: Hazırlanacak hacim aynı 1:10 oranında ayarlanabilir. Hacim, her bölüm için karışımın 50 μL'si olarak hesaplanır; bu, örneklerin boyutuna bağlı olarak değişebilir. - Karanlık odayı alın ve slaytları 1x PBS ile iki kez yıkayın.
- Daha sonra, emici kağıt kullanarak numunenin etrafındaki bölgeyi kurulayın ve her doku kaydırağına 50 μL TUNEL reaksiyon karışımı ekleyin, çözeltiyi tüm numunenin kaplanması için yayın. 2 saat boyunca 37 °C'de kuluçkaya yaslanın. Işıktan kork.
- Kuluçkadan sonra, slaydı 1x PBS ile üç kez durulayın ve kağıt havlu kullanarak numunenin etrafındaki bölgeyi kurulayın.
- Numunelere nükleer karşı koyma için 50 μL DAPI 1:1000 ekleyin ve oda sıcaklığında 5 dakika kuluçkaya yatırın. Işıktan kork.
- 1x PBS ile üç kez tekrar durulayın ve numunenin etrafındaki bölgeyi kurutun.
- Slaydı solmaya karşı hidrofilik bir ortamla monte edin, bir kapak yerleştirin ve oje ile kapatın. Slaytları yatay olarak, 4 °C'de ışıktan korunarak saklayın.
NOT: Montaj ortamının solmaya karşı koruma özellikleri, numunelerin floresanını korumaktır, ancak mevcut herhangi bir hidrofilik ortamı kullanmak mümkündür. Oje ile son sızdırmazlık adımı dehidratasyon önlemek için çok önemlidir. - Örnekleri floresan mikroskop altında görselleştirin. Bu tür floresan pigmentler için, 520-560 nm (yeşil) aralığında bir eksitasyon dalga boyu ve 570-620 nm (kırmızı) aralığında algılama kullanın.
Sonuçlar
Zebra balığının böbreği sırt duvarında bulunan düz pigmentli bir organdır ve temel fonksiyonel birimi olan nefron memelilerle korunur (Şekil 1). Yüksek rejenerasyon kapasitesine sahip sadece bir böbreğe sahip olmanın özelliği, bu model organizmayı model böbrek hasarı için mükemmel bir seçim haline getirir. Bu çalışmada sunulan protokoller, yetişkin zebra balıklarında cisplatin intraperitoneal (i.p.) enjeksiyonu ile AKI'yi teşvik etmek ve daha sonra daha önce ayrıntılı olarak açıklanan iki teknikle analiz edilecek şekilde tasarlanmıştır: akış sitometrisi (Şekil 3A) ve TUNEL (Şekil 3B). Şekil 4'te tüm sürecin akış çizelgesi resmedilmiştir. Cisplatin dozları başlangıçta fare modellerinde açıklananlara göre uygulandı15,16,17, kullanılan standart hayvan kg başına 10-13 mg cisplatin (mg / kg). Bununla birlikte, zebra balığının cisplatine karşı fareden daha dirençli olduğu gösterildi (veriler gösterilmedi) ve son doz artırıldı. Hayvanların hayatta kalma oranını değerlendirdiğimizde, deneyler cisplatinin doza bağımlı bir etkisini göstermiştir (Şekil 5A). Bu nedenle, talimatları tam olarak bu protokolde açıklandığı gibi izlemenizi ve herhangi bir malzemeyi toplamadan önce hayvanların hayatta kalma oranını tekrarlanabilirlik ölçüsü olarak sürekli izlemenizi öneririz. 120 μg/g cisplatin i.p. enjeksiyonundan sonra (Şekil 5A, kırmızı çizgi), ilk 24 saat içinde hayvanların yaklaşık% 30'unun hayatta kalmasında bir azalma gözlenmiş ve enjeksiyon sonrası 5. günde canlı hayvanların yaklaşık% 20'sine ulaşana kadar hayatta kalma yavaş yavaş azalmıştır, daha sonra stabilize edilir ( Şekil5A). Cisplatin toksisitesi hayvanların cinsiyetlerinden etkilenmedi, çünkü erkekler ve dişiler benzer sağkalım eğrilerine sahiptir (Şekil 5B).
Cisplatin kaynaklı AKI kinetiğinin analizi böbrekte iltihaplanma ve hücre ölümünün arttığını gösterdi 24 hpi. İltihaplanmayı değerlendirmenin en hızlı ve nicel yollarından biri akış sitometrisidir, ancak bu teknik için ticari olarak mevcut zebra balığı antijenlerine karşı antikor eksikliği göz önüne alındığında, bağışıklık belirteci olan transgenik bir çizgi kullanmak gerekir. Günümüzde, bağışıklık hücrelerini etiketleyen birçok zebra balığı hattına erişilebilir (Tablo 1). Bu çizgiler tekil olarak kullanılabilir veya kombinasyon halinde, analiz için yeterli repertuar verilebilir48,49,50,51,52,53,54,55,56,57,58,59,60. Bu, tekniği çok basitleştirir, çünkü herhangi bir antikor inkübasyon adımı gerekli değildir, aksine, hücrelerin mekanik ayırma ile izolasyondan sonra, sitometre üzerinde doğrudan okuma mümkündür.
Daha önce de belirtildiği gibi, zebra balığının böbreği sadece homeostatik fonksiyonlara sahip bir kan filtrasyon organı değil, aynı zamanda yetişkinlerde hematopoezis anatomik bölgesidir, memelilerde kemik iliğineeşdeğerdir 33,34,35. Bu şekilde akış sitometrisi ile analiz ettiğimizde, insan kanı61 , 62(Şekil 6A) ile karşılaştırılabilir hücre popülasyonlarını ayırt etmek mümkündür, bu da hücre popülasyonlarını başlangıçta boyut ve taneciklere göre tanımlamamızı ve döküntüleri hariç tutmamızı sağlar. Bu durumda nötrofillerde bulunan miyeoperoksidaz enzimi ile birlikte yeşil floresan proteini (GFP) ifade eden Tg(mpo:GFP)52 adlı transgenik bir hat kullandık. Bunu bilerek, kapı stratejimiz granülosit popülasyonunun ilk ayrılmasına dayanıyordu (Şekil 6B). Bundan sonra, doublet hücreleri dışlandı, çünkü analizi önemli ölçüde değiştirebilir ve yanlış sonuçlara yol açabilirler. Doublet, 2 bağımsız parçacıklardan oluşan tek bir olaydır ve ileri saçılma yüksekliği (FSC-H) ile ileri saçılma alanı (FSC-A) yoğunluk grafiği(Şekil 6C)seçilerek hariçtutulabilir. Bu adımdan sonra floresan işaretçiyi ifade eden hücreler tespit edilerek seçilmiştir (Şekil 6D). Son olarak, nüfus istatistikleri analizden çıkarılmış ve hücrelerin yüzdesi olarak çizilmiştir (Şekil 6E).
Cisplatin nefrotoksisitesinin en belirgin özelliklerinden biri tübüler hücre ölümü10ve bunu kolayca görselleştirmek için apoptoz tespiti için TUNEL testini kullandık. Bu yöntem, floresan belirteçleri olmayan vahşi tip hücrelerin ve dokuların kullanılmasını önerir, çünkü paralel floresan analize engel olur, zebra balığı durumunda AB, Tübingen, TAB gibi vahşi tip çizgilerin veya TUNEL floresan rengine müdahale etmeyen floresan proteinli transgenik bir çizgi kullanılması önerilir. TUNEL tekniği akış sitometrisi veya mikroskopi ile analize izin verir. Mikroskopi, hangi hücrelerin öldüğünü görmelerini sağlayarak doku yapısını koruma avantajına sahiptir. Floresan mikroskop altında, apoptotik hücrelerin parlak çekirdekleri arka plandan kolayca ayırt edilebilir. Cisplatin enjekte edilen hayvanlar (Şekil 7B) 24 hpi'deki kontrolden (Şekil 7A) daha fazla ölü hücreye sahiptir. Son niceleme FIJI Yazılımının hücre sayacı seçeneği ile yapıldı ve cisplatin ile tedavi edilen böbreklerde kontrollere göre istatistiksel olarak daha fazla ölü hücre gösterdi (Şekil 7C)
Bu yazıda açıklanan protokol, cisplatin'in doz yanıt veren, hızlı ve güvenilir olan yetişkin zebra balıklarında AKI indükleyicisi olarak nasıl kullanılacağını göstermiştir. Sağkalım oranlarından elde edilen verilere ve iltihaplanma (akış sitometrisi ile saptanan) ve hücre ölümü (TUNEL tahlili ile tespit edilen) dahil olmak üzere cisplatin netropoksisitesi belirtilerinin ölçümüne dayanarak, cisplatin nefrotoksikliğinin incelenmesi ve AKI ile ilgili hastalıklarda gelecekteki tedaviler için bu modeli öneriyoruz.
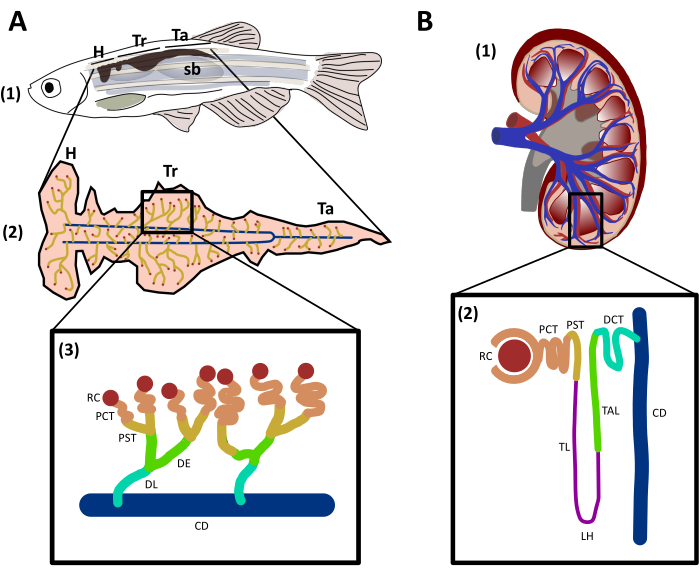
Şekil 1: Zebra balığı ve insan böbreklerinin yapısı ve karşılaştırılması. A. (1) Balıkların sırt duvarında, yüzme mesanesi (sb) ve omurga arasında bulunan koyu kahverengi ile temsil edilen böbrekli yetişkin bir zebra balığının yanal görünümü. (2) Toplama kanalına (mavi) bağlı nefronları (sarı) gösteren böbreğin ventral görünümü. Böbreğin farklı bölgeleri işaretlenir: baş (H), gövde (Tr) ve kuyruk (Ta). (3) Zebra balığı nefronlarını ve genetik korunmuş bölgeleri insan nefronuyla eşleştirmek için etiketlenmiş ve renklenmiş segmentlerini temsil eden şematik. B. (1) İnsan böbreğinin sagittal görünümü. (2) Bir insan nefron tasvir şematik ile segmentler etiketli ve renkli. RC: renal corpuscle; PCT: proksimal dolambaçlı tübül; PST: proksimal düz tübül; TL: ince uzuv; LH: Henle Döngüsü; TAL: kalın yükselen uzuv; DE: distal erken; DL: distal geç; DCT: distal dolambaçlı tübül; CD: kanal toplama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
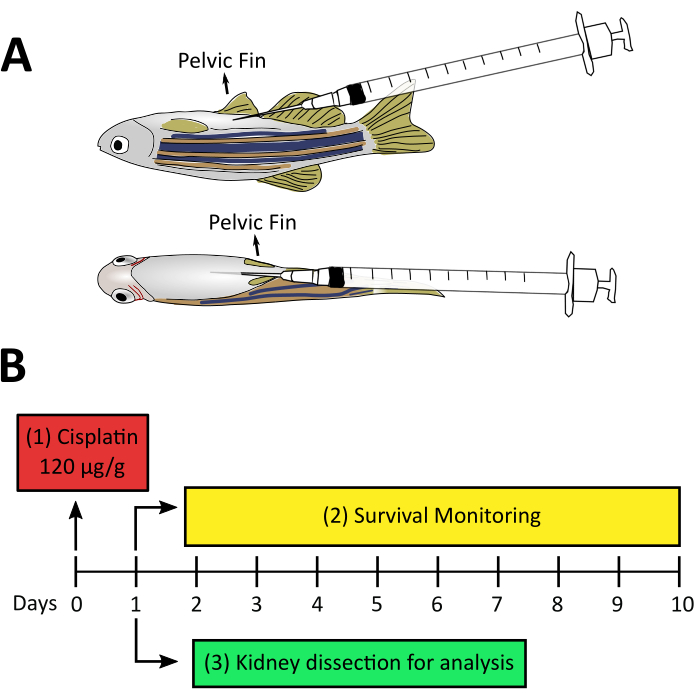
Şekil 2: Cisplatin kaynaklı AKI için deneysel tasarım. A. Enjeksiyon işlemi sırasında iğnenin konumunu gösteren yetişkin zebra balıklarının yanal ve ventral görünümü. İğne göbekten 20-30° açıyla nüfuz eder ve iç organların delinmesi önlenerek ventral duvara yavaşça paralel olarak yerleştirilir. B. Cisplatin kaynaklı AKI'nin deneysel tasarımı: (1) Hayvan başına cisplatin 120 μg/g enjeksiyonu sıfır gününde. (2) 3. adımı denemeden önce, enjeksiyondan sonra balıkların hayatta kalma takibi ilk günden onuncu güne kadar önerilir. (3) Daha fazla işlem teknikleri için cisplatin enjeksiyonundan bir gün sonra böbrek diseksiyonları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
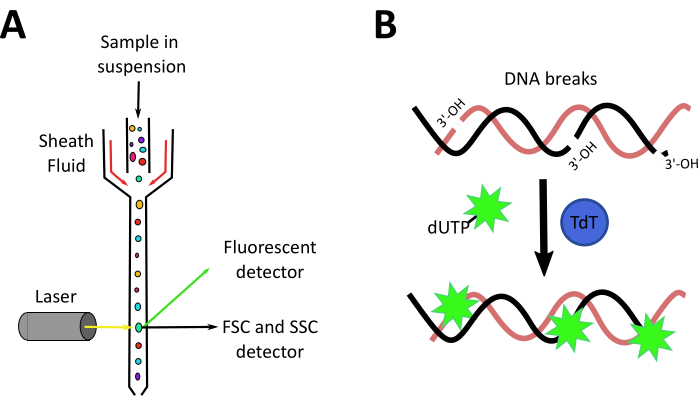
Şekil 3: Akış sitometri mekanizmaları ve TUNEL teknikleri. A. Akış sitometresine genel bakış: Hücrelerin süspansiyonu, bir kılım sıvısı tarafından tek bir hatta hidrodinamik olarak odaklanır ve hücrelerin bir lazer ışını önünden tek tek geçmesine neden olarak. Öndeki ve yan taraftaki dedektörler, hücrelerin ileri saçılımını (FSC), yan dağılımını (SSC) ve floresanını ölçer. B. TUNEL tahlil prensibi. Terminal deoksinükleotidil transferaz (TdT), parçalanmış bir DNA'nın 3'-OH uçlarına floresan işaretli bir dUTP eklenmesine aracılık eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
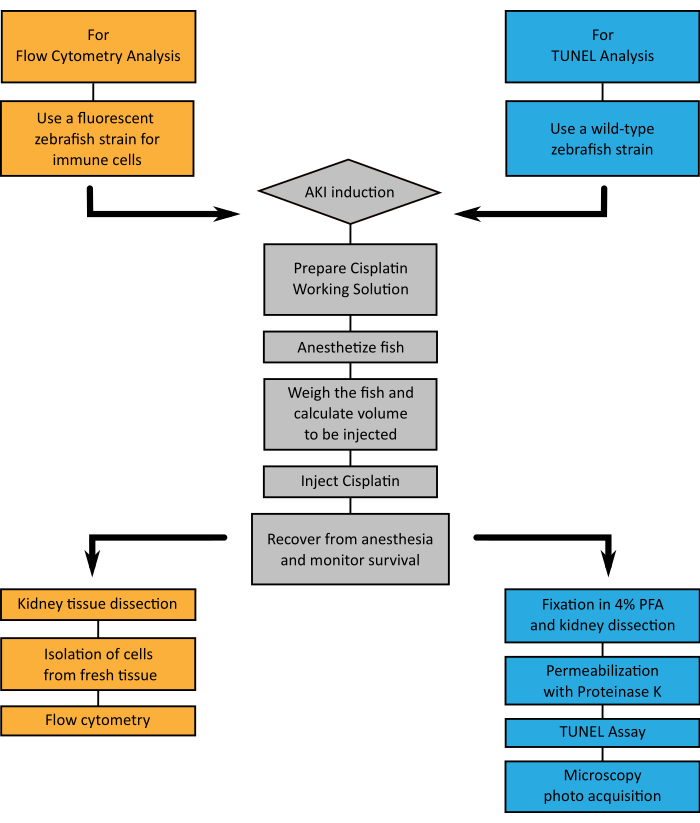
Şekil 4: Temsil edilen tekniklerin akış çizelgesi. A. Böbrek dokusunu akış sitometrisi (turuncu) veya TUNEL (mavi) yoluyla analiz etmeyi seçerken, AKI'yi cisplatin enjeksiyonu (gri) ile indüklerken izlenecek adımları gösteren bir akış çizelgesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
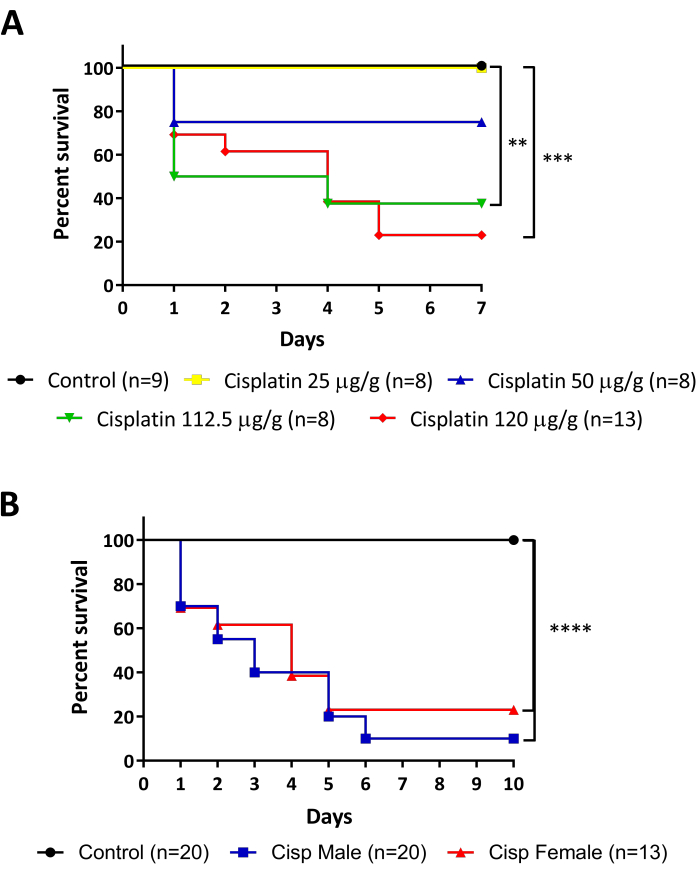
Şekil 5: Cisplatin enjekte edilen balıkların hayatta kalma takibi. A. Cisplatin enjeksiyonlarının farklı dozlarında sağkalım oranı (25 - 50 - 112.5 - 120 μg/g). Log-rank (Mantel-Cox) testi, ** p < 0.01. B. Erkeklerin ve kadınların sağkalım oranı 120 μg/g cisplatin ile enjekte edilir. Log-rank (Mantel-Cox) testi, *** p < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
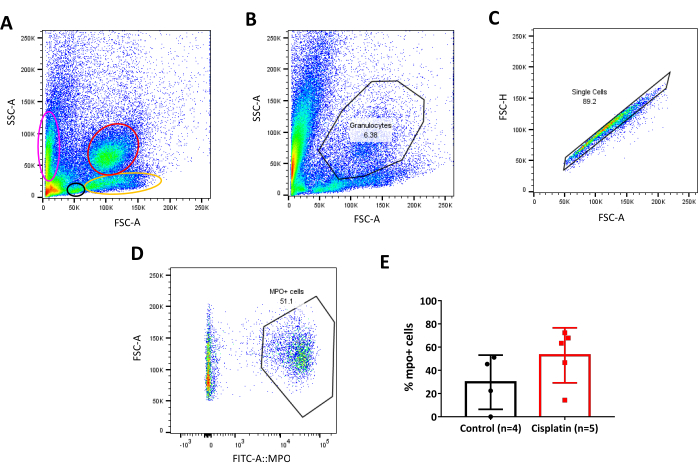
Şekil 6: Transgenik zebra balığı hattı için kapı stratejisi. A. Zebra balığı yetişkin böbrek hücrelerinin yoğunluk arsası, popülasyonlar boyut (FSC-A) ve tanecik (SSC-A) ile ayrılır. Farklı popülasyonlar renkli ovaller/daireler tarafından seçilir. Pembe: Eritroid; Siyah: Lenfoid; Sarı: Öncüller; Kırmızı: Granülositler. B. Böbrekteki Granülosit popülasyonunun seçimi için yan dağılım alanının (SSC-A) ve ileri saçılma alanının (FSC-A) yoğunluk grafiği. C. Granülosit kapısı içindeki singlet popülasyonunun seçimi için ileri saçılma yüksek (FSC-H) ve ileri saçılma alanının (FSC-A) yoğunluk grafiği. D. Böbrekteki mpo:GFP pozitif hücrelerinin (nötrofiller) seçimi için ileri saçılma alanının (FSC-A) ve FITC-A:MPO'nun yoğunluk grafiği. Olumlu bir popülasyon, floresan yoğunluğu yaklaşık10 3 açık olarak kabul edilir. E. Kontrol ve Cisplatin hayvanları arasındaki mpo:GFP pozitif hücrelerin (nötrofiller) yüzdesinin grafiği, 24 hpi . Eşleşmeyen t-test. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
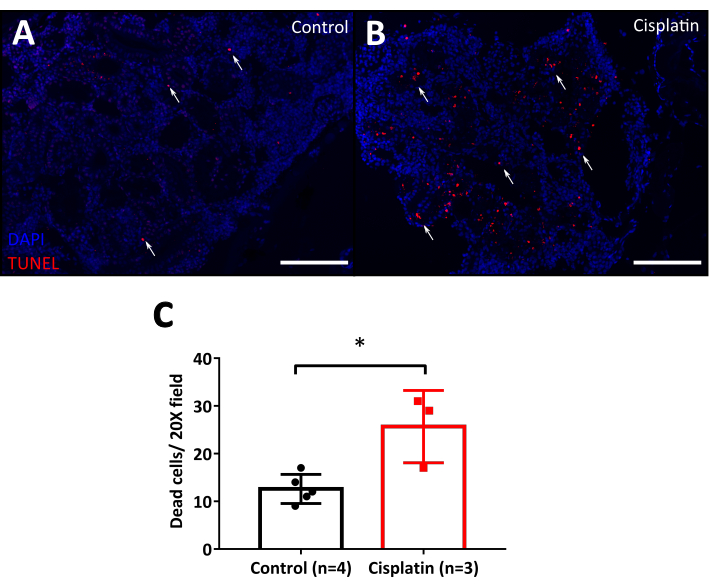
Şekil 7: CISPLATIN enjekte edilen balıkların TUNEL tahlilleri. A. Sabit erişkin böbreğinin mikrofotoğrafçıları 120 μg/g cisplatin enjeksiyonundan sonra 24 saat. Kontroller %0,9 NaCl ile enjekte edilir. TUNEL pozitif hücreler (apoptotik hücreler) kırmızı (beyaz oklar) ile boyanır. DAPI (mavi) nükleer karşıtlık olarak kullanılır. Ölçek çubuğu: 50 μm. 20x büyütme. B. Böbrekteki ölü hücre sayısının 20x alanla ölçülmesini gösteren grafik. Eşleşmeyen t-test, * p < 0.05. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Transgenik Hat | Etiketli Hücre Türü | Başvuru |
| Tg(spi1:EGFP)pA301 | Miyeloid hücreler | Koğuş ve ark. 200348 |
| Tg(zpu1:GFP) | Miyeloid hücreler | Hsu vd. 200449 |
| Tg(mhc2dab:GFP)sd6 | Monosit | Wittamer ve ark. 201150 |
| Tg(lysC:DsRED2) | Nötrofil | Salon ve ark. 200751 |
| Tg(mpo:GFP) | Nötrofil | Mathias vd. 200652 |
| Tg(mpeg1:mCherry) | Makrofajlar | Ellett ve ark. 201153 |
| Tg(mpeg1:Dendra2) | Makrofajlar | Harvie ve ark. 201354 |
| Tg(lck:GFP) | T hücreleri | Langenau vd. 200455 |
| TgBAC(ikaros:EGFP) | T hücreleri | Bajoghli vd. 200956 |
| Tg(rag1:GFP) | T hücreleri | Jessen ve ark. 199957 |
| Tg(rag2:GFP) | T hücreleri | Jessen ve ark. 200158 |
| Tg (CD79:GFP) | B hücreleri | Liu ve ark. 201759 |
| Tg(CD45:DsRed) | Lökosit | Bertrand vd. 200860 |
Tablo 1: Bağışıklık hücreleri için Zebra balığı transgenik çizgileri. Zebra balığı muhabir hatlarının adlarının, ilgili bağışıklık hücresi türü etiketli ve inşa edildikleri referans makalelerle devam eden tablo. Bu zebra balığı çizgilerinin bir kombinasyonu, akış sitometrisi ile yeni hücre seçimi olanakları sunabilir.
Tartışmalar
Böbrek hastalığının yaygınlığı dünya çapında artmaya devam etti, milyonlarca insanı etkileyen küresel bir halk sağlığı sorunu haline geldi63. Böbrek yaralı bireyleri tedavi etmenin bir yolunu bulmak, etiyolojileri ve ilerlemeleri hakkında daha fazla bilgi edinmenin yanı sıra çok önemlidir. Böbrek hasarlarını anlamak için çeşitli çalışmalar hayvan modelleri kullanmaktadır. Zebra balığı böbreği (Şekil 1) kendini yenileyen kapasiteleri ve genetik benzerliği nedeniyle gelişim biyolojisi ve yaralanma araştırmalarında yıllardır çalışılmıştır29,64. Burada, cisplatin özelliklerini nefrotoksik bir ajan olarak kullanarak yetişkin zebra balıklarında yeni bir AKI modeli sunuyoruz, 24 hpi'ye kadar görülebilecek hasarla hızlı ve akut reaksiyonu gerçekleştirme adımlarını detaylandırıyoruz (Şekil 2). Ayrıca, burada cisplatin enjeksiyonu, akış sitometrisi ve TUNEL sonrası doku hasarının değerlendirilmesine yardımcı olacak iki teknik açıklıyoruz (Şekil 3).
Yetişkin zebra balıklarındaki mevcut AKI modelleri, nefron ve tübüle yıkımında büyük hasara neden olan gentamisin i.p. enjeksiyonunu içerir, neoneprogenez olayları 5. günden itibaren başlar ve enjeksiyon sonrası 21 gün ile yenilenme tamamlanır65. Öte yandan, Sepsis ilişkili akut böbrek hasarı (S-AKI) modeli Edwardsiella tardaenfeksiyonu ile kuruldu , çünkü insülin benzeri büyüme faktörü bağlayıcı protein-7 (IGFBP7), metalloproteinaz 2 doku inhibitörü (TIMP-2) ve böbrek yaralanması molekülü-1 (KIM-1), larva ve yetişkin zebra balığı66gibi AKI belirteçlerinin ekspresyonunu önemli ölçüde artırdı. Zebra balığı terapötik ajanların aranması için yüksek verimli bir hayvan olarak bilinir ve bu böbrek fonksiyonu ve rejenerasyon67incelemek için probiyotiklerin ve mikrobiyota türevi metabolitlerin kullanımını içerir. Ancak mevcut modeller bu tedavilerin sonucunu doğrudan etkileyebilir. Bu nedenle, yetişkin zebra balıklarında AKI'yi teşvik etmek için farklı bir yöntem belirledik (Şekil 4), cisplatin'i balık mikrobiyotası üzerinde doğrudan bilinen etkileri olmayacak bilinen bir nefrotoksik ajan olarak kullanarak, antibiyotik olmak için gentamicin modeli veya E. tardaile enfeksiyon , sepsis modeli olduğu için. Bununla birlikte, cisplatin protokolümüzü geliştirirken, başka bir grup da yetişkin zebra balıklarında cisplatinin nefrotoksik etkilerini araştırdı, dozu hayvan başına 10-20-30 μgbasitleştirdi 68. Hayatta kalmada cisplatin doza bağımlı etki göstermelerine rağmen, aynı yaştaki zebra balıklarının çok farklı boyut ve ağırlığa sahip olabileceği ve bu sonuçlarda farklılıklara neden olabileceği için tüm balıklar için tek bir miktar cisplatin kullanılmasında dikkatli olmanızı öneririz69,70. Farelerde ve bu çalışmada olduğu gibi, dozu hayvanın ilgili ağırlığına ayarlamanın önemli olduğunu düşünüyoruz.
Yetişkin zebra balığı ile yaptığımız deneylerde cisplatin doz-yanıt etkisi gösterdi. Bu, cisplatin enjeksiyonundan sonra hayvanların hayatta kalma oranı izlenerek görselleştirilmiştir (Şekil 5). Hayatta kalmayı, izleme süresi boyunca başka bir fiziksel işaret görünmediği için, nefrotoksikliğin bir ölçüsü olarak değil, cisplatin dozunun yoğunluğunu tahmin etmenin bir yolu olarak kullandık. Bu kemirgenlerle karşılaştırılabilir, böbrek hasarının şiddeti cisplatin enjeksiyonunun dozu ve sıklığı ile modüle edilebilir15, daha yüksek cisplatin konsantrasyonları ile ölümcül dozlara ulaşmak71. Ölü ayrıca sonraki günlerde cisplatin72larva modelinde de görülür. Amacımız birkaç gün içinde akut bir yaralanmaya neden olmak olduğundan, enjeksiyondan 24 saat sonra böbrek hasarını gözlemlemek için mümkün olduğunca 120 μg / g cisplatin dozunu seçtik, ancak bu çalışmanın hedeflerine bağlı olarak ayarlanabilir.
İnsanlarda, AKI klinik olarak azalmış glomerüler filtrasyon oranı (GFR), yüksek serum kreatinin ve kan üre azot3ile teşhis edilir. Zebra balıklarında, AKI modellerinin repertuarı bazı genetik şartlı modeller73,74 ve bazı ilaçla ilgili modeller65,72içerir, ancak AKI fonksiyonel parametrelerinin bazıları teknik zorluklar nedeniyle zebra balığı üzerinde ölçülemediğinden(örneğin, kan toplama), çoğu araştırma çalışmamız gibi AKI 1,75'in özelliklerini gözlemlemek için morfolojik ve görsel teknikleri benimser.
Kemirgenlerde, cisplatin proksimal ve distal tübüllerdeki epitel hücrelerine girer, hücrenin içinde metabolik aktivasyona uğrar ve hücre organelleri üzerinde son derece reaktif olur ve hücre yapısında değişikliklere neden olur. Bu değişiklikler apoptoz ve otofajiye ve hatta nekroza çok yüksek dozlarda neden olabilir. Bu hasara yanıt olarak, birçok sitokin salınır ve iltihaplanmaya yol açan ve organın işlevselliğini etkileyen lökositler işe alınır15. Bu, yaralı böbrekte ne tür hücrelerin bulunabileceğinin, sakinler veya bağışıklık hücrelerine sızmış olarak değerlendirilmesinin önemini vurgulamaktadır. Burada, günümüzde mevcut olan transgenik immün muhabir hatlarını kullanarak akış sitometrisi ile bunun nasıl değerlendirileceğini gösterdik (Tablo 1). Cisplatin, enjeksiyondan sonra böbrekteki nötrofillerin(mpo:GFP pozitif hücreler) yüzdesini 24 saat artırdı (Şekil 6). Zebra balığı durumunda, böbrek farklı kan hücresi gruplarına yol açan HSC'lerin nişidir. Bununla birlikte, birçok granülosit ve makrofaj normalde kanda dolaşıyor. Örneğimizde, nötrofillerin miyeoperoksidazının promotörü altında GFP'yi ifade eden mpo:GFP transgenik çizgisini kullandık52. mpo:GFP transgenik hattının orijinal çalışmaları, nötrofil olgunlaşmasının farklı durumlarında miyeloksidaz ekspresyonunu göstermiştir76, ancak kapı stratejimiz kandan gelen olgun hücreleri içeren granülosit fraksiyonu üzerinde odaklanmıştır52, bu şekilde analizimiz yerleşik hücreleri değil, sızmış hücreleri içerir. Bu, istenen hücre popülasyonunun izole edilirken göz önünde bulundurulmasının önemlidir.
Yukarıda açıklandığı gibi, apoptoz cisplatin ile ilgili AKI'nin en klasik belirtecidir. Burada, TUNEL test tarafından ölü hücrelerin lokalizasyonu için basit bir protokol gösterdik. Cisplatin enjeksiyonu apoptotik hücre sayısını artırdı 24 hpi (Şekil 7). Bu, doğrudan dokudaki ölü hücreler sayılarak kolayca ölçülebilir. Bununla birlikte, hücreye özgü ölümün tanımlanması için istenen hücreye karşı antikorların kullanımı(örneğin, tübüler hücreler) veya transgenik bir muhabir hattının kullanımı bu teknikle birlikte kullanılabilir. AKI'nin gentamisin kaynaklı modeli ile karşılaştırıldığında, cisplatin daha şiddetli bir model gibi görünmektedir, çünkü gentamisin apoptozu enjeksiyondan sonraki üçüncü günde daha yüksekti65.
Çeşitli yan etkileri olmasına rağmen, cisplatin kanser tedavisinde hala yaygın olarak kullanılmaktadır, çünkü karsinomlar, mikrop hücreli tümörler, lenfomalar ve sarkomlar dahil olmak üzere çeşitli kanser türlerine karşı etkinliği77. Nefrotoksisite cisplatin10ile tedavide hastaların üçte birinde görülür Bu nedenle bu etkiyi azaltabilecek ve renoproteksiyonu artırabilecek stratejilerin araştırılması zorunludur. Bu yazıda sunulan yöntem ve tekniklerin böbrek yaralanması mekanizmalarının aydınlatılmasına ve böbrek komplikasyonlarından muzdarip bireylerin yaşam kalitesini artırmak için gerekli olabilecek terapötik hedefleri bulmaya yardımcı olacağına inanıyoruz, ağırlıklı olarak cisplatin kullanımı ile ilgili olanlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma Fundação de Amparo à Pesquisa do Estado de São Paulo - FAPESP (2015/21644-9; 2017/05264-7; 2017/05687-5; 2018/20722-4), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) ve Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), finansal kod 001. São Paulo Üniversitesi Biyobilim Enstitüsü'nde Maria Rita dos Santos e Passos-Bueno Laboratuvarı ve Genetik ve Evrimsel Biyoloji Bölümü Zebra Balığı Tesisi'ndeki işbirlikçilerimize teşekkür ederiz. Cristiane Naffah de Souza Breda ve Theresa Raquel de Oliveira Ramalho'ya el yazması hakkındaki yorum ve öneriler için teşekkür ederiz. Biyomedikal Bilimler Enstitüsü'nün multimedya ekibinden Marcio Villar Martins'e bu videonun kaydı, baskısı ve prodüksiyonu için çok teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1x PBS | Made by diluting 10 X PBS (prepared in lab) in distilled water | ||
| 31 G 1.0 cc insulin syringe | BD Plastipak | 990256 | Needle: BD Precision Glide 300110 |
| 3.5 L Fish tank | Tecniplast | Part of the aquactic system | |
| 6 well plate | Corning | 351146 | |
| 10 mM Tris/HCl | Prepared from solid Tris Base (Promega, H5135), adjusted to pH 7.4-8 with HCl (Merck, 1003171000) | ||
| 50 ml Falcon tube | Corning | 352070 | |
| 2-3% Agarose | Invitrogen | 16500-500 | Dissolve 2 or 3% agarose (w/v) in 1x PBS, warm until dissolve. |
| 2% FBS | Gibco | 12657-09 | Dilute 2% (w/v) directly in 1x PBS |
| 4% Paraformaldehyde | Sigma-Aldrich | P6148-500G | Dissolve 4% PFA (w/v) in warm 1x PBS, mix until dissolve in a hot plate in a fume hood. Aliquot and store at -20 °C |
| 50% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 70% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 90% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 100% Ethanol | Synth | 00A1115.01.BJ | |
| 100% Xylene | Synth | 00X1001.11.BJ | |
| Cell strainer 40 µm | Corning | 431750 | |
| Cisplatin | Blau Farmacêutica | 16020227 | C-PLATIN 1 mg/mL. Store at room temperature. |
| Cork board sheet | Obtained from local stationary store | ||
| DAPI | Sigma-Aldrich | D9542 | Stock solution 20 mg/ml dissolved in water |
| Fine forceps | Fine Science Tools | 11254-20 | |
| Flow cytometry tubes | Corning | 352052 | |
| Glass slide | Thermo-Fisher | 4445 | |
| Histology cassette | Ciencor | 2921 | |
| Immuno stain chamber | Ciencor | EP-51-05022 | |
| Incubator | NAPCO | 5400 | Set to 37 °C |
| Insect pins | Papillon | Model micro15x20 | |
| In Situ Cell Death Detection Kit | Roche Diagnostics | 12156792910 | |
| Metal mold | Leica Biosystems | 3803081 | |
| Micropipette 200-1000 µL | Eppendorf | Use 1 mL tips | |
| MS-222 (Tricaine) | Fluka Analytical | A5040-25G | |
| NaCl 0.9% | Synth | C1060.01.AG | Dissolve 0.9% NaCl (w/v) in distilled water |
| Nail polish | Prefer transparent | ||
| Neubauer chamber | Precicolor HGB | ||
| Pasteur plastic pipet | United Scientific Supplies | P31201 | |
| Paraplast | Sigma-Aldrich | P3558 | |
| Petri dish | J.ProLab | 0307-1/6 | 60 and 100 mm |
| Plastic spoon | Obtained from local store | ||
| Proteinase K | New England BioLabs | P8102 | Diluite from stock 20 mg/ml |
| Scissors | Fine Science Tools | 14060-09 | |
| Scalpel blade | Solidor | ||
| Sponge | Obtained from local store | ||
| Trypan Blue | Cromoline | 10621/07 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000-10 | |
| Centrifuge | Eppendorf | 5810R | |
| Cytometer | BD Biosciences | FACSCanto II | |
| Fluorescence Stereoscope | Zeiss | Axio Zoom.V16 | |
| Fluorescence Microscope | Zeiss | AxioVert.A1 | |
| Microtome | Leica | Jung Supercut | |
| Scale | Ohaus Corporation | AR2140 |
Referanslar
- McKee, R. A., Wingert, R. A. Zebrafish Renal Pathology: Emerging Models of Acute Kidney Injury. Current Pathobiology Reports. 3 (2), 171-181 (2015).
- Guo, C., Dong, G., Liang, X., Dong, Z. Epigenetic regulation in AKI and kidney repair: mechanisms and therapeutic implications. Nature Reviews Nephrology. 15 (4), 220-239 (2019).
- Makris, K., Spanou, L. Acute Kidney Injury: Definition, Pathophysiology and Clinical Phenotypes. Clinical Biochemist Reviews. 37 (2), 85-98 (2016).
- Sawhney, S., et al. Intermediate and Long-term Outcomes of Survivors of Acute Kidney Injury Episodes: A Large Population-Based Cohort Study. American Journal of Kidney Diseases. 69 (1), 18-28 (2017).
- Saxena, A., Meshram, S. V. Predictors of Mortality in Acute Kidney Injury Patients Admitted to Medicine Intensive Care Unit in a Rural Tertiary Care Hospital. Indian Journal of Critical Care Medicine. 22 (4), 231-237 (2018).
- Sawhney, S., Fraser, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in Chronic Kidney Disease. 24 (4), 194-204 (2017).
- Sales, G. T. M., Foresto, R. D. Drug-induced nephrotoxicity. Revista da Associação Médica Brasileira. 66, 82-90 (2020).
- Perazella, M. A. Drug use and nephrotoxicity in the intensive care unit. Kidney International. 81 (12), 1172-1178 (2012).
- Taber, S. S., Mueller, B. A. Drug-associated renal dysfunction. Critical Care Clinics. 22 (2), 357-374 (2006).
- Pabla, N., Dong, Z. Cisplatin nephrotoxicity: mechanisms and renoprotective strategies. Kidney International. 73 (9), 994-1007 (2008).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4 (4), 307-320 (2005).
- Shirmanova, M. V., et al. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Scientific Reports. 7 (1), 8911 (2017).
- Xu, Y., et al. A Role for Tubular Necroptosis in Cisplatin-Induced AKI. Journal of the American Society of Nephrology. 26 (11), 2647-2658 (2015).
- Kociba, R. J., Sleight, S. D. Acute toxicologic and pathologic effects of cis-diamminedichloroplatinum (NSC-119875) in the male rat. Cancer Chemotherapy Reports. 55 (1), 1-8 (1971).
- Perše, M., Večerić-Haler, &. #. 3. 8. 1. ;. Cisplatin-Induced Rodent Model of Kidney Injury: Characteristics and Challenges. BioMed Research International. 2018, 1462802 (2018).
- Dobyan, D. C., Levi, J., Jacobs, C., Kosek, J., Weiner, M. W. Mechanism of cis-platinum nephrotoxicity: II. Morphologic observations. Journal of Pharmacology and Experimental Therapeutics. 213 (3), 551-556 (1980).
- Singh, G. A possible cellular mechanism of cisplatin-induced nephrotoxicity. Toxicology. 58 (1), 71-80 (1989).
- Jodrell, D. I., et al. The renal effects of N10-propargyl-5,8-dideazafolic acid (CB3717) and a non-nephrotoxic analogue ICI D1694, in mice. British Journal of Cancer. 64 (5), 833-838 (1991).
- McKeage, M. J., et al. Lack of nephrotoxicity of oral ammine/amine platinum (IV) dicarboxylate complexes in rodents. British Journal of Cancer. 67 (5), 996-1000 (1993).
- Gautier, J. C., et al. Evaluation of novel biomarkers of nephrotoxicity in two strains of rat treated with Cisplatin. Toxicologic Pathology. 38 (6), 943-956 (2010).
- Vinken, P., et al. Tissue Kim-1 and urinary clusterin as early indicators of cisplatin-induced acute kidney injury in rats. Toxicologic Pathology. 40 (7), 1049-1062 (2012).
- Zorzetto, R., Guimarães, M. Um peixe modelo. Pesquisa FAPESP. 209, 16-21 (2013).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Chakrabarti, S., Streisinger, G., Singer, F., Walker, C. Frequency of gamma-Ray Induced Specific Locus and Recessive Lethal Mutations in Mature Germ Cells of the Zebrafish, BRACHYDANIO RERIO. Genetics. 103 (1), 109-123 (1983).
- Walker, C., Streisinger, G. Induction of Mutations by gamma-Rays in Pregonial Germ Cells of Zebrafish Embryos. Genetics. 103 (1), 125-136 (1983).
- Morales, E. E., Wingert, R. A. Zebrafish as a Model of Kidney Disease. Results and Problems in Cell Differentiation. 60, 55-75 (2017).
- Poureetezadi, S. J., Wingert, R. A. Little fish, big catch: zebrafish as a model for kidney disease. Kidney International. 89 (6), 1204-1210 (2016).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Translational Research. 163 (2), 109-122 (2014).
- Drummond, I. A., Davidson, A. J. Zebrafish kidney development. Methods in Cell Biology. 100, 233-260 (2010).
- Saxén, L., Sariola, H. Early organogenesis of the kidney. Pediatric Nephrology. 1 (3), 385-392 (1987).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470 (7332), 95-100 (2011).
- Hill, A. J., Bello, S. M., Prasch, A. L., Peterson, R. E., Heideman, W. Water permeability and TCDD-induced edema in zebrafish early-life stages. Toxicological Sciences. 78 (1), 78-87 (2004).
- Drummond, I. A., et al. Early development of the zebrafish pronephros and analysis of mutations affecting pronephric function. Development. 125 (23), 4655-4667 (1998).
- Majumdar, A., Drummond, I. A. Podocyte differentiation in the absence of endothelial cells as revealed in the zebrafish avascular mutant, cloche. Developmental Genetics. 24 (3-4), 220-229 (1999).
- Song, H. D., et al. Hematopoietic gene expression profile in zebrafish kidney marrow. Proceedings of the National Academy of Sciences of the United States of America. 101 (46), 16240-16245 (2004).
- Gore, A. V., Pillay, L. M., Venero Galanternik, M., Weinstein, B. M. The zebrafish: A fintastic model for hematopoietic development and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 7 (3), 312 (2018).
- Paik, E. J., Zon, L. I. Hematopoietic development in the zebrafish. The International Journal of Developmental Biology. 54 (6-7), 1127-1137 (2010).
- Palis, J., Yoder, M. C. Yolk-sac hematopoiesis: the first blood cells of mouse and man. Experimental Hematology. 29 (8), 927-936 (2001).
- O'Donnell, E. A., Ernst, D. N., Hingorani, R. Multiparameter flow cytometry: advances in high resolution analysis. Immune Network. 13 (2), 43-54 (2013).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews Immunology. 4 (8), 648-655 (2004).
- Ma, D., Zhang, J., Lin, H. F., Italiano, J., Handin, R. I. The identification and characterization of zebrafish hematopoietic stem cells. Blood. 118 (2), 289-297 (2011).
- Kulkeaw, K., et al. Purification of zebrafish erythrocytes as a means of identifying a novel regulator of haematopoiesis. British Journal of Haematology. 180 (3), 420-431 (2018).
- Ratnayake, D., Currie, P. D. Fluorescence-Activated Cell Sorting of Larval Zebrafish Muscle Stem/Progenitor Cells Following Skeletal Muscle Injury. Methods in Molecular Biology. 1889, 245-254 (2019).
- Kyrylkova, K., Kyryachenko, S., Leid, M., Kioussi, C. Detection of apoptosis by TUNEL assay. Methods in Molecular Biology. 887, 41-47 (2012).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Wilson, J. M., Bunte, R. M., Carty, A. J. Evaluation of rapid cooling and tricaine methanesulfonate (MS222) as methods of euthanasia in zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 48 (6), 785-789 (2009).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Institute for Laboratory Animal Research Journal. 53 (2), 192-204 (2012).
- Ward, A. C., et al. The zebrafish spi1 promoter drives myeloid-specific expression in stable transgenic fish. Blood. 102 (9), 3238-3240 (2003).
- Hsu, K., et al. The pu.1 promoter drives myeloid gene expression in zebrafish. Blood. 104 (5), 1291-1297 (2004).
- Wittamer, V., Bertrand, J. Y., Gutschow, P. W., Traver, D. Characterization of the mononuclear phagocyte system in zebrafish. Blood. 117 (26), 7126-7135 (2011).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7, 42 (2007).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. Journal of Leukocyte Biology. 80 (6), 1281-1288 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Harvie, E. A., Green, J. M., Neely, M. N., Huttenlocher, A. Innate immune response to Streptococcus iniae infection in zebrafish larvae. Infection and Immunity. 81 (1), 110-121 (2013).
- Langenau, D. M., et al. In vivo tracking of T cell development, ablation, and engraftment in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 101 (19), 7369-7374 (2004).
- Bajoghli, B., et al. Evolution of genetic networks underlying the emergence of thymopoiesis in vertebrates. Cell. 138 (1), 186-197 (2009).
- Jessen, J. R., Willett, C. E., Lin, S. Artificial chromosome transgenesis reveals long-distance negative regulation of rag1 in zebrafish. Nature Genetics. 23 (1), 15-16 (1999).
- Jessen, J. R., Jessen, T. N., Vogel, S. S., Lin, S. Concurrent expression of recombination activating genes 1 and 2 in zebrafish olfactory sensory neurons. Genesis. 29 (4), 156-162 (2001).
- Liu, X., et al. Zebrafish B Cell Development without a Pre-B Cell Stage, Revealed by CD79 Fluorescence Reporter Transgenes. Journal of Immunology. 199 (5), 1706-1715 (2017).
- Bertrand, J. Y., Kim, A. D., Teng, S., Traver, D. CD41+ cmyb+ precursors colonize the zebrafish pronephros by a novel migration route to initiate adult hematopoiesis. Development. 135 (10), 1853-1862 (2008).
- de Jong, J. L., Zon, L. I. Histocompatibility and hematopoietic transplantation in the zebrafish. Advances in Hematology. 2012, 282318 (2012).
- Ossowski, P., et al. Differentiation of morphotic elements in human blood using optical coherence tomography and a microfluidic setup. Optics Express. 23 (21), 27724-27738 (2015).
- McCullough, K., et al. Measuring the population burden of chronic kidney disease: a systematic literature review of the estimated prevalence of impaired kidney function. Nephrology Dialysis Transplantation. 27 (5), 1812-1821 (2012).
- Drummond, B. E., Wingert, R. A. Insights into kidney stem cell development and regeneration using zebrafish. World Journal of Stem Cells. 8 (2), 22-31 (2016).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Atlas of Cellular Dynamics during Zebrafish Adult Kidney Regeneration. Stem Cells International. 2015, 547636 (2015).
- Wen, X., et al. A zebrafish model of infection-associated acute kidney injury. American Journal of Physiology-Renal Physiology. 315 (2), 291-299 (2018).
- Gong, J., Noel, S., Pluznick, J. L., Hamad, A. R. A., Rabb, H. Gut Microbiota-Kidney Cross-Talk in Acute Kidney Injury. Seminars in Nephrology. 39 (1), 107-116 (2019).
- Kim, M. J., Moon, D., Jung, S., Lee, J., Kim, J. Cisplatin nephrotoxicity is induced via poly(ADP-ribose) polymerase activation in adult zebrafish and mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 318 (5), 843-854 (2020).
- Parichy, D. M., Elizondo, M. R., Mills, M. G., Gordon, T. N., Engeszer, R. E. Normal table of postembryonic zebrafish development: staging by externally visible anatomy of the living fish. Developmental Dynamics. 238 (12), 2975-3015 (2009).
- Singleman, C., Holtzman, N. G. Growth and maturation in the zebrafish, Danio rerio: a staging tool for teaching and research. Zebrafish. 11 (4), 396-406 (2014).
- Wagner, T., Kreft, B., Bohlmann, G., Schwieder, G. Effects of fosfomycin, mesna, and sodium thiosulfate on the toxicity and antitumor activity of cisplatin. Journal of Cancer Research and Clinical Oncology. 114 (5), 497-501 (1988).
- Hentschel, D. M., et al. Acute renal failure in zebrafish: a novel system to study a complex disease. American Journal of Physiology-Renal Physiology. 288 (5), 923-929 (2005).
- Zhou, W., Hildebrandt, F. Inducible podocyte injury and proteinuria in transgenic zebrafish. Journal of the American Society of Nephrology. 23 (6), 1039-1047 (2012).
- Huang, J., et al. A zebrafish model of conditional targeted podocyte ablation and regeneration. Kidney International. 83 (6), 1193-1200 (2013).
- Christou-Savina, S., Beales, P. L., Osborn, D. P. Evaluation of zebrafish kidney function using a fluorescent clearance assay. Journal of Visualized Experiments. (96), e52540 (2015).
- Lieschke, G. J., Oates, A. C., Crowhurst, M. O., Ward, A. C., Layton, J. E. Morphologic and functional characterization of granulocytes and macrophages in embryonic and adult zebrafish. Blood. 98 (10), 3087-3096 (2001).
- Dasari, S., Tchounwou, P. B. Cisplatin in cancer therapy: molecular mechanisms of action. European Journal of Pharmacology. 740, 364-378 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır