Method Article
Akute Nierenverletzung Modell induziert durch Cisplatin bei erwachsenen Zebrafischen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verfahren zur Induzieren akute Nierenverletzung (AKI) bei erwachsenen Zebrafischen mit Cisplatin als Nephrotoxisches Mittel. Wir haben die Schritte zur Bewertung der Reproduzierbarkeit der Technik und zwei Techniken zur Analyse von Entzündungen und Zelltod im Nierengewebe, Durchflusszytometrie bzw. TUNEL detailliert beschrieben.
Zusammenfassung
Cisplatin wird häufig als Chemotherapie angewendet. Obwohl es positive Effekte bei krebsbehandelten Personen hat, kann sich Cisplatin aufgrund seines geringen Molekulargewichts leicht in der Niere ansammeln. Eine solche Akkumulation verursacht den Tod von röhrenförmigen Zellen und kann die Entwicklung von akuten Nierenverletzungen (AKI) induzieren, die durch eine schnelle Abnahme der Nierenfunktion, Gewebeschäden und Infiltration von Immunzellen gekennzeichnet ist. Wenn in bestimmten Dosen verabreicht Cisplatin kann ein nützliches Werkzeug als AKI-Induktor in Tiermodellen sein. Der Zebrafisch ist als interessantes Modell erschienen, um Nierenfunktion, Nierenregeneration und Verletzungen zu untersuchen, da Nierenstrukturen funktionelle Ähnlichkeiten mit Säugetieren bewahren. Erwachsene Zebrafische, die mit Cisplatin injiziert werden, zeigen ein vermindertes Überleben, nierenzellzellabsterbenund erhöhte Entzündungsmarker nach 24 h Nachinjektion (hpi). In diesem Modell können Immunzelleninfiltration und Zelltod durch Durchflusszytometrie und TUNEL-Assay beurteilt werden. Dieses Protokoll beschreibt die Verfahren zur Induzierung von AKI bei erwachsenen Zebrafischen durch intraperitoneale Cisplatin-Injektion und zeigt anschließend, wie man das Nierengewebe für die Verarbeitung der Durchflusszytometrie und den Zelltod TUNEL-Assay sammelt. Diese Techniken werden nützlich sein, um die Wirkung von Cisplatin als nephrotoxisches Mittel zu verstehen und zur Erweiterung von AKI-Modellen bei erwachsenen Zebrafischen beitragen. Dieses Modell kann auch verwendet werden, um die Nierenregeneration zu studieren, bei der Suche nach Verbindungen, die Nierenschäden behandeln oder verhindern und um Entzündungen in AKI zu untersuchen. Darüber hinaus werden die in diesem Protokoll verwendeten Methoden die Charakterisierung von Gewebeschäden und Entzündungen verbessern, die therapeutische Ziele bei nierenassoziierten Komorbiditäten sind.
Einleitung
Die Nieren sind verantwortlich für mehrere wichtige physiologische Funktionen, die Homöostase aufrecht erhalten, wie Blutfiltration, Entfernung von überschüssigen Rückständen, und Regulierung der Ionenkonzentrationen1. Schäden des Nierengewebes können zu einem heterogenen Zustand namens Akute Nierenverletzung (AKI) führen, der klinisch als eine schnelle Abnahme der Nierenfunktion beschrieben wird, die durch Zerstörung und Tod von röhrenförmigen Epithelzellen, Endothelzellverletzungen und Leukozyteninfiltration 2,3verursacht wird. AKI ist ein Zustand, der bei 8-16% derKrankenhauseinweisungen4 auftreten wird, mit einer hohen Sterblichkeitsrate, die zwischen 20 und 50% auf der Intensivstation (ICU)5liegt. Diese Krankheit ist mit einem erhöhten Krankenhausaufenthalt und einem erheblichen Einsatz finanzieller Mittel verbunden5. Etiologische Faktoren sind Dehydrierung, Schock, Infektionen, Sepsis, Herz-Kreislauf-Erkrankungen und nephrotoxische Medikamente6. Nephrotoxizität ist definiert als eine Nierenverletzung durch Medikamente induziert, verursacht Auswirkungen wie AKI, Tubulopathien, und Glomerulopathien7. Nephrotoxizität betrifft zwei Drittel der Intensivpatienten, da etwa 20% der auf der Intensivstation verschriebenen Medikamente als nephrotoxisch8,9, dies umfasst nichtsteroidale entzündungshemmende Medikamente (NSAIDs), Antibiotika wie Vancomycin und Aminoglykoside, und Chemotherapeutika wie Methotrexat und Cisplatin7. Cisplatin ist eines der wirksamsten und häufigsten Chemotherapie-Medikamente, bei der Behandlung von soliden Tumoren wie Kopf und Hals, Hoden, Eierstock und Blase10verwendet. In der Niere wird Cisplatin in der proximalen konvolutierten Röhre (PCT) durch den organischen kationischen Transporter 2 (OCT-2) verinnerlicht und bindet in hohen Konzentrationen an die DNA auslösende Zelltodeswege7,10,11,12. Die Anhäufung dieses Medikaments in der Niere trägt zur Nephrotoxizität mit Tod und Entzündung13bei. Diese schädliche Nebenwirkung wirkt sich enorm auf das Leben und die Prognose von einem Drittel der Krebspatienten, die sich einer Cisplatin-Behandlung unterziehen, und ist daher zwingend notwendig, die Erforschung neuer Therapien, die die Nephrotoxizität senken können, ohne die tödliche Wirkung auf Krebszellen zu verlieren10.
Aufgrund dieser nephrotoxischen Wirkung wird Cisplatin häufig als Induktivität von AKI in experimentellen Tiermodellen verwendet, wie nach vorne beschrieben. Bei Nagetieren wurde das erste durch Cisplatin induzierte AKI-Modell 197114 berichtet, aber derzeit sind viele verschiedene Protokolle unter Verwendung der dosisabhängigen und kumulativen Wirkungen von Cisplatin15entstanden. Dabei können je nach Dosierung und Anzahl der Anwendungen unterschiedliche Schweregrade der Nierenverletzung induziert werden16,17,18,19,20,21. Die häufigste Methode besteht in einer intraperitonealen (i.p.) Injektion einer Dosis Cisplatin gefolgt von Euthanasie in den folgenden Tagen. In diesem klassischen Protokoll induziert eine einzige hohe nephrotoxische Dosis Cisplatin (10-13 mg/kg bei Mäusen und/oder 3-8 mg/kg bei Ratten) wenige Tage nach der Cisplatin-Injektion schwere histologische Veränderungen, wie den Verlust von Bürstenrand und Zellablagerungen im inneren röhrenförmigen Lumen. Der Schweregrad der histologischen Veränderungen ist dosisabhängig, und Anzeichen einer Regeneration werden 7 Tage nach cisplatin Injektion16,17beobachtet.
Obwohl Nagetiermodelle gut etabliert sind, haben wir uns entschieden, die Eigenschaften eines anderen Wirbeltiers zu nutzen, wobei wir unsere Studien auf den Zebrafisch (Danio rerio )konzentrierten. Dieser Fisch wurde ausgiebig zur Modellierung menschlicher Krankheiten verwendet, wegen seiner geringen Größe, der externen Befruchtung, der hohen Reproduktionsraten, der schnellen Entwicklung, der Transparenz der Embryonen und Larven, der geringen Wartungskosten, der ähnlichen Anatomie wie Säugetiere (mit einigen Ausnahmen), der hohen Geweberegenerationskapazität, des Sozialverhaltens, 70% der genetischen Ähnlichkeit mit menschenverachtenden und 84% mit den mit menschlichen Krankheiten assoziierten Genen22. Streisinger et al.23,24,25 begannen die Studien mit Zebrafischen, die die Praktikabilität der Verwendung dieses Modellorganismus für die genetische Analyse der Wirbeltierentwicklung bestätigten. In der Nierenforschung ist der Zebrafisch nicht nur in Entwicklungsstudien, sondern auch als genetisches Werkzeug bei der Suche nach neuen Genen im Zusammenhang mit Nierenerkrankungen entstanden26. Darüber hinaus machen die Fähigkeit der Regeneration ohne Narbenbildung und die Fähigkeit, Nephronen durch ihr Leben zu erzeugen, genannt Neonephrogenese, den Zebrafisch zu einem Schlüsseltiermodell für die Regenerationsforschung27,28. Darüber hinaus zeigt die Verfügbarkeit von experimentellen Modellen für verschiedene Nierenerkrankungen, einschließlich akuter und chronischer Nierenverletzungen, die Vielseitigkeit dieses Versuchsorganismus26,29. Wie bei Säugetieren werden die Nierenvorläufer der Zebrafische aus dem Zwischenmesoderm abgeleitet. Solche Nierenvorläufer erzeugen die anfälligenPhros, die sich später zu den Mesonephros entwickeln werden, die als reifes Organ bis zum Erwachsenwerden29,30beibehalten werden.
Die erwachsene Zebrafischniere befindet sich an der Rückenwand des Körpers, zwischen der Schwimmblase und dem Rückgrat29. Aus der ventralen Ansicht kann der Zebrafisch in drei Regionen unterteilt werden(Abbildung 1A):Kopf (H), Stamm (Tr) und Schwanz (Ta)29. Wie Säugetiere hat der Zebrafisch die Nephrone als funktionelle Einheiten der Niere, die in Tubulensegmente unterteilt sind (Abbildung 1A): Nierenteilchen (RC), proximale convoluted tubbule (PCT), proximale gerade Tubule (PST), distal früh (DE), spät distal (DL) und Sammelkanal (CD)29. Zebrafisch teilt genetische Erhaltung und strukturelle Ähnlichkeiten mit menschlichen Nephronen (Abbildung 1B), aber es fehlen einige Konformationen wie der Zwischentubuli, auch bekannt als die Schleife von Henle (LH)29,31. Süßwasserfische wie Zebrafische sind normalerweise von einem Medium mit sehr geringer Osmolarität umgeben, aus diesem Grund neigen sie dazu, hyperosmotisch zu sein und hängen von den Kiemen, der Haut in frühen Stadien und der Niere ab, um Osmolarität und Wasserausscheidung zu regulieren32. Die Filtration des Blutes aus der dorsalen Aorta durch die anfälligen Phros beginnt um 48 h nach der Befruchtung (hpf)33,34. Die Niere des Zebrafisches ist nicht nur ein Stoffwechselabfallausscheidungsorgan, sondern funktioniert auch als hämatopoetisches Organ von 4 Tagen nach der Befruchtung (dpf) bis zum Erwachsenenalter und entspricht dem Knochenmark bei Säugetieren35. Während der Entwicklung werden hämatopoetische Stammzellen (HSCs) die Niere säen, sich selbst renovieren und myeloische, erythroide und lymphoide Zelllinien erzeugen, Transkriptionsfaktoren beibehalten, Moleküle signalisieren und hochkonservierte genetische Programme mit Säugetieren36,37. Studien haben gezeigt, dass die meisten Erythroid-, Thrombozyten-, Myeloid- und Lymphzellen des menschlichen Immunsystems in Zebrafischen37,38vorhanden sind. Die einzigartigen Eigenschaften dieses Tieres und die konservierten Merkmale mit der menschlichen Niere machten diesen Modellorganismus vorteilhaft in der Erforschung der Nierenfunktion, Verletzung und Regeneration.
Obwohl die Niere des Zebrafisches gut untersucht ist und einige Modelle von AKI bereits bei Larven und erwachsenen Zebrafischen28verfügbar sind, gab es zum Zeitpunkt der Einführung dieses Protokolls keine Hinweise auf ein chemisch induziertes nichtantibiotisches AKI-Modell bei erwachsenen Zebrafischen. Darüber hinaus konzentriert sich unser Labor auf die Erprobung von probiotischen Bakterien und Mikrobiota-abgeleiteten Verbindungen, um Regeneration und Nierenschäden zu untersuchen, daher konzentrierten wir unsere Anstrengungen auf die Schaffung eines neuen Cisplatin-induzierten AKI-Modells bei erwachsenen Fischen. Der in diesem Manuskript vorgestellte Videoartikel zeigt die Verfahren für ein neues Modell der AKI-Induktion mit einer i.p. Injektion von 120 ug Cisplatin pro g Tier (120 g/g) (Abbildung 2A). Diese Dosis stützte sich zunächst auf Studien mit AKI, die durch Cisplatin in murinen Modellen induziert wurden und etwa 10 mg/kg (entspricht 10 g/g)14,15,16,17, jedoch nicht ausreichten, um Nierenschäden im Zusammenhang mit Nephrotoxizität zu induzieren (Daten nicht gezeigt). So erhöhten wir die Dosis auf die in dieser Studie verwendeten (Abbildung 2B). Unsere Arbeit zeigte eine dosisabhängige Wirkung von Cisplatin in der Überlebensrate nach der Injektion mit Induktion von NierengewebeSchäden 24 PSi, wie durch Verlust der röhrenförmigen Struktur, erhöhte entzündliche Infiltrat und hohe Rate des Zelltodes gezeigt. Hier beschreiben wir zwei Techniken zur Analyse der Entwicklung von Cisplatin-induziertem AKI: Durchflusszytometrie, um die Zellinfiltration zu analysieren, und TUNEL, um den Zelltod zu messen. Die Durchflusszytometrie ist eine Technologie, die die physikalischen (Größe und Granularität) und chemischen (fluoreszierenden Verbindungen) Eigenschaften der Zellen misst. Im Inneren des Zytometers verläuft die Zellsuspension durch eine Mantelflüssigkeit, die die Zellen in einer einzigen Linie organisiert, so dass sie eine Zelle nach der anderen durch einen Laserstrahl passieren können (Abbildung 3A). Ein Detektor vor dem Lichtstrahl misst die Vorwärtsstreuung (Forward Scatter, FSC), die mit der Zellgröße korreliert, und Detektoren zur Seite messen die Side Scatter (SSC), die mit der Granularität der Zellen korreliert. Andere Detektoren messen die Fluoreszenz von Partikeln, Fluoreszenzproteinen oder Antikörper-markierten Zellen39,40. Da kommerzielle Antikörper für Zebrafische heutzutage knapp sind, ermöglicht der Einsatz von Tierreportern und fluoreszierenden Biomarkern, diese Analyse zu verbessern und verschiedene Zellpopulationen zu identifizieren41,42,43. Ein weiteres in diesem Protokoll verwendetes Werkzeug war der Terminal deoxynucleotidyl transferase (TdT) dUTP Nick End Labeling (TUNEL) Assay. Der TUNEL-Assay ist eine Spätstadium-Apoptose-Erkennungsmethode, die auf der Fähigkeit des TdT beruht, fragmentierte DNA zu identifizieren und mit Deoxynukleotiden zu kennzeichnen, die mit einem fluoreszierenden Marker markiert sind, der später durch Mikroskopie44 visualisiert und quantifiziert werden kann (Abbildung 3B). Wenn man bedenkt, dass eines der auffälligsten Merkmale von AKI die Induktion von Apoptose in röhrenförmigen Nierenzellen3ist, ist diese Technik äußerst vorteilhaft, da sie durch Durchflusszytometrie und/oder Mikroskopie analysiert werden kann.
Die in diesem Artikel vorgestellten Ansätze ermöglichen die Beobachtung des AKI-Status und bieten ein neues akutes Modell zur Untersuchung von AKI-Erkrankungen, das für die Erforschung neuer therapeutischer Ziele im Cisplatin-assoziierten AKI nützlich sein kann.
Protokoll
Die in diesem Protokoll beschriebenen Verfahren wurden zuvor von der Ethikkommission für den Einsatz von Tieren des Instituts für Biomedizinische Wissenschaften der Universität von Sao Paulo für die Verwendung im Zebrafischmodell zugelassen.
1. AKI Induktion durch Cisplatin Intraperitoneale Injektion
- Bereiten Sie die Cisplatin-Arbeitslösung vor, indem Sie die Stammlösung in 0,9% NaCl auf 850 g/ml verdünnen. Bei Raumtemperatur aufbewahren, vor Licht geschützt.
VORSICHT: Der Hersteller empfiehlt die Manipulation von Cisplatin mit persönlicher Schutzausrüstung (PSA) einschließlich Brille, Handschuhen und Labormantel. Bewahren Sie die Lagerlösung bei Raumtemperatur auf, geschützt vor Licht. - Bereiten Sie 150 mg/L MS-222 (Tricain) Anästhetikum im Systemwasser45vor. Anästhetisieren Erwachsene Zebrafische (5-9 Monate) durch Eintauchen für ca. 1-2 min.
HINWEIS: Effektiv anästhesierte Fische sollten nicht berühren. Um eine wirksame Anästhesie zu testen, drücken Sie vorsichtig die Kaudalflosse, um die Reaktion zu beobachten.
VORSICHT: Tricain ist ein Reizmittel für die Haut und die Augen, verwenden PSA zu manipulieren. - Mit einem Plastiklöffel übertragen Sie den Fisch auf eine saugfähige Oberfläche, wie Papiertücher, um überschüssiges Wasser um den Körper zu entfernen. Dann, mit dem Plastiklöffel übertragen Sie den Fisch auf eine Petrischale über eine Skala und wiegen Sie den Fisch. Beachten Sie das Gewicht der Fische, da es für Dosisberechnungen notwendig sein wird.
HINWEIS: Die Aufnahme von überschüssigem Wasser von Fischen verhindert eine Überschätzung des Gewichts des Tieres, nicht übertrocknen, da dies den Fisch schadet. - Um die Enddosis von 120 g/g Gewicht zu erreichen, teilen Sie die 'g der Enddosis (120 g) pro 'g der Cisplatin-Arbeitslösung (850 g) auf und wandeln Diese Zahl in Mikroliter (L) um, indem Sie sich für 1000 multiplizieren, um das Volumen von 120 g Cisplatin (141,2 'L) zu erhalten. Dann multiplizieren Sie diese Zahl (141,2 l) für das Gewicht der Fische (g), um das endgültige Volumen zu injizieren.
- Mit einem Plastiklöffel den Fisch auf einen nassen Schwamm mit einem kleinen Schnitt übertragen, um ihn zu halten, mit der ventralen Seite nach oben. Der Schwamm sollte mit Anästhetikum im Systemwasser nass sein.
- Füllen Sie eine 31 G 1,0 ml Insulinspritze mit dem berechneten Volumen der Cisplatin-Arbeitslösung.
- Setzen Sie die Nadel in den intraperitonealen Teil des Tieres in der Nähe der Beckenflosse in einem flachen Winkel ein, um zu vermeiden, dass die Eingeweide durchbrochen wird (Abbildung 2A). Dann langsam injizieren Sie die Lösung.
- Nach der Injektion legen Sie den Fisch in einen Tank, um sich von der Anästhesie zu erholen. Beobachten Sie die Fische auf Anzeichen einer normalen Erholung(z. B. Schwimmbewegungen, Operkuläre Bewegungen).
HINWEIS: Das Tier sollte sich in den nächsten 3-5 min erholen. Bei Bedarf stimulieren Sie den Fisch, indem Sie ihn mit einem Plastiklöffel, einer Pasteur-Kunststoffpipette bewegen oder ihn in die Nähe eines Schlauches mit Blasen stellen. - Für Kontrollfische führen Sie das gleiche Verfahren durch Injektion einer Lösung von 0,9% NaCl durch. Verwenden Sie die gleiche Berechnung nach dem Anteil des Körpergewichts: Das zu injizierende Volumen beträgt 141 L multipliziert mit dem Gewicht des Fisches (g).
- Überwachen Sie das Überleben von Fischen mindestens zweimal täglich in den folgenden Tagen (Abbildung 2B).
2. Nierenisolation und Gewebeverarbeitung für die Durchflusszytometrie von Immunzellen
- Verwenden Sie für dieses Verfahren immunzellfluoreszierende transgene Tiere(z. B.Tg (mpo:GFP)).
- Nach 24 PSi von 120 g/g Cisplatin, einschläfern Tiere durch hypothermischen Schock (schnelles Abkühlen).
HINWEIS: Hypothermaler Schock hat sich als Euthanasiemethode als wirksamer erwiesen als eine MS-222-Überdosierung. Hypothermaler Schock ist weniger stressig, schnell, konsistent und sicherer für das Personal als die Verwendung von MS-222, hat zuvor beschrieben46,47. - In einem äußeren Kreuzungsbehälter Eiswasser in einem Verhältnis von Eis zu Systemwasser vorbereiten, den inneren Tank mit einem Sieb über dem Eis legen, warten, bis das Wasser 2-4 °C erreicht.
HINWEIS: Fische sollten nicht in direktem Kontakt mit dem Eis stehen, da dies zu thermischen Verbrennungen und Schmerzen führen kann. - Tier ins Eiswasser geben, mindestens 10 min warten, bis die Orientierung verloren geht und keine Operkuläre Bewegung besteht.
- Mit einem Plastiklöffel den Fisch auf Papiertücher legen, um das überschüssige Wasser auszutrocknen.
- Den Fisch auf eine 3% Agarose-Sektionsplatte geben und unter ein Stereoskop mit Oberlicht nehmen. Enthaupten Sie mit der Schere Fische, die einen schnellen Schnitt direkt hinter den Augen machen, und entfernen Sie den Kopf.
- Mit feiner Schere einen Schnitt von der offenen Seite zur Kloake machen und die inneren Organe mit feiner Zange entfernen.
- Verwenden Sie Insektenstifte, um die Seiten der Körperwände zu kneifen, um den Kadaver zu öffnen und die Amrand am Rückgrat befestigte Niere freizulegen.
- Lösen Sie die Niere mit feiner Zange und legen Sie das Organ in eine 6-Well-Platte mit einer kalten Lösung von 1x PBS/2% FBS. Auf Eis bleiben.
- Nehmen Sie das Gewebe mit einer Pasteur-Kunststoffpipette auf und leiten Sie das Gewebe durch ein 40-m-Zellsieb über ein 50 ml-Rohr, wobei Es sanft mit einem Spritzenkolben mazeriert wird.
- Zweimal mit 1 ml 1x PBS/2% FBS waschen und die Zellen in einem 50 ml Rohr sammeln.
- Zentrifugenzellen bei 400 × g für 5 min bei 4 °C.
- Nehmen Sie den ganzen Überstand vorsichtig mit einer 1 ml Mikropipette auf und entsorgen Sie ihn. Fügen Sie 500 l kalte 1x PBS hinzu, um die Zellen wieder aufzuhängen und sie in 5 ml Durchflusszytometrieröhrchen zu platzieren. Auf Eis bleiben.
- Zählzellen in Neubauer-Kammer, die eine Verdünnung von 1:10 in Trypan Blue bilden(z.B.10 l der Probe nehmen und mit 90 l Trypan Blue mischen). Fügen Sie 10 L der Mischung in eine Neubauer-Kammer und zählen Sie Zellen unter dem Mikroskop.
HINWEIS: Optimale Ergebnisse werden mit 1-5 x 106 Zellen/ml und >80% Lebensfähigkeit erwartet.
VORSICHT: Trypan blue ist ein krebserregendes Mittel, verwenden PSA zu handhaben. - Nehmen Sie die Zellen, die von einem Zytometer gelesen werden sollen. Analysieren Sie dann die Ergebnisse, indem Sie die Vongabier auswählen.
3. Verarbeitung von erwachsenen Zebrafisch Nierengewebe für TUNEL Assay
- Verwenden Sie für dieses Verfahren Wildtiere(z. B.AB, Tübingen, etc.) oder ein transgenes Tier mit einer anderen fluoreszierenden Farbe als das TUNEL-Kit, da eine ähnliche Fluoreszenz die ANALYSE von TUNEL beeinträchtigen kann.
- Nach 24 PSi von 120 g/g Cisplatin, einschläfern Tiere durch hypothermischen Schock (schnelles Abkühlen). Siehe 2.3-2.4.
- Sezieren Sie den Fisch wie in 2.5-2.6 beschrieben; die Niere muss während des Fixierungsvorgangs am Rückgrat befestigt bleiben (nachfolgend erläutert).
- Mit Insektenstiften, kneifen Sie die Seiten der Körperwände, um den Kadaver zu öffnen und stecken Sie es auf einer Korkoberfläche, um die Niere ausgesetzt zu halten.
HINWEIS: Dieses Verfahren stellt sicher, dass die Niere für eine spätere Analyse in der richtigen Position bleibt. - Dann legen Sie die Korkoberfläche mit der Niere nach unten in eine 6-Well-Platte über eine frisch hergestellte Lösung von 4% Paraformaldehyd (PFA). Über Nacht bei 4 °C aufbewahren.
VORSICHT: PFA ist krebserregend und reizend für Haut und Schleimhaut. Bereiten Sie PFA-Lösungen unter einer chemischen Haube mit PSA einschließlich Augenschutzausrüstung vor. - Am nächsten Tag sezieren Sie die Nieren wie in 2.8. Die Nieren in eine 60 mm Petrischale mit 1x PBS geben und zweimal in 1x PBS ausspülen.
- Bereiten Sie 2% Agarose vor, um eine Stützmatrix für das Gewebe zu erzeugen.
- Entsorgen Sie alle verbleibenden 1x PBS aus der Petrischale und gießen Sie 2% Agarose langsam, um das gesamte Organ zu bedecken. Positionieren Sie dann die Niere mit feinen Zangen unter einem Stereomikroskop, um zu verhindern, dass die Niere faltet. Agarose bei Raumtemperatur erstarren lassen.
HINWEIS: Dieses Verfahren wird die Ausrichtung und Form des Organs durch histologische Verarbeitung beibehalten, da die blattartige Form des Organs eine Neigung zum Falten bewirkt, wenn es sich nicht innerhalb einer unterstützenden Matrix befindet. - Nach der Agarose-Erstarrung, verwenden Sie ein Skalpell, um die Agarose um das Gewebe zu schneiden, bilden kleine Würfel, und entfernen Sie den Überschuss an Agarose um das Gewebe.
- Legen Sie die Agarose-Würfel in eine Kassette, die für die histologische Verarbeitung geeignet ist.
HINWEIS: Die folgenden Schritte können manuell oder in einem automatischen Gewebeprozessor ausgeführt werden. - Verarbeiten Sie zunächst das Gewebe in der Kassette nach den nächsten Schritten für jeweils 45 min bei Raumtemperatur: ein Bad mit 50 % Ethanol, ein Bad mit 70 % Ethanol, zwei aufeinander folgende Bäder mit 95 % Ethanol und drei aufeinander folgende Bäder mit 100 % Ethanol. Danach verarbeiten Sie das Gewebe in zwei aufeinanderfolgenden Bädern von Xylol und drei aufeinander folgenden Bädern von Paraffin; Letzteres dauert jeweils 1 Stunde bei 60 °C.
VORSICHT: Nehmen Sie Änderungen unter einer chemischen Haube vor, Dämpfe aus Ethanol und Xylol sind reizend und giftig. - Um Paraffinblöcke vorzubereiten, schmelzen Paraffinlinsen auf 60 °C.
- Öffnen Sie die Plastikkassette mit dem Gewebe im Inneren und halten Sie sie auf einer warmen Platte. Aufwärmmetallformen für das Paraffin.
- Mit einer Pinzette das Gewebe über eine Metallform legen, so dass die Nierenlänge parallel zur Formbasis ist. Fügen Sie das Paraffin hinzu, ordnen Sie das Gewebe bei Bedarf neu zu.
- Bedecken Sie die Form mit der Basis der Kassette und fügen Sie Paraffin hinzu, bis das Gitter abgedeckt ist. Bei Raumtemperatur erstarren lassen und dann bei -20 °C für einen schnelleren Erstarrungsprozess platzieren.
- Paraffinblock ca. 20-30 min später aus der Metallform lösen.
- Mit einem Mikrotom, schneiden Sie das Gewebe in Paraffin auf 5 m Dicke eingebettet. Verwenden Sie silanisierte oder positiv geladene Glasschlitten, um das Gewebe zu sammeln.
4. TUNEL-Test
HINWEIS: Das folgende Protokoll verwendet ein In Situ Cell Death Detection Kit (Materialtabelle).
- Dewax Gewebe gleitet sie in zwei aufeinander folgenden Bädern von Xylol für 5 min. Dann rehydrieren Sie das Gewebe durch eine abgestufte Reihe von Ethanol: 100%-95%-70%-50%, für jeweils 5 min.
- Dias in laufendes kaltes Leitungswasser legen, um das Ethanol abzuspülen. Bewahren Sie die Dias in destilliertem Wasser auf.
- Bereiten Sie eine dunkle Inkubatorkammer vor. Fügen Sie nasse Papiertücher auf der Unterseite hinzu, um die Feuchtigkeit während der Inkubationsschritte zu halten.
HINWEIS: In Ermangelung einer Inkubatorkammer ist es möglich, eine Petrischale mit feuchtem Papier in der Unterseite und zwei Zahnstocher zu verwenden, um die Folie zu platzieren. - Bereiten Sie frische Proteinase K Arbeitslösung vor:10 g/ml in 10 mM Tris/HCl, pH 7.4-8.
HINWEIS: Proteinase K wird als Permeabilisationsmittel verwendet, wie vom Hersteller empfohlen. - Legen Sie die Dias in die dunkle Inkubatorkammer und fügen Sie Proteinase K Arbeitslösung bis zur Abdeckung Proben. 30 min bei 37 °C inkubieren.
- Während der Inkubation von Proben bereiten Sie das TUNEL-Reaktionsgemischvor: Fügen Sie der 450-L-Etikettenlösung 50 l Enzymlösung hinzu. Vor Licht schützen.
HINWEIS: Die zu bereitende Lautstärke kann im gleichen Verhältnis von 1:10 eingestellt werden. Das Volumen wird berechnet, um 50 l der Mischung für jeden Abschnitt zu sein; Dies kann sich je nach Größe der Proben ändern. - Nehmen Sie die dunkle Kammer und waschen Sie die Rutschen zweimal mit 1x PBS.
- Als nächstes trocknen Sie den Bereich um die Probe mit saugfähigem Papier und fügen Sie 50 L TUNEL-Reaktionsgemisch über jeden Gewebeschlitten hinzu, verteilen Sie die Lösung, so dass die gesamte Probe abgedeckt wird. Bei 37 °C für 2 h inkubieren. Vor Licht schützen.
- Nach der Inkubation spülen Sie die Folie dreimal mit 1x PBS ab und trocknen Sie den Bereich um die Probe mit Papiertüchern.
- Fügen Sie den Proben 50 l DAPI 1:1000 zur nuklearen Gegenfärbung hinzu und brüten Sie 5 min bei Raumtemperatur ein. Vor Licht schützen.
- Spülen Sie erneut dreimal mit 1x PBS und trocknen Sie die Region um die Probe herum.
- Montieren Sie die Rutsche mit einem anti-verblassenden hydrophilen Medium, legen Sie einen Deckelschlupf und versiegeln Sie mit Nagellack. Dias horizontal lagern, bei 4 °C vor Licht geschützt.
HINWEIS: Die Anti-Fade-Eigenschaften des Montagemediums sind, um die Fluoreszenz der Proben zu erhalten, aber ist möglich, jedes hydrophile Medium zur Verfügung zu verwenden. Der letzte Dichtschritt mit Nagellack ist entscheidend, um Austrocknung zu vermeiden. - Visualisieren Sie die Proben unter einem Fluoreszenzmikroskop. Verwenden Sie für diese Art von fluoreszierendem Pigment eine Anregungswellenlänge im Bereich von 520-560 nm (grün) und Detektion im Bereich von 570-620 nm (rot).
Ergebnisse
Die Niere des Zebrafisches ist ein flaches pigmentiertes Organ an der Rückenwand und seine grundlegende funktionelle Einheit, das Nephron, wird mit Säugetieren konserviert (Abbildung 1). Die Besonderheit, nur eine Niere mit einer hohen Regenerationsfähigkeit zu haben, macht diesen Modellorganismus zu einer ausgezeichneten Wahl für Modellnierenverletzungen. Die in dieser Arbeit vorgestellten Protokolle sollen AKI durch intraperitoneale (i.p.) Injektion von Cisplatin bei erwachsenen Zebrafischen induzierenundspäter mit zwei zuvor beschriebenen Techniken analysiert werden: Durchflusszytometrie (Abbildung 3A) und TUNEL (Abbildung 3B). Ein Flussdiagramm des gesamten Prozesses ist in Abbildung 4dargestellt. Die Dosen von Cisplatin wurden zunächst auf der Grundlage der in den Mausmodellen15,16,17beschriebenen Dosen angewendet, bei denen die verwendete Norm 10-13 mg Cisplatin pro kg Tier (mg/kg) beträgt. Allerdings erwiesen sich die Zebrafische als resistenter gegen Cisplatin als die Maus (Daten nicht gezeigt), und die Enddosis wurde erhöht. Bei der Auswertung der Überlebensrate der Tiere zeigten die Experimente eine dosisabhängige Wirkung von Cisplatin (Abbildung 5A). Aus diesem Grund empfehlen wir, die Anweisungen genau wie in diesem Protokoll erläutert zu befolgen und die Überlebensrate der Tiere ständig als Maß für die Reproduzierbarkeit zu überwachen, bevor Material gesammelt wird. Nach der i.p. Injektion von 120 g/g Cisplatin (Abbildung 5A, rote Linie) wurde in den ersten 24 h eine Abnahme des Überlebens von etwa 30 % der Tiere beobachtet und das Überleben verringerte sich allmählich, bis sie am 5. Tag nach der Injektion etwa 20 % der lebenden Tiere erreichte, dann stabilisierte(Abbildung 5A). Die Cisplatin-Toxizität wurde durch das Geschlecht der Tiere nicht beeinträchtigt, da Männchen und Weibchen ähnliche Überlebenskurven aufweisen (Abbildung 5B).
Die Analyse der Kinetik des cisplatin-induzierten AKI zeigte erhöhte Entzündungen und Zelltod in der Niere 24 psi. Eine der schnellsten und quantitativen Möglichkeiten, Entzündungen zu bewerten, ist die Durchflusszytometrie, aber angesichts des Mangels an Antikörpern gegen Zebrafisch-Antigene, die kommerziell für diese Technik erhältlich sind, ist es notwendig, eine transgene Linie mit einem Immunmarker zu verwenden. Heutzutage sind viele Zebrafischlinien, die Immunzellen kennzeichnen, zugänglich (Tabelle 1). Diese Linien können singly verwendet werden oder in Kombination, genügend Repertoire für die Analyse48,49,50,51,52,53,54,55,56,57,58,59,60. Dies vereinfacht die Technik enorm, da kein Antikörperinkubationsschritt notwendig ist, im Gegenteil, nach der Isolierung der Zellen durch mechanische Trennung ist das direkte Ablesen auf dem Zytometer möglich.
Wie bereits erwähnt, ist die Niere des Zebrafisches nicht nur ein Blutfiltrationsorgan mit panostatischen Funktionen, sondern auch die anatomische Stelle der Hämatopoese bei Erwachsenen, gleichbedeutend mit dem Knochenmark bei Säugetieren33,34,35. Auf diese Weise, wenn wir es durch Durchflusszytometrie analysieren ist möglich, Zellpopulationen vergleichbar mit dem menschlichen Blut61,62 (Abbildung 6A) zu unterscheiden, ermöglicht es uns, die Zellpopulationen zunächst nach Größe und Granularität zu identifizieren und Schutt auszuschließen. In diesem Fall verwendeten wir eine transgene Linie namens Tg(mpo:GFP)52, die ein grünes fluoreszierendes Protein (GFP) zusammen mit dem Enzym Myeloperoxidase ausdrückt, das in Neutrophilen vorhanden ist. Da wir dies wussten, beruhte unsere Gate-Strategie auf der anfänglichen Trennung der Population des Granulozyten (Abbildung 6B). Danach wurden Doppelzellen ausgeschlossen, da sie die Analyse erheblich verändern und zu ungenauen Schlussfolgerungen führen können. Ein Doublet ist ein einzelnes Ereignis, das aus 2 unabhängigen Teilchen besteht und durch Auswahl einer Vorwärtsstreuhöhe (FSC-H) vs. eines Vorwärtsstreubereichs(FSC-A) Dichtediagramms(Abbildung 6C) ausgeschlossen werdenkann. Nach diesem Schritt wurden die Zellen identifiziert, die den Fluoreszenzmarker exprimierten (Abbildung 6D). Schließlich wurden die Bevölkerungsstatistiken aus der Analyse extrahiert und als Prozentsatz der Zellen dargestellt (Abbildung 6E).
Eines der prominentesten Merkmale der Cisplatin-Nephrotoxizität ist der tubuläre Zelltod10, und um dies leicht zu visualisieren, verwendeten wir den TUNEL-Assay zur Apoptose-Erkennung. Diese Methode empfiehlt die Verwendung von Wildzellen und Geweben ohne Fluoreszenzmarker, da die parallele Fluoreszenz die Analyse beeinträchtigen würde, im Fall des Zebrafisches wird empfohlen, Wildtyplinien wie AB, Tübingen, TAB oder eine transgene Linie mit einem fluoreszierenden Protein zu verwenden, das die TUNEL-Fluoreszenzfarbe nicht beeinträchtigt. Die TUNEL-Technik ermöglicht die Analyse über Durchflusszytometrie oder Mikroskopie. Die Mikroskopie hat den Vorteil, dass die Gewebestruktur erhalten bleibt, so dass sie sehen kann, welche Zellen absterben. Unter dem Fluoreszenzmikroskop lassen sich die hellen Kerne apoptotischer Zellen leicht vom Hintergrund unterscheiden. Tiere, die mit Cisplatin injiziert werden (Abbildung 7B) haben mehr abgestorbene Zellen als die Kontrolle (Abbildung 7A) bei 24 PSi. Die endgültige Quantifizierung erfolgte mit der Zellzähler-Option von FIJI Software und zeigte statistisch mehr abgestorbene Zellen in mit Cisplatin behandelten Nieren als bei den Kontrollen (Abbildung 7C)
Das in diesem Manuskript beschriebene Protokoll zeigte, wie Man Cisplatin als Induktor von AKI bei erwachsenen Zebrafischen verwendet, die dosisberespondt, schnell und zuverlässig ist. Basierend auf den Daten aus den Überlebensraten und der Messung von Anzeichen einer Nephrotoxizität von Cisplatin einschließlich Entzündungen (die durch Durchflusszytometrie erkannt werden) und zelldeatht (durch TUNEL-Assay erkannt), schlagen wir dieses Modell für die Untersuchung der Cisplatin-Nephrotoxizität sowie für zukünftige Behandlungen bei AKI-bedingten Erkrankungen vor.
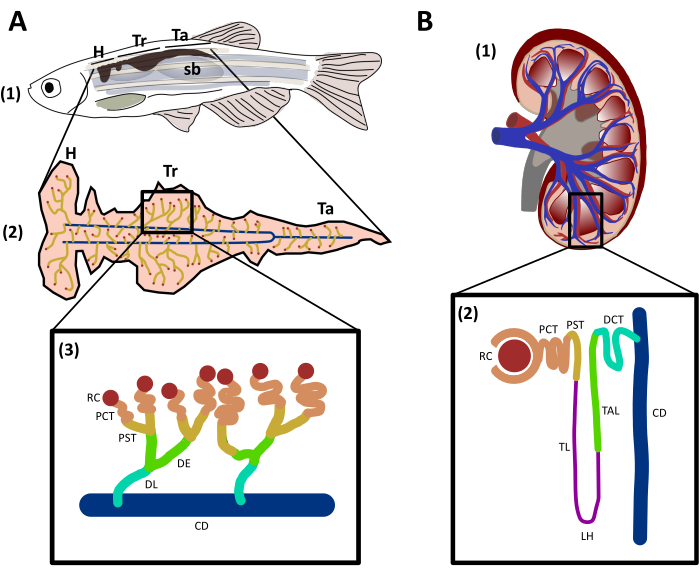
Abbildung 1: Struktur und Vergleich von Zebrafischen und menschlichen Nieren. A. (1) Seitenansicht eines erwachsenen Zebrafisches mit dunkelbraun dargestellter Niere in der Rückenwand des Fisches, zwischen der Schwimmblase (sb) und dem Rückgrat. (2) Ventralansicht der Niere mit Nephrone (gelb), die mit dem Sammelkanal verbunden sind (blau). Die verschiedenen Regionen der Niere sind gekennzeichnet: Kopf (H), Rumpf (Tr) und Schwanz (Ta). (3) Schematisch dargestellte Zebrafisch-Nephone und ihre Segmente, die so gekennzeichnet und gefärbt sind, dass sie genetisch konservierten Regionen mit menschlichem Nephron entsprechen. B. (1) Sagittalsicht einer menschlichen Niere. (2) Schematische Darstellung eines menschlichen Nephrons mit segmentierten und farbigen Segmenten. RC: Nierenteilchen; PCT: proximale verworrene Tubuli; PST: proximale gerade Tubuli; TL: dünne Gliedmaße; LH: Schleife von Henle; TAL: dicke saufsteigende Gliedmaße; DE: früh distal; DL: distal spät; DCT: distal verworrene Tubuli; CD: Abführungskanal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
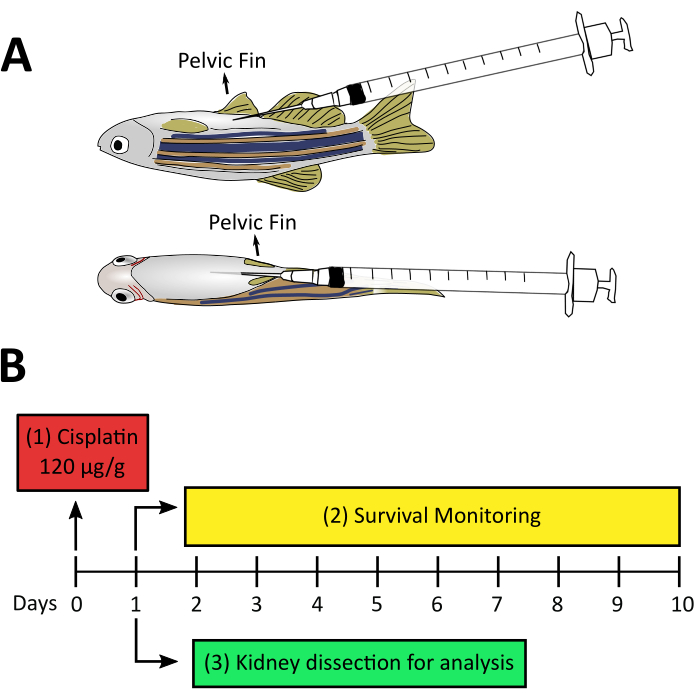
Abbildung 2:Experimentelles Design für cisplatin-induzierte AKI. A. Seitliche und ventrale Ansicht von erwachsenen Zebrafischen, die während des Injektionsvorgangs auf die Position der Nadel zeigen. Die Nadel dringt in einem 20-30°-Winkel aus dem Bauch ein und wird langsam parallel zur ventralen Wand eingesetzt, um eine Durchdringung der Eingeweide zu vermeiden. B. Experimentelles Design von cisplatin-induziertem AKI: (1) Injektion von Cisplatin 120 g/g pro Tier am Tag Null. (2) Vor dem Versuch von Schritt 3 wird die Überlebensüberwachung von Fischen nach der Injektion vom ersten tag bis zum zehnten Tag empfohlen. (3) Nierensektionen einen Tag nach der Cisplatin-Injektion zur Weiterverarbeitung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
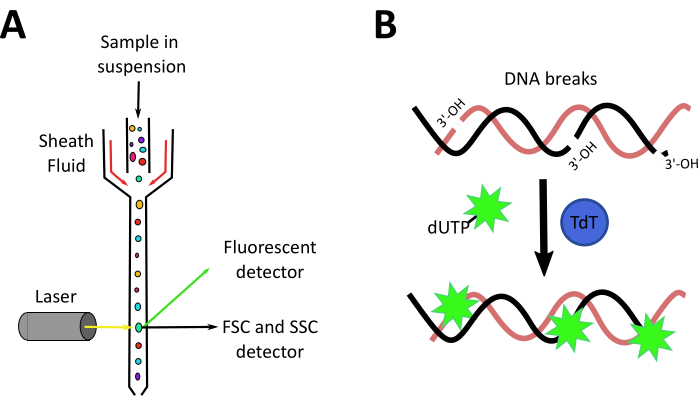
Abbildung 3:Mechanismen der Durchflusszytometrie und TUNEL-Techniken. A. Überblick über das Durchflusszytometer: Eine Suspension von Zellen wird hydrodynamisch durch eine Mantelflüssigkeit auf eine einzelne Linie fokussiert, wodurch Zellen vor einem Laserstrahl nacheinander passieren. Detektoren vor und auf der Seite messen die Vorwärtsstreuung (FSC), die Seitenstreuung (SSC) und die Fluoreszenz der Zellen. B. Prinzip des TUNEL-Assays. Terminal desoxynukleotidyl transferase (TdT) vermittelt die Zugabe eines fluoreszierenden dUTP zu 3'-OH-Enden einer fragmentierten DNA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
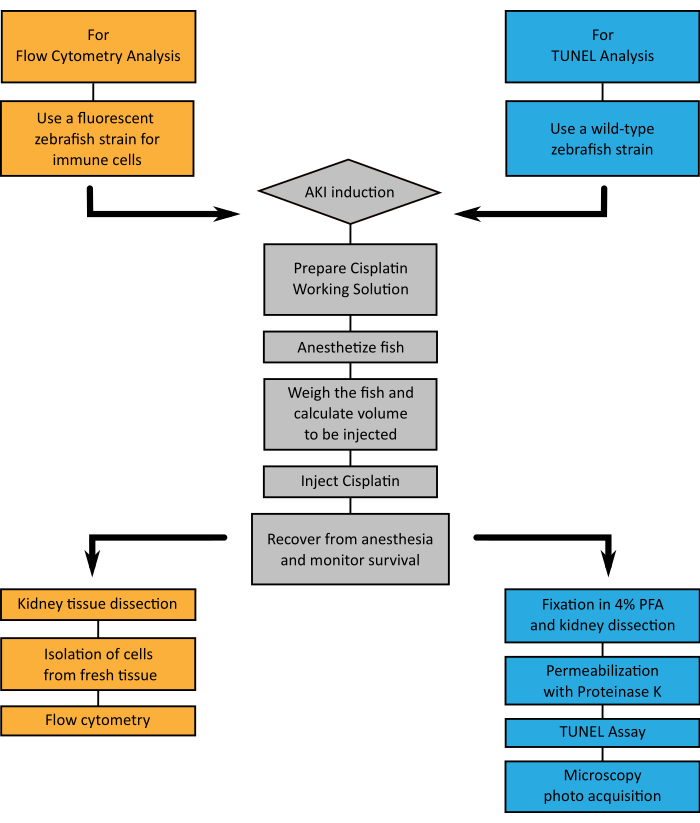
Abbildung 4:Flussdiagramm der dargestellten Techniken. A. Ein Flussdiagramm, das die Schritte zeigt, die bei der Wahl der Analyse des Nierengewebes durch Durchflusszytometrie (orange) oder TUNEL (blau) bei der Induktion von AKI durch Cisplatin-Injektion (grau) zu befolgen sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
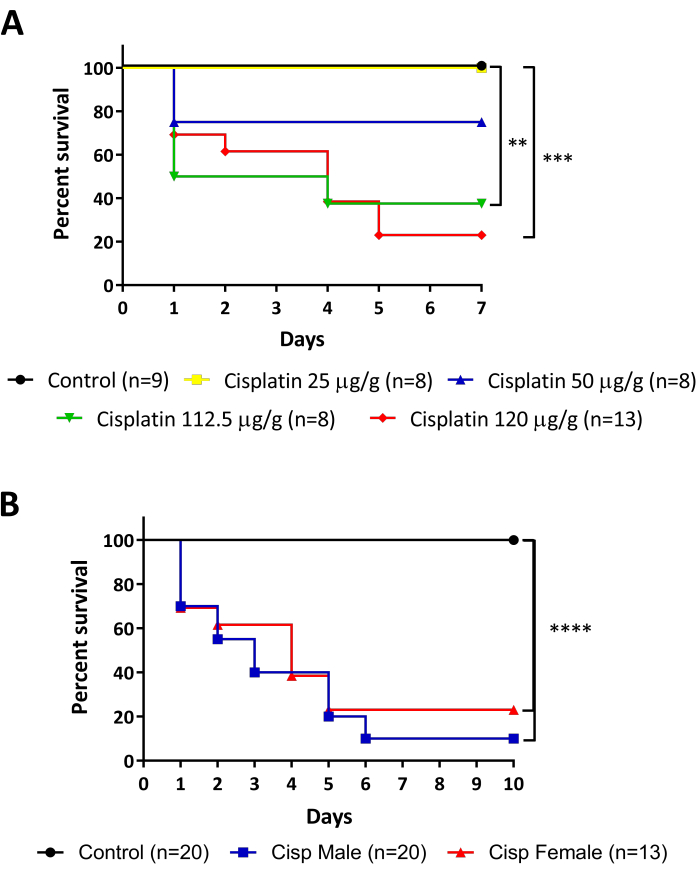
Abbildung 5: Überlebensüberwachung von Cisplatin-injizierten Fischen. A. Überlebensrate verschiedener Dosierungen von Cisplatin-Injektionen (25 - 50 - 112,5 - 120 g/g). Log-Rank (Mantel-Cox) Test, ** p < 0.01. B. Überlebensrate von Männchen vs. Weibchen, die mit 120 g/g Cisplatin injiziert wurden. Log-Rank (Mantel-Cox) Test, *** p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
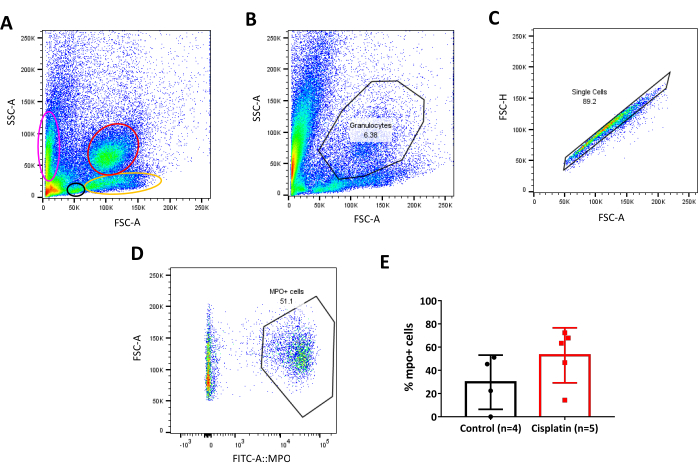
Abbildung 6:Torstrategie für transgene Zebrafischlinie. A. Dichteplot von Zebrafischen adulten Nierenzellen, Populationen sind durch Größe (FSC-A) und Granularität (SSC-A) getrennt. Verschiedene Populationen werden durch farbige Ovale/Kreise ausgewählt. Rosa: Erythroid; Schwarz: Lymphoid; Gelb: Vorläufer; Rot: Granulozyten. B. Dichtediagramm der Seitenstreufläche (SSC-A) und des Vorwärtsstreubereichs (FSC-A) zur Auswahl der Granulozytenpopulation in der Niere. C. Dichtediagramm von Vorwärtsstreuhoch (FSC-H) und Vorwärtsstreufläche (FSC-A) für die Auswahl der Singlets-Population innerhalb des Granulozyten-Gatter-Tors. D. Dichtediagramm der vorwärts gerichteten Streufläche (FSC-A) und FITC-A:MPO zur Auswahl von mpo:GFP-positiven Zellen (Neutrophilen) in der Niere. Eine positive Population wird um 103 auf, von Fluoreszenzintensität betrachtet. E. Graph des Prozentsatzes der mpo:GFP-positiven Zellen (Neutrophilen) in Control vs. Cisplatin-Tieren, 24 PSi . Unpaired t-test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
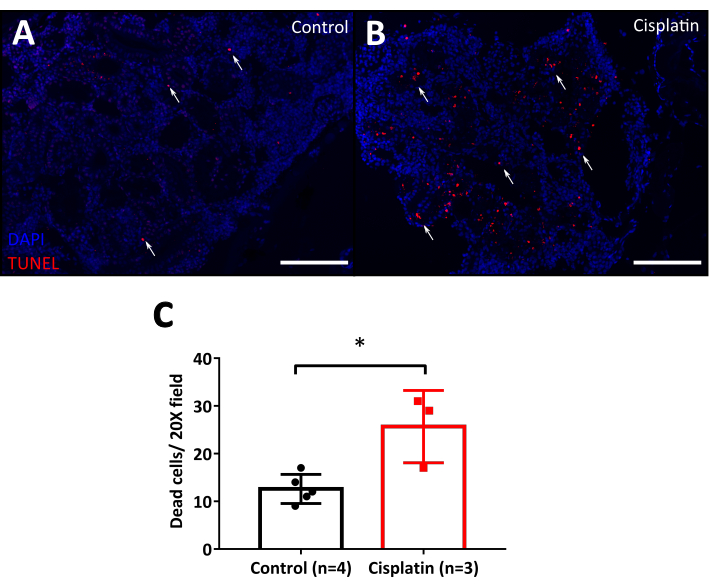
Abbildung 7: TUNEL-Assay von Cisplatin-injizierten Fischen. A. Mikrofotos der festen erwachsenen Niere 24 h nach 120 g/g Cisplatin-Injektion. Die Kontrollen werden mit 0,9% NaCl injiziert. TUNEL-positive Zellen (apoptotische Zellen) sind rot (weiße Pfeile) gefärbt. DAPI (blau) wird als nukleare Gegenfärbung verwendet. Skalenbalken: 50 m. 20-fache Vergrößerung. B. Grafik, die die Quantifizierung der Anzahl der abgestorbenen Zellen in der Niere um das 20-fache Feld zeigt. Unpaired t-test, * p < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Transgene Linie | Zellentyp beschriftet | Verweise |
| Tg(spi1:EGFP)pA301 | Myeloide Zellen | Ward et al. 200348 |
| Tg(zpu1:GFP) | Myeloide Zellen | Hsu et al. 200449 |
| Tg(mhc2dab:GFP)sd6 | Monozyten | Wittamer et al. 201150 |
| Tg(lysC:DsRED2) | Neutrophilen | Hall et al. 200751 |
| Tg(mpo:GFP) | Neutrophilen | Mathias et al. 200652 |
| Tg(mpeg1:mCherry) | Makrophagen | Ellett et al. 201153 |
| Tg(mpeg1:Dendra2) | Makrophagen | Harvie et al. 201354 |
| Tg(lck:GFP) | T-Zellen | Langenau et al. 200455 |
| TgBAC(ikaros:EGFP) | T-Zellen | Bajoghli et al. 200956 |
| Tg(rag1:GFP) | T-Zellen | Jessen et al. 199957 |
| Tg(rag2:GFP) | T-Zellen | Jessen et al. 200158 |
| Tg (CD79:GFP) | B-Zellen | Liu et al. 201759 |
| Tg(CD45:DsRed) | Leukozyten | Bertrand et al. 200860 |
Tabelle 1: Zebrafisch transgene Linien für Immunzellen. Tabelle, die die Namen der Zebrafischreporterlinien mit der jeweiligen Art der Immunzelle beschriftet und die Referenzartikel, in denen sie konstruiert wurden, wieder aufführt. Eine Kombination dieser Zebrafischlinien kann neue Möglichkeiten der Zellauswahl durch Durchflusszytometrie bieten.
Diskussion
Die Prävalenz von Nierenerkrankungen hat weltweit weiter zugenommen und ist zu einem globalen Problem der öffentlichen Gesundheit geworden, von dem Millionen von Menschen63betroffen sind. Einen Weg zu finden, um Nierenverletzte zu behandeln, ist von größter Bedeutung und mehr über ihre Ätiologie und Progression zu verstehen. Mehrere Studien haben Tiermodelle verwendet, um Nierenschäden zu verstehen. Die Zebrafischniere (Abbildung 1) wird seit Jahren in der Entwicklungsbiologie und Verletzungsforschung wegen ihrer selbstregenerierenden Fähigkeiten und genetischen Ähnlichkeit29,64untersucht. Hier präsentieren wir ein neues AKI-Modell in erwachsenen Zebrafischen unter Verwendung der Eigenschaften von Cisplatin als nephrotoxisches Mittel, das die Schritte zur Durchführung einer schnellen und akuten Reaktion mit sichtbaren Schäden zeigt, sobald 24 PSi sind (Abbildung 2). Darüber hinaus erklären wir hier zwei Techniken, die zur Bewertung der Gewebeschäden nach der Cisplatin-Injektion, Durchflusszytometrie und TUNEL helfen werden (Abbildung 3).
Aktuelle AKI-Modelle in erwachsenen Zebrafischen umfassen die i.p. Injektion von Gentamicin, die große Schäden in der Nephron- und Tubuli-Zerstörung induziert, Neonephrogenese-Ereignisse beginnen ab Tag 5, und die Regeneration wird durch 21 Tage nach der Injektion65abgeschlossen. Auf der anderen Seite wurde ein Modell der Sepsis-assoziierten akuten Nierenverletzung (S-AKI) durch die Infektion mit Edwardsiella tardaetabliert, da die Expression von AKI-Markern, wie Insulin-ähnliche Wachstumsfaktor-bindendes Protein-7 (IGFBP7), Gewebehemmer von Metalloproteinasen 2 (TIMP-2) und Nierenverletzungmolekül-1 (KIM-1), bei Larven und Erwachsenenzebrafischen66signifikant erhöht wurde. Der Zebrafisch ist bekannt für ein High-Throughput-Tier für die Suche nach therapeutischen Mitteln und dies schließt die Verwendung von Probiotika und Mikrobiota-abgeleiteten Metaboliten zur Untersuchung der Nierenfunktion und Regeneration67. Die verfügbaren Modelle könnten jedoch direkt auf das Ergebnis dieser Behandlungen auswirken. So haben wir eine andere Methode eingeführt, um AKI bei erwachsenen Zebrafischen zu induzieren (Abbildung 4), mit Cisplatin als bekanntes Nephrotoxisches Mittel, das keine direkten bekannten Auswirkungen auf die Fischmikrobiota haben würde, wie das Gentamicin-Modell als Antibiotikum oder die Infektion mit E. tarda,als Sepsis-Modell. Zur gleichen Zeit, als wir unser Cisplatin-Protokoll entwickelten, untersuchte eine andere Gruppe auch die nephrotoxische Wirkung von Cisplatin bei erwachsenen Zebrafischen und vereinfachte die Dosis auf 10-20-30 g pro Tier68. Obwohl sie auch Cisplatin dosisabhängige Wirkung im Überleben zeigten, empfehlen wir Vorsicht bei der Verwendung einer einzigen Menge Cisplatin für alle Fische, da Zebrafische aus dem gleichen Alter sehr unterschiedliche Größen und Gewicht haben können und dies Schwankungen in den Ergebnissen69,70induzieren könnte. Wir halten es für wichtig, die Dosis an das entsprechende Gewicht des Tieres anzupassen, wie es bei Mäusen und dieser Studie der Fall ist.
In unseren Experimenten mit erwachsenen Zebrafischen zeigte Cisplatin einen Dosis-Wirkungs-Effekt. Dies wurde durch die Überwachung der Überlebensrate der Tiere nach Cisplatin-Injektion visualisiert (Abbildung 5). Wir verwendeten das Überleben als eine Möglichkeit, die Intensität der Dosis von Cisplatin zu schätzen und nicht als Maß für die Nephrotoxizität, da während der Überwachungszeit kein anderes physikalisches Zeichen sichtbar ist. Dies kann mit Nagetieren vergleichbar sein, bei denen die Schwere der Nierenverletzung durch die Dosierung und Häufigkeit der Cisplatin-Injektion15moduliert werden kann, um tödliche Dosen mit höheren Konzentrationen von Cisplatin71zu erreichen. Tot ist auch in den folgenden Tagen im Larvenmodell von Cisplatin72zu sehen. Da es unser Ziel war, in wenigen Tagen eine akute Verletzung auszulösen, haben wir die 120-g/g-Dosis Cisplatin ausgewählt, da es möglich ist, Nierenschäden 24 h nach der Injektion zu beobachten, dies kann jedoch je nach den Zielen der Studie angepasst werden.
Beim Menschen wird AKI klinisch durch verminderte glomeruläre Filtrationsrate (GFR), erhöhtes Serumkreatinin und Harnstoffstickstoff im Blut3diagnostiziert. Bei Zebrafischen umfasst das Repertoire der AKI-Modelle einige genetisch bedingte Modelle73,74 und einige drogenbezogene Modelle65,72, aber da einige der AKI-Funktionsparameter aufgrund technischer Schwierigkeiten(z. B. Blutentnahme) nicht an Zebrafischen gemessen werden können, nehmen die meisten Forschungen morphologische und visuelle Techniken an, um die Merkmale von AKI1,75 wie unsere Studie zu beobachten.
Bei Nagetieren tritt Cisplatin in die Epithelzellen in den proximalen und distalen Tubuli ein, innerhalb der Zelle wird metabolisch aktiviert und wird hochreaktiv, wenn es auf Zellorganellen wirkt und Veränderungen in der Zellstruktur hervorruft. Diese Veränderungen können Apoptose und Autophagie und sogar Nekrose induzieren, bei sehr hohen Dosen. Als Reaktion auf diese Schäden werden viele Zytokine freigesetzt und Leukozyten rekrutiert, was zu Entzündungen führt und die Funktionalität des Organs15beeinträchtigt. Dies unterstreicht die Bedeutung der Beurteilung, welche Art von Zellen in der verletzten Niere gefunden werden können, als Bewohner oder infiltrierte Immunzellen. Hier haben wir gezeigt, wie man dies anhand der heute verfügbaren transgenen Immunreporterlinien(Tabelle 1) anhand der Durchflusszytometrie beurteilt. Cisplatin erhöhte den Anteil der Neutrophilen (mpo:GFP-positive Zellen) in der Niere 24 h nach der Injektion (Abbildung 6). Im Falle des Zebrafisches ist die Niere die Nische von HSCs, die zu verschiedenen Blutzelltypen führen. Dennoch zirkulieren viele Granulozyten und Makrophagen normalerweise im Blut. In unserem Beispiel verwendeten wir die transgene Linie mpo:GFP, die GFP unter dem Promotor der Myeloperoxidase von Neutrophilen ausdrückt52. Ursprüngliche Studien der transgenen Linie mpo:GFP zeigten die Expression der Myeloperoxidase in verschiedenen Zuständen der Neutrophilenreifung76, aber unsere Gate-Strategie konzentrierte sich auf die Granulozytenfraktion, die aus reifen Zellen aus dem Blut52besteht, auf diese Weise umfasst unsere Analyse infiltrierte Zellen und nicht ansässige Zellen. Dies ist wichtig, wenn die gewünschte Zellpopulation isoliert wird.
Wie oben erläutert, ist Apoptose der klassischste Marker von Cisplatin-bezogener AKI. Hier haben wir ein einfaches Protokoll zur Lokalisierung abgestorbener Zellen durch den TUNEL-Assay demonstriert. Cisplatin-Injektion erhöhte die Anzahl der apoptotischen Zellen 24 PSi (Abbildung 7). Dies kann leicht quantifiziert werden, indem direkt die abgestorbenen Zellen aus dem Gewebe gezählt werden. Dennoch kann zur Identifizierung des zellspezifischen Todes die Verwendung von Antikörpern gegen die gewünschte Zelle(z.B. Röhrenzellen) oder die Verwendung einer transgenen Reporterlinie zusammen mit dieser Technik verwendet werden. Im Vergleich zum Gentamicin-induzierten Modell von AKI scheint Cisplatin ein schwereres Modell zu sein, da die Gentamicin-Apoptose am dritten Tag nach der Injektion65höher war.
Trotz einer Vielzahl von Nebenwirkungen, Cisplatin ist immer noch weit verbreitet in der Krebstherapie verwendet, wegen seiner Wirksamkeit gegen verschiedene Arten von Krebs, einschließlich Karzinome, Keimzelltumoren, Lymphome, undSarkome 77. Nephrotoxizität tritt bei einem Drittel der Patienten in der Behandlung mit Cisplatin10, so dass die Suche nach Strategien, die diesen Effekt zu verringern und renoprotection erhöhen kann zwingend erforderlich. Wir glauben, dass die in diesem Manuskript vorgestellten Methoden und Techniken dazu beitragen werden, Mechanismen von Nierenverletzungen aufzuklären und therapeutische Ziele zu finden, die wesentlich sein können, um die Lebensqualität von Personen zu verbessern, die unter Nierenkomplikationen leiden, vor allem solche, die mit der Verwendung von Cisplatin zusammenhängen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschung wurde unterstützt von Fundao de Amparo - Pesquisa do Estado de Sao Paulo - FAPESP (2015/21644-9; 2017/05264-7; 2017/05687-5; 2018/20722-4), Conselho Nacional de Desenvolvimento Cientéfico e Tecnolégico (CNPq) und Coordenaéo de Aperfeiéoamento de Pessoal de N'vel Superior (CAPES), Finanzleitnummer 001. Wir danken unseren Mitarbeitern im Labor von Maria Rita dos Santos e Passos-Bueno es und der Zebrafish Facility der Abteilung Genetik und Evolutionsbiologie im Biowissenschaftlichen Institut der Universität von Sao Paulo. Wir danken Cristiane Naffah de Souza Breda und Theresa Raquel de Oliveira Ramalho für die Kommentare und Vorschläge zum Manuskript. Wir schätzen und danken Marcio Villar Martins vom Multimedia-Team des Instituts für Biomedizinische Wissenschaften für die Aufnahme, Ausgabe und Produktion dieses Videos.
Materialien
| Name | Company | Catalog Number | Comments |
| 1x PBS | Made by diluting 10 X PBS (prepared in lab) in distilled water | ||
| 31 G 1.0 cc insulin syringe | BD Plastipak | 990256 | Needle: BD Precision Glide 300110 |
| 3.5 L Fish tank | Tecniplast | Part of the aquactic system | |
| 6 well plate | Corning | 351146 | |
| 10 mM Tris/HCl | Prepared from solid Tris Base (Promega, H5135), adjusted to pH 7.4-8 with HCl (Merck, 1003171000) | ||
| 50 ml Falcon tube | Corning | 352070 | |
| 2-3% Agarose | Invitrogen | 16500-500 | Dissolve 2 or 3% agarose (w/v) in 1x PBS, warm until dissolve. |
| 2% FBS | Gibco | 12657-09 | Dilute 2% (w/v) directly in 1x PBS |
| 4% Paraformaldehyde | Sigma-Aldrich | P6148-500G | Dissolve 4% PFA (w/v) in warm 1x PBS, mix until dissolve in a hot plate in a fume hood. Aliquot and store at -20 °C |
| 50% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 70% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 90% Ethanol | Made by diluting 100% ethanol in distilled water | ||
| 100% Ethanol | Synth | 00A1115.01.BJ | |
| 100% Xylene | Synth | 00X1001.11.BJ | |
| Cell strainer 40 µm | Corning | 431750 | |
| Cisplatin | Blau Farmacêutica | 16020227 | C-PLATIN 1 mg/mL. Store at room temperature. |
| Cork board sheet | Obtained from local stationary store | ||
| DAPI | Sigma-Aldrich | D9542 | Stock solution 20 mg/ml dissolved in water |
| Fine forceps | Fine Science Tools | 11254-20 | |
| Flow cytometry tubes | Corning | 352052 | |
| Glass slide | Thermo-Fisher | 4445 | |
| Histology cassette | Ciencor | 2921 | |
| Immuno stain chamber | Ciencor | EP-51-05022 | |
| Incubator | NAPCO | 5400 | Set to 37 °C |
| Insect pins | Papillon | Model micro15x20 | |
| In Situ Cell Death Detection Kit | Roche Diagnostics | 12156792910 | |
| Metal mold | Leica Biosystems | 3803081 | |
| Micropipette 200-1000 µL | Eppendorf | Use 1 mL tips | |
| MS-222 (Tricaine) | Fluka Analytical | A5040-25G | |
| NaCl 0.9% | Synth | C1060.01.AG | Dissolve 0.9% NaCl (w/v) in distilled water |
| Nail polish | Prefer transparent | ||
| Neubauer chamber | Precicolor HGB | ||
| Pasteur plastic pipet | United Scientific Supplies | P31201 | |
| Paraplast | Sigma-Aldrich | P3558 | |
| Petri dish | J.ProLab | 0307-1/6 | 60 and 100 mm |
| Plastic spoon | Obtained from local store | ||
| Proteinase K | New England BioLabs | P8102 | Diluite from stock 20 mg/ml |
| Scissors | Fine Science Tools | 14060-09 | |
| Scalpel blade | Solidor | ||
| Sponge | Obtained from local store | ||
| Trypan Blue | Cromoline | 10621/07 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000-10 | |
| Centrifuge | Eppendorf | 5810R | |
| Cytometer | BD Biosciences | FACSCanto II | |
| Fluorescence Stereoscope | Zeiss | Axio Zoom.V16 | |
| Fluorescence Microscope | Zeiss | AxioVert.A1 | |
| Microtome | Leica | Jung Supercut | |
| Scale | Ohaus Corporation | AR2140 |
Referenzen
- McKee, R. A., Wingert, R. A. Zebrafish Renal Pathology: Emerging Models of Acute Kidney Injury. Current Pathobiology Reports. 3 (2), 171-181 (2015).
- Guo, C., Dong, G., Liang, X., Dong, Z. Epigenetic regulation in AKI and kidney repair: mechanisms and therapeutic implications. Nature Reviews Nephrology. 15 (4), 220-239 (2019).
- Makris, K., Spanou, L. Acute Kidney Injury: Definition, Pathophysiology and Clinical Phenotypes. Clinical Biochemist Reviews. 37 (2), 85-98 (2016).
- Sawhney, S., et al. Intermediate and Long-term Outcomes of Survivors of Acute Kidney Injury Episodes: A Large Population-Based Cohort Study. American Journal of Kidney Diseases. 69 (1), 18-28 (2017).
- Saxena, A., Meshram, S. V. Predictors of Mortality in Acute Kidney Injury Patients Admitted to Medicine Intensive Care Unit in a Rural Tertiary Care Hospital. Indian Journal of Critical Care Medicine. 22 (4), 231-237 (2018).
- Sawhney, S., Fraser, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in Chronic Kidney Disease. 24 (4), 194-204 (2017).
- Sales, G. T. M., Foresto, R. D. Drug-induced nephrotoxicity. Revista da Associação Médica Brasileira. 66, 82-90 (2020).
- Perazella, M. A. Drug use and nephrotoxicity in the intensive care unit. Kidney International. 81 (12), 1172-1178 (2012).
- Taber, S. S., Mueller, B. A. Drug-associated renal dysfunction. Critical Care Clinics. 22 (2), 357-374 (2006).
- Pabla, N., Dong, Z. Cisplatin nephrotoxicity: mechanisms and renoprotective strategies. Kidney International. 73 (9), 994-1007 (2008).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4 (4), 307-320 (2005).
- Shirmanova, M. V., et al. Chemotherapy with cisplatin: insights into intracellular pH and metabolic landscape of cancer cells in vitro and in vivo. Scientific Reports. 7 (1), 8911 (2017).
- Xu, Y., et al. A Role for Tubular Necroptosis in Cisplatin-Induced AKI. Journal of the American Society of Nephrology. 26 (11), 2647-2658 (2015).
- Kociba, R. J., Sleight, S. D. Acute toxicologic and pathologic effects of cis-diamminedichloroplatinum (NSC-119875) in the male rat. Cancer Chemotherapy Reports. 55 (1), 1-8 (1971).
- Perše, M., Večerić-Haler, &. #. 3. 8. 1. ;. Cisplatin-Induced Rodent Model of Kidney Injury: Characteristics and Challenges. BioMed Research International. 2018, 1462802 (2018).
- Dobyan, D. C., Levi, J., Jacobs, C., Kosek, J., Weiner, M. W. Mechanism of cis-platinum nephrotoxicity: II. Morphologic observations. Journal of Pharmacology and Experimental Therapeutics. 213 (3), 551-556 (1980).
- Singh, G. A possible cellular mechanism of cisplatin-induced nephrotoxicity. Toxicology. 58 (1), 71-80 (1989).
- Jodrell, D. I., et al. The renal effects of N10-propargyl-5,8-dideazafolic acid (CB3717) and a non-nephrotoxic analogue ICI D1694, in mice. British Journal of Cancer. 64 (5), 833-838 (1991).
- McKeage, M. J., et al. Lack of nephrotoxicity of oral ammine/amine platinum (IV) dicarboxylate complexes in rodents. British Journal of Cancer. 67 (5), 996-1000 (1993).
- Gautier, J. C., et al. Evaluation of novel biomarkers of nephrotoxicity in two strains of rat treated with Cisplatin. Toxicologic Pathology. 38 (6), 943-956 (2010).
- Vinken, P., et al. Tissue Kim-1 and urinary clusterin as early indicators of cisplatin-induced acute kidney injury in rats. Toxicologic Pathology. 40 (7), 1049-1062 (2012).
- Zorzetto, R., Guimarães, M. Um peixe modelo. Pesquisa FAPESP. 209, 16-21 (2013).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Chakrabarti, S., Streisinger, G., Singer, F., Walker, C. Frequency of gamma-Ray Induced Specific Locus and Recessive Lethal Mutations in Mature Germ Cells of the Zebrafish, BRACHYDANIO RERIO. Genetics. 103 (1), 109-123 (1983).
- Walker, C., Streisinger, G. Induction of Mutations by gamma-Rays in Pregonial Germ Cells of Zebrafish Embryos. Genetics. 103 (1), 125-136 (1983).
- Morales, E. E., Wingert, R. A. Zebrafish as a Model of Kidney Disease. Results and Problems in Cell Differentiation. 60, 55-75 (2017).
- Poureetezadi, S. J., Wingert, R. A. Little fish, big catch: zebrafish as a model for kidney disease. Kidney International. 89 (6), 1204-1210 (2016).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Translational Research. 163 (2), 109-122 (2014).
- Drummond, I. A., Davidson, A. J. Zebrafish kidney development. Methods in Cell Biology. 100, 233-260 (2010).
- Saxén, L., Sariola, H. Early organogenesis of the kidney. Pediatric Nephrology. 1 (3), 385-392 (1987).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470 (7332), 95-100 (2011).
- Hill, A. J., Bello, S. M., Prasch, A. L., Peterson, R. E., Heideman, W. Water permeability and TCDD-induced edema in zebrafish early-life stages. Toxicological Sciences. 78 (1), 78-87 (2004).
- Drummond, I. A., et al. Early development of the zebrafish pronephros and analysis of mutations affecting pronephric function. Development. 125 (23), 4655-4667 (1998).
- Majumdar, A., Drummond, I. A. Podocyte differentiation in the absence of endothelial cells as revealed in the zebrafish avascular mutant, cloche. Developmental Genetics. 24 (3-4), 220-229 (1999).
- Song, H. D., et al. Hematopoietic gene expression profile in zebrafish kidney marrow. Proceedings of the National Academy of Sciences of the United States of America. 101 (46), 16240-16245 (2004).
- Gore, A. V., Pillay, L. M., Venero Galanternik, M., Weinstein, B. M. The zebrafish: A fintastic model for hematopoietic development and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 7 (3), 312 (2018).
- Paik, E. J., Zon, L. I. Hematopoietic development in the zebrafish. The International Journal of Developmental Biology. 54 (6-7), 1127-1137 (2010).
- Palis, J., Yoder, M. C. Yolk-sac hematopoiesis: the first blood cells of mouse and man. Experimental Hematology. 29 (8), 927-936 (2001).
- O'Donnell, E. A., Ernst, D. N., Hingorani, R. Multiparameter flow cytometry: advances in high resolution analysis. Immune Network. 13 (2), 43-54 (2013).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews Immunology. 4 (8), 648-655 (2004).
- Ma, D., Zhang, J., Lin, H. F., Italiano, J., Handin, R. I. The identification and characterization of zebrafish hematopoietic stem cells. Blood. 118 (2), 289-297 (2011).
- Kulkeaw, K., et al. Purification of zebrafish erythrocytes as a means of identifying a novel regulator of haematopoiesis. British Journal of Haematology. 180 (3), 420-431 (2018).
- Ratnayake, D., Currie, P. D. Fluorescence-Activated Cell Sorting of Larval Zebrafish Muscle Stem/Progenitor Cells Following Skeletal Muscle Injury. Methods in Molecular Biology. 1889, 245-254 (2019).
- Kyrylkova, K., Kyryachenko, S., Leid, M., Kioussi, C. Detection of apoptosis by TUNEL assay. Methods in Molecular Biology. 887, 41-47 (2012).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 53 (2), 198-203 (2014).
- Wilson, J. M., Bunte, R. M., Carty, A. J. Evaluation of rapid cooling and tricaine methanesulfonate (MS222) as methods of euthanasia in zebrafish (Danio rerio). Journal of the American Association for Laboratory Animal Science. 48 (6), 785-789 (2009).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Institute for Laboratory Animal Research Journal. 53 (2), 192-204 (2012).
- Ward, A. C., et al. The zebrafish spi1 promoter drives myeloid-specific expression in stable transgenic fish. Blood. 102 (9), 3238-3240 (2003).
- Hsu, K., et al. The pu.1 promoter drives myeloid gene expression in zebrafish. Blood. 104 (5), 1291-1297 (2004).
- Wittamer, V., Bertrand, J. Y., Gutschow, P. W., Traver, D. Characterization of the mononuclear phagocyte system in zebrafish. Blood. 117 (26), 7126-7135 (2011).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7, 42 (2007).
- Mathias, J. R., et al. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. Journal of Leukocyte Biology. 80 (6), 1281-1288 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Harvie, E. A., Green, J. M., Neely, M. N., Huttenlocher, A. Innate immune response to Streptococcus iniae infection in zebrafish larvae. Infection and Immunity. 81 (1), 110-121 (2013).
- Langenau, D. M., et al. In vivo tracking of T cell development, ablation, and engraftment in transgenic zebrafish. Proceedings of the National Academy of Sciences of the United States of America. 101 (19), 7369-7374 (2004).
- Bajoghli, B., et al. Evolution of genetic networks underlying the emergence of thymopoiesis in vertebrates. Cell. 138 (1), 186-197 (2009).
- Jessen, J. R., Willett, C. E., Lin, S. Artificial chromosome transgenesis reveals long-distance negative regulation of rag1 in zebrafish. Nature Genetics. 23 (1), 15-16 (1999).
- Jessen, J. R., Jessen, T. N., Vogel, S. S., Lin, S. Concurrent expression of recombination activating genes 1 and 2 in zebrafish olfactory sensory neurons. Genesis. 29 (4), 156-162 (2001).
- Liu, X., et al. Zebrafish B Cell Development without a Pre-B Cell Stage, Revealed by CD79 Fluorescence Reporter Transgenes. Journal of Immunology. 199 (5), 1706-1715 (2017).
- Bertrand, J. Y., Kim, A. D., Teng, S., Traver, D. CD41+ cmyb+ precursors colonize the zebrafish pronephros by a novel migration route to initiate adult hematopoiesis. Development. 135 (10), 1853-1862 (2008).
- de Jong, J. L., Zon, L. I. Histocompatibility and hematopoietic transplantation in the zebrafish. Advances in Hematology. 2012, 282318 (2012).
- Ossowski, P., et al. Differentiation of morphotic elements in human blood using optical coherence tomography and a microfluidic setup. Optics Express. 23 (21), 27724-27738 (2015).
- McCullough, K., et al. Measuring the population burden of chronic kidney disease: a systematic literature review of the estimated prevalence of impaired kidney function. Nephrology Dialysis Transplantation. 27 (5), 1812-1821 (2012).
- Drummond, B. E., Wingert, R. A. Insights into kidney stem cell development and regeneration using zebrafish. World Journal of Stem Cells. 8 (2), 22-31 (2016).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Atlas of Cellular Dynamics during Zebrafish Adult Kidney Regeneration. Stem Cells International. 2015, 547636 (2015).
- Wen, X., et al. A zebrafish model of infection-associated acute kidney injury. American Journal of Physiology-Renal Physiology. 315 (2), 291-299 (2018).
- Gong, J., Noel, S., Pluznick, J. L., Hamad, A. R. A., Rabb, H. Gut Microbiota-Kidney Cross-Talk in Acute Kidney Injury. Seminars in Nephrology. 39 (1), 107-116 (2019).
- Kim, M. J., Moon, D., Jung, S., Lee, J., Kim, J. Cisplatin nephrotoxicity is induced via poly(ADP-ribose) polymerase activation in adult zebrafish and mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 318 (5), 843-854 (2020).
- Parichy, D. M., Elizondo, M. R., Mills, M. G., Gordon, T. N., Engeszer, R. E. Normal table of postembryonic zebrafish development: staging by externally visible anatomy of the living fish. Developmental Dynamics. 238 (12), 2975-3015 (2009).
- Singleman, C., Holtzman, N. G. Growth and maturation in the zebrafish, Danio rerio: a staging tool for teaching and research. Zebrafish. 11 (4), 396-406 (2014).
- Wagner, T., Kreft, B., Bohlmann, G., Schwieder, G. Effects of fosfomycin, mesna, and sodium thiosulfate on the toxicity and antitumor activity of cisplatin. Journal of Cancer Research and Clinical Oncology. 114 (5), 497-501 (1988).
- Hentschel, D. M., et al. Acute renal failure in zebrafish: a novel system to study a complex disease. American Journal of Physiology-Renal Physiology. 288 (5), 923-929 (2005).
- Zhou, W., Hildebrandt, F. Inducible podocyte injury and proteinuria in transgenic zebrafish. Journal of the American Society of Nephrology. 23 (6), 1039-1047 (2012).
- Huang, J., et al. A zebrafish model of conditional targeted podocyte ablation and regeneration. Kidney International. 83 (6), 1193-1200 (2013).
- Christou-Savina, S., Beales, P. L., Osborn, D. P. Evaluation of zebrafish kidney function using a fluorescent clearance assay. Journal of Visualized Experiments. (96), e52540 (2015).
- Lieschke, G. J., Oates, A. C., Crowhurst, M. O., Ward, A. C., Layton, J. E. Morphologic and functional characterization of granulocytes and macrophages in embryonic and adult zebrafish. Blood. 98 (10), 3087-3096 (2001).
- Dasari, S., Tchounwou, P. B. Cisplatin in cancer therapy: molecular mechanisms of action. European Journal of Pharmacology. 740, 364-378 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten