Method Article
Laboratuvar Sınıflarında D1S80 Locus Kullanılarak DNA Parmak İzi Uygulaması
Bu Makalede
Özet
Burada VNTR locus D1S80'i epitel hücre DNA'sından yükselterek DNA parmak izi profilleri oluşturmak için basit bir protokol açıklıyoruz.
Özet
Biyolojik bilimlerde DNA parmak izi babalık testi, adli uygulamalar ve filogenetik çalışmalar için yaygın olarak kullanılmaktadır. Burada, lisans laboratuvar sınıfları bağlamında Değişken Tandem Tekrarı (VNTR) analizi ile genotipleme bireyleri için güvenilir ve sağlam bir yöntem tarif ediyoruz. İnsan D1S80 VNTR lokus, bu protokolde tekrarlayan dizilerin sayısındaki değişime dayanan son derece polimorfik bir işaretleyici olarak kullanılır.
Bu basit protokol, öğretmenler için yararlı bilgiler ve pratik laboratuvar sınıflarında DNA parmak izi uygulamasını iletir. Sunulan laboratuvar çalışmasında, DNA ekstraksiyonu ve ardından PCR amplifikasyonu D1S80 VNTR lokusundaki genetik varyasyonu belirlemek için kullanılır. PCR ürünlerinin parça boyutundaki farklılıklar agarose jel elektroforez ile görselleştirilir. Parça boyutları ve yineleme sayıları, DNA boyutu standardının boyutunun ve geçiş mesafesinin doğrusal bir gerilemesi temel alınarak hesaplanır.
Bu kılavuzu izleyerek, öğrenciler şunları yapabilmelidir:
• Buksal mukoza epitel hücrelerinden DNA toplamak ve çıkarmak
• Bir PCR deneyi gerçekleştirin ve çeşitli reaksiyon bileşenlerinin işlevini anlayın
• Ampliconları agarose jel elektroforez ile analiz edin ve sonuçları yorumlayın
• VNTR'lerin DNA parmak izinde kullanımını ve biyolojik bilimlerde uygulanmasını anlayın
Giriş
DNA parmak izi olarak da adlandırılan moleküler parmak izi, 1984 yılında Leicester Üniversitesi Genetik Bölümü'nde çalışırken Sir Alec Jeffreys tarafından tanıtıldı1984 1. Bireyler arasında farklılık gösteren ve yaklaşık üç milyon varyantdan oluşan insan genomunun% 0.1'ine dayanmaktadır. Genotipteki bu benzersiz farklılıklar bireyler arasındaki farklılaşmaya izin verir ve bu nedenle monozygotik ikizler dışında genetik bir parmak izi olarak işlev görür. Sonuç olarak, DNA parmak izi, örneğin babalık testinde veya nüfus çeşitliliği çalışmalarında uygulanan farklı bireylerin ilişkililiklerinin tahmin edilmesi için kullanılır. Laboratuvar sınıflarımızda DNA parmak izi ve alel frekansları kavramını aktarmayı amaçladık. Burada açıklanan yöntem, D1S80 lokusundaki Değişken Tandem Tekrar Sayısını (VNTR) analiz ederek genetik parmak izi için güvenilir ve sağlam bir yöntem göstermektedir. Yöntem, D1S80 lokusu yükseltmek için buccal mukoza epitel hücrelerinden DNA'nın ve ardından Polimeraz Zincir Reaksiyonu'ndan (PCR) çıkarılmasını ve ardından bir agarose jel üzerindeki parça uzunluğu farklılıklarının görselleştirilmesini içerir.
D1S80 VNTR minisatellit lokus oldukça değişkendir ve kromozom 1'in (1p36-p35) telomer bölgesinde bulunur. Karsai ve iş arkadaşları tarafından 1990 yılında 16 bp çekirdek tekrar ünitesine sahip bir locus olarak tanımlandı ve tanımlandı, sadece bir birim2ile farklı olan alellerin ayrılmasına izin verdi. Ayrıca, D1S80 yaklaşık 7.77 x 10-5 3mutasyon oranı ile yüksek derecede varyasyon gösterir. D1S80 yüksek derecede heterozygozite4,5 (örneğin, Kafkasyalılar için% 80.8 heterozygozite6 ve Afrika kökenli Amerikalılar için% 87 heterozygoziteye kadar7). Ek olarak, D1S80 lokusu çoğu popülasyonda polimorfiktir ve tipik olarak her biri 14 ila 41 tekrar taşıyan 15'in üzerinde farklı alel vardır. D1S80 alellerinin sıklığı popülasyonlar arasında değişir. 24 tekrar ünitesine sahip alele (alele 24) en sık Avrupa ve Asya popülasyonlarında görülürken, allele 21 en çok Afrika popülasyonlarında4, 7,8,9,10'da yaygındır. Sonuç olarak, alaşım frekansı dağılımları farklı insan popülasyonları için tanısaldır ve ilişkinin tahmini için dikkate alınması gerekir (örneğin, babalık testlerinde).
D1S80 VNTR lokusun PCR bazlı amplifikasyonu adli bilim, babalık testleri, hastalık analizi ve nüfus çeşitliliği çalışmalarında çok yararlı bir yöntem olmuştur11,12,13,14. Günümüzde adli tıpta VNTR'lerin kullanımı kısa tandem tekrarlarla değiştirilmiş olsa da, D1S80 VNTR lokus, 4 ,8,9,11popülasyonları arasındaki kökenlerin ve genetik ilişkilerin belirlenmesinde yaygın olarak kullanılmaktadır. Ayrıca, genellikle pratik laboratuvar sınıflarında DNA parmak izini öğretmek için kullanılır15,16. Burada açıklanan yöntem, lisans laboratuvar sınıflarında çok yüksek başarı oranına sahip sağlam, uygun maliyetli ve kullanımı kolay bir yöntemi temsil eder. Bu makalenin amacı, bukal mukoza epitel hücrelerinden insan D1S80 minisatellit lokusun moleküler analizi için iş akışına genel bir bakış sağlamaktır. Daha önce yayınlanan2,17çalışmalarında açıklanan tekniklerin, basitleştirilmiş protokollerin ve pratik önerilerin gösterimini içerir.
Protokol
NOT: Bu protokol, yalnızca öğrenciler veya ilgili yasal vasiler bu protokolün genotipik profiller olarak yürütülmesini kabul ettiyse, genetik ilişkiler hakkında fikir veriyorsa kullanılacaktır. DNA parmak izi, esas olarak nüfus çalışmaları ve adli konulara uygulanan yaygın bir moleküler biyoloji yöntemidir. Bu nedenle, kontaminasyon risklerini mümkün olduğunca düşük tutmak için dikkat edilmelidir. Numunenin dış kaynaktan veya DNases'ten ALıNAN DNA ile kirlenmesini önlemek için eldiven takılmalı, aletler iyice temizlenmeli veya sterilize edilmeli ve çözeltiler kullanımdan önce filtre sterilize edilmeli veya otomatik olarak kapatılmalıdır.
1. Buksal mukoza epitel hücrelerinin toplanması
DİkKAT: Tükürük ve epitel hücreleri ile çalışmak bulaşıcı hastalıkların bulaşmasına yol açabilir. Bu nedenle standart ve iletime dayalı önlemler uygulanmalıdır (örneğin, uygun kişisel koruyucu ekipmanların kullanımı).
NOT: Eğitmen tarafından sağlanan (örneğin, eğitmen tarafından çıkarılan DNA) ve aşağı akış işleme adımlarına dahil edilen pozitif bir kontrol ekleyin.
- Numune toplamadan önce dişleri yedikten veya fırçalamadan sonra en az 1 saat bekleyin.
- Boş ve steril bir 2,0 mL mikrosantrifüj tüpünü etiketle.
- Bir steril buccal bezini ambalajdan çıkarın ve bukal mukoza epitel hücrelerini toplamak için yanağın içine 30-40 kez veya 30-40 saniye boyunca kuvvetlice sürün.
- Toplama çubuğunun ucunu önceden etiketlenmiş steril mikrosantrifüj tüpüne yerleştirin ve kenarın ötesine uzanan plastiğin uzunluğunu elle veya steril makas kullanarak koparın.
- Kapağı tüpe güvenli bir şekilde yerleştirin ve toplama çubuğu içine kapatın.
2. Genomik DNA'nın insan hücrelerinden çıkarılması
- Ekstraksiyondan önce, numune lizisi için bir termal karıştırıcı veya ısıtma bloğunu 65 °C'ye ayarlayın.
DİkKAT: Kullanılan bazı kimyasallar tehlikeli olarak sınıflandırılır. Güvenlik veri sayfasını dikkatlice okuyun ve işlemeden önce uygun güvenlik önlemlerini alın.- Gerekli tüm tamponları ve çözeltileri (lizis çözeltisi, 8 M potasyum asetat, 2 propanol, %70 etanol ve elüsyon tamponu) filtreleyarak veya otomatik olarak kapatarak hazırlayın ve sterilize edin.
NOT: Tüm santrifüjleme adımları belirtilmedikçe oda sıcaklığında (20-30 °C) yapılmalıdır.
- Gerekli tüm tamponları ve çözeltileri (lizis çözeltisi, 8 M potasyum asetat, 2 propanol, %70 etanol ve elüsyon tamponu) filtreleyarak veya otomatik olarak kapatarak hazırlayın ve sterilize edin.
- Buccal sülfata 500 μL lizis çözeltisi (50 mM Tris/HCl, pH 8.0; 10 mM etilenediamin tetra-asetik asit (EDTA); %2 sodyum dodecyl sülfat (SDS)) ekleyerek numunenin tamamen liziz çözeltisine daldığından emin olun.
- En az 5 s için güçlü bir şekilde girdap.
- Örnekleri 65 °C'de bir termal karıştırıcıda 10 dakika kuluçkaya yatır.
- Kuluçka sırasında 5 sn için darbe girdabı ile numuneyi 3-4 kez karıştırın.
- Svabı liziz tamponundan çıkarın, maksimum numune hacmi elde etmek için çubuğu tüpün içine bastırın.
- Katlanmış hücrelere 100 μL 8 M potasyum asetat ekleyin.
- Beyaz bir çökelti olana kadar tüpü ters çevirerek iyice karıştırın.
- Oda sıcaklığında 5 dakika kuluçkaya yatır.
- Numuneyi 18.000 x g'da 5 dakika santrifüj edin.
- Süpernatantın 450 μL'lik kısmını temiz ve steril 1,5 mL mikrosantrifüj tüpüne aktarın.
- 450 μL 2 propanol ekleyin ve tüpü ters çevirerek (DNA'nın çökeltme) iyice karıştırın.
- Oda sıcaklığında 5 dakika kuluçkaya yatır.
- 18.000 x g'da5 dakika santrifüj.
- Peleti kurutmak ve çapraz kontaminasyonu önlemek için süpernatant atın ve tüpü temiz bir kağıt havluya ters çevirin.
- Peletin tamamen kurutılması için DNA'yı bir ısıtma bloğunda 65 °C'de 5 dakika kuluçkaya bırakın.
- DNA'yı yıkamak için% 70 etanolden 500 μL ekleyin.
- 18.000 x g'da1 dakika santrifüj.
- Üstnatant atın ve peleti kurutmak için tüpü temiz bir kağıt havluya ters çevirin.
- Peletin içine 30 μL resüspenzyon tamponu (10 mM Tris/HCl pH 8.0, 1 mM EDTA) ekleyin.
- DNA'yı 65 °C'de 10 dakika boyunca bir ısıtma bloğunda kuluçkaya yatırarak DNases'i etkisiz hale getir.
3. PCR kullanarak D1S80 VNTR lokusu amplifying
NOT: Gerekli plastikleri ve diğer malzemeleri toplamadan önce kullanılacak numune sayısını kaydedin ve gerekli reaktifleri ve hacimlerini içeren bir çalışma sayfası hazırlayın. PCR için kullanılacak steril tüpleri/şeritleri/plakaları örnek numaralarla etiketle. PCR'yi doğrulamak için DNA yerine H2O kullanarak negatif bir kontrol ve pozitif bir kontrol (örneğin, eğitmen tarafından sağlanan DNA'yı kullanarak) eklemeyi unutmayın.
- Her birinin 10 μL 5x PCR reaksiyon tamponu (15 mM MgCl2içeren), 1 μL deoksiribonükleotid trifosfat (dNTP' ler) (10 mM), 5 μL (10 pmol) içeren 1x PCR ana karışımını hazırlayın kasai ve ark'a göre astar pMCT118-f ve pMCT118-r (ileri - 5'-GAAACTGGCCTCCAAACACTGCCCGCCG-3', ters - 5'-GTCTTGTTAGATGCACGTCCTTC-3')2, 23,8 μL ultra saf H2O ve 0,2 μL Taq DNA polimeraz (5 U/μL).
NOT: pMCT118-f/pMCT118-r astarları, D1S80 VNTR bölgesinin yan bölgelerinde tüm lokusu güçlendiren şekilde tasarlanmıştır. - PCR tüplerini/şeritlerini/plakasını kullanılacak numune numaralarıyla etiketle.
- Aliquot 45 μL ana karışımı her etiketli PCR örnek tüp veya kuyu.
- Toplam 50 μL hacim elde etmek için her PCR tüpünde / plakasında ana karışıma 5 μL DNA şablonu ekleyin.
- DNA yerine ultra saf H2O kullanarak şablon denetimi (NTC) içermez.
- PCR tüplerini/şeritlerini veya sızdırmazlık plakalarını kapatın ve karıştırın.
- PCR tüplerini/şeritlerini/plakalarını masa üstü santrifüj kullanarak 20 sn sn santrifüj haline koyun.
NOT: Bu protokolde verilen PCR koşulları DNA polimeraz ve kullanılan PCR termal çevrimleyici kullanılarak optimize edilmiştir. Genel olarak PCR koşulları DNA polimerazine uyarlanmalıdır. Taq DNA polimeraz için standart uzatma süresi 1 dk/kb'tır. - Numune tüplerini / şeritlerini / plakasını termosiklere yerleştirin ve aşağıdaki koşulları kullanarak reaksiyonları kuluçkaya yatırın (DNA polimeraz uzatma süresi): 2 dakika boyunca 95 °C'lik 1 döngü; 15 s için 94 °C 25 döngü, 15 s için 60 °C, 30 sn için 72 °C; 10 dakika boyunca 72 °C'lik 1 döngü.
- Program tamamlandığında, ürünleri termosiklerden çıkarın ve elektroforeise kadar gece boyunca 4 °C veya -20 °C'de saklayın.
4. PCR ürünlerinin agarose jel elektroforezi
- % 1.5 agarose jel hazırlayın.
- 1,5 g agarose tozu kullanın ve bir şişede 100 mL 1x Tris-asetat-EDTA (TAE) tampon çözeltisi ile karıştırın.
- Karışımı mikrodalga fırında (600 W) yaklaşık 1,5-2 dakika ısıtın. İçeriği döndürün ve gerekirse agarose'un tamamen çözülmesi için tekrar ısıtın. Hafifçe soğutun ve agarose'a 2 μL PeqGreen ekleyin.
- Jeli tüm numuneler için yeterli kuyuya sahip bir tarak kullanarak bir forma dökün ve en az bir moleküler ağırlık işareti ekleyin.
DİkKAT: Kaynama geriliği oluşabilir. Henüz çözülmemiş agarose'u yeniden diriltirken matarayı dikkatlice çalkalayın.
NOT: PeqGreen, nükleik asitlerin tespiti için toksik olmayan bir boyadır. Çift iplikli DNA (dsDNA) ve tek iplikli DNA'nın (ssDNA) yanı sıra RNA'nın boyanmalarında da geçerlidir. Hassasiyet ethidium bromür ile karşılaştırılabilir.
- PCR ürünlerini 4 °C'den çıkarın ve yaklaşık 10 sn sn santrifüj çıkarın.
- Jelin kuyularını 10 μL numune ile yükleyin. Jeli aşırı yüklemeyin.
NOT: DNA polimeraz tamponu, numune yoğunluğunu artıran bileşikler de içerir, böylece numuneler yükleme boyasına gerek kalmadan doğrudan jellere yüklenebilir. Bu, örneğin kuyuya batmasını sağlar ve boyalar DNA örneğinin ne kadar uzağa göç ettiğini izlemeye yardımcı olur.- Yan kuyulara bir moleküler ağırlık standardı ekleyin (tercihen 50 bp moleküler ağırlık standardı).
NOT: Agarose jel elektroforezisinin tekrarlanması durumunda kalan PCR örneklerini -20 °C'de saklayın.
- Yan kuyulara bir moleküler ağırlık standardı ekleyin (tercihen 50 bp moleküler ağırlık standardı).
- Jeli 1x TAE'de yaklaşık 40 dakika boyunca 150 V (sabit) tamponda veya yaklaşık 50 bp'de hareket eden alt sarı boya cephesi jelin alt ucuna ulaşana kadar çalıştırın.
- Mavi ışık veya ultraviyole (UV) ışığı uygulanırken jeli görüntüleyin ve parça uzunluğu analizi için bir görüntü kaydedin.
DİkKAT: UV ışığı gözlerinize ve cildinize zarar verebilir. UV ışık kutusu kullanırken her zaman koruyucu giysiler ve UV güvenlik gözlükleri giyin. - Jeli kurumsal tehlikeli maddeler politikasına uygun olarak atın.
5. Parça uzunluğu sonuçlarının analizi
NOT: Parçaların uzunluklarını tahmin etmek için doğrusal regresyon analizini kullanın.
- D1S80 PCR parçalarını boyutlandırmak için, jel fotoğrafın üzerine 50 bp moleküler ağırlık standart şeridinin üzerine bir cetvel yerleştirin, böylece cetvelin üst kısmı numunenin yüklendiği kuyunun alt kısmıyla hizalar (Şekil 1).
NOT: Moleküler ağırlık standardı (50 bp moleküler ağırlık standardı) için doğrusal regresyon denklemini hesaplamak için bir elektronik tablo programı kullanılmıştır. - Bir elektronik tablo programı kullanarak bir tablodaki 50 bp moleküler ağırlık standardının her bandı için kuyudan uzaklığı (örneğin cm olarak) kaydedin (Şekil 2).
- 50 bp moleküler ağırlık standardının her parça boyutunun günlüğünü (örneğin, temel 10) belirleyin ve günlük değerlerini tabloya girin (Şekil 2).
- Her veri işaretini dikey eksendeki bant boyutlarının günlüğü (y ekseni) ve jelin üstünden yatay eksendeki (x ekseni) moleküler ağırlık standardının her bandına ölçülen çalışma mesafesi olan bir grafiğe bir dağılım pilotu kullanarak çizin (Şekil 3).
- Bir eğilim çizgisi (doğrusal regresyon çizgisi) takın ve grafikte regresyon denklemini (y = ax + b) ve R2 değerini gösterin (Şekil 4).
- Her D1S80 amplicon için geçirilen mesafeyi (örneğin cm olarak) ölçün (Şekil 5).
- Regresyon denklemini kullanarak her D1S80 ampliconunun boyutunu tahmin edin: y = ax + b
burada y = parça boyutunun günlüğü
a = çizginin eğimi (5. noktada hesaplanır)
x = kuyudan uzaklık (cm olarak)
b = regresyon çizgisinin y eksenini kestiği nokta (5. noktada hesaplanır)
NOT: y değeri parça boyutunun günlüğünü temsil edildiğinden, D1S80 amplicons'un bp'sinde parça boyutunu elde etmek için antilog(10 y)hesaplanmalıdır.
6. Test edilen bireylerin alellerindeki tekrar ünitelerinin sayısının tahmini
NOT: D1S80 tekrar ünitesinin uzunluğu 16 bp'dir. D1S80 için bilinen en küçük alele 14 tekrara sahiptir. Burada açıklanan amplicon şeması, son boyuta ekstra 145 bp ekleyen yan bölgelere sahip ampliconlar üretir.
- Her PCR parçasında kaç yinelenen birimin bulunduğunu tahmin etmek için Tablo 1'i kullanın. Doğrusal regresyon kullanılarak tahmin edilen boyut, belirli bir alelenin 8 bp'si içinde olmalıdır.
- Test edilen her bireyin genotipini alaşım yineleme boyutu numaralarının bir birleşimi olarak kaydedin.
Sonuçlar
Açıklanan protokol kullanılarak, SVAP örneklemesi ile hasat edilen bukal mukoza epitel hücrelerinden çıkarılan insan genomik DNA'sı üzerinde D1S80 VNTR işaretleyici analizi yapıldı (Şekil 6). PCR kullanılarak yapılan amplifikasyonun ardından, D1S80 ampliconlarını içeren bir agarose jelinin tipik bir gösterimi Şekil 1'de gösterilmiştir. Şerit 1, 50 bp moleküler ağırlık standardını gösterir. Moleküler ağırlık standardının yanında, sekiz öğrenci örneğinden PCR ürünleri görselleştirilir. Lane 10, şablon DNA'sı yerine suyun kullanıldığı NTC'yi gösterir. Analiz edilen örneklerin çoğu, D1S80 lokusu için heterozygous bireyleri temsil eden iki bandı açıkça gösterir. Lane 2 ve Lane 9, D1S80 lokusu için homozigous bireyleri temsil eden tek bir grup gösterir. Lane 5, diğer gruplara kıyasla çok daha geniş olan belirsiz bir tekli bant gösteriyor. Bu, yalnızca bir tekrar ünitesinde farklılık gösterir iki D1S80 alelinin bir sonucu olabilir. Daha fazla analiz için, şerit 5'teki örnek homozigöz bir bireyi temsil eden tek bir bant olarak kabul edilecektir.
Doğrulanmış PCR ürünlerinde yapılan aşağı akış jel elektroforez parça analizi, farklı öğrenci örneklerinin D1S80 VNTR lokusunun boyut çağırması için kullanılmıştır. PCR analizi ile elde edilen amplicon boyutlarının yorumlanması kullanılan moleküler ağırlık standardına dayanır. Moleküler ağırlık standardının her bandı için kuyudan uzaklık ölçüldü (Şekil 1) ve kaydedildi (Şekil 2). Boyuta ve geçiş mesafeye bağlı olarak, tek tek bantların boyutu doğrusal bir regresyon analizi kullanılarak hesaplanabilir. Günlük (temel 10) öğrenci örneklerindeki her bant için belirlenmiştir (Şekil 5) ve ilgili antilog her amplicon için bp sayısını temsil eder. Tekrar ünitelerinin sayısı elde edilen amplicon boyutuna göre hesaplanabilir (Tablo 2).
Her öğrenci örneği için amplicon boyutları doğrusal regresyon ile hesaplanmıştır ve her bant Tablo 2'degösterildiği gibi belirli bir alizeye kolayca atanabilir. D1S80 alel boyutları hakkındaki bilgiler daha sonra lisans öğrencilerinin küçük nüfus alt kümesi arasındaki alel frekanslarını belirlemek için kullanılabilir. 28-tekrar eden alele, bu tekrarlayan alele için iki homozigöz birey nedeniyle öğrenciler arasında en sık görülenidir (bireyler 1 ve 4). İkinci en sık alele, homozigöz birey 8 ve heterozipöz birey 6 tarafından taşınan 18 tekrarlayan aleledir. Düşük frekanslı aleller, sırasıyla 6, 5 ve 3 kişilik bireylerde yalnızca bir kez bulunan 21, 26 ve 30-tekrar alelleridir. Küçük öğrenci popülasyonunun D1S80 VNTR çekirgesinin alaşağı frekans desenleri, daha büyük insan popülasyonlarının, örneğin farklı kıtalardan kaynaklanan popülasyonların4, 7 ,8,9,10'unalaşağı sıklığı ile karşılaştırılabilir.
Öğrenciler arasında 2 ve 3 kişilik bireyler 24 tekrarlı aleleyi, 2 ve 7 kişilik bireyler 20 tekrarlı aleleyi ve 5 ve 7 bireyler 23 tekrarlı aleleyi paylaşır. İlginçtir ki, iki D1S80 homozigöz birey (bireysel 1 ve 4) 28 tekrarlı aleleyi paylaşır. İki kişi arasındaki alellerin eşleşmesi potansiyel bir akrabalığa işaret edebilir. Bununla birlikte, paylaşılan aleller de tesadüfen ortaya çıkabilir. Bu nedenle, iki kişi arasında bir alaşum eşleşmesi olasılığını belirlemek çok önemlidir. Olasılık, genel popülasyondaki bireysel alellerin alel sıklığına bağlıdır ve Bayes yaklaşımı gibi VNTR işaret analizine istatistiksel bir ağırlık eklemek için istatistiksel yaklaşımlar kullanılmalıdır. Özetle, sunulan parmak izi yöntemi, VNTR'lerin DNA parmak izi kullanımında ve biyolojik bilimde uygulanmasını öğretmek için uygulamalı sınıf pratiklerinde kullanılabilir.
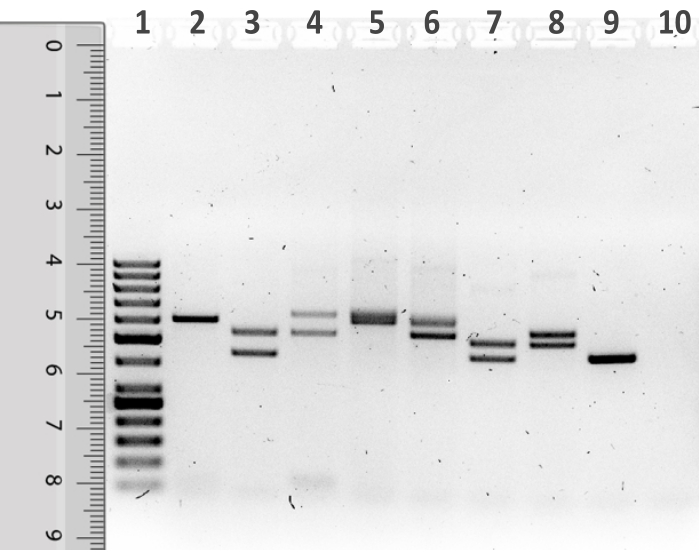
Şekil 1: D1S80 amplifikasyon ürünlerinin elektroforesi sonrası agarose jelin 50 bp moleküler ağırlık standart şeridinin yanına yerleştirilmiş bir cetvel ile temsili. Lane 1 50 bp moleküler ağırlık standardını içerirken, 2-9 şeritleri PCR reaksiyon ürünleri içerir. Şerit 10 şablon yok denetimini (NTC) içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
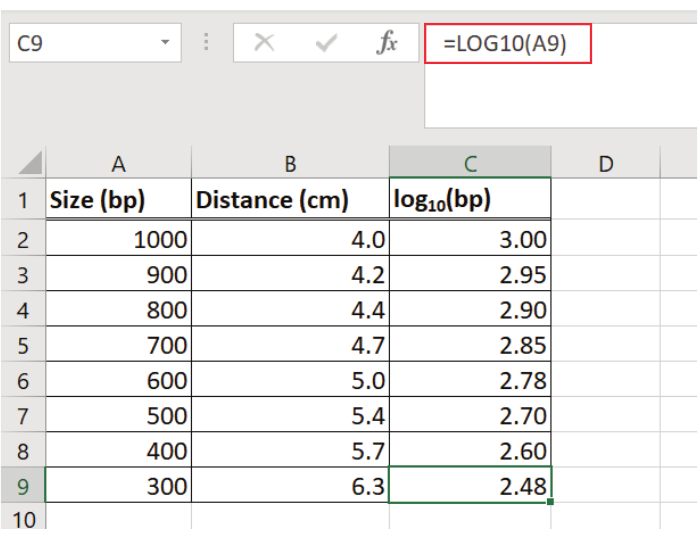
Şekil 2: DNA parça göç mesafesinin ve 50 bp moleküler ağırlık standardının her parça boyutunun günlüğünün belirlenmesi. 50 bp moleküler ağırlık standardının her bandı için kuyudan (cm olarak) uzaklık kaydedilir ve her parça için günlük (temel 10) belirlenir. Değerler bir elektronik tablo programı kullanılarak tabloya girilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: X eksenindeki moleküler ağırlık standardının DNA parçası geçiş mesafesinin y eksenindeki her parçanın boyutunun günlüğüne (temel 10) karşı çizilerek oluşturulan dağılım grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
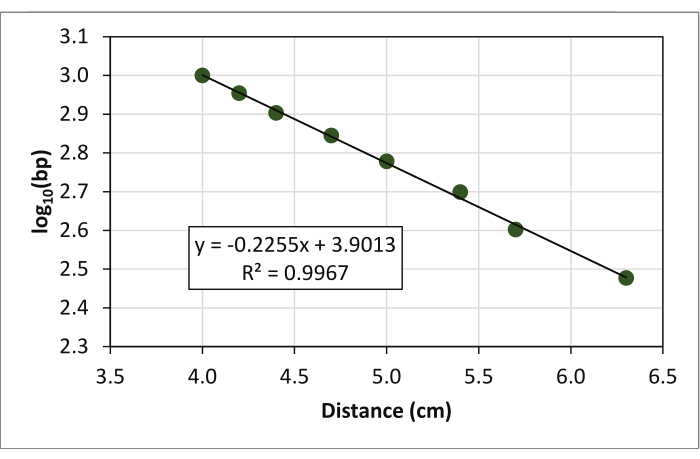
Şekil 4: Doğrusal regresyon çizgisinin ve regresyon denkleminin yanı sıra veriler için R2 değerinin kullanılması.
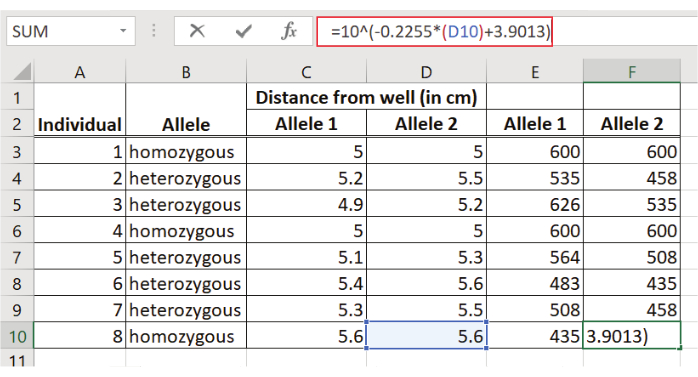
Şekil 5: D1S80 ampliconlarının boyutunun belirlenmesi. Her parça için kuyudan uzaklık regresyon denklemine girilir. y değerinin antilog'u bp'deki parça boyutunu temsil eder.
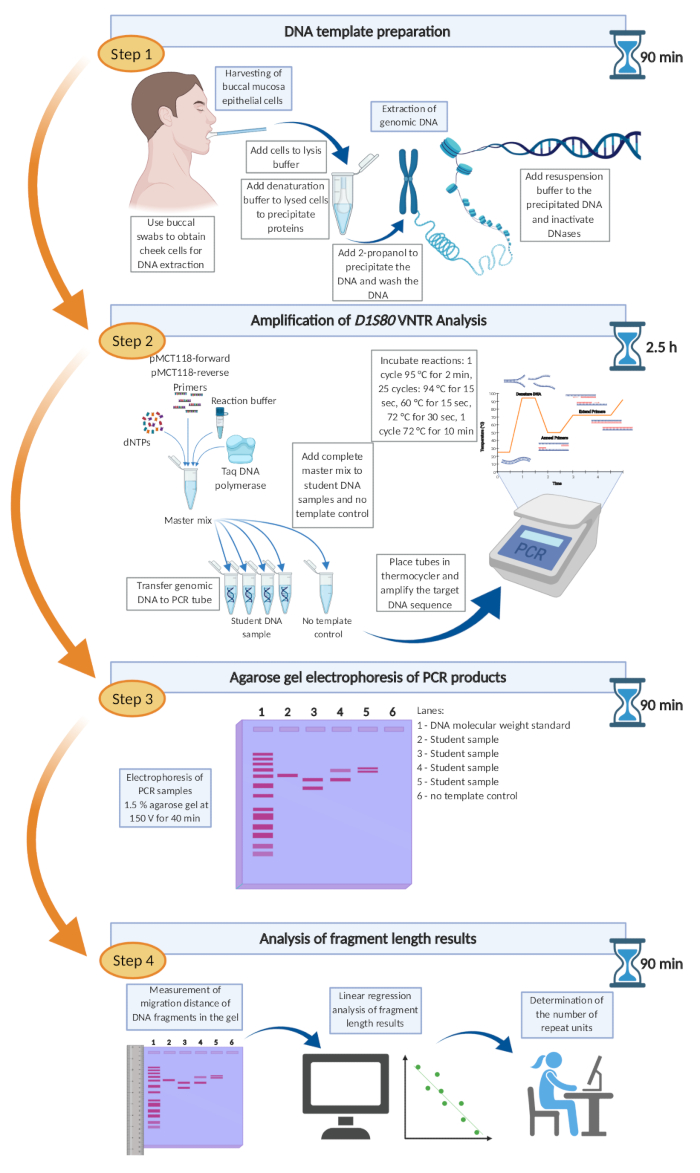
Şekil 6: D1S80 VNTR analizi için önerilen zaman çizelgesi ve iş akışı. Burada sunulan bukreal epitel hücre hasadından parça uzunluğu değerlendirmesine kadar tüm D1S80 VNTR analiz prosedürü tek bir iş günü içinde tamamlanabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Alaşim boyutu (bp olarak) | Yineleme sayısı |
| 369 | 14 |
| 385 | 15 |
| 401 | 16 |
| 417 | 17 |
| 433 | 18 |
| 449 | 19 |
| 465 | 20 |
| 481 | 21 |
| 497 | 22 |
| 513 | 23 |
| 529 | 24 |
| 545 | 25 |
| 561 | 26 |
| 577 | 27 |
| 593 | 28 |
| 609 | 29 |
| 625 | 30 |
| 641 | 31 |
| 657 | 32 |
| 673 | 33 |
| 689 | 34 |
| 705 | 35 |
| 721 | 36 |
| 737 | 37 |
| 753 | 38 |
| 769 | 39 |
| 785 | 40 |
| 801 | 41 |
Tablo 1: Her D1S80 VNTR lokus için amplicon boyutu.
| birey | Allel | Mesafe (cm olarak) | Boyut (bp olarak) | Yinelenen birim sayısı |
| 1 | homozigous | 5 | 600 | 28 |
| 2 | heterozygous | 5.2 ; 5.5 | 535, 458 | 24, 20 |
| 3 | heterozygous | 4.9 ; 5.2 | 626, 535 | 30, 24 |
| 4 | homozigous | 5 | 600 | 28 |
| 5 | heterozygous | 5.1 ; 5.3 | 564, 508 | 26, 23 |
| 6 | heterozygous | 5.4 ; 5.6 | 483, 435 | 21, 18 |
| 7 | heterozygous | 5.3 ; 5.5 | 508, 458 | 23, 20 |
| 8 | homozigous | 5.6 | 435 | 18 |
Tablo 2: Test edilen farklı bireylerin alaşim bileşimi. Doğrusal regresyon analizi ile elde edilen amplicon boyutuna göre tekrar ünitelerinin sayısı yaklaşık olarak sayılabilir.
Tartışmalar
Burada, lisans pratik sınıflarında moleküler parmak izi uygulaması için basit ve uygun maliyetli bir yöntem tanımladık.
D1S80 lokustaki genetik varyasyonu taramak için DNA ekstraksiyonu ve analizi ile birlikte insan biyolojik örnek toplanması gerekir. Tüm süreç boyunca insan biyolojik örneklerinin etik kullanımının sağlanması esastır. Numune yönetimi, numunelerin ve ilgili verilerin doğru kullanımını sağlayan kapsamlı bir düzenleyici çerçevede kontrol edilir18 (örneğin, insan biyolojik materyalinin kullanımına izin). Katılımcılar, örneklerinin kullanımı, genetik ilişkilerde anormalliklerin keşfedilme riski (örneğin, ilgili kişiler için), gizliliğin korunması ve biyolojik örneklerin ve verilerin gelecekteki depolanmasının niyetleri hakkında uygun şekilde bilgilendirilmelidir. Tüm bağışçılar (öğrenciler veya meslektaşları) özgürce onay vermeli ve sebep göstermeden cayma hakkını anlamalıdır. Genel olarak, bu laboratuvar sınıfını çalıştırmadan önce insan numune yönetimi için ilgili kılavuz ve yönetmeliklere aşina olmak vazgeçilmezdir.
Buccal mukoza epitel hücrelerinin lisans laboratuvarı derslerinde toplanması için, DNA örneklerinin operatörden veya DNases'ten alınan DNA ile kirlenmemesine özen edilmelidir. Laboratuvar önlükleri, eldivenler ve koruyucu gözlüklerin yanı sıra steril sürüntü ve mikrosantrifüj tüplerinin de kullanılması önerilir. Buccal swab bazlı hücre hasadı, nispeten ucuz ve invaziv olmadığı için PCR tabanlı VNTR analizine uygun genetik materyalin toplanması için uygun ve uygun maliyetli bir yöntem olarak kabul edilir. Bukkal sürüntülerin yanı sıra, tükürük tıbbi araştırmalar için en yaygın oral örnekleme yöntemidir. Buklasal sürüntü örneklerinin tükürükten daha yüksek oranda epitel hücresi içerdiği ve PCR tabanlı D1S80 VNTR analizi 19,20için yeterli miktarda ve kalitede DNA sağlamada daha güvenilir hale getirdiği gösterilmiştir. Ek olarak, buklam sürüntüler, örneğin nüfus çeşitliliği çalışmalarında kullanıldığında coğrafi engellerin üstesinden geldikten sonra kendi kendine toplamadan sonra postalanabilir21.
DNA ekstraksiyonu, farklı şirketlerden ekstraksiyon kitlerinin geliştirilmesi nedeniyle nispeten kolay hale gelmiştir. Bununla birlikte, bu kitlerin kullanımı sınırlı finansal kaynaklar nedeniyle laboratuvar sınıflarında uygun olmayabilir. Burada, piyasada bulunan bir DNA ekstraksiyon kitine ihtiyaç duymadan insan örneklerinden DNA çıkarılması için kolay, hızlı ve uygun maliyetli bir yöntem sunduk. Açıklanan DNA ekstraksiyon yöntemi organik çözücüler kullanmaz, bunun yerine hücresel proteinler 8 M potasyum asetat çözeltisi kullanılarak tuz konsantrasyonu artırılarak çıkarılır. Bu yöntem aynı anda birkaç numunenin işlenmesine izin verir ve her örnek için birkaç genotip analizi için yeterli DNA verir.
PCR birçok moleküler laboratuvarda yaygın bir tekniktir. Genellikle sorunsuz olsa da, başka bir yerde tartışılan sahte sonuçlar üreten reaksiyonları zorlaştırabilecek tuzaklar vardır22. Burada sunulan PCR koşulları, düşük şablon DNA kalitesi karşısında çok sağlam görünmektedir, ancak pcr amplifikasyon eksikliği, zayıf bukreal epitel hücre hasadı nedeniyle son derece düşük DNA konsantrasyonlarına sahip şablonlar kullanırken zaman zaman gözlenmiştir. Bu çalışmada kullanılan DNA astarları, bu makalenin sonundaki malzeme tablosunda belirtilenler gibi farklı şirketlerden sipariş edilebilir. Operatörden GELEN DNases veya DNA ile kontaminasyonu önlemek için DNA astarları ile çalışırken özel dikkat edilmelidir. PCR ürünleri de kullanılmadığında soğuk tutulmalıdır.
Bir diğer kritik adım agarose jel elektroforezidir. 16 bp'lik tek bir tekrar ünitesi ile farklılık gösteren parçalar jel elektroforezda ayrılamayabilir ve böylece tek bir bant olarak görünebilir. Bu durumda, test edilen D1S80 alellerinin tekrar ünitelerinin sayısının doğru bir şekilde belirlenmesi garanti edilemez. Bu nedenle, jelin çalışma süresi artırılmalı, voltaj azaltılmalıdır ve tek bantların daha iyi bir çözünürlüğünü ve ayrışmasını sağlamak için jel konsantrasyonu arttırılabilir.
Bir VNTR lokus için tüm alellerin tam tekrar üniteleri içermediğini belirtmek gerekir. Eksik tekrar üniteleri içeren konsensüs olmayan aleller (mikrovariantlar) çoğu VNTR loci'de yaygındır ve boyutları tam tekrar üniteleri ile alel boyutları arasında düşer. Bu mikrovariantlar agarose jel elektroforezi ile zar zor tespit edilebilir. Buna karşılık, poliakrilamid jeller veya kılcal elektroforez gibi teknikler, birkaç tekrar ünitesine veya mikrovariantlara12 , 23,24,25,26arasında farklılık gösteren alelleri çözebilir. Bununla birlikte, ikinci teknikler lisans laboratuvar sınıfları için daha az uygundur, çünkü tehlikeli bileşiklerin kullanımı, karmaşık hazırlık ve ekipman eksikliği gibi birçok dezavantajları vardır. Parça boyutu tespiti için, göç edilen DNA parçalarının mesafesini ölçerken özel dikkat gösterilmelidir. Bantlar tam olarak ölçülemeyecek kadar dağınıksa, D1S80 alaşım parçası boyutunun doğrusal regresyona göre hesaplanması yanlış olabilir ve bu da yinelenen birim numaralarının yanlış tahmin edilmesine neden olabilir. Bu durumda, jel koşullarını optimize ettikten sonra agarose jel elektroforezinin yeniden çalıştırılması, lorenz ve iş arkadaşları tarafından daha önce açıklandığı gibi tavsiye edilir22.
Burada sunulan bukreal epitel hücre hasadından parça uzunluğu değerlendirmesine kadar sunulan D1S80 VNTR analiz prosedürünün tamamı tek bir iş gününde tamamlanabilir. Bu protokol, lisans pratik laboratuvar sınıflarına uygun sağlam, uygun maliyetli ve kullanımı kolay bir yöntemdir.
Açıklamalar
Yazarların açıklayacak bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Kevin Graham'a seslendirmesi ve bu çalışma için örnek bağışlayan tüm katılımcılar için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Sarstedt | 72,706 | autoclaved |
| 2 mL microcentrifuge tube | Sarstedt | 7,26,95,500 | autoclaved |
| 2-propanol | Fisher chemical | PI7508/17 | |
| 5x PCR buffer | Promega | M7845 | |
| Acetic acid | Sigma/Merck | A6283-500ML | |
| Agarose | BioBudget | 10-35-1020 | |
| Buccal swabs | BioBudget | 57-BS-05-600 | |
| Centrifuge | Eppendorf | 5430 | |
| Combs | BioRad | ||
| dNTPs (10 mM) | Invitrogen | R0192 | |
| EDTA | Carl Roth | 8043.1 | |
| Ethanol | Honeywell | 32221-2.5L | |
| Gel caster | BioRad | ||
| Gel chamber | BioRad | SubCell GT | |
| Gel Doc XR+ | BioRad | ||
| Geltray | BioRad | SubCell GT | |
| GeneRuler 50 bp DNA Ladder | Thermo Fisher | SM0371 | |
| Go-Taq Polymerase | Promega | M7845 | |
| Heating block | Eppendorf | Thermomixer | 1.5 mL and 2 mL |
| Microwave | Sharp | R-941STW | |
| peqGreen | VWR | 732-3196 | |
| Pipettes | Gilson | 1000 µL, 200 µL, 20 µL, 2 µL | |
| Potassium acetate | Arcos Organics | 217100010 | |
| PowerPac power supply | BioRad | 100-120/220-240V | |
| Primers | Sigma/Merck | ||
| Scale | Kern | PCB 2.5 kg | |
| SDS | Arcos Organics | 218591000 | |
| Shaker | IKA labortechnik | IKA RH basic | |
| Tabletop centrifuge | myFuge | ||
| Thermal Cycler | BioRad | C100 Touch | |
| Tris | VWR | 103156x | |
| Vortex mixer | LMS | VTX-3000L |
Referanslar
- Jeffreys, A. J., Wilson, V., Thein, S. L. Hypervariable 'minisatellite' regions in human DNA. Nature. 314 (6006), 67-73 (1985).
- Kasai, K., Nakamura, Y., White, R. Amplification of a variable number of tandem repeats (VNTR) locus (pMCT118) by the polymerase chain reaction (PCR) and its application to forensic science. Journal of Forensic Science. 35 (5), 1196-1200 (1990).
- Balamurugan, K., Tracey, M. L., Heine, U., Maha, G. C., Duncan, G. T. Mutation at the human D1S80 minisatellite locus. The Scientific World Journal. 2012 (917235), (2012).
- Herrera, R. J., Adrien, L. R., Ruiz, L. M., Sanabria, N. Y., Duncan, G. D1S80 single-locus discrimination among African populations. Human Biology. 76 (1), 87-108 (2004).
- Lauritzen, S. L., Mazumder, A. Informativeness of genetic markers for forensic inference - An information theoretic approach. Forensic Science International: Genetics Supplement Series. 1 (1), 652-653 (2008).
- Budowle, B., Chakraborty, R., Giusti, A. M., Eisenberg, A. J., Allen, R. C. Analysis of the VNTR locus D1S80 by the PCR followed by high-resolution PAGE. American Journal of Human Genetics. 48 (1), 137 (1991).
- Budowle, B., et al. D1S80 population data in African Americans, Caucasians, southeastern Hispanics, southwestern Hispanics, and Orientals. Journal of Forensic Science. 40 (1), 38-44 (1995).
- Verbenko, D. A., et al. Polymorphisms at locus D1S80 and other hypervariable regions in the analysis of Eastern European ethnic group relationships. Annals of Human Biology. 33 (5-6), 570-584 (2006).
- Walsh, S. J., Eckhoff, C. Australian Aboriginal population genetics at the D1S80 VNTR locus. Annals of Human Biology. 34 (5), 557-565 (2007).
- Limborska, S. A., Khrunin, A. V., Flegontova, O. V., Tasitz, V. A., Verbenko, D. A. Specificity of genetic diversity in D1S80 revealed by SNP-VNTR haplotyping. Annals of Human Biology. 38 (5), 564-569 (2011).
- Sajib, A. A., Yeasmin, S., Akter, M., Uddin, M. A., Akhteruzzaman, S. Phylogenetic analysis of Bangladeshi population with reference to D1S80 VNTR locus. Bioresearch Communications. 2 (1), 146-151 (2016).
- Köseler, A., Atalay, A., Atalay, E. &. #. 2. 1. 4. ;. Allele frequency of VNTR locus D1S80 observed in Denizli province of Turkey. Biochemical genetics. 47 (7-8), 540-546 (2009).
- Mastana, S. S., Papiha, S. S. D1S80 distribution in world populations with new data from the UK and the Indian sub-continent. Annals of Human Biology. 28 (3), 308-318 (2001).
- Okuda, H., et al. A Japanese propositus with D-- phenotype characterized by the deletion of both the RHCE gene and D1S80 locus situated in chromosome 1p and the existence of a new CE-D-CE hybrid gene. Journal of Human Genetics. 45 (3), 142-153 (2000).
- Campbell, A. M., Williamson, J. H., Padula, D., Sundby, S. Use PCR & a Single Hair to Produce a "DNA Fingerprint.". The American Biology Teacher. 59 (3), 172-178 (1997).
- Jackson, D. D., Abbey, C. S., Nugent, D. DNA profiling of the D1S80 locus: A forensic analysis for the undergraduate biochemistry laboratory. Journal of Chemical Education. 83 (5), 774 (2006).
- Mansoor, S. K., Hussein, E. F., Ibraheem, A. K. Use the Variable Number of Tandem Repeats (VNTR) in DNA fingerprinting and its application biological sciences. EurAsian Journal of BioSciences. 14 (2), 2835-2839 (2020).
- Beier, K., Schnorrer, S., Hoppe, N., Lenk, C. The ethical and legal regulation of human tissue and biobank research in Europe. Proceedings of the Tiss. EU Project. , (2011).
- Aida, J., et al. Telomere length variations in 6 mucosal cell types of gastric tissue observed using a novel quantitative fluorescence in situ hybridization method. Human Pathology. 38 (8), 1192-1200 (2007).
- Theda, C., et al. Quantitation of the cellular content of saliva and buccal swab samples. Scientific Reports. 8 (1), 1-8 (2018).
- McMichael, G. L., et al. DNA from buccal swabs suitable for high-throughput SNP multiplex analysis. Journal of biomolecular techniques: JBT. 20 (5), 232 (2009).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Destro-Bisol, G., Capelli, C., Belledi, M. Inferring microevolutionary patterns from allele-size frequency distributions of minisatellite loci: a worldwide study of the APOB 3'hypervariable region polymorphism. Human Biology. 72 (5), 733-751 (2000).
- Chen, B., et al. Structure and function of alleles in the 3'end region of human apoB gene. Chinese Medical Journal. 112 (3), 221-223 (1999).
- Renges, H. -. H., Peacock, K., Dunning, A. M., Talmud, P., Humphries, S. E. Genetic relationship between the 3 '-VNTR and diallelic apolipoprotein B gene polymorphisms: Haplotype analysis in individuals of European and South Asian origin. Annals of Human Genetics. 56 (1), 11-33 (1992).
- Kravchenko, S. A., Maliarchuk, O. S., Livshits, L. A. A population genetics study of the allelic polymorphism in the hypervariable region of the apolipoprotein B gene in the population of different regions of Ukraine. Tsitologiia i Genetika. 30 (5), 35-41 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır