Method Article
Hedeflenen mikro kabarcıkların hazırlanması ve karakterizasyonu
Bu Makalede
Özet
Bu protokolün amacı, gazla doldurulmuş mikro kabarcıkları (ultrason moleküler görüntüleme için hedeflenen kontrast maddeleri) hazırlamak, saflaştırmak ve karakterize etmektir. İki hedefleme sistemi tanımlanmıştır: streptavidine yapışan biyotinile kabarcıklar ve bilinen bir tümör neovasküler sistem biyobelirteci olan αvβ3'e bağlanan döngüsel RGD peptit mikro kabarcıkları.
Özet
Mikro kabarcıkların (moleküler görüntüleme için ultrason kontrast maddeleri) hedeflenmesi yirmi yıldan fazla bir süredir araştırılmaktadır. Bununla birlikte, mikro kabarcık hazırlama ve hedefleme ligandı bağlanma yöntemleri hantal, karmaşık ve uzundur. Bu nedenle, klinik translasyona daha yakın hale getirmek için hedeflenen mikro kabarcık hazırlama prosedürünü basitleştirmeye ihtiyaç vardır. Bu yayının amacı, hedeflenen mikro kabarcık hazırlama, fonksiyonel karakterizasyon ve test için gerekli adımların ayrıntılı bir tanımını ve açıklamasını sağlamaktır. İki sistem için optimize edilmiş ve basitleştirilmiş prosedürlerin bir dizisi sunulmuştur: bir biyotin-streptavidin hedefleme çifti modeli ve tümör neovaskülatürünün endotel astarında aşırı eksprese edilen rekombinant αvβ3 proteinini hedefleyen bir siklik RGD peptidi.
Burada aşağıdakileri gösteriyoruz: hedefleme ligandının bir lipit ankrajına kovalent bağlanması, reaktif kalitesinin değerlendirilmesi ve reaksiyonun başarılı bir şekilde tamamlandığını doğrulayan testler; mikro kabarcık kabuğu bileşenleri içeren sulu öncü ortamın hazırlanması, ardından birleştirme yoluyla mikro kabarcık hazırlanması; mikrokabarcık stabilizatör kabuğuna lipid transferinin etkinliğinin değerlendirilmesi; in vivo kullanım için zararlı olabilecek daha büyük mikro kabarcıkları uzaklaştırmak için normal yerçekiminde yüzdürme yoluyla mikro kabarcık boyutu dağılımının ayarlanması; elektrozon algılama ile mikro kabarcık boyutu dağılımının değerlendirilmesi; Mikro kabarcıkların reseptör kaplı yüzeye hedeflenen bağlanmasının bir statik bağlanma tahlil testinde (ters çevrilmiş bir tabakta) değerlendirilmesi; ve paralel plaka akış odası testinde mikro kabarcıkların reseptör kaplı yüzeye hedeflenen bağlanmasının değerlendirilmesi.
Giriş
Hedeflenen mikro kabarcıklarla moleküler görüntüleme, yirmi yılı aşkın bir süredir araştırma ve test edilmektedir. Genel konsept basittir: hastalık alanındaki vasküler endotelyuma özgü moleküler biyobelirteçte seçici afiniteye sahip gaz dolu mikro kabarcıklar intravenöz olarak enjekte edilir. Bu parçacıklar hedefte dolaşır ve birikir (örneğin, tümör neovaskülatürü veya iskemik inflamatuar yaralanma alanı). Yapışık mikro kabarcıklar daha sonra kontrast ultrason görüntüleme ile tespit edilir. Geçen yüzyıldanitibaren 1,2 başlayan erken konsept araştırma çabaları şimdi yavaş yavaş klinik benimsemeye doğru ilerliyor: sadece birkaç yıl önce orta ölçekli klinik araştırma aşamasına ulaştılar 3,4. Bu makalenin amacı, yayınlanmış iki örneğe dayalı olarak, bu tür hedeflenen mikro kabarcıkların hazırlanması ve karakterizasyonu hakkında ayrıntılı açıklama sağlamaktır 1,5.
Bu hedeflenen mikro kabarcıkların formülasyonu için çok önemli bir bileşen olan peptit-PEG-fosfolipidin hazırlanması prosedürü, reaksiyonun başarılı bir şekilde tamamlanması için gerekli olan reaktif kalite kontrolünün tanımı ile desteklenir. Ne yazık ki, bazı aktif ester lipid reaktif tedarikçileri, varışta hidrolize olan ve bu nedenle amid bağı oluşumuna katılamayan malzeme sağlar. Mikro kabarcık hazırlığı sırasında lipit materyalinin ne kadarının sulu ortamdan mikro kabarcık kabuğuna aktarıldığı ve bu bilgiyi elde etme tekniği hakkında bilgi verilmektedir.
Nispeten dar bir partikül boyutu dağılımına sahip mikro kabarcıklar hazırlamak önemlidir: intravasküler in vivo test için enjekte edilebilir ortamda büyük mikro kabarcıkların birlikte bulunması, mikrovasküler sistemin tıkanmasına neden olabilir; Akciğer şantlarını atlayan spesifik olmayan mikro kabarcık birikimi, daha büyük boyutlardaki mikro kabarcıkların çıkarılmasıyla önlenen spesifik olmayan yanlış pozitif doku büyümesine6 neden olabilir. Bu nedenle, partikül boyutu seçimini elde etmek için basit bir prosedür sunulur ve bir partikül sayacı ile partikül konsantrasyonunu ve boyut dağılımını değerlendirmek için bir yöntemin tanımı ile desteklenir.
Mikro kabarcık hedefleme değerlendirmesi için ilk test protokolü, aşağıda sunulduğu gibi, streptavidin kaplı yüzey1'i hedefleyen biyotinile mikro kabarcıklar ile tamamen model bir sistemi tanımlar. İkinci protokol, tümör neovaskülatür5'in moleküler bir biyobelirteci olan αvβ3'e karşı spesifik afiniteye sahip siklik bir RGD peptidi ile süslenmiş, peptit hedefli mikro kabarcıkların basitleştirilmiş hazırlanmasını tanımlayan bir el yazmasına dayanmaktadır. Bu siklo [Arg-Gly-Asp-D-Phe-Lys], yani sunulan teknikle c (RGDfK) peptidi ile süslenmiş mikro kabarcıkların, tümör neovasküler sistemini hedeflediği ve bir murin tümör modelinde ultrason moleküler görüntüleme elde ettiği gösterilmiştir.
Protokol
1. Peptitin NHS-PEG-DSPE'ye kovalent bağlanması
- C(RGDfK) peptidini, korumasız ve birleştirme için uygun olan lizinin birincil ε-aminogrubu ile dimetil sülfoksit (DMSO, 10 mg / mL) içinde çözün. Poli (etilenglikol) -3400-distearoil fosfatidiletanolamin (NHS-PEG-DSPE, 200 mg / mL) N-hidroksisüksinamid esterinin bir metanol veya kloroform çözeltisi hazırlayın ve DMSO'da 1 mg peptide ekleyin. 3 μL N,N-diizopropil etilamin (DIPEA) ekleyin.
- Tüm birincil amino gruplarının reaksiyona girebilmesi için peptit-NHS-PEG-DSPE molar oranını en az 1: 1.2 oranında tutun. Temel ortam koşullarını sağlamak için bir DIPEA: peptit molar oranını en az 2: 1 koruyun.
DİKKAT: Kloroform, metanol ve DIPEA tehlikeli maddelerdir. Eldiven, laboratuvar önlüğü, gözlük ve çeker ocak gibi uygun koruma kullanın.
NOT: Birincil amino grubuna sahip başka herhangi bir peptit veya mimetik, korumasız N-terminali veya bağlanma bölgesinin dışında bulunan bir lizin ile c (RGDfK) yerine kullanılabilir. Reaksiyonun devam etmesi için, tüm bileşenlerin (yani hedefleme ligandı ve lipid) DMSO-kloroform karışımında çözünür olması gerekir. Dimetilformamid veya karışımları gibi alternatif çözücüler de test edilebilir. Sulu ortamda reaksiyon da mümkündür, ancak aktif esterin hızlı hidrolizi nedeniyle birleştirme verimi çok daha düşük olacaktır.
- Tüm birincil amino gruplarının reaksiyona girebilmesi için peptit-NHS-PEG-DSPE molar oranını en az 1: 1.2 oranında tutun. Temel ortam koşullarını sağlamak için bir DIPEA: peptit molar oranını en az 2: 1 koruyun.
- Oda sıcaklığında gece boyunca inkübasyonun ardından, uçucu organik materyali buharlaştırarak çıkarın (DMSO'yu çıkarmak için nitrojen gazı akışı veya döner bir buharlaştırıcı kullanın, ardından yüksek vakum pompası altında gece boyunca buharlaştırma). Kontrollü örnekleme için uçucu olmayan kalıntıyı kloroformda 1 mg/mL'de yeniden çözün.
- İnce tabaka kromatografisi ile reaksiyonun tamamlandığını onaylayın (kloroformda TLC plakaları geliştirin: metanol çözücü ortamında, 2: 1 v / v). Plakayı 150 ° C'lik bir ısıtma bloğunda ısıttıktan sonra ninhidrin spreyi ile birincil amino grubunun varlığını veya yokluğunu onaylayın.
DİKKAT: Ninhidrin tehlikeli bir maddedir. Yukarıda açıklandığı gibi uygun koruma kullanın. TLC plakalarının ısıtma bloğu işlemi bir davlumbazda yapılmalıdır. Isıtma bloğu potansiyel bir yangın tehlikesidir. - Mikro kabarcık hazırlığından önce, kloroformdan (örneğin, 1 mL 1 mg / mL çözelti) bir peptid-PEG-DSPE numunesi alın, kloroformu bir nitrojen gazı akışında kuruyana kadar buharlaştırın, müteakip yüksek vakum pompası inkübasyonu ile ve şeffaf misel çözeltisi elde etmek için 1 mg / mL'ye salin ekleyin.
- Reaksiyon karışımının daha fazla saflaştırılması arzu edilirse, normal tuzlu su içinde yeniden çözün. Daha sonra elde edilen misel karışımını, önce normal saline karşı ve daha sonra birkaç deiyonize su değişikliğine karşı diyalize (6-8 kDa moleküler ağırlık kesme veya benzeri) tabi tutun.
- Diyalizatın iletkenlik kontrolü ile diyalizin tamamlandığını onaylayın. Diyaliz malzemesini diyaliz torbasından çıkarın, kütlesi bilinen bir şişeye koyun ve tamamen kuruyana kadar liyofilize edin.
NOT: Ligandı PEG-lipid terminaline bağlamak için alternatif bir kovalent reaksiyon mevcuttur (ör., maleimid-PEG-DSPE'nin tiyol-ligand ile reaksiyonu). Bu yaklaşımın ana avantajı, ligand molekülü 7 üzerinde tek bir tiyol mevcutsa, yönlendirilmiş eşleşmedir. Ana endişe uzun vadeli stabilitedir: maleimid ve tiyol arasında ortaya çıkan bağlantı, depolama koşullarına bağlı olarak retro-Michael reaksiyonu ile bozunmaya eğilimli olabilir 8.
NOT: Aktif ester reaktiflerinin kalitesi üreticiler arasında büyük farklılıklar gösterir: transfer ve depolama koşullarına bağlı olabilir (malzeme uygun şekilde depolanmaz veya taşınmazsa, aktif ester hidrolize olur ve peptit ile birleşemez). Sonuç olarak, hedefleme ligandlarının mikro kabarcıklara kovalent bağlanması için bir reaktif olan NHS-PEG-DSPE'nin bozunma derecesinin belirlenmesi için bir prosedürü (aşağıya bakınız) tanımlama yükümlülüğü vardır. Argon altında kuru toz olarak tedarik edilen NHS-PEG-DSPE, derin dondurucuda saklanır. Bir şişe oda sıcaklığına getirilir (nem yoğunlaşmasını önlemek için), bir numune analitik terazi kullanılarak tartılır ve metanol veya DMSO içinde çözülür. Toplu kuru reaktifli bir şişe, argon altında kapatılmalı ve daha fazla kullanılana kadar kurutucu madde içeren kapalı bir kapta derin dondurucuya geri gönderilmelidir. - Sulu tuzlu suya basit bir kuru reaktif ilavesi ve inkübasyon yoluyla sulu bir misel peptid-PEG-DSPE çözeltisi (Adım 1.4) ve ayrıca biotin-PEG-DSPE hazırlayın. Küçük küresel miseller oluşur. Reaktifin toplu durumdan misel formuna transferini hızlandırmak için sonikasyon ve sıcak su banyosu uygulanabilir.
- NHS-PEG-DSPE aktif esterin reaktif kalitesini değerlendirin.
- Amid bağı oluşumu ile birleştirme reaksiyonunu gerçekleştirebilmek için reaktifte bulunan NHS'nin aktif ester formunda olduğunu onaylayın.
- 0.99 mL 0.1 M sodyum tetraborat tamponu, pH 9.2'yi bir spektrofotometrede kuvars veya ultraviyole şeffaf plastik küvete (cam değil) ve 260 nm dalga boyunda sıfıra yerleştirin.
- Küvete metanol içinde taze hazırlanmış 200 mg / mL NHS-PEG-DSPE çözeltisinden 10 μL ekleyin. Aynı zamanda kronometreyi başlatın. Tekdüzelik elde etmek için küvet içeriğini hızlı ve kuvvetli bir şekilde karıştırın. Küveti fotometreye yerleştirin, kapağı kapatın ve ölçüme başlayın.
- Spektrofotometre ölçümünün başlangıcında, kaydın başlama zamanını işaretleyin ve ~ 10 dakika boyunca veya absorbans değerinin stabilizasyonuna kadar her 10 saniyede bir 260 nm'de sürekli olarak fotometrik absorbans ölçümleri gerçekleştirin.
- Kinetik eğriyi çizin, ilk A260 zaman noktalarını kontrol edin ve eğriyi reaksiyon başlangıç zamanına göre tahmin edin (yani, reaktifin sulu tampona eklendiği ve hidroliz reaksiyonunun başladığı noktada A260'ı bulun). Küvetteki tampona NHS-PEG-DSPE eklenmeden önce, su eksikliği nedeniyle organik çözücüde herhangi bir hidroliz gerçekleşmediğini varsayalım.
- Reaksiyonun başlangıcında ve hidrolizin tamamlanmasında A260 arasındaki oranı hesaplayın; Bozulmuş aktif esterin fraksiyonunu temsil eder. Peptitin birincil amino grubunun tam modifikasyonu için uygun NHS-PEG-DSPE miktarını seçmek için bu bilgiyi kullanın.
2. Birleştirme yoluyla mikro kabarcıkların hazırlanması
- Biyotinile mikro kabarcıkların hazırlanması
- Propilen glikol içinde distearoil fosfatidilkolin (DSPC) ve PEG stearat birlikte çözülür (PG, saf çözücüde her biri için 10 mg / mL konsantrasyon). Malzemeleri çözündürmek için bir sıcak su banyosu kullanın.
- Bu sıcak PG çözeltisinin 0.1 mL'sini 0.85 mL sıcak normal salin içeren bir şişeye ekleyin, hızla karıştırın ve DSPC'ye 1: 20 kütle oranında misel biotin-PEG-DSPE (50 μL, salin içinde 1 mg / mL) ekleyin.
NOT: PG'deki lipid bileşenlerinin çözünürlüğü sıcaklığa bağlıdır, bu nedenle sıcak su banyosu gereklidir. Görünür parçacıklar olmadan homojen bir ortam oluşturmak için tuzlu su içeren cam şişeyi lipid ilavesinden önce bir sıcak su banyosunda ısıtmak faydalıdır. - Şişeyi oda sıcaklığına getirin, şişenin üzerine yarıya kadar yerleştirilmiş bir lastik tıpa yerleştirin ve PTFE kılcal boruyu şişeye yerleştirin. Şişeyi doldurmak için dekaflorobütan gazı akışını kullanın ve ardından kılcal damarı çıkarırken durdurucuyu kapatın.
NOT: Birleştirme sırasında şişenin sıcaklığı, elde edilen mikro kabarcıkların 9 boyut dağılımı üzerinde önemli bir etkiye sahip olabilir. - Durdurucu şişeyi oda sıcaklığında kıvırın ve bir birleştirme aparatına yerleştirin. Birleştiriciyi başlatın. Kullanılan klinik ünite, 45 saniye boyunca 4300 rpm'de çalışacak şekilde önceden ayarlanmıştır.
- Birleştirme tamamlandığında, elde edilen mikro kabarcıklarla şişeyi amalgatörden çıkarın. Tercihen, mikro kabarcık boyutu dağılımını ve bileşimini karakterize edin ve bunları hazırlandıktan sonraki birkaç saat içinde kullanın.
- Peptit ile süslenmiş mikro kabarcıkların hazırlanması
- DSPC ve PEG stearatı saf PG'de (her malzeme için 10 mg / mL konsantrasyon) birlikte çözün. Çözündürmek için sıcak su banyosu kullanın. PG'deki bu sıcak çözeltinin 0.1 mL'sini 0.85 mL sıcak normal salin içeren bir şişeye ekleyin, hızla karıştırın ve 1: 20 kütle oranında eklenen misel peptid-PEG-DSPE (50 μL, salin içinde 1 mg / mL) ekleyin.
- Şişeyi oda sıcaklığına getirin, şişenin üzerine yarıya kadar yerleştirilmiş bir lastik tıpa yerleştirin ve şişeye politetrafloroetilen (PTFE) kılcal boru yerleştirin. Şişeyi doldurmak için dekaflorobütan gazı akışını kullanın ve ardından kılcal damarı çıkarırken durdurucuyu kapatın.
- Tıpalı şişeyi kıvırın ve karıştırmak için bir birleştiriciye yerleştirin. Mikro kabarcık dispersiyonlu flakon 45 saniyede hazırdır.
- Mikro kabarcık kabuğuna lipit transferinin değerlendirilmesi için boya lipid mikro kabarcıklarının hazırlanması
- DSPC ve PEG stearatı, yukarıda tarif edildiği gibi saf PG içinde birlikte çözün (sıcak su banyosu kullanın) (her malzeme için 10 mg / mL konsantrasyon).
- Bu sıcak PG çözeltisinin 0.1 mL'sini 0.89 mL sıcak normal salin içeren bir şişeye ekleyin, hızla karıştırın, 10 μL DiI boya çözeltisi (saf PG'de 1 mg / mL) ekleyin ve karıştırın. Şişeyi oda sıcaklığına getirin.
- Flakon üst boşluğunu yukarıdaki gibi dekaflorobütan gazı ile doldurun, flakonu durdurun, yukarıda tarif edildiği gibi kıvırın ve birleştirin.
3. Misel sulu ortamdan kabarcık kabuğuna DiI lipid transferini test edin
- Floresan lipid materyalinin sulu ortamdan mikro kabarcık kabuğuna geçtiğine dair mikroskopi doğrulaması için, bir insülin şırıngası ile flakondan septum boyunca bir dizi mikro kabarcık örneği alın.
- Ardından bir cam slayta bir damla ekleyin ve standart bir lamel ile örtün. İlk önce bir damla gazı alınmış tuzlu su ile seyreltin.
- Floresan epi-aydınlatma, 100x yağ objektifi ve yüksek hassasiyetli video kamera ile donatılmış bir video mikroskobu ile mikroskopi yapın.
- Birleştirme sırasında lipid materyalinin sulu tuzlu su / PG ortamından kabarcık kabuğuna transferinin etkinliğini belirlemek için, kapalı bir mikro kabarcık şişesi alın, ters çevirin ve konik 50 mL'lik bir tüpe yerleştirin.
- Bir kova rotorunda santrifüjleme yapın (10 dk, 200 x g). Şişeyi santrifüjden çıkarın ve ters çevrilmiş halde tutun.
- Ters çevrilmiş şişenin septumuna bir insülin şırınga iğnesi yerleştirin. Küçük bir hacimde (~ 50 μL) berrak infranatantı yavaşça aspire edin.
NOT: Santrifüjlemeden sonra ters çevrilmiş flakondan infranatant aspirasyon için iğnenin konik ucu, mikro kabarcık alımı olasılığını en aza indirmek için septuma mümkün olduğunca yakın yerleştirilmelidir.
- İnfranatant (2 μL) numunelerinin yanı sıra mikro kabarcıklar (2 μL) oluşturmak için kullanılan orijinal lipid-PG-salin ortamının numunelerini 0.1 mL fosfat tamponlu salin (PBS) içeren 96 oyuklu bir plakaya yerleştirin: etanol 1: 1 ortam% 1 Triton X-100 ile.
- Bir floresan mikroplaka okuyucu ile DiI boyasının kırmızı floresansını (555 nm uyarma, 620 nm emisyon) ölçün.
- Daha düşük arka plan ve şeffaf plakalar için bir sorun haline gelebilecek kuyular arası sinyal aktarımının olmaması nedeniyle floresan spektroskopisi için şeffaf olmayan tabanlı siyah plakalar kullanın.
- Floresan sinyalinin doğrusal kalibrasyon aralığı içinde olduğundan emin olun: kuyucuklardaki aşırı boya konsantrasyonu ışık zayıflamasına ve sinyalin yetersiz bildirilmesine neden olabilir.
NOT: Bazen, birleşmeyi takiben sulu ortamda kalan artık kabuk malzemesinin çıkarılması istenebilir. Bunu yapmak için, mikro kabarcık yüzdürme santrifüjünden sonra, ters çevrilmiş şişeden yavaş aspirasyon ile tüm infranatant hacmini alın ve gazı alınmış normal salin ile değiştirin. Sıvının çıkarılması veya eklenmesi nedeniyle şişedeki ortam basıncının aşırı değişimini önlemek için, şişenin içindeki gaz fazına ulaşmak için septuma ek bir uzun iğne yerleştirin. Gaz fazını şişenin içinde tutmak için, önce mikro kabarcık preparatı ile hava temasını önlemek için iğneyi florokarbon gazı ile doldurulmuş bir şırıngaya bağlayın.
4. Mikro kabarcık boyutu dağılım ayarı
- Mikro kabarcıkların boyut dağılımını ayarlamak, yani en büyük mikro kabarcıkları hızlı ve verimli bir şekilde çıkarmak için statik ters çevrilmiş bir şişede normal yerçekimi yüzdürme kullanın 5,10.
- Bölüm 2'de açıklandığı gibi hazırlamanın hemen ardından bir şişe mikro kabarcık alın. Ters çevirin ve 15-20 dakika boyunca sabit, titreşimsiz bir yüzeye baş aşağı yerleştirin.
- Bu inkübasyonu takiben, şişenin septumuna hala ters çevrilmiş durumdayken bir insülin şırınga iğnesi yerleştirin ve alt tabakadan yavaşça 300-500 μL mikro kabarcıklar toplayın.
NOT: Şırınganın iğnesi, şişedeki sıvının üst kısmına daha yakın bulunan daha büyük kabarcıkların toplanmasını önlemek için septum iç yüzeyine yakın kalmalıdır.- Şırınga gövdesindeki kabarcıkların türbülansını ve hidrostatik genleşmesini önlemek için şırınga pistonunu yavaşça geri çekin. Toplanan numune şırıngadan çıkarıldığında, kabarcık çökmesini önlemek için aşırı basınçtan kaçının.
- Mikro kabarcık dispersiyonunu şırıngadan küçük hacimli bir şişeye aktarın. Daha sonra kısa süreli depolama, partikül sayımı (aşağıya bakınız) ve daha fazla kullanım için perflorlu gaz, tıpa ve kıvırma ile doldurun.
- Numune alma doğrudan şırıngadan yapılıyorsa, kabarcık yüzdürülmesini önlemek ve numune homojenliği elde etmek için yatay olarak tutun ve döndürün.
5. Mikro kabarcık boyutu dağılımı değerlendirmesi
- Partikül boyutunu, dağılımını ve konsantrasyonunu değerlendirmek için bir partikül sayacı (elektrozon algılama veya ışık karartma prensibine dayalı) kullanın. Alternatif olarak, bir hemositometre ve mikroskop kullanın.
- Kısaca, bir karşı haznede (tipik olarak 60-100 mL hacim) normal salin veya izoton içine bir mikro kabarcık numunesi alikotu ekleyin ve sayın. Yüzdürme saflaştırmasından önce ve sonra mikro kabarcık boyutu dağılımlarını karşılaştırın.
NOT: Temsili ve tekrarlanabilir ölçümler elde etmek için şişeyi numune almadan hemen önce nazikçe karıştırmaya (vorteksleme değil) tabi tutun. Test edilen hacmin merkezinden örnek. - 100 mL'lik bir kabı en az 60 mL% 0.9 tuzlu su çözeltisi seyreltici ile doldurun ve elektrozon gönderme aletinin aşamasına yerleştirin. Tüpün, dış elektrot plakasının ve karıştırıcının tümü seyrelticiye tamamen daldırılacak ve karıştırıcı dönebilecek şekilde sahneyi kaldırın.
NOT: Beherdeki seyreltici hacmi, kütlesi kullanılarak bir ölçekle (tuzlu su yoğunluğu 1'e yakındır) hassas bir şekilde belirlenebilir. Alternatif olarak, bir ölçüm pompası kullanılabilir. Elektrozon algılama çalışması sırasında elektrotlar tamamen daldırılmalıdır. - Seyreltici elektrolit hacmini ünite kontrol yazılımına kaydedin. Elektrozon algılama sayacı, çapı 1 ila 30 μm arasındaki partiküllerin ölçülmesine izin veren 50 μm delik ile donatılmıştır. Önce bir arka plan çalıştırması gerçekleştirin; boş olarak 0,5 mL seyrelticide 5000'den az sayıma sahip olması beklenmektedir. En iyi arka plan seviyeleri 100 sayımın altında olabilir.
- Seyreltme faktörünü hesaba katmak için ünite kontrol yazılımında numune hacmini ayarlayın. Behere 10-20 μL mikro kabarcık karışımı ekleyin ve ikinci işlemi gerçekleştirin.
- Yazılım içindeki "arka plan çalıştırmasını çıkar" işlevinin kullanılmasıyla hesaba katmak için arka plan boyutu dağıtım verilerini kullanın. Orijinal mikro kabarcık numunesindeki partiküllerin konsantrasyonunu partikül sayısı/mL olarak elde edin; Seyreltme faktörünü içerir.
- Pipet ucunun dış yüzeyi de örnekleme sırasında kabarcıklarla kaplanabilir; Ucu sayma ortamına yerleştirmeden önce sildiğinizden emin olun. Pipet ucu ağzına mendille dokunmayın.
- Sensör deliğinde aynı anda birden fazla partikülün bulunduğu tesadüf düzeltmesi ile ilgili sorunları en aza indirmek için sayım sırasında numune partiküllerinin yetersiz seyreltilmesinden kaçının: sistem bu durumda partikül konsantrasyonunu hafife alabilir.
NOT: Partikül sayımı için delik çapı değişebilir. 50 μm'lik deliğin seçilmesi, çapı 1 μm'ye kadar olan mikro kabarcıkların algılanmasına izin verir, ancak daha küçük çap seçenekleri kadar tıkanmaya eğilimli değildir. - Elektrozon algılama sayacını, gerçek testlerde kullanılanla aynı seyreltici test ortamı (örneğin, steril filtrelenmiş normal tuzlu sulama çözeltisi) için kalibre edin. Elektrozon algılamaya alternatif bir lazer karartma, kontrollü tuz konsantrasyonu ve elektriksel iletkenliğe sahip filtrelenmiş tuzlu suya ihtiyaç duymama avantajına sahiptir.
- Kısaca, bir karşı haznede (tipik olarak 60-100 mL hacim) normal salin veya izoton içine bir mikro kabarcık numunesi alikotu ekleyin ve sayın. Yüzdürme saflaştırmasından önce ve sonra mikro kabarcık boyutu dağılımlarını karşılaştırın.
6. Mikro kabarcık hedeflemeyi in vitro olarak bir yapışma / tutma testinde test edin
- Biyobelirteç reseptör yüzeyini, Petri kaplarına mikro kabarcık hedeflemesi için hazırlayın.
- Hedef yüzey olarak kullanılacak polistiren 35 mm çapındaki tabakları alın. Proteinlerin normal tuzlu sudan polistiren çanak yüzeyine spesifik olmayan yapışmasından yararlanın. Kabuğun bir parçası olarak biotin-PEG-DSPE içeren biyotinile baloncukların hedeflenmesini test etmek için bir model protein olan streptavidin kullanın.
- Her bir Petri kabının ortasına bir damla streptavidin çözeltisi (PBS'de 0,2 mL, 10 μg/mL) yerleştirin ve tabak yüzeyinin eşit şekilde kaplanmasını sağlamak için 22 mm x 22 mm'lik plastik bir lamel ile örtün. Bulaşığın kurumasını önlemek için kapalı nemli bir ortamda 4 °C'de gece boyunca inkübe ettikten sonra, lamelleri çıkarın.
- Plakaları derhal ve yorucu bir şekilde su, PBS ile yıkayın ve mikro kabarcıkların kaplanmamış yüzeye spesifik olmayan yapışmasını en aza indirmek için PBS'de% 1.5 sığır serum albümini (BSA) ile en az 4 saat inkübe ederek bloke edin. Kontrol olarak %1,5 BSA ile bloke edilmiş temiz kültür kaplarını kullanın.
- Alternatif olarak, rekombinant αVβ3 reseptör çözeltisi kullanın (ör., PBS'de 4 μg / mL'de)5 streptavidin yerine. Mikro kabarcık kabuğuna bağlı döngüsel RGD peptit ligandı yoluyla bu biyobelirteçte mikro kabarcıkları hedefleyin.
- Biriken hedef reseptörlü tabağı ıslak tutun: kurursa reseptör proteini inaktive olabilir.
NOT: Ortamda herhangi bir taşıyıcı protein veya yüzey aktif madde içermeyen taşıyıcısız reseptör proteinlerinin kullanılması önemlidir - bunların varlığı yapışmayı etkisiz hale getirecektir.
- Mikro kabarcıkların küçük bir damlacık içinde yapışması: statik koşullarda hedeflenen yapışmayı hızlı bir şekilde kontrol edin.
- Alttan bir damla mikro kabarcık (5-20 μL) baş aşağı ters çevrilmiş bir Petri kabında hedef (veya yalnızca BSA'yı kontrol edin) yüzeyine bırakın. Bu, kabarcıkları yüzdürme yoluyla reseptör kaplı yüzeye getirecektir.
- Ters çevrilmiş tabağın nemli bir ortamda 5-10 dakika inkübe edilmesinden sonra, tabağı normal bir konuma geri çevirin, PBS ile doldurun ve serbest mikro kabarcıkları çıkarmak için hafifçe durulayın. Hedeflenen yapışmayı değerlendirmek için parlak alan mikroskobu yapın.
- Mikro kabarcıkların Petri kabı yüzeyine yapışması: dolu bir tabakta hedefleme yapın1.
- Reseptör yüzey kaplaması olan çanağı alın ve tamamen gazı alınmış PBS-BSA tamponu (35 mm'lik tabak için 10 mL'den fazla) ile doldurun, böylece tampon menisküsü tabağın üstüne uzanır ve kılcal kuvvetle tutulur. Kabarcıkları (50 μL) tamponun büyük kısmına enjekte edin ve homojenlik elde etmek için hızla karıştırın. Karıştırma sırasında hava kabarcıkları oluşmasını önleyin.
- Tabağın üzerine hızlı bir şekilde düz bir plastik parçasıyla desteklenen bir parça şeffaf ambalaj bandı veya bir kültür plakası kapatma bandı yerleştirin. Filmi tabağa basınçla kapatın, "düzeneği" ters çevirin ve mikro kabarcıkların yukarı doğru yüzmesini, hedef yüzeye dokunmasını ve yapışmasını sağlamak için 30 dakika boyunca baş aşağı yerleştirin.
- Mühürlü kabı "düzeneği" tekrar "baş aşağı" konfigürasyonuna ters çevirin, contayı çıkarın ve gazı alınmış tampon solüsyonu ile durulayarak yapışmayan mikro kabarcıkları yıkayın. Mikroskopi veya ultrason görüntüleme ile hedeflenen mikro kabarcıkları gözlemleyin.
NOT: Mikro kabarcık dispersiyonu ile tamamen doldurulmuş ters çevrilmiş kapalı kap inkübe edildiğinde, hafif bir açıyla yerleştirilebilir, böylece herhangi bir büyük kabarcık varsa, ilgilenilen merkez bölgenin dışında, yemeğin kenarına doğru yüzerler. Mikroskopi sırasında bir mikropipet ucundan gelen hızlı akışla zorla durulama, kabarcıkların hedefe ne kadar sıkı bir şekilde yapıştığını değerlendirmek için kullanılabilir (kabarcıklar, yavaş akışta bile kontrol yüzeyinden tamamen ayrılır) 11. Kabarcık seyreltmesi için gazı alınmış tampon tercih edilir, çünkü fazla çözünmüş hava mikro kabarcıkların kontrolsüz büyümesine yol açacaktır.
7. Mikro kabarcık hedeflemeyi in vitro olarak test edin: paralel bir plaka akış odasında dinamik yapışma / tutma testlerini değerlendirin
NOT: Ultrason görüntüleme ile biyotinile baloncukların streptavidin tabakasına yapışmasını test ediyoruz.
- Akan ortamdan 35 mm'lik bir Petri kabına hedeflenen yapışmayı gözlemlemek için özel yapım bir invertör tutucuya sahip, piyasada bulunan bir paralel plakalı akış odası kullanın. Hedef proteinin tabağa adsorpsiyonundan sonra (bkz. 6.1.1), önceden takılmış contalı hazne gövdesini tabağa yerleştirin ve tutucuya kapatın. Kanal yüksekliği (yani conta kalınlığı) 0,127 mm ve kanal genişliği 2,5 mm olan contalar kullanın.
NOT: Paralel plakalı akış odasının montajı sırasında, conta üzerinde kullanılan silikon gres miktarı minimum olmalıdır. Gresin kanal alanına girmesine izin vermeyin: biyobelirteç protein kaplı yüzeyi gres ile kaplamaktan kaçının. Düzgün bir sızdırmazlık elde etmek için 35 mm'lik tabakları dikkatli bir şekilde seçin (hazne ve tabak bilgileri için Malzeme Tablosuna bakın). - Akış odası tertibatı için, sızıntıyı önlemek için çanak-akış odası kombinasyonunu tutan kapağı ve çerçeveyi çok sıkı vidalamayın.
- Akış hortumunu, çekme modunda çalıştırılan bir şırınga pompasına bağlayın ve besleyici tarafında, manyetik bir karıştırıcı12 aracılığıyla bir karıştırma çubuğu ile sürekli karıştırmaya tabi tutulmuş, seyreltik bir mikro kabarcık dispersiyonu ile şişeye ince bir polietilen boru (PE50) bağlayın. Pompa hacimsel akış hızını 6Q/bh2 formülüne göre ayarlayarak odanın duvar kesme hızı (WSR) parametresini kontrol edin, burada Q akış hızı, 'b' kanalın genişliği ve 'h' kanalın yüksekliğidir.
NOT: Kanaldan geçen herhangi bir hava kabarcığı, yapışan mikro kabarcıkları hedef yüzeyden çıkaracağından ve deneyi geçersiz kılacağından, mikro kabarcık içeren ortamın veya PBS'nin perfüzyonundan önce hava kabarcıklarını tüm sistemden çıkarın. Akış odası borusu ile şırınga arasındaki bağlantı uygun şekilde kapatılmalıdır. - % 0.1 BSA ile PBS tamponunda 106 mikro kabarcık / mL konsantrasyon elde etmek için mikro kabarcık rezervuarına (20 mL parıldama şişesi) hesaplanmış bir konsantrasyon hacmi ekleyerek bir mikro kabarcık dispersiyonu hazırlayın. Besleyici haznesini manyetik plakalı bir karıştırıcı üzerine yerleştirin. 1 cm x 2 cm'lik bir manyetik karıştırma çubuğu yerleştirin ve çalışma süresince homojenliği korumak için ~ 400 RPM'de karıştırın.
- Bir su tankındaki13 akış odasının ultrason görüntülemesini gerçekleştirin.
- Akış odası tertibatını gazı alınmış suya batırın ve deneyler sırasında hareketi önlemek için bir ağırlıkla yerinde tutun.
- Görüntüleme probunu kenetlenmiş olarak doğrudan kanalın üzerine yerleştirin ve çanak yüzeyinden aynasal yansımayı en aza indirmek için geriye doğru 15° açıyla ve saat yönünde 5° açıyla eğin. Akış odası kanalını görüntüleme düzlemi içinde konumlandırın.
- Aşağıdaki görüntüleme koşullarını kullanın: 15L8 dönüştürücü, kontrasta özgü görüntüleme modu, dinamik aralık 50 dB, 7 MHz, Mekanik İndeks (MI) = 0,18, CPS Kazancı = 0. Zaman kazancı telafisini tüm görüntü boyunca aynı tutun.
- Dönüştürücü yüzünü, derine daldırılmayacak şekilde değil, su yüzeyine temas edecek şekilde yerleştirin. Alternatif olarak, ultrason jeli ile doldurulmuş kauçuk bir koruyucu kılıf kullanın.
NOT: Görüntüleme için akış odası sisteminin tekrarlanabilir şekilde konumlandırılmasını garanti etmek için, işaretleyiciler su havuzuna veya ultrason sistemi ekranına yerleştirilmelidir.
- Mikro kabarcık dağılımını rezervuardan hazneden ve 2 dakika boyunca pompaya çekin.
- Kanaldan yapışmayan kabarcıkları çıkarmak ve kalan yapışkan (hedeflenen) kabarcıkların akustik geri saçılımını değerlendirmek için akışı PBS'ye geçirin. Bir arka plan görüntüsü elde etmek için, ultrason görüntüleme görüş alanındaki yapışkan kabarcıkları yok etmek için MI'yı 1.9'a yükseltin.
NOT: Tekrarlanan çalıştırmalar için mikro kabarcık dağılımı değiştirilmelidir: yüksek seyreltmede, mikro kabarcıklar zamanla yavaş yavaş bozulur.
- Kanaldan yapışmayan kabarcıkları çıkarmak ve kalan yapışkan (hedeflenen) kabarcıkların akustik geri saçılımını değerlendirmek için akışı PBS'ye geçirin. Bir arka plan görüntüsü elde etmek için, ultrason görüntüleme görüş alanındaki yapışkan kabarcıkları yok etmek için MI'yı 1.9'a yükseltin.
- Ekran kaydı video akışından tek tek görüntüleri dışa aktarın: PBS yıkamadan önce, yıkamadan sonra ve imha işleminden sonra, çevrimdışı analiz için ImageJ'e aktarılmak üzere. Odanın giriş ve çıkış kısımlarını hariç tutmak için ilgilenilen bölgeyi (ROI) seçin. Arka plan ROI sinyalinin çıkarılmasından sonra, yankı yoğunluğunu ROI içindeki ortalama piksel yoğunluğu olarak ölçün.
NOT: Ultrason görüntülemeye bir alternatif olarak, mikro kabarcıkların hedef yüzeye yapışması, ters çevrilmiş tutucudaki paralel plaka akış odası düzeneği, video kaydı 5,11,12,14 ile bir bileşik mikroskop aşamasına yerleştirildiğinde video mikroskobu ile gözlemlenebilir. Bu, özellikle hücre kültüründe hücre yüzeyi biyobelirteç reseptörlerine hedeflenen yapışmasının görüntülenmesi için yararlıdır, reseptör eksprese eden hücreler doku kültürü kabı üzerinde büyütüldüğünde ve her bir hedef hücreye bağlı mikro kabarcıkların sayısı doğrudan sayılabilir.
Sonuçlar
Peptit ve lipitin kovalent bağlanması
Reaksiyonun tamamlanması ve istenen ürün oluşumu TLC tarafından onaylandı. Ayrı bir reaksiyona girmemiş peptit kontrolü, TLC sırasında yukarı hareket etmedi: başlangıçta tutuldu ve noktası, ısıtma üzerine ninhidrin spreyinden sonra gözlemlendiği gibi birincil amino grubu için pozitifti. Bu ninhidrin pozitif serbest peptit noktası, reaksiyonun tamamlanmasını takiben, reaksiyon karışımı numunesinin TLC'sini takiben, DIPEA, DMSO'nun çıkarılmasından ve kloroformda yeniden çözünmesinden sonra karışımda artık gözlenmedi. NHS ester reaktif kalitesinin önemli konusuna gelince, Şekil 1 , hidroliz kinetiğinin spektrofotometrik izini sunar ve reaksiyonun başlangıcındaki sıfır zaman noktası, organik bir çözücü içindeki NHS esterinin küvete eklendiği zamandır. Bu, karboksi-PEG-DSPE'nin NHS aktif esterinin işlevselliğini doğrular (bkz. Yöntemler Bölüm 1). Sıfır zaman noktasında, tahmin edilen A260=0.33, testten önce zaten hidrolize edilmiş olan malzemeyi temsil eder. Hidroliz reaksiyonunun tamamlanmasında, 10-15 dakikadan fazla, A260=1.54 (absorbans artık önemli ölçüde artmadığında). Bu, aktif esterin varlığını doğrular. Ayrıca, materyalin %78'inden fazlasının önceden hidrolize edilmiş NHS olmadığına ve bu nedenle reaktif miktarının uygun şekilde ayarlanmasıyla peptit eşleşmesi için başarılı bir şekilde kullanılabileceğine dair nicel veriler sağlar.
Lipid malzemesinin sulu ortamdan kabarcık kabuğuna hazırlanması ve aktarılması: floresan lipid
Bu çalışma için mikro kabarcıklar, DSPC ve PEG stearatın salin-PG çözeltisine PG içinde bir çözelti olarak eklenen, karakteristik kırmızı floresan ile eser miktarda (% 1'in altında) floresan boya DiI içerecek şekilde hazırlandı. Ortaya çıkan mikro kabarcıklar, mikroskopta yeşil ışık uyarımı ve kırmızı emisyon filtreleri kullanıldığında kabuk floresansını açıkça gösterir (bkz. Şekil 2, sol). Mikro kabarcık gaz fazının parlak alan mikroskobu (Şekil 2, sağda), mikro kabarcık kabuğu floresansı ile karşılaştırılabilir. Sulu fazdan kabarcık kabuğuna lipid materyal transferinin kantitatif değerlendirmesi için, mikro kabarcıklar santrifüjleme kullanılarak yüzdürüldü ve berrak infranatant fazın floresan sinyali, mikro kabarcık birleşmesinden önce ilk çözeltinin floresansı ile karşılaştırıldı. Neredeyse bir büyüklük sırası sinyal azalması gözlendi (Şekil 3), yani lipit materyalinin% 85'inden fazlası birleşme yoluyla mikro kabarcık kabuğuna aktarıldı.
Mikro kabarcıkların hazırlanması ve boyut dağılımının düzeltilmesi
Birleştirme ile üretilen mikro kabarcıklar, yüksek konsantrasyonlu tipik bir boyut dağılımı göstermiştir (örneğin, biyotinile edilmiş kabarcıklar için mL başına ~ 4.8 x10 9 parçacık). Boyut dağılımı genişti ve ölçülen aralıkta (1 ila 30 μm arasında) parçacıklar mevcuttu; ~%6,3 mikro kabarcıkların çapı 5 μm'yi aşar (Şekil 4, yeşil eğri). Büyük mikro kabarcıkların intravasküler uygulaması, kan kılcal damarlarında spesifik olmayan birikimlerine yol açabilir ve bundan kaçınılmalıdır. Ters çevrilmiş şişenin normal yerçekiminde kısa (15-17 dakika) yüzdürülmesi ve ardından septum yüzeyine yakın 0,3 mL'lik toplanması, toplam parçacık sayısı konsantrasyonunda ~ 4,6 x 10'a kadar küçük bir kayıpla daha büyük mikro kabarcıkların tamamen çıkarılmasına izin verir9: yüzdürmeyi takiben, saflaştırılmış numunedeki parçacıkların yalnızca %0,01'inin çapı 5 μm'nin üzerindedir (Şekil 4, kırmızı eğri).
Mikro kabarcıkların reseptör kaplı yüzeye yapışması: statik tahlil
Bu prosedür ilk olarak önceki yüzyıl1'de tanımlanmıştır ve hedeflenen mikro kabarcıkların işlevselliğini doğrulayan hızlı bir test olarak kullanılmaktadır. Mikro kabarcıkların reseptör taşıyan çanak yüzeyine temas etmesine izin verilir. Ligand-reseptör etkileşimi gerçekleşirse, kuvvetli yıkamaya rağmen kabarcıklar yüzeyde kalabilir. C(RGDfK)-mikro kabarcıkların rekombinant αvβ3 ile kaplanmış yüzeye fonksiyonel yapışmasının bu kadar hızlı bir testinin bir örneği sunulmuştur. Şekil 5 , bağlanmamış kabarcıkları çıkarmak için PBS ile yıkamayı takiben bir Petri kabında reseptör yüzeyindeki yapışık mikro kabarcıkların temsili bir parlak alan mikroskobu görüntüsüdür. Bu tip mikroskopideki kabarcıklar koyu dairesel desenler olarak bulunur. Benzer durumda, yüzey sadece albümin ile kaplanmışsa (spesifik olmayan yapışmayı engellemek için), mikro kabarcıklar yapışmaz ve nazik durulama ile bile kolayca yıkanır.
Mikro kabarcıkların akan ortamdan bağlanması: paralel plakalı akış odası
Bu prosedür başlangıçta kontrollü bir akış ayarında15 hücre yapışmasının incelenmesi için bir araç olarak önerilmiş ve on yıllar sonra mikro kabarcık hedefleme çalışması için uyarlanmıştır11. Statik bir testten farklı olarak, bir akış sisteminde test etmek, bir kan akışında dolaşan kabarcıkların damar duvarına kısa bir süre temas ettiği ve hedef reseptör mevcutsa ona yapışabileceği bir klinik görüntüleme senaryosu için çok daha gerçekçidir. Bu tür çalışmalardan iki örnek sunulmuştur. İlk örnek, peptit ile dekore edilmiş mikro kabarcıkların reseptör kaplı yüzeye yapışmasının video mikroskobu ile izlendiği daha geleneksel bir yaklaşımdır. Mikroskopi, yapışık mikro kabarcıkların akan kabarcıklardan ayırt edilmesini sağlar. Aynı zamanda, mikroskop görüntüleme çerçevesindeki bu yapışkan mikro kabarcıkların ölçülmesine de izin verir: karıştırılmış c (RADfK) peptidinin kullanıldığı kontrol ile karşılaştırıldığında veya yüzey sadece BSA ile kaplanmışsa, çok daha fazla c (RGDfK) mikro kabarcık (sol sütun) yüzeye yapışır (Şekil 6).
İkinci örnek, streptavidin ile kaplanmış Petri kabının kontrast ultrason görüntülemesidir (Şekil 7, sağ taraf), biyotinile mikrokabarcıkların akan ortamdan başarılı bir şekilde adsorbe edildiği ve PBS ile yıkamayı takiben kontrast ultrason görüntüleme ile tespit edilebildiği görülmektedir. Kontrol çanağı yüzeyi, akıştan herhangi bir yapışkan mikro kabarcık tutmaz, bu nedenle esasen tüm ultrason kontrast sinyali PBS akışı ile giderilir. Ultrason kontrast sinyali ölçümü, gözlemlenen farkın güçlü istatistiksel anlamlılığını gösterir; Hedef ve kontrol sinyallerinin oranı bir büyüklük sırasını aştı.
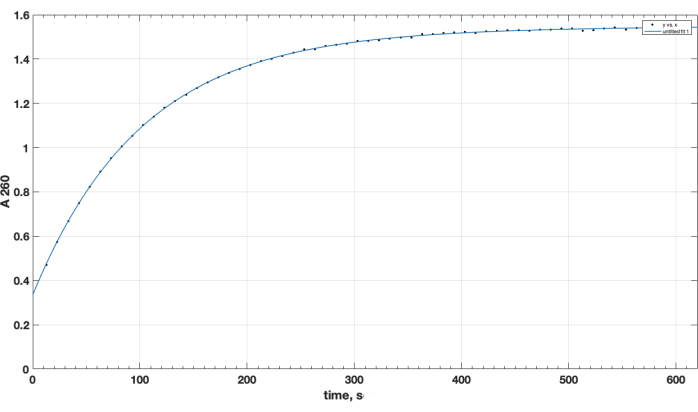
Şekil 1. 260 nm dalga boyunda spektrofotometrik test ile alkali ortamda NHS salınımı ile gözlemlenen NHS-PEG-DSPE aktif esterin hidroliz kinetiği. Sıfır zaman noktası, organik çözücü içinde NHS-PEG-DSPE'nin 0.1 M borat tamponuna, pH 9.2'ye eklenme zamanıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2. Birleşmeyi takiben gazla doldurulmuş mikro kabarcıkların mikroskobu. Sol, floresan mikroskobu (yeşil uyarma, kırmızı emisyon, DiI lipid kabuk boyası). Sağ, parlak alan mikroskobu (gaz fazı gözlemi), aynı büyütme. Çerçeve genişliği, 85 um (her görüntünün sağ alt kısmına gömülü 10 μm aşamalı mikrometre). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
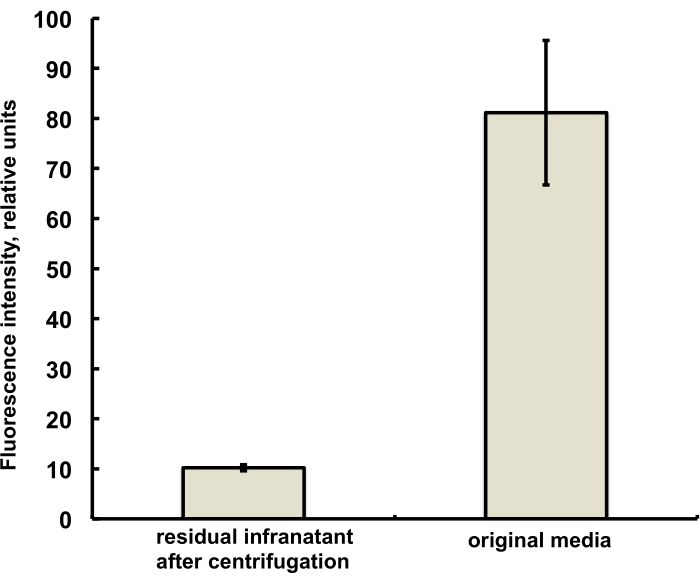
Şekil 3. Birleştirmeden önce (sağda) ve birleştirmeden ve santrifüjlü yüzdürme ile mikro kabarcıkların birleştirilmesinden ve çıkarılmasından sonra (solda) mikro kabarcık hazırlama ortamından DiI lipid boya numunesinin floresan spektroskopisi. Floresan uyarma - 555 nm, emisyon - 620 nm. Veriler Ortalama ± Standart Sapma olarak sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. Birleştirme hazırlığını (yeşil) takiben mikro kabarcıkların sayı konsantrasyonunun partikül boyutu dağılımı, büyük mikro kabarcıkların (kırmızı) çıkarılması için müteakip normal yerçekimi yüzdürme ve yalnızca seyreltici arka plan sayımı (mavi). Normal tuzlu suda elektrozon algılamalı partikül sayımı, 50 μm delik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5. αvβ3 ile kaplanmış bir tabak üzerinde c(RGDfK)-mikro kabarcıkların parlak alan mikroskobu. Görüntü çerçevesi genişliği 106 μm'dir; çubuk 10 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
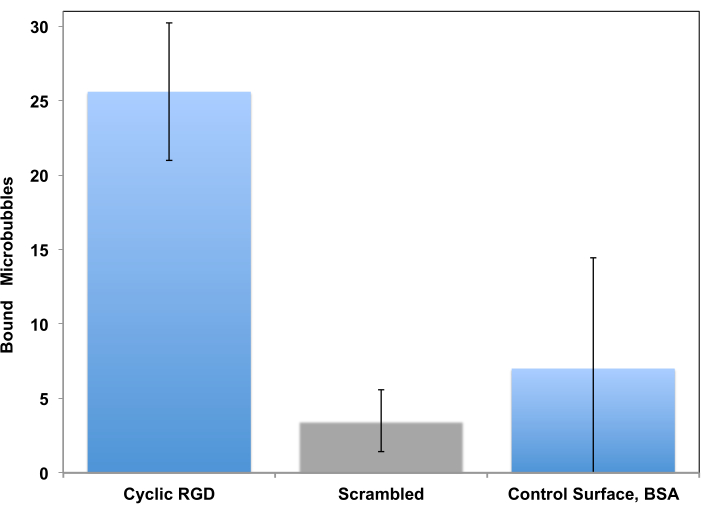
Şekil 6. İn vitro paralel plaka akış odası, peptit ile dekore edilmiş mikro kabarcıkların rekombinant αv ile kaplanmış yüzeye β3. cRGDfK ile süslenmiş mikro kabarcıklar tabağa verimli bir şekilde yapıştı (solda), kontrol hedeflenmemiş cRADfK (karıştırılmış, orta) mikro kabarcıkların bağlanması minimumdu (p<0.00005), sadece albümin kontrol yüzeyinde mikro kabarcık tutulması gibi (sağ, p<0.0025). 1 dyn /cm2'de hazne akış duvarı kesme gerilimi. Video mikroskobu ile izlenen mikro kabarcık yapışması; Görüş alanındaki parçacıkların sayısı sunulmuştur. Biriktirme süresi 4 dakikadır. Veriler Ortalama ± Standart Sapma olarak sunulmuştur. 5'in izniyle yeniden basıldı. Telif Hakkı, 2018, Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
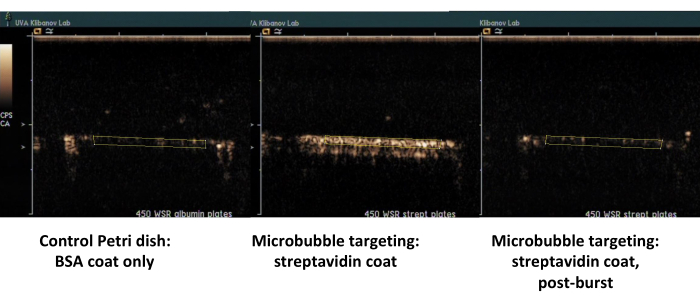
Şekil 7. Streptavidin ile kaplanmış çanak üzerinde biyotinile mikrokabarcıkların hedeflenen yapışma ve tampon yıkamasını takiben paralel bir plaka akış odasının kontrast ultrason görüntülemesi (orta, yapışık hedefli mikro kabarcıklar, sağ, aynı tabak, yüksek MI ultrason patlamasını takiben) ve sadece albümin ile kaplanmış kontrol kabı (solda). 450 s-1 kesme hızında iki dakikalık mikro kabarcık dispersiyonu (PBS/BSA, 106 parçacık/mL) perfüzyonu, ardından tampon yıkama. Ultrason sinyalinin nicelleştirilmesi, arka plan çıkarılmasından sonra video karelerindeki ilgili bölgelerden gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Ligand ile süslenmiş mikro kabarcıkların hazırlanması için basit bir tekniğin önemi açıktır. Unger ve ark.16 tarafından öncülük edildiği gibi, mikro kabarcık hazırlığı için birleştirme tekniğinin kullanılması, birkaç nedenden dolayı bu amaca hizmet edebilir. Mikro kabarcıkların amalgamator tarafından üretilmesi kolaydır. Az yer kaplayan bir masaüstü tek fazlı 120 V ünite mevcuttur ve ucuzdur. Prosedür hızlı (45 saniye) ve etkilidir: Sulu bir ortamda 1 mL mikro kabarcık dispersiyonu bir kerede hazırlanır. mL başına milyarlarca parçacık içerir, bu da araştırma çalışmaları için fazlasıyla yeterlidir. Üretim, perflorlu gaz üst boşluğuna sahip kapalı bir şişede gerçekleşir. Gerekirse, flakon içerikleri aseptik dolum anından, üretim sırasında (birleştirme) ve kullanıma kadar steril kalacaktır. Bu, klinikte özel bir steril ortamda ayrıntılı hazırlıklar gerektirmediği için yaklaşımı klinik kullanım için uygun hale getirir.
Prosedür kendi kendine montaja dayanır: karıştırma sırasında, hareketli flakon içindeki gaz-su arayüzüne yüksek kesme uygulandığından, yüzey geriliminin etkisinden dolayı küresel bir şekil alan küçük gaz parçaları oluşur. PG, ortamda yüksek konsantrasyonda bulunan bir yardımcı yüzey aktif madde olarak, kesme sırasında gaz-su arayüzü oluşturmak için gereken yüzey gerilimini ve enerjiyi azaltır. Daha sonra, çok daha düşük konsantrasyonlarda bulunan PEG lipidleri ve fosfolipidler gibi daha "klasik" yüzey aktif maddeler, büyük olasılıkla PG'nin yerini alarak ve kabarcık yüzeyinde monomoleküler bir tabaka oluşturarak arayüze ulaşır. Bu kabuk oldukça kararlıdır; muhtemelen "katı" bir lipid (DSPC faz geçiş sıcaklığı 56 °C'dir, bu nedenle zarlar arası füzyona eğilimli değildir) ve mikro kabarcıkları çevreleyen ve komşu kabarcıkların doğrudan tek katmanlı temasını engelleyen genişletilmiş bir PEG fırça tabakasının bir kombinasyonundan kaynaklanmaktadır. Ortamda yüksek konsantrasyonda PG bulunmasının mikro kabarcık kabuğu stabilitesini azaltabileceği tahmin edilebilir. Yokluğunda, mikro kabarcıklar, florokarbon atmosferi altında kapalı şişelerde aylarca stabildir ve kabarcıklar arasında sadece orta derecede füzyon olur. Klinik kullanım için, yatak başında küçük bir amalgamatör cihazı ile, mikro kabarcık hazırlama ve kullanım arasındaki aralık kısa, dakikalar veya saatler olabilir. Ortamda PG bulunduğunda, mikro kabarcık konsantrasyonu, en azından birkaç saatlik buzdolabında saklama için önemli bir düşüş göstermez.
Tarif edilen prosedürün ek bir avantajı (kabarcık hazırlama ortamında PG cosurfaktan kullanımı ile desteklenir), kabuğa lipit transferinin yüksek etkinliği (% >85) iken, geleneksel sonikasyon ~% 20 etkinlik5 ve modern mikroakışkan yöntemler daha da düşük17 sağlar. Yüksek transfer verimliliği seviyesi, sadece lipit materyali ve pahalı ligand israfı azaldığı için değil, aynı zamanda ortamda birlikte bulunan kabarcıksız ligand miktarının da en aza indirilmesi nedeniyle önemlidir. Daha sonra serbest ligand, mikro kabarcıkların yüzeylerindeki ligand yoluyla bağlanması beklenen biyobelirteç hedef reseptörünü bloke etme fırsatına sahip olmayabilir. Hedef damar sistemi üzerindeki biyobelirteç reseptörünün genel miktarı genellikle oldukça yüksektir, bu nedenle bu çok önemli olmayabilir. Mevcut patent literatüründen18 , klinik testlerde mikro kabarcık formülasyonlarındaki lipid kabuğu materyalinin ve hedefleme ligandının en az %50'sinin kabarcık kabuğu ile ilişkili olabileceği öne sürülebilir. Bu genellikle nükleer tıp reseptör görüntüleme çalışmalarında yaygın olarak kullanılan radyoaktif işaretli antikorlar veya peptitler ile karşılaştırılabilir: ligand moleküllerini hedefleyenlerin çoğu, bildirilen en yüksek spesifik aktivite için bile aslında "sıcak" radyoizotop taşımaz19, oysa hedeflenen mikro kabarcıklar için, bu çalışmadaki kabuk materyali (ligand-lipid dahil) çoğunlukla mikro kabarcıklara bağlıdır.
Bu teknikle hazırlanan hedeflenen mikro kabarcıkların seçici yapışması in vitro olarak iki hedefleme modeli setinde gösterilmiştir: statik yapışma ve bir akış odası hedefleme deneyi. Statik bir tahlilde, hedeflenen mikro kabarcıklar, hedef reseptör katmanına sıkıca yapıştı ve mikro kabarcıkların nazik bir durulama ile bile yüzeyden çıkarıldığı bir kontrol ortamının aksine, tampon durulama ile yerinden çıkarılmadı. Benzer şekilde, paralel bir plaka akış odasında gerçekleştirilen bir akış testinde, biyotinile kabarcıklar, yalnızca kontrol albümini içeren yüzeyle karşılaştırıldığında, bir polistiren tabak üzerindeki streptavidin tabakasına istatistiksel olarak anlamlı ve mükemmel yapışma göstermiştir. Peptit c (RGDfK) ile dekore edilmiş mikro kabarcıklar, hem statik yapışma testinde hem de paralel bir plaka akış odasında αvβ3 kaplamalı yüzeye seçici olarak yapıştırılmıştır.
Aşağıdaki hususlar açıklanan protokolün sınırlamaları olarak düşünülebilir. İlk olarak, prosedür mikron altı parçacıkları hesaba katmaz. Çalışmada kullanılan cihaz, nanokabarcıkları (yani, çapı 1 μm'nin altındaki parçacıkları) tespit etmek için ayarlanmamıştır. Bu parçacıklar formülasyonda mevcut olabilir. Akustik geri saçılma sinyallerinin genellikle düşük olduğu bilinmesine ve bu çalışmada mikroskopi ile gözlenmemiş olmalarına rağmen, nanokabarcıkların varlığı hala göz önünde bulundurulmalıdır. İkinci önemli sorun, mikro kabarcıkların boyut heterojenliğidir. Daha büyük parçacıkların uzaklaştırılmasına rağmen, ortaya çıkan kabarcıkların boyutu tekdüze olmaktan uzaktır. Bu, mikro kabarcık formülasyonu alanında daha fazla araştırma için bir değerlendirme ve gerekçe olmalıdır.
Sonuç olarak, bu yazıda verilen anlatı, hedeflenen mikro kabarcıkları hızlı ve kolay bir şekilde üretmek için yeterli düzeyde teknik ayrıntı sağlamalıdır. Ek saflaştırma (istenirse), boyutun ayarlanması ve/veya sulu ortamda kalan kabuk malzemesinin küçük miktarının değerlendirilmesi için adımlar sağlanır. Boyut dağılımı ve konsantrasyon gibi mikro kabarcık parametrelerinin değerlendirilmesi için ayrıntılı analitik araçlar ve ligand ile dekore edilmiş mikro kabarcıkların hedef reseptörlere yapışma kabiliyeti in vitro olarak açıklanmaktadır.
Açıklamalar
A. Klibanov, klinik öncesi hedefli mikro kabarcıklar alanında bir girişim olan Targeson Inc'in kurucu ortağı ve azınlık hissedarıdır. UVA laboratuvarı, SoundPipe Therapeutics'ten NIH R44 HL139241 aracılığıyla bir taşeronluk yapmaktadır.
Teşekkürler
AL Klibanov, Ulusal Sağlık Enstitüleri Ulusal Biyomedikal Görüntüleme ve Biyomühendislik Enstitüsü tarafından verilen NIH R01EB023055, NIH R01NS076726 aracılığıyla Virginia Üniversitesi'ne bir taşeronluk, Ulusal Nörolojik Bozukluklar ve Ulusal Sağlık Enstitüleri İnme Enstitüsü tarafından UCSF'ye verilen ve NIH hibe R44HL139241 aracılığıyla Virginia Üniversitesi'ne bir taşeronluk tarafından kısmen destek kabul eder. Ulusal Kalp, Akciğer ve Kan Enstitüsü tarafından SoundPipe Therapeutics'e verildi. Bu yayının içeriği yalnızca yazarın sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Referanslar
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, Suppl 1 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , US Patent 5,585,112 (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , US Patent 5,686,060A (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır