Method Article
Herstellung und Charakterisierung von gezielten Mikrobläschen
In diesem Artikel
Zusammenfassung
Ziel dieses Protokolls ist die Präparation, Reinigung und Charakterisierung von gasgefüllten Mikrobläschen (gezielte Kontrastmittel für die molekulare Ultraschallbildgebung). Es werden zwei Targeting-Systeme beschrieben: biotinylierte Bläschen, die an Streptavidin adhärent, und zyklische RGD-Peptid-Mikrobläschen, die an αvβ 3, einen bekannten Tumor-Neovaskulatur-Biomarker, binden.
Zusammenfassung
Das Targeting von Mikrobläschen (Ultraschallkontrastmittel für die molekulare Bildgebung) wird seit mehr als zwei Jahrzehnten erforscht. Die Methoden zur Vorbereitung der Mikroblase und zur gezielten Ligandenbindung sind jedoch umständlich, kompliziert und langwierig. Daher besteht die Notwendigkeit, das Verfahren der gezielten Vorbereitung von Mikrobläschen zu vereinfachen, um es der klinischen Umsetzung näher zu bringen. Der Zweck dieser Veröffentlichung ist es, eine detaillierte Beschreibung und Erläuterung der Schritte zu geben, die für die gezielte Vorbereitung von Mikroblasen, die funktionelle Charakterisierung und die Prüfung erforderlich sind. Eine Sequenz der optimierten und vereinfachten Verfahren wird für zwei Systeme vorgestellt: ein Biotin-Streptavidin-Targeting-Paarmodell und ein zyklisches RGD-Peptid, das auf das rekombinante αvβ3-Protein abzielt, das auf der endothelialen Auskleidung des Tumorneovaskulaturs überexprimiert wird.
Hier zeigen wir Folgendes: kovalente Kopplung des Zielliganden an einen Lipidanker, Beurteilung der Reagenzqualität und Tests, die den erfolgreichen Abschluss der Reaktion bestätigen; Herstellung des wässrigen Vorläufermediums, das Bestandteile der Mikroblasenhülle enthält, gefolgt von der Herstellung der Mikroblase durch Amalgamierung; Bewertung der Wirksamkeit des Lipidtransfers auf die Hülle des Mikroblasenstabilisators; Anpassung der Größenverteilung der Mikroblasen durch Flotation bei normaler Schwerkraft, um größere Mikrobläschen zu entfernen, die für die In-vivo-Verwendung nachteilig sein könnten; Bewertung der Größenverteilung der Mikroblase durch Elektrozonenmessung; Bewertung der gezielten Bindung der Mikrobläschen an die rezeptorbeschichtete Oberfläche in einem statischen Bindungsassay-Test (in einer umgekehrten Schale); und Bewertung der gezielten Bindung der Mikrobläschen an die rezeptorbeschichtete Oberfläche in einem parallelen Plattenströmungskammertest.
Einleitung
Die molekulare Bildgebung mit gezielten Mikrobläschen wird seit mehr als zwei Jahrzehnten erforscht und getestet. Das allgemeine Konzept ist einfach: Gasgefüllte Mikrobläschen, die eine selektive Affinität zu dem molekularen Biomarker besitzen, der für das Gefäßendothel im Krankheitsbereich spezifisch ist, werden intravenös injiziert. Diese Partikel zirkulieren und reichern sich im Ziel an (z. B. Tumor-Neovaskulatur oder im Bereich der ischämischen Entzündungsverletzung). Anhaftende Mikrobläschen werden dann mittels Kontrastultraschall nachgewiesen. Frühe Konzeptforschungsbemühungen aus dem letzten Jahrhundert 1,2 schreiten nun allmählich in Richtung klinischer Akzeptanz voran: Sie haben erst vor wenigen Jahren ein mittleres Stadium klinischer Studien erreicht 3,4. Der Zweck dieses Manuskripts ist es, eine detaillierte Erläuterung zur Herstellung und Charakterisierung solcher zielgerichteten Mikrobläschen zu liefern, basierend auf zwei veröffentlichten Beispielen 1,5.
Das Verfahren zur Herstellung von Peptid-PEG-Phospholipid, einer entscheidenden Komponente für die Formulierung dieser gezielten Mikrobläschen, wird durch die Beschreibung der Reagenzienqualitätskontrolle ergänzt, die für den erfolgreichen Abschluss der Reaktion erforderlich ist. Leider stellen einige Lieferanten von aktiven Esterlipidreagenzien Material zur Verfügung, das bei der Ankunft hydrolysiert wird und daher nicht an der Bildung der Amidbindung teilnehmen kann. Es wird die Information darüber bereitgestellt, wie viel des Lipidmaterials während der Herstellung der Mikroblase aus dem wässrigen Medium auf die Mikroblasenhülle übertragen wird, sowie die Technik, um diese Information zu erhalten.
Es ist wichtig, Mikrobläschen mit einer relativ engen Partikelgrößenverteilung herzustellen: Das gleichzeitige Vorhandensein großer Mikrobläschen in den injizierbaren Medien für intravaskuläre In-vivo-Tests kann zu einer Verstopfung der Mikrogefäße führen. Eine unspezifische Akkumulation von Mikrobläschen, die Lungenshunts umgehen, kann zu einer unspezifischen falsch-positiven Gewebeverstärkungführen 6, die durch die Entfernung größerer Mikrobläschen vermieden wird. Daher wird ein einfaches Verfahren zur Erzielung einer Partikelgrößenselektion vorgestellt, ergänzt durch die Beschreibung eines Verfahrens zur Beurteilung der Partikelkonzentration und Größenverteilung mit einem Partikelzähler.
Das erste Testprotokoll für die Bewertung des Mikrobläschen-Targetings, wie unten vorgestellt, beschreibt ein reines Modellsystem, bei dem biotinylierte Mikrobläschen auf eine Streptavidin-beschichtete Oberfläche1 gerichtet sind. Das zweite Protokoll basiert auf einem Manuskript, das eine vereinfachte Herstellung von peptidgesteuerten Mikrobläschen beschreibt, die mit einem zyklischen RGD-Peptid dekoriert sind, das eine spezifische Affinität zu αvβ 3, einem molekularen Biomarker für Tumorneovaskulaturen5, besitzt. Es wurde gezeigt, dass Mikrobläschen, die mit diesem Cyclo[Arg-Gly-Asp-D-Phe-Lys], d.h. c(RGDfK)-Peptid, durch die vorgestellte Technik dekoriert wurden, auf Tumorneovaskulatur abzielen und eine molekulare Ultraschallbildgebung in einem murinen Tumormodell erreichen.
Protokoll
1. Kovalente Kopplung des Peptids an NHS-PEG-DSPE
- Das c(RGDfK)-Peptid wird mit der primären ε-Aminogruppe von Lysin, die ungeschützt und zur Kopplung zur Verfügung steht, in Dimethylsulfoxid (DMSO, 10 mg/ml) gelöst. Bereiten Sie eine Methanol- oder Chloroformlösung von N-Hydroxysuccinimidester von Poly(ethylenglykol)-3400-distearoylphosphatidylethanolamin (NHS-PEG-DSPE, 200 mg/ml) vor und fügen Sie 1 mg Peptid in DMSO hinzu. Fügen Sie 3 μl N,N-Diisopropylethylamin (DIPEA) hinzu.
- Halten Sie ein Peptid-zu-NHS-PEG-DSPE-Molverhältnis von mindestens 1:1,2 aufrecht, damit alle primären Aminogruppen reagieren können. Halten Sie ein DIPEA:Peptid-Molverhältnis von mindestens 2:1 aufrecht, um die grundlegenden Medienbedingungen zu gewährleisten.
ACHTUNG: Chloroform, Methanol und DIPEA sind gefährliche Stoffe. Verwenden Sie geeignete Schutzmaßnahmen wie Handschuhe, Laborkittel, Schutzbrille und Abzug.
HINWEIS: Jedes andere Peptid oder Mimetikum mit einer primären Aminogruppe kann anstelle von c(RGDfK) verwendet werden, mit ungeschütztem N-Terminus oder einem Lysin, das sich außerhalb der Bindungsstelle befindet. Damit die Reaktion ablaufen kann, müssen alle Komponenten (d. h. der Zielligand und das Lipid) in einem DMSO-Chloroform-Gemisch löslich sein. Alternative Lösungsmittel wie Dimethylformamid oder seine Mischungen können ebenfalls getestet werden. Eine Reaktion in wässrigen Medien ist ebenfalls möglich, aber die Kopplungsausbeute wird aufgrund der schnellen Hydrolyse des aktiven Esters viel geringer sein.
- Halten Sie ein Peptid-zu-NHS-PEG-DSPE-Molverhältnis von mindestens 1:1,2 aufrecht, damit alle primären Aminogruppen reagieren können. Halten Sie ein DIPEA:Peptid-Molverhältnis von mindestens 2:1 aufrecht, um die grundlegenden Medienbedingungen zu gewährleisten.
- Nach der nächtlichen Inkubation bei Raumtemperatur wird das flüchtige organische Material durch Verdampfen entfernt (verwenden Sie einen Stickstoffgasstrom oder einen Rotationsverdampfer, gefolgt von einer nächtlichen Verdampfung unter einer Hochvakuumpumpe, um DMSO zu entfernen). Lösen Sie den nichtflüchtigen Rückstand in Chloroform bei 1 mg/ml für eine kontrollierte Probenahme.
- Bestätigung des Reaktionsabschlusses durch Dünnschichtchromatographie (Entwicklung von DC-Platten in Chloroform:Methanol-Lösungsmittelmedien, 2:1 v/v). Bestätigen Sie das Vorhandensein oder Fehlen der primären Aminogruppe mit Ninhydrin-Spray, wenn Sie die Platte auf einem 150 °C-Heizblock erhitzen.
ACHTUNG: Ninhydrin ist ein gefährliches Material. Verwenden Sie den richtigen Schutz, wie oben beschrieben. Die Behandlung von DC-Platten mit Heizblöcken muss in einem Abzug durchgeführt werden. Der Heizblock stellt eine potenzielle Brandgefahr dar. - Vor der Herstellung der Mikroblase aliquotiert eine Probe von Peptid-PEG-DSPE aus Chloroform (z. B. 1 ml 1 mg/ml-Lösung), verdampft Chloroform in einem Stickstoffgasstrom bis zur Trockenheit, mit anschließender Hochvakuumpumpeninkubation, und fügt Kochsalzlösung zu 1 mg/ml hinzu, um eine transparente mizellare Lösung zu erhalten.
- Wenn eine weitere Reinigung des Reaktionsgemisches wünschenswert ist, in normaler Kochsalzlösung wieder auflösen. Dann wird das resultierende mizellare Gemisch einer Dialyse (6-8 kDa Molekulargewichts-Cut-off oder ähnliches) unterzogen, zuerst gegen normale Kochsalzlösung und dann gegen mehrere Wechsel von deionisiertem Wasser.
- Bestätigen Sie den Abschluss der Dialyse durch eine Leitfähigkeitsprüfung des Dialysats. Entfernen Sie das dialysierte Material aus dem Dialysebeutel, geben Sie es in ein Fläschchen mit bekannter Masse und lyophilisieren Sie es, bis es vollständig trocken ist.
HINWEIS: Eine alternative kovalente Reaktion zur Bindung des Liganden an den Terminus des PEG-Lipids ist verfügbar (z. B. eine Reaktion von Maleimid-PEG-DSPE mit Thiol-Liganden). Der Hauptvorteil dieses Ansatzes ist die orientierte Kopplung, wenn ein einzelnes Thiol auf dem Ligandenmolekül 7 verfügbar ist. Das Hauptanliegen ist die Langzeitstabilität: Die daraus resultierende Verbindung zwischen Maleimid und Thiol kann je nach Lagerbedingungen anfällig für den Abbau durch eine Retro-Michael-Reaktion sein 8.
HINWEIS: Die Qualität der aktiven Esterreagenzien variiert stark zwischen den Herstellern: Sie kann von den Transfer- und Lagerbedingungen abhängen (wenn das Material nicht richtig gelagert oder transportiert wird, hydrolysiert der aktive Ester und kann nicht mit dem Peptid koppeln). Folglich besteht ein Gefühl der Verpflichtung, ein Verfahren (siehe unten) zur Bestimmung des Abbaugrades von NHS-PEG-DSPE, einem Reagenz zur kovalenten Bindung von Zielliganden an Mikrobläschen, zu beschreiben. NHS-PEG-DSPE, das als trockenes Pulver unter Argon geliefert wird, wird tiefgekühlt gelagert. Ein Fläschchen wird auf Raumtemperatur gebracht (um Feuchtigkeitskondensation zu vermeiden), eine Probe mit einer Analysenwaage gewogen und in Methanol oder DMSO gelöst. Eine Durchstechflasche mit trockenem Reagenz in loser Schüttung sollte unter Argon verschlossen und bis zur weiteren Verwendung in einem verschlossenen Behälter mit Trockenmittel in den Tiefkühlschrank zurückversetzt werden. - Bereiten Sie eine wässrige mizellare Lösung von Peptid-PEG-DSPE (Schritt 1.4) sowie Biotin-PEG-DSPE durch einfache Zugabe von Trockenreagenz zu wässriger Kochsalzlösung und Inkubation vor. Es bilden sich kleine kugelförmige Mizellen. Um den Übergang des Reagenzes vom Massenzustand in die mizellare Form zu beschleunigen, können Ultraschall und Heißwasserbad angewendet werden.
- Beurteilen Sie die Reagenzqualität von NHS-PEG-DSPE Aktivester.
- Bestätigen, dass das im Reagenz vorhandene NHS in Form eines aktiven Esters vorliegt, um die Kopplungsreaktion mit der Bildung von Amidbindungen durchführen zu können.
- 0,99 ml 0,1 M Natriumtetraboratpuffer mit einem pH-Wert von 9,2 in eine Quarz- oder UV-transparente Kunststoffküvette (kein Glas) in ein Spektralphotometer geben und bei einer Wellenlänge von 260 nm auf Null stellen.
- 10 μl der frisch zubereiteten 200 mg/ml-Lösung von NHS-PEG-DSPE in Methanol werden in die Küvette gegeben. Starten Sie gleichzeitig die Stoppuhr. Mischen Sie den Küvetteninhalt schnell und kräftig, um eine Gleichmäßigkeit zu erreichen. Legen Sie die Küvette in das Photometer, schließen Sie den Deckel und starten Sie die Messung.
- Markieren Sie zu Beginn der Spektralphotometer-Messung den Zeitpunkt des Beginns der Aufzeichnung und führen Sie kontinuierlich photometrische Absorptionsmessungen bei 260 nm alle 10 s für ~10 min oder bis zur Stabilisierung des Absorptionswerts durch.
- Stellen Sie die kinetische Kurve dar, überprüfen Sie die anfänglichen Zeitpunkte von A260 und extrapolieren Sie die Kurve auf den Startzeitpunkt der Reaktion (d. h. ermitteln Sie A260 an dem Punkt, an dem das Reagenz zum wässrigen Puffer hinzugefügt wurde und die Hydrolysereaktion begonnen hat). Es wird angenommen, dass vor der Zugabe von NHS-PEG-DSPE zum Puffer in der Küvette aufgrund von Wassermangel keine Hydrolyse in einem organischen Lösungsmittel stattgefunden hat.
- Das Verhältnis zwischen A260 zu Beginn der Reaktion und am Ende der Hydrolyse ist zu berechnen; Er stellt den Anteil des abgebauten aktiven Esters dar. Verwenden Sie diese Informationen, um die richtige Menge an NHS-PEG-DSPE für die vollständige Modifikation der primären Aminogruppe des Peptids auszuwählen.
2. Herstellung von Mikrobläschen durch Amalgamierung
- Herstellung von biotinylierten Mikrobläschen
- Distearoyl Phosphatidylcholin (DSPC) und PEG Stearat in Propylenglykol gemeinsam auflösen (PG, jeweils 10 mg/ml Konzentration in reinem Lösungsmittel). Verwenden Sie ein heißes Wasserbad, um die Materialien aufzulösen.
- Geben Sie 0,1 mL dieser heißen PG-Lösung in ein Fläschchen mit 0,85 mL heißer normaler Kochsalzlösung, mischen Sie schnell und fügen Sie mizellares Biotin-PEG-DSPE (50 μL, 1 mg/ml in Kochsalzlösung) in einem Massenverhältnis von 1:20 zu DSPC hinzu.
HINWEIS: Die Löslichkeit der Lipidkomponenten in PG ist temperaturabhängig, daher ist ein heißes Wasserbad erforderlich. Es ist hilfreich, das Glasfläschchen mit Kochsalzlösung vor der Lipidzugabe in einem heißen Wasserbad zu erhitzen, um ein gleichmäßiges Medium ohne sichtbare Partikel zu erzeugen. - Bringen Sie das Fläschchen auf Raumtemperatur, setzen Sie einen Gummistopfen auf das Fläschchen, führen Sie es halb ein, und führen Sie einen PTFE-Kapillarschlauch in das Fläschchen ein. Verwenden Sie den Strom von Decafluorbutangas, um die Durchstechflasche zu füllen, und schließen Sie dann den Stopfen, während Sie die Kapillare entfernen.
HINWEIS: Die Temperatur der Durchstechflasche während der Amalgamierung kann einen erheblichen Einfluss auf die Größenverteilung der resultierenden Mikrobläschen haben 9. - Crimpen Sie das Fläschchen mit Verschluss bei Raumtemperatur und legen Sie es in einen Amalgamator. Starten Sie den Amalgamator. Die verwendete klinische Einheit ist so voreingestellt, dass sie 45 Sekunden lang mit 4300 U/min arbeitet.
- Wenn die Verschmelzung abgeschlossen ist, nehmen Sie das Fläschchen mit den resultierenden Mikrobläschen aus dem Amalgamator. Charakterisieren Sie vorzugsweise die Größenverteilung und Zusammensetzung der Mikroblase und verwenden Sie sie innerhalb mehrerer Stunden nach der Zubereitung.
- Herstellung von peptiddekorierten Mikrobläschen
- Lösen Sie DSPC- und PEG-Stearat in reinem PG zusammen (10 mg/ml-Konzentration für jedes Material). Verwenden Sie ein heißes Wasserbad, um die Lösung zu lösen. Geben Sie 0,1 ml dieser heißen Lösung in PG in ein Fläschchen mit 0,85 ml heißer normaler Kochsalzlösung, mischen Sie schnell und fügen Sie mizellares Peptid-PEG-DSPE (50 μl, 1 mg/ml in Kochsalzlösung) hinzu, das in einem Massenverhältnis von 1:20 zu DSPC hinzugefügt wird.
- Bringen Sie die Durchstechflasche auf Raumtemperatur, setzen Sie einen Gummistopfen auf die Durchstechflasche, setzen Sie sie halb ein, und führen Sie einen Kapillarschlauch aus Polytetrafluorethylen (PTFE) in die Durchstechflasche ein. Verwenden Sie den Strom von Decafluorbutangas, um die Durchstechflasche zu füllen, und schließen Sie dann den Stopfen, während Sie die Kapillare entfernen.
- Das Fläschchen mit Stopfen crimpen und zum Mischen in einen Amalgamator legen. Das Fläschchen mit Mikroblasendispersion ist in 45 s fertig.
- Präparation von Farbstofflipid-Mikrobläschen zur Beurteilung des Lipidtransfers auf die Mikrobläschenhülle
- Lösen Sie DSPC- und PEG-Stearat in reinem PG auf, wie oben beschrieben (verwenden Sie ein heißes Wasserbad) (10 mg/ml-Konzentration für jedes Material).
- Geben Sie 0,1 ml dieser heißen PG-Lösung in ein Fläschchen mit 0,89 mL heißer normaler Kochsalzlösung, mischen Sie schnell, fügen Sie 10 μl DiI-Farbstofflösung (1 mg/ml in reinem PG) hinzu und mischen Sie. Bringen Sie die Durchstechflasche auf Raumtemperatur.
- Füllen Sie den Kopfraum des Fläschchens wie oben beschrieben mit Decafluorbutangas, verschließen Sie das Fläschchen, crimpen Sie es und amalgamieren Sie wie oben beschrieben.
3. Testen Sie den DiI-Lipidtransfer vom mizellaren wässrigen Medium zur Blasenhülle
- Für die mikroskopische Bestätigung, dass fluoreszierendes Lipidmaterial vom wässrigen Medium auf die Mikroblasenhülle übertragen wurde, wird mit einer Insulinspritze ein Aliquot von Mikrobläschen aus dem Fläschchen durch das Septum entnommen.
- Geben Sie dann einen Tropfen auf einen Objektträger und decken Sie ihn mit einem handelsüblichen Deckglas ab. Verdünnen Sie es zuerst mit einem Tröpfchen entgaster Kochsalzlösung.
- Führen Sie Mikroskopie mit einem Videomikroskop durch, das mit einer Fluoreszenz-Epi-Beleuchtung, einem 100-fach-Ölobjektiv und einer hochempfindlichen Videokamera ausgestattet ist.
- Um die Wirksamkeit des Transfers von Lipidmaterial aus dem wässrigen Kochsalz-/PG-Medium auf die Blasenhülle während der Amalgamierung zu bestimmen, nehmen Sie ein versiegeltes Fläschchen mit Mikroblasen, drehen Sie es um und legen Sie es in ein konisches 50-ml-Röhrchen.
- Führen Sie die Zentrifugation in einem Schaufelrotor durch (10 min, 200 x g). Nehmen Sie das Fläschchen aus der Zentrifuge und halten Sie es umgedreht.
- Führen Sie eine Nadel einer Insulinspritze in das Septum der umgekehrten Durchstechflasche ein. Aspirieren Sie langsam ein kleines Volumen (~50 μL) klaren Infranatant.
HINWEIS: Die abgeschrägte Spitze der Nadel für die infranatante Aspiration aus dem umgedrehten Fläschchen nach der Zentrifugation muss so nah wie möglich am Septum platziert werden, um die Wahrscheinlichkeit einer Aufnahme von Mikrobläschen zu minimieren.
- Legen Sie die Proben des Infranatants (2 μl) sowie die Proben des ursprünglichen Lipid-PG-Kochsalzmediums, das zur Erzeugung von Mikrobläschen (2 μl) verwendet wurde, in eine 96-Well-Platte mit 0,1 mL phosphatgepufferter Kochsalzlösung (PBS):Ethanol 1:1 Medium mit 1 % Triton X-100.
- Messen Sie die rote Fluoreszenz des DiI-Farbstoffs (555 nm Anregung, 620 nm Emission) mit einem Fluoreszenz-Mikroplatten-Reader.
- Verwenden Sie für die Fluoreszenzspektroskopie schwarze Platten mit undurchsichtigem Boden, da der Hintergrund geringer ist und die Signalübertragung zwischen den Vertiefungen bei klaren Platten zu einem Problem werden kann.
- Stellen Sie sicher, dass das Fluoreszenzsignal innerhalb des linearen Kalibrierbereichs liegt: Eine zu hohe Farbstoffkonzentration in den Vertiefungen kann zu einer Lichtabschwächung und einem zu geringen gemeldeten Signal führen.
HINWEIS: Es kann manchmal wünschenswert sein, das restliche Schalenmaterial, das nach der Verschmelzung im wässrigen Medium verbleibt, zu entfernen. Zu diesem Zweck wird nach der Mikroblasenflotationszentrifugation das gesamte infranatante Volumen durch langsame Aspiration aus dem umgedrehten Fläschchen entnommen und durch entgaste normale Kochsalzlösung ersetzt. Um eine übermäßige Änderung des Umgebungsdrucks in der Durchstechflasche durch Entfernen oder Hinzufügen von Flüssigkeit zu vermeiden, führen Sie eine zusätzliche lange Nadel in das Septum ein, um die Gasphase im Inneren der Durchstechflasche zu erreichen. Um die Gasphase im Fläschchen aufrechtzuerhalten, verbinden Sie die Nadel zunächst mit einer mit Fluorkohlenstoffgas gefüllten Spritze, um den Luftkontakt mit der Mikroblasenzubereitung zu verhindern.
4. Anpassung der Größenverteilung der Mikroblase
- Verwenden Sie die normale Schwerkraftflotation in einem statischen umgekehrten Fläschchen, um die Größenverteilung der Mikrobläschen anzupassen, d. h. um die größten Mikrobläschen schnell und effizient zu entfernen 5,10.
- Nehmen Sie unmittelbar nach der Zubereitung, wie in Abschnitt 2 beschrieben, eine Durchstechflasche mit Mikrobläschen ein. Umkehren und kopfüber für 15-20 min auf eine stabile, nicht vibrierende Unterlage stellen.
- Führen Sie nach dieser Inkubation eine Insulinspritzennadel in das Septum der Durchstechflasche ein, während sie noch invertiert ist, und sammeln Sie vorsichtig 300-500 μl Mikrobläschen aus der unteren Schicht.
HINWEIS: Die Nadel der Spritze muss nahe an der Innenfläche des Septums bleiben, um eine Ansammlung größerer Blasen zu vermeiden, die näher an der Oberseite der Flüssigkeit in der Durchstechflasche vorhanden sind.- Ziehen Sie den Spritzenkolben langsam zurück, um Turbulenzen und hydrostatische Ausdehnung der Blasen im Spritzenkörper zu vermeiden. Wenn die entnommene Probe aus der Spritze entnommen wird, vermeiden Sie Überdruck, um einen Blasenkollaps zu verhindern.
- Übertragen Sie die Mikroblasendispersion aus der Spritze in eine Durchstechflasche mit kleinem Volumen. Anschließend mit perfluoriertem Gas befüllen, Stopfen und Bördeln, zur kurzfristigen Lagerung, Partikelzählung (siehe unten) und zur weiteren Verwendung.
- Wenn die Probenahme direkt aus der Spritze erfolgt, halten Sie sie horizontal und drehen Sie sie, um Blasenflotation zu vermeiden und eine Gleichmäßigkeit der Probe zu erreichen.
5. Bewertung der Größenverteilung der Mikroblase
- Verwenden Sie einen Partikelzähler (basierend auf Elektrozonenmessung oder Lichtabblendung), um die Partikelgrößenverteilung und -konzentration zu beurteilen. Alternativ können Sie ein Hämozytometer und ein Mikroskop verwenden.
- Geben Sie kurz eine Mikroblasenprobe, aliquot in normale Kochsalzlösung oder Isoton in einer Gegenkammer (typischerweise 60-100 ml Volumen) und zählen Sie. Vergleichen Sie die Größenverteilungen der Mikroblasen vor und nach der Flotationsreinigung.
HINWEIS: Unmittelbar vor der Probenahme ist das Fläschchen einem sanften Mischen (nicht Vortexen) zu unterziehen, um repräsentative und reproduzierbare Messungen zu erzielen. Probe aus der Mitte des getesteten Volumens. - Füllen Sie ein 100-ml-Becherglas mit mindestens 60 ml 0,9%igem Salzlösungsverdünnungsmittel und stellen Sie es auf den Tisch des Elektrozonen-Sendeinstruments. Heben Sie den Tisch so an, dass das Rohr, die äußere Elektrodenplatte und der Rührer vollständig in das Verdünnungsmittel eingetaucht sind und sich der Rührer drehen kann.
HINWEIS: Das Verdünnungsvolumen im Becherglas kann anhand seiner Masse mit einer Skala genau bestimmt werden (die Salzdichte liegt nahe 1). Alternativ kann auch eine Dosierpumpe verwendet werden. Die Elektroden während der Elektrozonenerfassung sollten vollständig eingetaucht werden. - Zeichnen Sie das Volumen des Verdünnungsmittelelektrolyten in der Gerätesteuerungssoftware auf. Der Elektrozonen-Messzähler ist mit einer 50-μm-Blende ausgestattet, die die Messung von Partikeln mit einem Durchmesser von 1 bis 30 μm ermöglicht. Führen Sie zuerst einen Hintergrundlauf durch. Es wird erwartet, dass es weniger als 5000 Zählungen in 0,5 ml Verdünnungsmittel als Blindwert hat. Die besten Hintergrundwerte können unter 100 Zählungen liegen.
- Stellen Sie das Probenvolumen in der Gerätesteuerungssoftware ein, um den Verdünnungsfaktor zu berücksichtigen. Geben Sie 10-20 μl der Mikroblasenmischung in das Becherglas und führen Sie den zweiten Durchlauf durch.
- Verwenden Sie die Daten zur Größenverteilung im Hintergrund, um die Funktion "Hintergrundlauf subtrahieren" in der Software zu berücksichtigen. Ermitteln Sie die Konzentration der Partikel in der ursprünglichen Mikroblasenprobe als Partikelzahl/ml; Er beinhaltet den Verdünnungsfaktor.
- Die äußere Oberfläche der Pipettenspitze kann während der Probenahme ebenfalls mit Blasen bedeckt sein. Stellen Sie sicher, dass Sie es abwischen, bevor Sie die Spitze in das Zählmedium einführen. Berühren Sie die Pipettenspitzenöffnung nicht mit einem Tuch.
- Vermeiden Sie unzureichende Verdünnungen von Probenpartikeln während der Zählung, um die Probleme mit der Koinzidenzkorrektur zu minimieren, wenn sich mehr als ein Partikel gleichzeitig in der Sensoröffnung befindet: Das System kann dann die Partikelkonzentration unterschätzen.
HINWEIS: Der Blendendurchmesser für die Partikelzählung kann variieren. Die Wahl der 50-μm-Blende ermöglicht die Detektion von Mikroblasen mit einem Durchmesser von bis zu 1 μm, ist jedoch nicht so anfällig für Verstopfungen wie Optionen mit kleinerem Durchmesser. - Kalibrieren Sie den Elektrozonen-Messzähler für das gleiche Verdünnungsmittel-Testmedium (z. B. steril filtrierte normale Kochsalzlösung), das in tatsächlichen Tests verwendet wird. Eine Laserverdunkelungsalternative zur Elektrozonenerfassung hat den Vorteil, dass keine gefilterte Kochsalzlösung mit kontrollierter Salzkonzentration und elektrischer Leitfähigkeit erforderlich ist.
- Geben Sie kurz eine Mikroblasenprobe, aliquot in normale Kochsalzlösung oder Isoton in einer Gegenkammer (typischerweise 60-100 ml Volumen) und zählen Sie. Vergleichen Sie die Größenverteilungen der Mikroblasen vor und nach der Flotationsreinigung.
6. Testen Sie das Targeting von Mikrobläschen in vitro in einem Adhäsions-/Retentionsassay
- Bereiten Sie die Oberfläche des Biomarker-Rezeptors für die Ausrichtung der Mikroblase auf Petrischalen vor.
- Nehmen Sie Styroporschalen mit einem Durchmesser von 35 mm, die als Zielfläche verwendet werden sollen. Nutzen Sie die unspezifische Adhäsion von Proteinen an der Oberfläche der Polystyrolschale aus normaler Kochsalzlösung. Verwenden Sie ein Modellprotein, Streptavidin, um das Targeting von biotinylierten Blasen zu testen, die Biotin-PEG-DSPE als Teil der Hülle enthalten.
- Geben Sie ein Tröpfchen Streptavidin-Lösung (0,2 mL, 10 μg/mL in PBS) in die Mitte jeder Petrischale und decken Sie sie mit einem 22 mm x 22 mm großen Kunststoffdeckglas ab, um eine gleichmäßige Beschichtung der Schalenoberfläche zu ermöglichen. Nach der Inkubation über Nacht bei 4 °C in einer geschlossenen feuchten Umgebung, um ein Austrocknen der Schale zu verhindern, entfernen Sie die Deckgläser.
- Waschen Sie die Platten sofort und gründlich mit Wasser, PBS, und blockieren Sie sie durch Inkubation mit 1,5 % Rinderserumalbumin (BSA) in PBS für mindestens 4 Stunden, um die unspezifische Adhäsion von Mikrobläschen auf der unbeschichteten Oberfläche zu minimieren. Als Kontrollen sind die mit 1,5 % BSA verstopften Reinkulturschalen zu verwenden.
- Alternativ können Sie anstelle von Streptavidin rekombinante αVβ 3-Rezeptorlösung (z. B. bei 4 μg/ml in PBS)5 verwenden. Richten Sie Mikrobläschen auf diesen Biomarker über einen zyklischen RGD-Peptidliganden ab, der an die Mikroblasenhülle gebunden ist.
- Halten Sie das Gericht mit abgelagertem Zielrezeptor feucht: Rezeptorprotein kann inaktiviert werden, wenn es austrocknet.
HINWEIS: Es ist wichtig, trägerfreie Rezeptorproteine zu verwenden, die keine Trägerproteine oder Tenside im Medium enthalten - ihre Anwesenheit inaktiviert die Adhäsion.
- Adhäsion von Mikrobläschen in einem kleinen Tröpfchen: Schnelle Überprüfung der gezielten Haftung unter statischen Bedingungen.
- Legen Sie ein Tröpfchen Mikrobläschen (5-20 μl) von unten auf die Zieloberfläche (oder kontrollieren Sie nur BSA) in einer Petrischale, die auf dem Kopf steht. Dadurch werden die Blasen durch Flotation auf die rezeptorbeschichtete Oberfläche gebracht.
- Nach 5-10 min Inkubation der umgedrehten Schale in einer feuchten Umgebung drehen Sie die Schale wieder in eine normale Position, füllen Sie sie mit PBS und spülen Sie sie vorsichtig aus, um freie Mikrobläschen zu entfernen. Führen Sie eine Hellfeldmikroskopie durch, um die gezielte Adhäsion zu beurteilen.
- Adhäsion von Mikrobläschen auf der Oberfläche der Petrischale: Targeting in einer vollen Schaledurchführen 1.
- Nehmen Sie die Schale, die mit einer Rezeptoroberflächenbeschichtung versehen ist, und füllen Sie sie vollständig mit entgastem PBS-BSA-Puffer (über 10 mL für die 35-mm-Schale), so dass der Meniskus des Puffers über die Oberseite der Schale hinausragt und durch Kapillarkraft gehalten wird. Injizieren Sie die Blasen (50 μl) in den Großteil des Puffers und mischen Sie schnell, um eine Homogenität zu erreichen. Vermeiden Sie die Bildung von Luftblasen beim Mischen.
- Legen Sie ein Stück transparentes Verpackungsband oder ein Kulturplatten-Versiegelungsband, das mit einem flachen Stück Plastik hinterlegt ist, schnell über die Schale. Versiegeln Sie die Folie mit einem Druck auf die Schale, drehen Sie die "Montage" um und legen Sie sie 30 Minuten lang auf den Kopf, damit die Mikrobläschen nach oben schwimmen, die Zieloberfläche berühren und anhaften können.
- Drehen Sie die "Baugruppe" der versiegelten Schale wieder in die "auf dem Kopf stehende" Konfiguration um, entfernen Sie die Dichtung und waschen Sie die nicht anhaftenden Mikrobläschen durch Spülen mit entgaster Pufferlösung ab. Beobachten Sie gezielte Mikrobläschen durch Mikroskopie oder durch Ultraschall.
HINWEIS: Wenn die umgekehrte versiegelte Schale, die vollständig mit der Mikroblasendispersion gefüllt ist, inkubiert wird, kann sie in einem leichten Winkel aufgestellt werden, so dass große Blasen, wenn sie vorhanden sind, zum Rand der Schale, außerhalb des mittleren Bereichs von Interesse, schwimmen. Durch erzwungenes Spülen mit schnellem Fluss, der während der Mikroskopie aus einer Mikropipettenspitze kommt, kann beurteilt werden, wie fest die Blasen am Ziel haften (Blasen lösen sich auch bei langsamem Fluss vollständig von der Bedienoberfläche) 11. Entgaster Puffer ist für die Blasenverdünnung vorzuziehen, da ein Überschuss an gelöster Luft zu einem unkontrollierten Wachstum von Mikroblasen führt.
7. Testen Sie das Mikroblasen-Targeting in vitro: Bewertung dynamischer Adhäsions-/Retentionsassays in einer parallelen Plattendurchflusskammer
HINWEIS: Wir testen die Adhäsion von biotinylierten Blasen an der Streptavidin-Schicht mit Ultraschall.
- Verwenden Sie eine im Handel erhältliche Parallelplatten-Durchflusskammer mit einem speziell angefertigten Wechselrichterhalter, um eine gezielte Haftung an einer 35-mm-Petrischale aus strömendem Medium zu beobachten. Nach der Adsorption des Zielproteins an die Schale (siehe 6.1.1) wird der Kammerkörper mit der vorinstallierten Dichtung in die Schale eingesetzt und in der Halterung verschlossen. Verwenden Sie Dichtungen mit einer Kanalhöhe (d. h. Dichtungsdicke) von 0,127 mm und einer Kanalbreite von 2,5 mm.
HINWEIS: Bei der Montage der parallelen Plattenströmungskammer sollte die Menge an Silikonfett, die auf der Dichtung verwendet wird, minimal sein. Lassen Sie kein Fett in den Kanalbereich gelangen: Vermeiden Sie es, die mit Biomarkerproteinen beschichtete Oberfläche mit Fett zu bedecken. Um eine korrekte Abdichtung zu erreichen, wählen Sie 35-mm-Schalen sorgfältig aus (siehe Materialtabelle für Informationen zu Kammer und Schüssel). - Schrauben Sie bei der Durchflusskammerbaugruppe die Kappe und den Rahmen, die die Kombination aus Schale und Durchflusskammer halten, nicht zu fest, um Leckagen zu vermeiden.
- Verbinden Sie den Durchflussschlauch mit einer Spritzenpumpe, die in einem Entnahmemodus betrieben wird, und verbinden Sie auf der Zuführseite einen dünnen Polyethylenschlauch (PE50) mit einer verdünnten Mikroblasendispersion mit dem Fläschchen, das über einen Magnetrührer12 einem konstanten Mischen mit einem Rührstab unterzogen wird. Steuern Sie den Parameter der Wandscherrate (WSR) der Kammer, indem Sie den Pumpenvolumenstrom basierend auf der Formel 6Q/bh2 anpassen, wobei Q die Durchflussrate, "b" die Breite des Kanals und "h" die Höhe des Kanals ist.
HINWEIS: Entfernen Sie die Luftblasen aus dem gesamten System, bevor Sie das mikroblasenhaltige Medium oder PBS perfusionieren, da jede Luftblase, die durch den Kanal strömt, anhaftende Mikrobläschen von der Zieloberfläche löst und das Experiment ungültig macht. Die Verbindung zwischen dem Schlauch der Durchflusskammer und der Spritze muss ordnungsgemäß abgedichtet sein. - Bereiten Sie eine Mikroblasendispersion vor, indem Sie ein berechnetes Volumen konzentrierter Blasen in das Mikroblasenreservoir (ein 20-ml-Szintillationsfläschchen) geben, um eine Konzentration von 106 Mikrobläschen/ml in PBS-Puffer mit 0,1 % BSA zu erreichen. Stellen Sie das Feeder-Reservoir auf einen Magnetplattenrührer. Setzen Sie einen 1 cm x 2 cm großen Magnetrührstab ein und rühren Sie mit ~400 U/min, um die Homogenität im Verlauf der Studie zu erhalten.
- Es ist eine Ultraschallbildgebung der Durchflusskammer in einem Wassertankdurchzuführen 13.
- Tauchen Sie die Strömungskammerbaugruppe in entgastes Wasser und halten Sie sie mit einem Gewicht an Ort und Stelle, um Bewegungen während der Experimente zu verhindern.
- Platzieren Sie die bildgebende Sonde direkt über dem Kanal und neigen Sie sie in einem Winkel von 15° nach hinten sowie um einen Winkel von 5° im Uhrzeigersinn, um Spiegelreflexionen von der Schalenoberfläche zu minimieren. Positionieren Sie den Strömungskammerkanal innerhalb der Bildgebungsebene.
- Verwenden Sie die folgenden Bildgebungsbedingungen: 15L8-Schallkopf, kontrastspezifischer Bildgebungsmodus, Dynamikbereich 50 dB, 7 MHz, mechanischer Index (MI) = 0,18, CPS-Verstärkung = 0. Halten Sie die Kompensation des Zeitgewinns über das gesamte Bild gleichmäßig.
- Platzieren Sie die Geberfläche so, dass sie die Wasseroberfläche berührt und nicht tief eintaucht. Alternativ können Sie eine mit Ultraschallgel gefüllte Gummischutzhülle verwenden.
HINWEIS: Um eine reproduzierbare Positionierung des Durchflusskammersystems für die Bildgebung zu gewährleisten, sollten die Marker auf dem Wasserbecken oder auf dem Bildschirm des Ultraschallsystems platziert werden.
- Ziehen Sie die Mikroblasendispersion aus dem Reservoir durch die Kammer und in die Pumpe für 2 min.
- Schalten Sie den Durchfluss auf PBS um, um nicht haftende Blasen aus dem Kanal zu entfernen und die akustische Rückstreuung der verbleibenden anhaftenden (gezielten) Blasen zu beurteilen. Um ein Hintergrundbild zu erhalten, erhöhen Sie den MI auf 1,9, um die anhaftenden Blasen im Sichtfeld der Ultraschallbildgebung zu zerstören.
HINWEIS: Die Mikroblasendispersion sollte bei wiederholten Durchläufen ausgetauscht werden: Bei hoher Verdünnung bauen sich die Mikrobläschen mit der Zeit allmählich ab.
- Schalten Sie den Durchfluss auf PBS um, um nicht haftende Blasen aus dem Kanal zu entfernen und die akustische Rückstreuung der verbleibenden anhaftenden (gezielten) Blasen zu beurteilen. Um ein Hintergrundbild zu erhalten, erhöhen Sie den MI auf 1,9, um die anhaftenden Blasen im Sichtfeld der Ultraschallbildgebung zu zerstören.
- Exportieren Sie einzelne Bilder aus dem Bildschirmaufzeichnungs-Videostream: vor dem PBS-Spülen, nach dem Leeren und nach der Zerstörung, um sie zur Offline-Analyse in ImageJ zu importieren. Wählen Sie den Region-of-Interest (ROI) aus, um die Einlass- und Auslassteile der Kammer auszuschließen. Nach Subtraktion des Hintergrund-ROI-Signals quantifizieren Sie die Echointensität als mittlere Pixelintensität innerhalb des ROI.
HINWEIS: Als Alternative zur Ultraschallbildgebung kann die Adhäsion von Mikrobläschen an der Zieloberfläche durch Videomikroskopie beobachtet werden, wenn die Anordnung der parallelen Plattenströmungskammer in dem umgekehrten Halter auf einem Tisch eines Verbundmikroskops platziert wird, mit Videoaufzeichnung 5,11,12,14. Dies ist besonders nützlich für die Abbildung der gezielten Adhäsion von Mikrobläschen an Biomarker-Rezeptoren der Zelloberfläche in Zellkulturen, wenn rezeptorexprimierende Zellen auf der Gewebekulturschale gezüchtet werden und die Anzahl der an jede Zielzelle gebundenen Mikrobläschen direkt gezählt werden kann.
Ergebnisse
Kovalente Kopplung von Peptid und Lipid
Der Reaktionsabschluss und die gewünschte Produktbildung wurden durch TLC bestätigt. Eine separate, nicht umgesetzte Peptidkontrolle bewegte sich während der TLC nicht nach oben: Sie wurde zu Beginn beibehalten und ihr Spot war positiv für die primäre Aminogruppe, wie nach dem Ninhydrin-Spray beim Erhitzen beobachtet wurde. Dieser Ninhydrin-positive freie Peptidfleck wurde in dem Gemisch nach Abschluss der Reaktion, nach TLC der Reaktionsgemischprobe, nach Entfernung von DIPEA, DMSO und erneuter Auflösung in Chloroform nicht mehr beobachtet. Was die entscheidende Frage der Qualität des NHS-Ester-Reagenzes betrifft, so zeigt Abbildung 1 die spektrophotometrische Spur der Hydrolysekinetik, wobei der Nullpunkt zu Beginn der Reaktion der Zeitpunkt ist, an dem der NHS-Ester in einem organischen Lösungsmittel zur Küvette hinzugefügt wurde. Dies bestätigt die Funktionalität des NHS-Wirkstoffesters von Carboxy-PEG-DSPE (siehe Methoden Abschnitt 1). Zum Nullzeitpunkt stellt das extrapolierte A260=0,33 das Material dar, das bereits vor der Prüfung hydrolysiert wurde. Nach Abschluss der Hydrolysereaktion, länger als 10-15 min, ist A260 = 1,54 (wenn die Absorption nicht mehr wesentlich zunimmt). Dies bestätigt das Vorhandensein von aktivem Ester. Es liefert auch quantitative Daten, dass über 78% des Materials nicht vorhydrolysiertes NHS ist und somit erfolgreich für die Peptidkopplung verwendet werden kann, wenn die Reagenzmenge richtig eingestellt wird.
Aufbereitung und Transfer von Lipidmaterial aus dem wässrigen Medium auf die Blasenhülle: Fluoreszenzlipid
Die Mikrobläschen für diese Studie wurden so präpariert, dass sie Spuren (unter 1%) des Fluoreszenzfarbstoffs DiI mit charakteristischer roter Fluoreszenz enthalten, der als Lösung in PG zur Kochsalzlösung von DSPC und PEG-Stearat hinzugefügt wurde. Die resultierenden Mikrobläschen zeigen deutlich die Schalenfluoreszenz, wenn Grünlichtanregung und rote Emissionsfilter im Mikroskop verwendet werden (siehe Abbildung 2, links). Die Hellfeldmikroskopie der Mikroblasengasphase (Abbildung 2, rechts) kann mit der Fluoreszenz der Mikroblasenhülle verglichen werden. Für die quantitative Beurteilung des Lipidmaterialtransfers von der wässrigen Phase zur Blasenhülle wurden Mikrobläschen mittels Zentrifugation schweben gelassen und das Fluoreszenzsignal der klaren infranatanten Phase mit der Fluoreszenz der Ausgangslösung vor der Mikroblasenamalgamierung verglichen. Es wurde eine Signalreduktion um fast eine Größenordnung beobachtet (Abbildung 3), d.h. über 85% des Lipidmaterials wurden durch Amalgamierung in die Mikroblasenhülle übertragen.
Aufbereitung und Korrektur der Größenverteilung von Mikrobläschen
Mikrobläschen, die durch Amalgamierung erzeugt wurden, wiesen eine typische Größenverteilung mit hoher Konzentration auf (z. B. ~4,8 x 109 Partikel pro mL für biotinylierte Blasen). Die Größenverteilung war groß, wobei die Partikel innerhalb des gemessenen Bereichs (zwischen 1 und 30 μm) vorhanden waren; ~6,3 % Mikrobläschen haben einen Durchmesser von mehr als 5 μm (Abbildung 4, grüne Kurve). Die intravaskuläre Verabreichung von großen Mikrobläschen kann zu deren unspezifischer Anreicherung in den Blutkapillaren führen und sollte vermieden werden. Eine kurze (15-17 min) Flotation des umgedrehten Flotators in normaler Schwerkraft mit anschließender Sammlung von 0,3 mL in der Nähe der Septumoberfläche ermöglicht die vollständige Entfernung größerer Mikrobläschen mit einem geringen Verlust in der Gesamtpartikelanzahlkonzentration bis zu ~4,6 x 109: Nach der Flotation haben nur 0,01 % der Partikel in der gereinigten Probe einen Durchmesser von mehr als 5 μm (Abbildung 4, rote Kurve).
Adhäsion von Mikrobläschen an rezeptorbeschichteter Oberfläche: statischer Assay
Dieses Verfahren wurde erstmals im vorigen Jahrhundertbeschrieben 1 und wird als Schnelltest zur Bestätigung der Funktionalität von gezielten Mikrobläschen verwendet. Mikrobläschen werden zugelassen, um mit der rezeptortragenden Oberfläche der Schale in Kontakt zu kommen. Wenn die Liganden-Rezeptor-Interaktion stattfindet, können Blasen trotz der starken Waschung auf der Oberfläche zurückbleiben. Ein Beispiel für einen solchen Schnelltest der funktionellen Adhäsion von c(RGDfK)-Mikrobläschen auf der mit rekombinantem αvβ 3 beschichteten Oberfläche wird vorgestellt. Abbildung 5 ist ein repräsentatives Hellfeldmikroskopie-Bild von anhaftenden Mikrobläschen auf der Rezeptoroberfläche in einer Petrischale, nachdem sie mit PBS gewaschen wurde, um ungebundene Blasen zu entfernen. Blasen in dieser Art der Mikroskopie zeigen sich als dunkle kreisförmige Muster. Wenn die Oberfläche in ähnlichem Zustand nur mit Albumin beschichtet ist (um unspezifische Adhäsion zu blockieren), haften die Mikrobläschen nicht an und werden auch durch das sanfte Spülen leicht weggewaschen.
Bindung von Mikrobläschen aus dem strömenden Medium: parallele Plattenströmungskammer
Dieses Verfahren wurde ursprünglich als Werkzeug für die Untersuchung der Zelladhäsion in einer kontrollierten Flusseinstellung vorgeschlagen15 und Jahrzehnte später für die Untersuchung des Mikroblasen-Targetings angepasst11. Die Prüfung in einem Durchflusssystem ist im Gegensatz zu einem statischen Assay für ein klinisches Bildgebungsszenario viel realistischer, da zirkulierende Blasen in einem Blutfluss kurz die Gefäßwand berühren und an ihr haften können, wenn der Zielrezeptor vorhanden ist. Es werden zwei Beispiele für solche Studien vorgestellt. Das erste Beispiel ist ein traditionellerer Ansatz, bei dem die Adhäsion von peptiddekorierten Mikrobläschen an der rezeptorbeschichteten Oberfläche durch Videomikroskopie überwacht wird. Die Mikroskopie ermöglicht es, anhaftende Mikrobläschen von den fließenden zu unterscheiden. Es ermöglicht auch die Quantifizierung der anhaftenden Mikrobläschen im Mikroskop-Bildgebungsrahmen: Im Vergleich zur Kontrolle, bei der das c(RADfK)-Peptid verwendet wird oder wenn die Oberfläche nur mit BSA beschichtet ist, haften viel mehr c(RGDfK)-Mikrobläschen (linke Spalte) an der Oberfläche (Abbildung 6).
Das zweite Beispiel ist die Kontrastultraschallbildgebung der mit Streptavidin beschichteten Petrischale (Abbildung 7, rechte Seite), an der biotinylierte Mikrobläschen erfolgreich aus dem strömenden Medium adsorbieren und durch Kontrastultraschallbildgebung nach einer Spülung mit PBS nachgewiesen werden können. Die Oberfläche der Bedienschale hält keine anhaftenden Mikrobläschen aus der Strömung zurück, so dass bei der PBS-Strömung im Wesentlichen alle Ultraschallkontrastsignale entfernt werden. Die Quantifizierung des Ultraschallkontrastsignals zeigt eine starke statistische Signifikanz des beobachteten Unterschieds; Das Verhältnis von Soll- und Steuersignal überschritt eine Größenordnung.
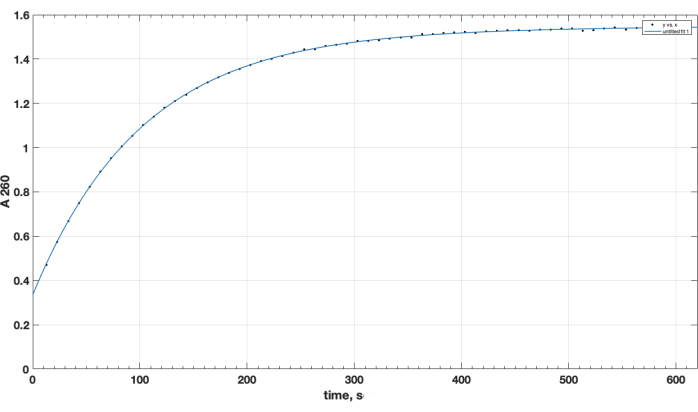
Abbildung 1. Kinetik der Hydrolyse von NHS-PEG-DSPE Aktivester, beobachtet durch NHS-Freisetzung in alkalischem Medium durch spektrophotometrische Tests bei 260 nm Wellenlänge. Der Nullpunkt ist der Zeitpunkt der Zugabe von NHS-PEG-DSPE in organischem Lösungsmittel zum 0,1 M Boratpuffer, pH 9,2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Mikroskopie von gasgefüllten Mikrobläschen nach der Verschmelzung. Links, Fluoreszenzmikroskopie (grüne Anregung, rote Emission, DiI-Lipidschalenfarbstoff). Rechts, Hellfeldmikroskopie (Gasphasenbeobachtung), gleiche Vergrößerung. Rahmenbreite, 85 μm (10 μm Tischmikrometer, eingebettet unten rechts in jedem Bild). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
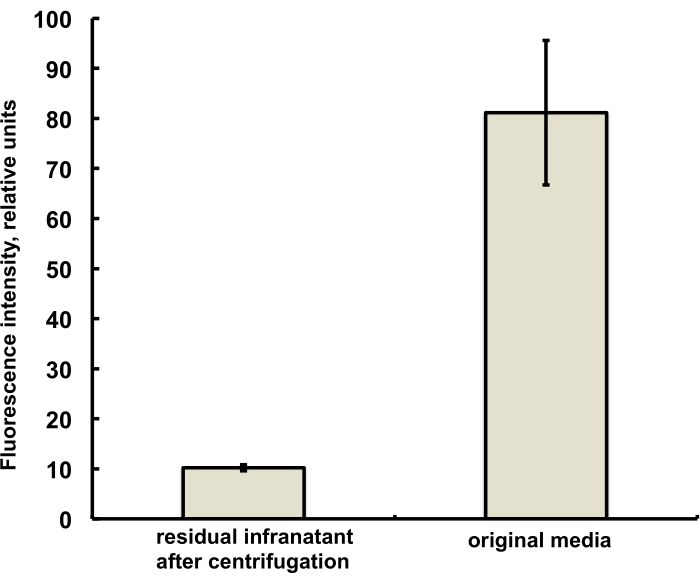
Abbildung 3. Fluoreszenzspektroskopie einer DiI-Lipidfarbstoffprobe aus dem Mikrobläschenvorbereitungsmedium vor der Amalgamierung (rechts) und nach der Verschmelzung und Entfernung der Mikrobläschen durch Zentrifugalflotation (links). Fluoreszenzanregung - 555 nm, Emission - 620 nm. Die Daten werden als mittlere ± Standardabweichung dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Partikelgrößenverteilung der Anzahlkonzentration von Mikrobläschen nach der Amalgamierungsvorbereitung (grün), mit anschließender Flotation mit normaler Schwerkraft zur Entfernung großer Mikrobläschen (rot) und reiner Verdünner-Hintergrundzählung (blau). Elektrozonenmessung zur Partikelzählung in normaler Kochsalzlösung, 50 μm Blende. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5. Hellfeldmikroskopie von c(RGDfK)-Mikrobläschen auf einer mit αvβ 3 beschichteten Schale. Die Bildbreite beträgt 106 μm, die Balkenbreite 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
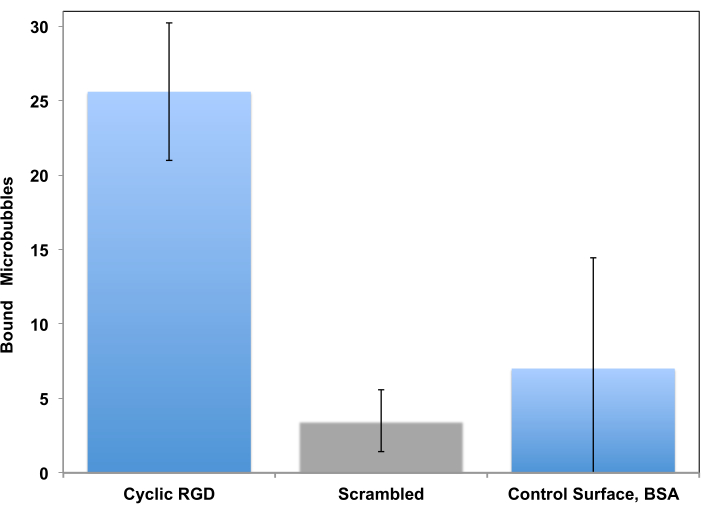
Abbildung 6. In vitro parallele Plattenströmungskammer, die auf die mit rekombinantem α v β beschichtete Oberfläche von Peptid-dekorierten Mikrobläschen abzielt 3. cRGDfK-dekorierte Mikrobläschen hafteten effizient an der Schale (links), die Bindung von nicht zielgerichteten cRADfK-Mikrobläschen (Rührei, Mitte) war minimal (p<0,00005), ebenso wie die Mikroblasenretention an der reinen Albumin-Kontrolloberfläche (rechts, S<0,0025). Scherspannung der Kammerströmungswand bei 1 dyn/cm2. Überwachung der Mikroblasenadhäsion durch Videomikroskopie; Die Anzahl der Partikel im Sichtfeld wird angezeigt. Die Akkumulationszeit beträgt 4 Minuten. Die Daten werden als mittlere ± Standardabweichung dargestellt. Nachdruck mit Genehmigung von5. Urheberrecht, 2018, Amerikanische Chemische Gesellschaft. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
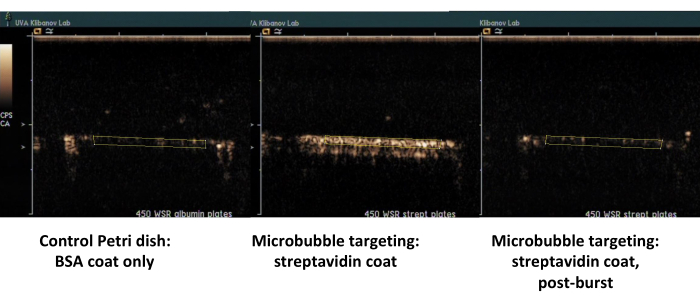
Abbildung 7. Kontrastultraschallbildgebung einer parallelen Plattenströmungskammer nach gezielter Adhäsion und Pufferspülung von biotinylierten Mikrobläschen auf der mit Streptavidin beschichteten Schale (Mitte, anhaftende gezielte Mikrobläschen, rechts, dieselbe Schale, nach einem Ultraschallstoß mit hohem MI) und einer Kontrollschale, die nur mit Albumin beschichtet ist (links). Zwei Minuten Perfusion der Mikroblasendispersion (PBS/BSA, 106 Partikel/ml) bei einer Scherrate von 450 s-1 , gefolgt von einer Pufferspülung. Die Quantifizierung des Ultraschallsignals erfolgt aus den interessierenden Bereichen in den Videobildern nach der Hintergrundsubtraktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Bedeutung einer einfachen Technik zur Herstellung von ligandendekorierten Mikrobläschen liegt auf der Hand. Die Verwendung der Amalgamierungstechnik zur Herstellung von Mikroblasen, wie sie von Unger et al.16 entwickelt wurde, kann diesem Zweck aus einer Reihe von Gründen dienen. Die Herstellung von Mikrobläschen mit dem Amalgamator ist einfach durchzuführen. Ein einphasiges 120-V-Desktop-Gerät mit geringem Platzbedarf ist verfügbar und kostengünstig. Das Verfahren ist schnell (45 Sekunden) und effizient: 1 ml Mikroblasendispersion in einem wässrigen Medium wird sofort hergestellt. Es enthält Milliarden von Partikeln pro ml, mehr als ausreichend für Forschungsstudien. Die Herstellung erfolgt in einem versiegelten Fläschchen mit perfluoriertem Gas-Headspace. Falls erforderlich, bleibt der Inhalt der Fläschchen ab dem Zeitpunkt der aseptischen Abfüllung, während der Herstellung (Amalgamierung) und bis zur Verwendung steril. Damit ist der Ansatz für den klinischen Einsatz relevant, da er keine aufwendigen Präparationen in einer speziellen sterilen Umgebung in der Klinik erfordert.
Das Verfahren basiert auf der Selbstorganisation: Während des Mischens werden kleine Gasfragmente gebildet, die durch die Einwirkung der Oberflächenspannung eine kugelförmige Form annehmen, da eine hohe Scherung auf die Gas-Wasser-Grenzfläche innerhalb des sich bewegenden Fläschchens ausgeübt wird. PG als Cotensid, das in hoher Konzentration im Medium vorhanden ist, reduziert die Oberflächenspannung und die Energie, die zur Erzeugung einer Gas-Wasser-Grenzfläche während der Scherung erforderlich sind. Als nächstes gelangen "klassischere" Tenside wie PEG-Lipide und Phospholipide, die in viel niedrigeren Konzentrationen vorliegen, an die Grenzfläche, wodurch höchstwahrscheinlich PG verdrängt und eine monomolekulare Schicht an der Blasenoberfläche entsteht. Diese Schale ist einigermaßen stabil; Dies ist wahrscheinlich auf eine Kombination aus einem "festen" Lipid (die DSPC-Phasenübergangstemperatur beträgt 56 °C, daher ist es nicht anfällig für Intermembranfusion) und einer ausgedehnten PEG-Bürstenschicht zurückzuführen, die die Mikrobläschen umgibt und den direkten Monolayer-Kontakt benachbarter Blasen verhindert. Man kann spekulieren, dass das Vorhandensein einer hohen PG-Konzentration in den Medien die Stabilität der Mikroblasenhülle verringern kann. In Abwesenheit dieser Mikrobläschen sind in den versiegelten Fläschchen unter Fluorkohlenstoffatmosphäre viele Monate lang stabil, mit nur mäßiger Fusion zwischen den Blasen. Für den klinischen Einsatz, mit einem kleinen Amalgamator am Krankenbett, kann das Intervall zwischen der Vorbereitung der Mikroblase und der Verwendung kurz, Minuten oder Stunden betragen. Wenn PG in den Medien vorhanden ist, zeigt die Konzentration der Mikroblasen keinen signifikanten Abfall, zumindest nicht für mehrere Stunden gekühlter Lagerung.
Ein zusätzlicher Vorteil des beschriebenen Verfahrens (unterstützt durch die Verwendung von PG-Cotensid im Blasenvorbereitungsmedium) ist die hohe Wirksamkeit (>85%) des Lipidtransfers in die Hülle, während die traditionelle Beschallung eine Wirksamkeit von ~20%5 und moderne mikrofluidische Methoden sogar eine niedrigere Wirksamkeit von17 bietet. Ein hohes Maß an Transfereffizienz ist nicht nur wichtig, weil die Verschwendung von Lipidmaterial und teuren Liganden reduziert wird, sondern auch, weil die Menge an blasenfreiem Liganden, die in den Medien gleichzeitig vorhanden sind, minimiert wird. Dann hat der freie Ligand möglicherweise keine Möglichkeit, den Biomarker-Zielrezeptor zu blockieren, an den die Mikrobläschen über einen Liganden auf ihrer Oberfläche binden sollen. Die allgemeine Menge des Biomarker-Rezeptors auf dem Zielgefäßsystem ist oft recht hoch, so dass dies möglicherweise nicht von größter Bedeutung ist. Aus der verfügbaren Patentliteratur18 könnte man vermuten, dass mindestens 50 % des Lipidschalenmaterials und des Zielliganden in den Mikroblasenformulierungen in klinischen Tests mit der Blasenhülle assoziiert sein könnten. Dies kann im Allgemeinen mit radioaktiv markierten Antikörpern oder Peptiden verglichen werden, die in nuklearmedizinischen Rezeptor-Bildgebungsstudien weit verbreitet sind: Die meisten von denen, die auf Ligandenmoleküle abzielen, tragen tatsächlich kein "heißes" Radioisotop, selbst für die höchste spezifische Aktivität, die berichtet wurde19, während bei gezielten Mikrobläschen das Schalenmaterial in dieser Studie (einschließlich Liganden-Lipid) hauptsächlich an Mikrobläschen gebunden ist.
Die selektive Adhäsion von gezielten Mikrobläschen, die mit dieser Technik in vitro hergestellt wurden, wurde in zwei Gruppen von Targeting-Modellen demonstriert: statische Adhäsion und ein Experiment zum Targeting in der Durchflusskammer. In einem statischen Assay hafteten die gezielten Mikrobläschen fest an der Zielrezeptorschicht und wurden mit der Pufferspülung nicht entfernt, im Gegensatz zu einer Kontrollumgebung, bei der Mikrobläschen auch bei einer sanften Spülung von der Oberfläche entfernt wurden. Ebenso zeigten biotinylierte Blasen in einem Durchflusstest, der in einer parallelen Plattenströmungskammer durchgeführt wurde, eine statistisch signifikante und hervorragende Haftung an der Streptavidin-Schicht auf einer Polystyrolschale im Vergleich zur reinen Albumin-Oberfläche der Kontrolle. Peptid-c(RGDfK)-dekorierte Mikrobläschen hafteten selektiv an αvβ3-beschichtete Oberfläche, sowohl im statischen Adhäsionsassay als auch in einer parallelen Plattendurchflusskammer.
Die folgenden Punkte können als Einschränkungen des beschriebenen Protokolls betrachtet werden. Erstens berücksichtigt das Verfahren die Submikron-Partikel nicht. Das Instrument, das in der Studie verwendet wurde, war nicht für den Nachweis von Nanoblasen (d. h. Partikeln mit einem Durchmesser von weniger als 1 μm) ausgelegt. Diese Partikel könnten in der Formulierung vorhanden gewesen sein. Obwohl allgemein bekannt ist, dass ihr akustisches Rückstreusignal gering ist und sie in dieser Studie nicht mikroskopisch beobachtet wurden, sollte das Vorhandensein von Nanoblasen dennoch in Betracht gezogen werden. Das zweite wichtige Problem ist die Größenheterogenität der Mikrobläschen. Trotz der Entfernung größerer Partikel ist die Größe der resultierenden Blasen alles andere als gleichmäßig. Dies sollte eine Überlegung und Rechtfertigung für weitere Forschungen auf dem Gebiet der Mikroblasenformulierung sein.
Zusammenfassend lässt sich sagen, dass die in diesem Manuskript gegebene Erzählung einen ausreichenden technischen Detaillierungsgrad bieten sollte, um zielgerichtete Mikrobläschen schnell und einfach herzustellen. Die Schritte zur Durchführung einer zusätzlichen Reinigung (falls wünschenswert), zur Anpassung der Größe und/oder zur Beurteilung der geringen Menge des Schalenmaterials, die im wässrigen Medium verbleibt, sind vorgesehen. Die detaillierten analytischen Werkzeuge zur Beurteilung der Mikroblasenparameter, wie Größenverteilung und Konzentration, sowie die in vitro Fähigkeit ligandendekorierter Mikrobläschen, an Zielrezeptoren zu adhäsieren, werden beschrieben.
Offenlegungen
A. Klibanov ist Mitbegründer und Minderheitsaktionär von Targeson Inc., einem Startup im Bereich präklinischer zielgerichteter Mikrobläschen, das inzwischen aufgelöst wurde. Sein UVA-Labor hat einen Unterauftrag über NIH R44 HL139241 von SoundPipe Therapeutics.
Danksagungen
A.L. Klibanov dankt für die teilweise Unterstützung durch NIH R01EB023055, die vom National Institute of Biomedical Imaging and Bioengineering der National Institutes of Health vergeben wurde, einen Unterauftrag an die University of Virginia über NIH R01NS076726, der vom National Institute of Neurological Disorders and Stroke der National Institutes of Health an die UCSF vergeben wurde, und einen Unterauftrag an die University of Virginia über NIH Grant R44HL139241, verliehen an SoundPipe Therapeutics vom National Heart, Lung, and Blood Institute. Der Inhalt dieser Veröffentlichung liegt ausschließlich in der Verantwortung des Autors und gibt nicht unbedingt die offizielle Meinung der National Institutes of Health wieder.
Materialien
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Referenzen
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, Suppl 1 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , US Patent 5,585,112 (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , US Patent 5,686,060A (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten