Method Article
Получение и определение характеристик целевых микропузырьков
В этой статье
Резюме
Целью данного протокола является подготовка, очистка и определение характеристик газонаполненных микропузырьков (целевых контрастных веществ для ультразвуковой молекулярной визуализации). Описаны две системы мишени: биотинилированные пузырьки, адгезивные к стрептавидину, и циклические микропузырьки пептида RGD, которые связываются с αvβ3, известным биомаркером опухолевой неоваскулятуры.
Аннотация
Нацеливание на микропузырьки (ультразвуковые контрастные вещества для молекулярной визуализации) исследуется уже более двух десятилетий. Тем не менее, методы получения микропузырьков и присоединения нацеленного лиганда являются громоздкими, сложными и длительными. Поэтому возникает необходимость в упрощении процедуры таргетного приготовления микропузырьков, чтобы приблизить ее к клинической трансляции. Целью данной публикации является подробное описание и разъяснение этапов, необходимых для целенаправленного получения микропузырьков, определения функциональных характеристик и испытаний. Представлена последовательность оптимизированных и упрощенных процедур для двух систем: модели мишенной пары биотин-стрептавидин и циклического пептида RGD, нацеленного на рекомбинантный белок αvβ3 , который сверхэкспрессируется на эндотелиальной выстилке опухолевой неоваскулятуры.
Здесь мы показываем следующее: ковалентное связывание лиганда-мишени с липидным якорем, оценку качества реагента и тесты, подтверждающие успешное завершение реакции; получение водной среды-предшественника, содержащей компоненты оболочки микропузырьков, с последующим получением микропузырьков путем амальгамирования; оценка эффективности переноса липидов на оболочку микропузырькового стабилизатора; регулировка распределения микропузырьков по размерам путем флотации при нормальной силе тяжести для удаления более крупных микропузырьков, которые могут быть вредны для использования in vivo; оценка распределения микропузырьков по размерам с помощью электрозонного зонозонирования; оценка целевого связывания микропузырьков с поверхностью, покрытой рецептором, в тесте статического связывания (в перевернутой чашке); и оценка целенаправленного связывания микропузырьков с поверхностью, покрытой рецептором, в испытании в камере параллельного проточного потока.
Введение
Молекулярная визуализация с помощью целевых микропузырьков исследуется и тестируется уже более двух десятилетий. Общая концепция проста: заполненные газом микропузырьки, обладающие избирательным сродством к молекулярному биомаркеру, специфичному для эндотелия сосудов в области заболевания, вводятся внутривенно. Эти частицы циркулируют и накапливаются в мишени (например, в опухолевой неоваскулятуре или в области ишемического воспалительного поражения). Затем адгезивные микропузырьки обнаруживаются с помощью контрастной ультразвуковой визуализации. Ранние концептуальные исследования прошлого века 1,2 в настоящее время постепенно продвигаются к клиническому внедрению: всего несколько лет назад они достигли стадии среднемасштабных клинических испытаний 3,4. Целью данной рукописи является подробное объяснение получения и характеристики таких целевых микропузырьков на основе двух опубликованных примеров 1,5.
Процедура получения пептида-ПЭГ-фосфолипида, ключевого компонента для формирования этих целевых микропузырьков, дополнена описанием контроля качества реагента, необходимого для успешного завершения реакции. К сожалению, некоторые поставщики активных эфирных липидных реагентов поставляют материал, который гидролизуется по прибытии и поэтому не может участвовать в образовании амидной связи. Приведена информация о том, сколько липидного материала переносится на оболочку микропузырьков из водной среды при подготовке микропузырьков, а также о способе получения этой информации.
Важно готовить микропузырьки с относительно узким распределением частиц по размерам: одновременное присутствие крупных микропузырьков в вводимых средах для внутрисосудистого тестирования in vivo может привести к закупорке микроциркуляторного русла; Неспецифическое накопление микропузырьков, которые обходят легочные шунты, может вызвать неспецифическое ложноположительное улучшение тканей6, которого можно избежать путем удаления микропузырьков большего размера. В связи с этим представлена простая процедура выбора размера частиц, дополненная описанием метода оценки концентрации и распределения частиц по размерам с помощью счетчика частиц.
Первый протокол испытаний для оценки нацеливания микропузырьков, представленный ниже, описывает чисто модельную систему с биотинилированными микропузырьками, нацеленными на покрытую стрептавидином поверхность1. Второй протокол основан на рукописи, описывающей упрощенное получение пептид-таргетных микропузырьков, украшенных циклическим пептидом RGD, обладающим специфическим сродством к αvβ3, молекулярному биомаркеру опухолевой неоваскулятуры5. Показано, что микропузырьки, декорированные этим цикло[Arg-Gly-Asp-D-Phe-Lys], т.е. пептидом c(RGDfK) с помощью представленной методики, нацелены на неоваскуляторное русло опухоли и обеспечивают ультразвуковую молекулярную визуализацию в модели опухоли мыши.
протокол
1. Ковалентное связывание пептида с NHS-PEG-DSPE
- Растворите пептид c(RGDfK) с первичной ε-аминогруппой лизина, незащищенной и доступной для связывания, в диметилсульфоксиде (ДМСО, 10 мг/мл). Приготовьте метанол или хлороформ раствор N-гидроксисукцинимидного эфира поли(этиленгликоля)-3400-дистеароилфосфатидилэтаноламинана (NHS-PEG-DSPE, 200 мг/мл) и добавьте к 1 мг пептида в ДМСО. Добавьте 3 мкл N,N-диизопропилэтиламина (DIPEA).
- Поддерживайте молярное соотношение пептидов и NHS-PEG-DSPE не менее 1:1,2, чтобы все первичные аминогруппы могли реагировать. Поддерживайте молярное соотношение DIPEA:пептид не менее 2:1 для обеспечения основных условий среды.
ВНИМАНИЕ: Хлороформ, метанол и DIPEA являются опасными материалами. Используйте надлежащую защиту, такую как перчатки, лабораторный халат, очки и вытяжной шкаф.
Примечание: Любой другой пептид или миметик с первичной аминогруппой может быть использован вместо c(RGDfK), с незащищенным N-концом или лизином, расположенным вне сайта связывания. Для того чтобы реакция протекала, все компоненты (т.е. целевой лиганд и липид) должны быть растворимы в смеси ДМСО и хлороформа. Также могут быть испытаны альтернативные растворители, такие как диметилформамид или его смеси. Реакция в водных средах также возможна, но выход соединения будет значительно ниже из-за быстрого гидролиза активного эфира.
- Поддерживайте молярное соотношение пептидов и NHS-PEG-DSPE не менее 1:1,2, чтобы все первичные аминогруппы могли реагировать. Поддерживайте молярное соотношение DIPEA:пептид не менее 2:1 для обеспечения основных условий среды.
- После ночной инкубации при комнатной температуре удалите летучий органический материал путем выпаривания (используйте поток газообразного азота или роторный испаритель с последующим ночным выпариванием под высоковакуумным насосом для удаления ДМСО). Растворите нелетучий остаток в хлороформе в концентрации 1 мг/мл для контролируемого отбора проб.
- Подтвердить завершение реакции с помощью тонкослойной хроматографии (разработать ТСХ-планшеты в среде растворителя хлороформ:метанол, 2:1 об./об.). Подтвердите наличие или отсутствие первичной аминогруппы с помощью спрея нингидрина при нагревании пластины на нагревательном блоке при температуре 150 °С.
ВНИМАНИЕ: Нингидрин является опасным веществом. Используйте надлежащую защиту, как описано выше. Обработка нагревательных блоков пластин TLC должна выполняться в вытяжном шкафу. Нагревательный блок представляет потенциальную опасность возгорания. - Перед получением микропузырьков аликвотируют образец пептида-PEG-DSPE из хлороформа (например, 1 мл раствора 1 мг/мл), выпаривают хлороформ до сухости в потоке газообразного азота с последующей инкубацией высоковакуумным насосом и добавляют физиологический раствор до 1 мг/мл для получения прозрачного мицеллярного раствора.
- Если желательна дальнейшая очистка реакционной смеси, растворите ее в обычном физрастворе. Затем подвергнуть полученную мицеллярную смесь диализу (отсечка молекулярной массы 6-8 кДа или аналогичная) сначала против нормального физиологического раствора, а затем против нескольких замен деионизированной воды.
- Подтвердите завершение диализа проверкой проводимости диализата. Извлеките диализованный материал из диализного пакета, поместите во флакон с известной массой и лиофилизируйте до полной сухости.
Примечание: Доступна альтернативная ковалентная реакция на присоединение лиганда к концу PEG-липида (например, реакция малеимида-PEG-DSPE с тиол-лигандом). Основным преимуществом такого подхода является ориентированная связь, если на молекуле лиганда 7 имеется один тиол. Основная проблема заключается в долгосрочной стабильности: результирующая связь между малеимидом и тиолом может быть склонна к деградации в результате ретро-Михаэля, в зависимости от условий хранения.
ПРИМЕЧАНИЕ: Качество реагентов на основе активного эфира сильно различается у разных производителей: оно может зависеть от условий передачи и хранения (если материал не хранится или не транспортируется должным образом, активный эфир гидролизуется и не сможет соединиться с пептидом). Следовательно, возникает чувство долга описать процедуру (см. ниже) для определения степени деградации NHS-PEG-DSPE, реагента для ковалентного присоединения целевых лигандов к микропузырькам. NHS-PEG-DSPE, поставляемый в виде сухого порошка под аргоном, хранится в глубокой заморозке. Флакон доводят до комнатной температуры (во избежание конденсации влаги), образец взвешивают с помощью аналитических весов и растворяют в метаноле или ДМСО. Флакон с объемным сухим реагентом следует закрыть под аргоном и вернуть в глубокую заморозку, в герметичную емкость с влагопоглотителем, до дальнейшего использования. - Готовят водный мицеллярный раствор пептида-ПЭГ-ДСПЭ (Шаг 1.4), а также биотина-ПЭГ-ДСПЭ, путем простого добавления сухого реагента в водный раствор и инкубации. Образуются небольшие шарообразные мицеллы. Для ускорения перевода реагента из объемного состояния в мицеллярную форму можно применять ультразвуковую обработку и ванну с горячей водой.
- Оцените качество реагента активного эфира NHS-PEG-DSPE.
- Убедитесь, что NHS, присутствующий в реагенте, находится в форме активного эфира, чтобы иметь возможность проводить реакцию связывания с образованием амидных связей.
- Поместите 0,99 мл 0,1 М буфера тетрабората натрия, pH 9,2, в кварцевую или ультрафиолетово-прозрачную пластиковую кювету (не стекло) в спектрофотометре, и ноль на длине волны 260 нм.
- Добавьте в кювету 10 мкл свежеприготовленного раствора NHS-PEG-DSPE в метаноле с концентрацией 200 мг/мл. В это же время запустите секундомер. Быстро и энергично перемешайте содержимое кюветы для достижения однородности. Поместите кювету в фотометр, закройте крышку и начните измерение.
- В начале измерения спектрофотометром отметьте время начала записи и непрерывно выполняйте фотометрические измерения поглощения на длине волны 260 нм каждые 10 с в течение ~10 мин или до стабилизации значения поглощения.
- Постройте кинетическую кривую, проверьте начальные временные точки A260 и экстраполируйте кривую на время начала реакции (т. е. найдите A260 в точке, где реагент был добавлен в водный буфер и началась реакция гидролиза). Предположим, что до добавления NHS-PEG-DSPE в буфер в кювете не происходил гидролиз в органическом растворителе из-за недостатка воды.
- Рассчитать соотношение между A260 в начале реакции и в конце гидролиза; Он представляет собой долю разложившегося активного эфира. Используйте эту информацию для выбора подходящего количества NHS-PEG-DSPE для полной модификации первичной аминогруппы пептида.
2. Получение микропузырьков методом амальгамации
- Приготовление биотинилированных микропузырьков
- Совместное растворение дистеароилфосфатидилхолина (ДСПК) и стеарата ПЭГ в пропиленгликоле (ПГ, концентрация 10 мг/мл для каждого в чистом растворителе). Используйте ванну с горячей водой для растворения материалов.
- Добавьте 0,1 мл этого горячего раствора ПГ во флакон, содержащий 0,85 мл горячего нормального физиологического раствора, быстро перемешайте и добавьте мицеллярный биотин-PEG-DSPE (50 μл, 1 мг/мл в физрастворе) в соотношении 1:20 по массе к DSPC.
ПРИМЕЧАНИЕ: Растворимость липидных компонентов в ПГ зависит от температуры, поэтому необходима ванна с горячей водой. Перед добавлением липидов стеклянный флакон с физиологическим раствором полезно нагреть на водяной бане, чтобы создать однородную среду без видимых частиц. - Доведите флакон до комнатной температуры, наденьте на флакон, вставленный наполовину, резиновую пробку и вставьте в флакон капиллярную трубку из ПТФЭ. Используйте поток газообразного декафторбутана для наполнения флакона, а затем закройте пробку, удаляя при этом капилляр.
ПРИМЕЧАНИЕ: Температура флакона во время амальгамации может оказывать существенное влияние на распределение по размерам образующихся микропузырьков 9. - Сожмите пробку флакон при комнатной температуре и поместите в амальгаматор. Запустите амальгаматор. Используемый клинический блок предварительно настроен на работу со скоростью 4300 об/мин в течение 45 секунд.
- Когда амальгамация будет завершена, извлеките флакон с образовавшимися микропузырьками из амальгаматора. Желательно охарактеризовать распределение микропузырьков по размерам и составу и использовать их в течение нескольких часов после приготовления.
- Приготовление микропузырьков, декорированных пептидами
- Растворите стеарат DSPC и PEG в чистом PG (концентрация 10 мг/мл для каждого материала). Используйте ванну с горячей водой для растворения. Добавьте 0,1 мл этого горячего раствора в ПГ во флакон, содержащий 0,85 мл горячего нормального физиологического раствора, быстро перемешайте и добавьте мицеллярный пептид-PEG-DSPE (50 мкл, 1 мг/мл в физрастворе), добавленный в соотношении 1:20 по массе, к DSPC.
- Доведите флакон до комнатной температуры, поместите резиновую пробку поверх флакона, вставленного наполовину, и вставьте в флакон капиллярную трубку из политетрафторэтилена (ПТФЭ). Используйте поток газообразного декафторбутана для наполнения флакона, а затем закройте пробку, удаляя при этом капилляр.
- Сожмите флакон с пробкой и поместите в амальгаматор для перемешивания. Флакон с дисперсией микропузырьков готов через 45 с.
- Приготовление липидных микропузырьков красителя для оценки переноса липидов в оболочку микропузырьков
- Растворите стеарат DSPC и PEG в чистом PG, как описано выше (используйте ванну с горячей водой) (концентрация 10 мг/мл для каждого материала).
- Добавьте 0,1 мл этого горячего раствора ПГ во флакон с 0,89 мл горячего физиологического раствора, быстро перемешайте, добавьте 10 мкл раствора красителя DiI (1 мг/мл в чистом ПГ) и перемешайте. Доведите флакон до комнатной температуры.
- Заполните пространство флакона газообразным декафторбутаном, как указано выше, закройте флакон крышкой, обжмите и амальгамат, как описано выше.
3. Тест переноса липидов DiI из мицеллярной водной среды в оболочку пузырьков
- Для подтверждения с помощью микроскопии того, что флуоресцентный липидный материал перешел из водной среды в оболочку микропузырьков, с помощью инсулинового шприца необходимо взять образец микропузырьков из флакона через перегородку.
- Затем добавьте каплю на предметное стекло и накройте ее стандартным покровным стеклом. Сначала разведите его с каплей дегазированного физиологического раствора.
- Проводите микроскопию с помощью видеомикроскопа, оснащенного флуоресцентным эпиолюминатором, 100-кратным масляным объективом и высокочувствительной видеокамерой.
- Чтобы определить эффективность переноса липидного материала из водной солевой среды/ПГ в оболочку пузырьков при амальгамировании, возьмите герметичный флакон с микропузырьками, переверните его и поместите в коническую пробирку объемом 50 мл.
- Выполнить центрифугирование в роторе ведра (10 мин, 200 х г). Извлеките флакон из центрифуги и держите его в перевернутом положении.
- Введите иглу инсулинового шприца в перегородку перевернутого флакона. Медленно отсасывайте небольшой объем (~50 μл) прозрачного инфранатанта.
ПРИМЕЧАНИЕ: Скошенный кончик иглы для аспирации инфранатанта из перевернутого флакона после центрифугирования должен быть расположен как можно ближе к перегородке, чтобы свести к минимуму вероятность попадания микропузырьков.
- Поместите образцы инфранатанта (2 мкл), а также образцы исходной липид-ПГ-солевой среды, которая использовалась для получения микропузырьков (2 мкл), в 96-луночный планшет с 0,1 мл фосфатно-солевой буферизованной (PBS):этанол 1:1 с 1% Triton X-100.
- Измерьте красную флуоресценцию красителя DiI (возбуждение 555 нм, излучение 620 нм) с помощью флуоресцентного микропланшетного ридера.
- Используйте черные пластины с непрозрачным дном для флуоресцентной спектроскопии из-за более низкого фона и отсутствия передачи сигнала между лунками, что может стать проблемой для прозрачных пластин.
- Убедитесь, что сигнал флуоресценции находится в пределах линейного калибровочного диапазона: чрезмерная концентрация красителя в скважинах может привести к затуханию света и занижению сигнала.
ПРИМЕЧАНИЕ: Иногда может быть желательно удалить остаточный материал оболочки, который остается в водной среде после амальгамации. Для этого после центрифугирования с микропузырьковой флотацией извлеките весь объем инфранатанта путем медленной аспирации из перевернутого флакона и замените его дегазированным обычным физиологическим раствором. Чтобы избежать чрезмерного изменения давления окружающей среды во флаконе из-за удаления или добавления жидкости, вставьте дополнительную длинную иглу в перегородку, чтобы добраться до газовой фазы внутри флакона. Чтобы сохранить газовую фазу внутри флакона, сначала подсоедините иглу к шприцу, наполненному фторуглеродным газом, чтобы предотвратить контакт воздуха с микропузырьковым препаратом.
4. Регулировка распределения микропузырьков по размерам
- Используйте нормальную гравитационную флотацию в статической перевернутой пробирке для регулировки распределения микропузырьков по размерам, т.е. для быстрого и эффективного удаления самых крупных микропузырьков 5,10.
- Возьмите флакон с микропузырьками сразу после приготовления, как описано в разделе 2. Перевернуть и поставить вверх ногами на устойчивую невибрирующую поверхность на 15-20 минут.
- После этой инкубации введите иглу инсулинового шприца в перегородку флакона, пока она еще перевернута, и аккуратно соберите 300-500 мкл микропузырьков с нижнего слоя.
ПРИМЕЧАНИЕ: Игла шприца должна находиться близко к внутренней поверхности перегородки, чтобы избежать скопления более крупных пузырьков, присутствующих ближе к верху жидкости во флаконе.- Медленно оттяните поршень шприца, чтобы избежать турбулентности и гидростатического расширения пузырьков в корпусе шприца. Когда собранный образец будет извлечен из шприца, избегайте избыточного давления, чтобы предотвратить схлопывание пузырьков.
- Перенесите дисперсию микропузырьков из шприца во флакон небольшого объема. Затем заполнить перфторированным газом, пробкой и обжимом, для кратковременного хранения, подсчета частиц (см. ниже) и дальнейшего использования.
- Если отбор проб выполняется непосредственно из шприца, держите его горизонтально и вращайте, чтобы избежать пузырьковой флотации и добиться однородности пробы.
5. Оценка распределения микропузырьков по размерам
- Используйте счетчик частиц (основанный на датчике электрозоны или принципе светового затемнения) для оценки распределения частиц по размерам и концентрации. В качестве альтернативы можно использовать гемоцитометр и микроскоп.
- Вкратце, добавьте образец микропузырьков аликвоты в обычный физиологический раствор или изотон в противокамере (обычно объем 60-100 мл) и посчитайте. Сравните распределение микропузырьков по размерам до и после флотационной очистки.
ПРИМЕЧАНИЕ: Подвергайте флакон осторожному перемешиванию (не вортексу) непосредственно перед отбором проб, чтобы получить репрезентативные и воспроизводимые измерения. Образец от центра испытуемого объема. - Наполните стакан объемом 100 мл не менее 60 мл 0,9% разбавителя физиологического раствора и поместите его на столик электрозонального посылающего прибора. Поднимите столик так, чтобы трубка, внешняя электродная пластина и мешалка были полностью погружены в разбавитель, а мешалка могла вращаться.
ПРИМЕЧАНИЕ: Объем разбавителя в стакане можно точно определить по его массе, с помощью шкалы (плотность физиологического раствора близка к 1). В качестве альтернативы можно использовать дозирующий насос. Электроды во время исследования электрозонального зонирования должны быть полностью погружены в воду. - Запишите объем электролита разбавителя в программном обеспечении для управления установкой. Счетчик датчиков электрозоны оснащен отверстием 50 мкм, которое позволяет измерять частицы диаметром от 1 до 30 мкм. Сначала выполните фоновый прогон; ожидается, что он будет содержать менее 5000 единиц в 0,5 мл разбавителя в виде холостого растворителя. Лучшие уровни фона могут быть менее 100 счетов.
- Задайте объем пробы в программном обеспечении для управления агрегатом с учетом коэффициента разрежения. Добавьте в стакан 10-20 μл смеси микропузырьков, и выполните второй прогон.
- Используйте данные о распределении размера фона с помощью функции «вычесть фоновый прогон» в программном обеспечении. Получить концентрацию частиц в исходном образце микропузырьков в виде количества частиц/мл; Он включает в себя коэффициент разбавления.
- Наружная поверхность наконечника пипетки также может быть покрыта пузырьками во время отбора проб; Обязательно сотрите его перед тем, как вставить наконечник в счетную среду. Не прикасайтесь к отверстию наконечника пипетки салфеткой.
- Избегайте недостаточного разбавления частиц образца во время подсчета, чтобы свести к минимуму проблемы с коррекцией совпадений, когда в отверстии датчика одновременно находится более одной частицы: в этом случае система может недооценить концентрацию частиц.
ПРИМЕЧАНИЕ: Диаметр отверстия для подсчета частиц может варьироваться. Выбор отверстия 50 мкм позволяет обнаруживать микропузырьки диаметром до 1 мкм, но при этом оно не так подвержено засорению, как варианты меньшего диаметра. - Откалибруйте счетчик датчиков электрозоны для той же разбавляющей тестовой среды (например, стерильно отфильтрованного обычного физиологического раствора для орошения), что и для реальных испытаний. Преимущество лазерного затемнения, являющегося альтернативой зонному зонированию, заключается в том, что не требуется фильтрованный физиологический раствор с контролируемой концентрацией соли и электропроводностью.
- Вкратце, добавьте образец микропузырьков аликвоты в обычный физиологический раствор или изотон в противокамере (обычно объем 60-100 мл) и посчитайте. Сравните распределение микропузырьков по размерам до и после флотационной очистки.
6. Тестирование нацеливания на микропузырьки in vitro в анализе адгезии/ретенции
- Подготовьте поверхность рецептора биомаркера для нацеливания микропузырьков на чашки Петри.
- Возьмем посуду из полистирола диаметром 35 мм, которая будет использоваться в качестве целевой поверхности. Воспользуйтесь преимуществами неспецифической адгезии белков к поверхности полистирольной чашки из обычного физиологического раствора. Используйте модельный белок, стрептавидин, для тестирования нацеливания на биотинилированные пузырьки, которые содержат биотин-PEG-DSPE в качестве части скорлупы.
- Поместите каплю раствора стрептавидина (0,2 мл, 10 мкг/мл в PBS) в центр каждой чашки Петри и накройте ее пластиковым покровным стеклом размером 22 мм x 22 мм, чтобы обеспечить равномерное покрытие поверхности чашки. После ночной инкубации при температуре 4 °C в закрытой влажной среде для предотвращения высыхания посуды снимите покровные стекла.
- Немедленно и всесторонне промойте планшеты водой, PBS, и заблокируйте их инкубацией с 1,5% бычьим сывороточным альбумином (BSA) в PBS в течение не менее 4 ч для минимизации неспецифической адгезии микропузырьков к непокрытой поверхности. В качестве контроля используйте чистые питательные чашки, заблокированные 1,5% BSA.
- В качестве альтернативы вместо стрептавидина можно использовать рекомбинантныйраствор α Vβ3 (например, при концентрации 4 мкг/мл в PBS)5 . Нацеливание микропузырьков на этот биомаркер осуществляется с помощью циклического пептидного лиганда RGD, прикрепленного к оболочке микропузырька.
- Держите чашку с отложенным рецептором мишени влажной: белок рецептора может быть инактивирован, если он высохнет.
ПРИМЕЧАНИЕ: Важно использовать белки-рецепторы, свободные от носителей, которые не содержат белков-носителей или поверхностно-активных веществ в среде - их присутствие будет инактивировать адгезию.
- Адгезия микропузырьков в мелкой капельке: быстро проверьте целевую адгезию в статических условиях.
- Нанесите каплю микропузырьков (5-20 мкл) снизу на целевую поверхность (или контрольную БСА) в перевернутую вверх ногами чашку Петри. Это приведет к тому, что пузырьки будут выведены на поверхность, покрытую рецептором, путем флотации.
- После 5-10 минут инкубации перевернутой посуды во влажной среде переверните чашку обратно в нормальное положение, наполните ее PBS и аккуратно промойте для удаления свободных микропузырьков. Проведите светлопольную микроскопию для оценки целевой адгезии.
- Адгезия микропузырьков к поверхности чашки Петри: выполните нацеливание в полную чашку1.
- Возьмите чашку с рецепторным покрытием поверхности и полностью заполните ее дегазированным буфером PBS-BSA (более 10 мл для чашки 35 мм) так, чтобы мениск буфера выходил за пределы чашки и удерживался капиллярной силой. Введите пузырьки (50 μл) в основную массу буфера и быстро перемешайте для достижения однородности. Избегайте образования пузырьков воздуха во время перемешивания.
- Быстро наденьте на посуду отрезок прозрачной упаковочной ленты или герметизирующей ленты для тарелки с плоской подкладкой. Приложите пленку к чашке под давлением, переверните «узел» и положите его вверх дном на 30 минут, чтобы микропузырьки всплыли вверх, коснулись целевой поверхности и прилипли.
- Переверните герметичную «сборку» чашки обратно в конфигурацию «вниз ногами», снимите пломбу и смойте неприлипшие микропузырьки путем промывки дегазированным буферным раствором. Наблюдайте за целевыми микропузырьками с помощью микроскопии или ультразвуковой визуализации.
ПРИМЕЧАНИЕ: Когда инкубируется перевернутая герметичная чашка, полностью заполненная дисперсией микропузырьков, ее можно разместить под небольшим углом, поэтому при наличии крупных пузырьков они будут плавать к краю чашки, за пределами центральной области интереса. Принудительное промывание с быстрым потоком, исходящим от наконечника микропипетки во время микроскопии, может быть использовано для оценки того, насколько прочно пузырьки прилипают к мишени (пузырьки полностью отделяются от контрольной поверхности даже при медленном потоке) 11. Дегазированный буфер предпочтительнее для разбавления пузырьков, поскольку избыток растворенного воздуха приведет к неконтролируемому росту микропузырьков.
7. Тестовое нацеливание на микропузырьки in vitro: оценка динамических анализов адгезии/удержания в проточной камере с параллельным планшетом
ПРИМЕЧАНИЕ: Мы проверяем адгезию биотинилированных пузырьков к слою стрептавидина с помощью ультразвуковой визуализации.
- Используйте имеющуюся в продаже проточную камеру с параллельными пластинами и специально изготовленным держателем инвертора для наблюдения за целенаправленной адгезией к чашке Петри диаметром 35 мм из проточной среды. После адсорбции целевого белка в чашке (см. 6.1.1) вставьте корпус камеры с предварительно установленной прокладкой в чашку и запечатайте его в держателе. Используйте прокладки с высотой канала (т.е. толщиной прокладки) 0,127 мм и шириной канала 2,5 мм.
ПРИМЕЧАНИЕ: При сборке проточной камеры с параллельными пластинами количество силиконовой смазки, используемой на прокладке, должно быть минимальным. Не допускайте попадания смазки в область канала: избегайте покрытия смазкой поверхности, покрытой белком биомаркера. Чтобы добиться надлежащей герметизации, тщательно выбирайте посуду диаметром 35 мм (информацию о камере и посуде см. в Таблице материалов ). - Во избежание утечки при сборке проточной камеры не завинчивайте крышку и раму, которая удерживает комбинацию посуды и проточной камеры, слишком плотно.
- Подсоединить проточную трубку к шприцевому насосу, работающему в режиме отбора, а со стороны питателя подсоединить тонкую полиэтиленовую трубку (ПЭ50) к флакону с разбавленной дисперсией микропузырьков, подвергнутую постоянному перемешиванию мешалкой через магнитную мешалку12. Контролируйте параметр скорости сдвига стенки (WSR) камеры, регулируя объемный расход насоса на основе формулы 6Q/bh2, где Q — расход, «b» — ширина канала, а «h» — высота канала.
ПРИМЕЧАНИЕ: Удалите пузырьки воздуха из всей системы перед перфузией среды, содержащей микропузырьки, или PBS, так как любой пузырь воздуха, проходящий через канал, вытеснит прилипшие микропузырьки с целевой поверхности и сделает эксперимент недействительным. Соединение между трубкой проточной камеры и шприцем должно быть надлежащим образом герметизировано. - Приготовьте дисперсию микропузырьков, добавив рассчитанный объем концентрированных пузырьков в резервуар для микропузырьков (сцинтилляционный флакон объемом 20 мл) для достижения концентрации 106 микропузырьков/мл в буфере PBS с 0,1% BSA. Поместите резервуар питателя на магнитную пластинчатую мешалку. Вставьте магнитную мешалку размером 1 см x 2 см и перемешивайте со скоростью ~400 об/мин для поддержания однородности в ходе исследования.
- Выполнение ультразвуковой визуализации проточной камеры в резервуаре для воды13.
- Погрузите узел проточной камеры в дегазированную воду и удерживайте его на месте с помощью груза, чтобы предотвратить движение во время экспериментов.
- Поместите зажимной датчик изображения непосредственно над каналом и наклоните его под углом 15° назад, а также под углом 5° по часовой стрелке, чтобы свести к минимуму зеркальное отражение от поверхности чашки. Расположите канал проточной камеры в плоскости изображения.
- Используйте следующие условия визуализации: преобразователь 15L8, режим визуализации с учетом контраста, динамический диапазон 50 дБ, 7 МГц, механический индекс (MI) = 0,18, усиление CPS = 0. Следите за тем, чтобы компенсация временного усиления была равномерной по всему изображению.
- Расположите поверхность датчика так, чтобы она касалась поверхности воды, а не глубоко погружалась. В качестве альтернативы можно использовать резиновый защитный чехол, наполненный гелем для ультразвука.
ПРИМЕЧАНИЕ: Чтобы гарантировать воспроизводимое позиционирование системы проточной камеры для визуализации, маркеры должны быть размещены на водоеме или на экране ультразвуковой системы.
- Втяните дисперсию микропузырьков из резервуара через камеру в насос в течение 2 минут.
- Переключите поток на PBS, чтобы удалить неадгезивные пузырьки из канала и оценить акустическое обратное рассеяние оставшихся адгезивных (целевых) пузырьков. Для получения фонового изображения необходимо увеличить ИМ до 1,9 для уничтожения адгезивных пузырьков в поле зрения ультразвуковой визуализации.
ПРИМЕЧАНИЕ: Дисперсию микропузырьков следует заменить при повторных прогонах: при сильном разбавлении микропузырьки постепенно деградируют со временем.
- Переключите поток на PBS, чтобы удалить неадгезивные пузырьки из канала и оценить акустическое обратное рассеяние оставшихся адгезивных (целевых) пузырьков. Для получения фонового изображения необходимо увеличить ИМ до 1,9 для уничтожения адгезивных пузырьков в поле зрения ультразвуковой визуализации.
- Экспортируйте отдельные изображения из видеопотока записи экрана: до сброса PBS, после сброса и после уничтожения, для импорта в ImageJ для анализа в автономном режиме. Выберите область интереса (ROI), чтобы исключить входную и выходную части камеры. После вычитания фонового сигнала ROI количественно определите интенсивность эха как среднюю интенсивность пикселей в пределах ROI.
ПРИМЕЧАНИЕ: В качестве альтернативы ультразвуковой визуализации адгезия микропузырьков к поверхности мишени может наблюдаться с помощью видеомикроскопии, когда параллельный блок проточной камеры пластины в инвертированном держателе помещается на предметный столик составного микроскопа, с видеозаписью 5,11,12,14. Это особенно полезно для визуализации целенаправленной адгезии микропузырьков к рецепторам биомаркеров клеточной поверхности в клеточной культуре, когда клетки, экспрессирующие рецепторы, выращиваются на чашке для культуры тканей, и количество микропузырьков, связанных с каждой клеткой-мишенью, может быть подсчитано напрямую.
Результаты
Ковалентное соединение пептида и липида
Завершение реакции и формирование желаемого продукта было подтверждено TLC. Отдельный непрореагировавший пептидный контроль не перемещался вверх во время ТСХ: он сохранялся в начале, и его пятно было положительным для первичной аминогруппы, что наблюдалось после распыления нингидрина при нагревании. Это нингрин-положительное пятно свободного пептида больше не наблюдалось в смеси после завершения реакции, после ТСХ образца реакционной смеси, после удаления DIPEA, ДМСО и повторного растворения в хлороформе. Что касается важнейшего вопроса качества реагента NHS-эфира, то на рисунке 1 представлен спектрофотометрический трек кинетики гидролиза, при этом нулевой временной точкой в начале реакции является момент, когда NHS-эфир в органическом растворителе был добавлен в кювету. Это подтверждает функциональность NHS активного эфира карбокси-PEG-DSPE (см. раздел «Методы» 1). В нулевой временной точке экстраполированное A260 = 0,33 представляет материал, который уже был гидролизован до испытания. По окончании реакции гидролиза, превышающей 10-15 мин, А260=1,54 (когда абсорбция уже существенно не увеличивается). Это подтверждает наличие активного эфира. Он также предоставляет количественные данные, что более 78% материала не является предварительно гидролизованным NHS и, таким образом, может быть успешно использован для пептидного связывания при правильной регулировке количества реагента.
Приготовление и перенос липидного материала из водной среды на оболочку пузырьков: флуоресцентный липид
Микропузырьки для этого исследования были приготовлены таким образом, чтобы содержать следовое количество (менее 1%) флуоресцентного красителя DiI с характерной красной флуоресценцией, который был добавлен в виде раствора в ПГ к физиологическому раствору ПГ DSPC и стеарата ПЭГ. Образующиеся микропузырьки ясно демонстрируют флуоресценцию оболочки при использовании в микроскопе фильтра возбуждения зеленым светом и красного излучения (см. рис. 2, слева). Светлопольная микроскопия газовой фазы микропузырьков (рис. 2, справа) может быть сравнена с флуоресценцией оболочки микропузырьков. Для количественной оценки переноса липидного материала из водной фазы в оболочку пузырьков микропузырьки сплавляли с помощью центрифугирования, а сигнал флуоресценции прозрачной инфранатантной фазы сравнивали с флуоресценцией исходного раствора до амальгамации микропузырьков. Наблюдалось снижение сигнала почти на порядок (рис. 3), т.е. более 85% липидного материала перешло в оболочку микропузырьков путем амальгамации.
Подготовка и коррекция распределения микропузырьков по размерам
Микропузырьки, полученные в результате амальгамирования, продемонстрировали типичное распределение по размерам с высокой концентрацией (например, ~4,8 x 109 частиц на мл для биотинилированных пузырьков). Распределение по размерам было широким, с частицами, присутствующими в пределах измеряемого диапазона (от 1 до 30 мкм); ~6,3% микропузырьков превышают 5 мкм в диаметре (Рисунок 4, зеленая кривая). Внутрисосудистое введение крупных микропузырьков может привести к их неспецифическому накоплению в кровеносных капиллярах, и его следует избегать. Короткая (15-17 мин) флотация перевернутого флакона при нормальной плотности с последующим забором 0,3 мл вблизи поверхности перегородки позволяет полностью удалить более крупные микропузырьки с незначительными потерями в общей концентрации частиц, вплоть до ~4,6 х 109: после флотации только 0,01% частиц в очищенном образце имеют диаметр более 5 мкм (Рисунок 4, красная кривая).
Адгезия микропузырьков к поверхности с рецепторным покрытием: статический анализ
Эта процедура была впервые описана впредыдущем веке 1 и используется в качестве быстрого теста, подтверждающего функциональность целевых микропузырьков. Допускается контакт микропузырьков с поверхностью чашки, несущей рецепторы. Если происходит взаимодействие лиганд-рецептор, пузырьки могут оставаться на поверхности, несмотря на энергичное смыв. Приведен пример такого быстрого испытания функциональной адгезии c(RGDfK)-микропузырьков на поверхность, покрытую рекомбинантным αvβ3 . На рисунке 5 представлено репрезентативное изображение в светлопольной микроскопии адгезивных микропузырьков на поверхности рецептора в чашке Петри после промывки PBS для удаления несвязанных пузырьков. Пузырьки при этом типе микроскопии представлены в виде темных круговых узоров. В подобном состоянии, если поверхность покрыта только альбумином (для блокировки неспецифической адгезии), микропузырьки не прилипнут и будут легко смываться даже при легком смывании.
Связывание микропузырьков с проточной средой: проточная камера с параллельными пластинами
Эта процедура была первоначально предложена в качестве инструмента для изучения адгезии клеток в условиях контролируемого потока15 и адаптирована для изучения нацеливания на микропузырьки десятилетияспустя11. Тестирование в проточной системе, в отличие от статического анализа, гораздо более реалистично для сценария клинической визуализации, где циркулирующие пузырьки в потоке крови кратковременно касаются стенки сосуда и могут прилипать к ней при наличии целевого рецептора. Представлены два примера таких исследований. Первый пример — более традиционный подход, при котором адгезия микропузырьков, декорированных пептидами, к поверхности, покрытой рецептором, контролируется с помощью видеомикроскопии. Микроскопия позволяет отличить адгезивные микропузырьки от протекающих. Это также позволяет количественно определить те адгезивные микропузырьки в кадре микроскопа: гораздо больше микропузырьков c(RGDfK) (левая колонка) прилипают к поверхности по сравнению с контролем, где используется скремблированный пептид c(RADfK) или если поверхность покрыта только BSA (рис. 6).
Вторым примером является контрастная ультразвуковая визуализация чашки Петри, покрытой стрептавидином (рис. 7, справа), к которой биотинилированные микропузырьки успешно адсорбируются из проточной среды, и может быть обнаружена с помощью контрастной ультразвуковой визуализации после промывки PBS. Поверхность контрольной чашки не задерживает прилипшие микропузырьки от потока, поэтому практически весь ультразвуковой контрастный сигнал удаляется с помощью потока PBS. Количественная оценка контрастного сигнала ультразвука показывает сильную статистическую значимость наблюдаемой разницы; Соотношение сигналов цели и управления превысило на порядок.
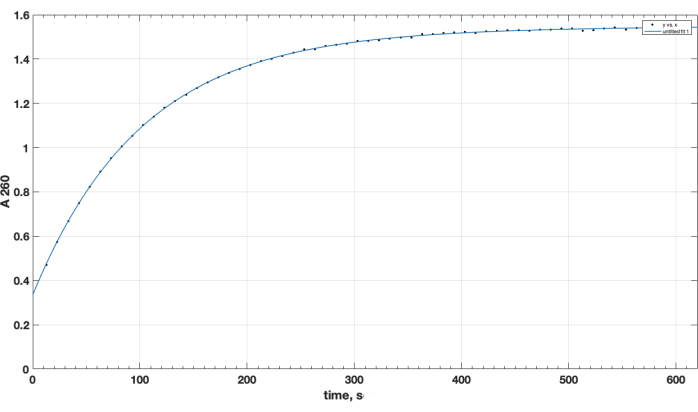
Рисунок 1. Кинетика гидролиза активного эфира NHS-PEG-DSPE, наблюдаемая по высвобождению NHS в щелочной среде при спектрофотометрическом тестировании на длине волны 260 нм. Нулевая временная точка – это время добавления NHS-PEG-DSPE в органический растворитель к 0,1 М боратному буферу, pH 9,2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2. Микроскопия газонаполненных микропузырьков после амальгамации. Слева, флуоресцентная микроскопия (зеленое возбуждение, красное излучение, краситель липидной оболочки DiI). Справа, светлопольная микроскопия (наблюдение за газовой фазой), такое же увеличение. Ширина кадра, 85 мкм (микрометр 10 мкм встроен в правый нижний угол каждого изображения). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
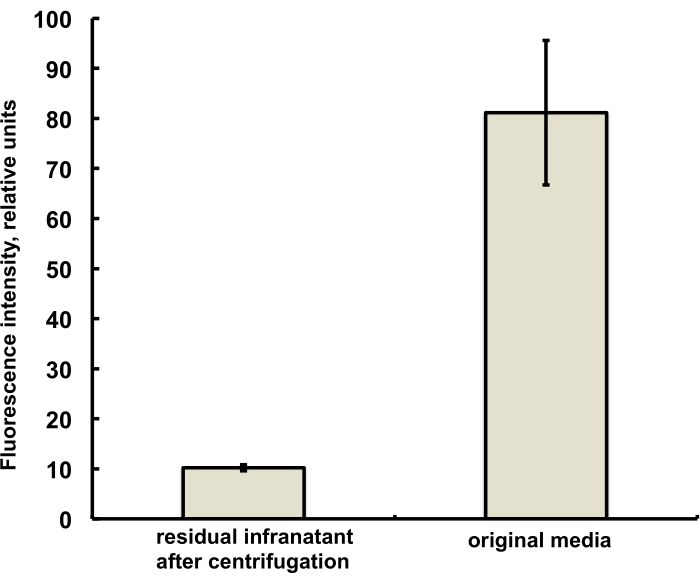
Рисунок 3. Флуоресцентная спектроскопия образца липидного красителя DiI из микропузырьковой подготовительной среды до амальгамации (справа) и после амальгамирования и удаления микропузырьков методом центробежной флотации (слева). Возбуждение флуоресценции - 555 нм, излучение - 620 нм. Данные представлены в виде среднего ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4. Распределение частиц по размерам от числовой концентрации микропузырьков после приготовления амальгамации (зеленый) с последующей нормальной гравитационной флотацией для удаления крупных микропузырьков (красный) и фонового количества только разбавителя (синий). Подсчет частиц с помощью электрозонального зонирования в нормальном физиологическом растворе, отверстие 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5. Светлопольная микроскопия c(RGDfK)-микропузырьков на чашке, покрытой αvβ3. Ширина рамки изображения – 106 μмкм, ширина полосы – 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
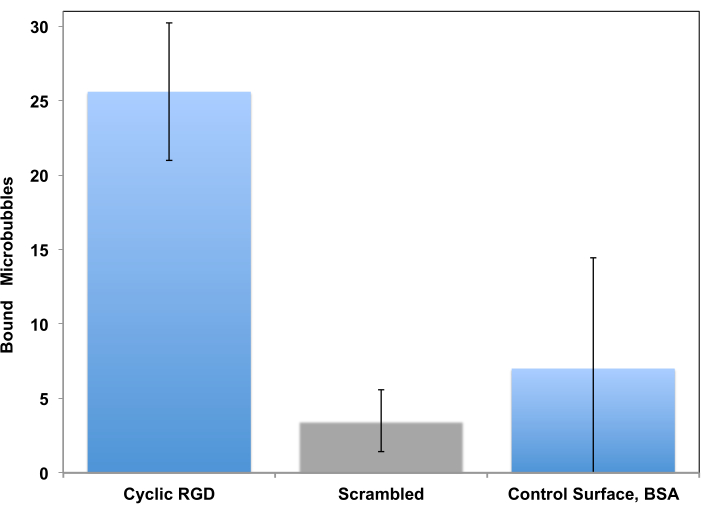
Рисунок 6. В параллельной проточной камере in vitro микропузырьки, украшенные пептидами, нацелены на поверхность, покрытую рекомбинантным αvβ3. микропузырьки, украшенные cRGDfK, эффективно прилипли к чашке (слева), прикрепление контрольных нецелевых микропузырьков cRADfK (скремблированные, центральные) было минимальным (p<0,00005), как и удержание микропузырьков на контрольной поверхности, содержащей только альбумин (справа, p<0,0025). Напряжение сдвига стенки потока в камере со скоростью 1 дин/см2. Адгезия микропузырьков контролируется с помощью видеомикроскопии; Представлено количество частиц в поле зрения. Время накопления 4 мин. Данные представлены в виде среднего ± стандартного отклонения. Перепечатано с разрешенияот 5. Авторское право, 2018, Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
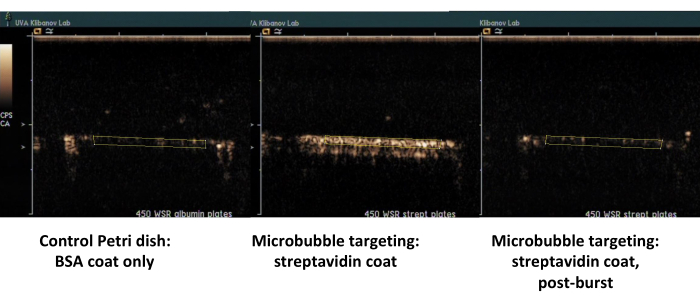
Рисунок 7. Контрастная ультразвуковая визуализация проточной камеры с параллельной пластиной после целенаправленной адгезии и буферной промывки биотинилированных микропузырьков на чашке, покрытой стрептавидином (в центре, адгезивные целевые микропузырьки, справа, та же чашка, после ультразвуковой вспышки с высоким инфарктом миокардации), и контрольной чашке, покрытой только альбумином (слева). Двухминутная перфузия дисперсии микропузырьков (PBS/BSA, 106 частиц/мл) со скоростью сдвига 450 с-1 с последующей промывкой буфера. Количественная оценка ультразвукового сигнала производится из интересующих областей видеокадров после вычитания фона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Важность простой техники приготовления микропузырьков, украшенных лигандом, очевидна. Использование метода амальгамирования для получения микропузырьков, впервые предложенный Unger et al.,16 может служить этой цели по ряду причин. Изготовление микропузырьков с помощью амальгаматора легко выполнить. Компактный настольный однофазный блок 120 В доступен и недорог. Процедура быстрая (45 секунд) и эффективная: за один раз готовится 1 мл дисперсии микропузырьков в водной среде. Он содержит миллиарды частиц на мл, что более чем достаточно для научных исследований. Производство происходит в герметичном флаконе с перфторированным газом. При необходимости содержимое флакона будет оставаться стерильным с момента асептического наполнения, во время изготовления (амальгамации) и до использования. Это делает подход актуальным для клинического использования, поскольку он не требует сложных препаратов в специальной стерильной среде в клинике.
Процедура основана на самосборке: при смешивании, при воздействии большого сдвига на границу раздела газ-вода внутри движущейся пробирки, образуются мелкие фрагменты газа, которые под действием поверхностного натяжения приобретают сферическую форму. PG, как поверхностно-активное вещество, присутствующее в среде в высокой концентрации, снижает поверхностное натяжение и энергию, необходимую для генерации газа и воды на границе раздела во время сдвига. Далее на границу раздела попадают более «классические» поверхностно-активные вещества, такие как ПЭГ-липиды и фосфолипиды, которые присутствуют в гораздо меньших концентрациях, скорее всего, вытесняя ПГ и создавая мономолекулярный слой на поверхности пузырька. Эта оболочка достаточно стабильна; вероятно, это связано с сочетанием «твердого» липида (температура фазового перехода DSPC составляет 56 °C, поэтому он не склонен к межмембранному сплавлению) и расширенного щеточного покрытия PEG, которое окружает микропузырьки и препятствует прямому монослойному контакту соседних пузырьков. Можно предположить, что присутствие высокой концентрации PG в среде может снизить стабильность оболочки микропузырьков. При его отсутствии микропузырьки стабильны в герметичных флаконах в атмосфере фторуглеродов в течение многих месяцев, при этом между пузырьками происходит лишь умеренное слияние. Для клинического использования, при наличии небольшого амальгаматора у постели больного, интервал между приготовлением микропузырьков и использованием может быть коротким, минут или часов. При наличии ПГ в среде концентрация микропузырьков не показывает значительного снижения, по крайней мере, в течение нескольких часов хранения в холодильнике.
Дополнительным преимуществом описанной процедуры (с использованием ПГ-косурванта в среде для подготовки пузырьков) является высокая эффективность (>85%) переноса липидов в оболочку, в то время как традиционная ультразвуковая обработка обеспечивает эффективность ~20%5 , а современные микрофлюидные методы ещениже17. Высокий уровень эффективности переноса важен не только потому, что сокращаются отходы липидного материала и дорогостоящего лиганда, но и потому, что количество безпузырькового лиганда, присутствующего в среде, также сводится к минимуму. В этом случае свободный лиганд может не иметь возможности блокировать рецептор-мишень биомаркера, с которым, как ожидается, микропузырьки будут связываться через лиганд на своей поверхности. Общее количество рецептора биомаркера в сосудистой сети-мишени часто довольно высокое, поэтому это может не иметь первостепенного значения. Исходя из имеющейся патентнойлитературы18 , можно предположить, что по меньшей мере 50% материала липидной оболочки и целевого лиганда в микропузырьковых составах в клинических испытаниях могут быть связаны с пузырьковой оболочкой. В целом это можно сравнить с мечеными радиоактивными антителами или пептидами, которые широко используются в исследованиях визуализации рецепторов ядерной медицины: большинство из тех, которые нацелены на молекулы лигандов, на самом деле не несут «горячий» радиоизотоп даже при самой высокой специфической активности, о которой сообщается19, в то время как для целевых микропузырьков материал оболочки в этом исследовании (включая лиганд-липид) в основном прикреплен к микропузырькам.
Селективная адгезия целевых микропузырьков, полученных по этой методике, была продемонстрирована in vitro в двух наборах моделей нацеливания: статическая адгезия и эксперимент по нацеливанию в проточной камере. В статическом анализе целевые микропузырьки плотно прилегали к целевому рецепторному слою и не вытеснялись при буферной промывке, в отличие от контрольной системы, где микропузырьки удалялись с поверхности даже при осторожном промывании. Аналогичным образом, в проточном испытании, проведенном в проточной камере с параллельной пластиной, биотинилированные пузырьки продемонстрировали статистически значимую и превосходную адгезию к слою стрептавидина на полистирольной чашке по сравнению с контрольной поверхностью, содержащей только альбумин. Микропузырьки, декорированные пептидом c(RGDfK), селективно прилипают к поверхности αvβ3-покрытием, как в статическом анализе адгезии, так и в проточной камере с параллельными планшетами.
К ограничениям описываемого протокола можно отнести следующие проблемы. Во-первых, процедура не учитывает субмикронные частицы. Инструмент, который использовался в исследовании, не был настроен на обнаружение нанопузырьков (т.е. частиц диаметром менее 1 мкм). Эти частицы могли присутствовать в составе. Хотя их акустический сигнал обратного рассеяния, как правило, известен как низкий, и они не наблюдались в этом исследовании с помощью микроскопии, присутствие нанопузырьков все же следует учитывать. Вторая существенная проблема – неоднородность микропузырьков по размеру. Несмотря на удаление более крупных частиц, размер образующихся пузырьков далеко не однороден. Это должно стать соображением и обоснованием для дальнейших исследований в области рецептуры микропузырьков.
В заключение, описание, приведенное в этой рукописи, должно обеспечивать достаточный уровень технической детализации для быстрого и легкого изготовления целевых микропузырьков. Приведены шаги по выполнению дополнительной очистки (если это желательно), регулировке размера и/или оценке небольшого количества материала оболочки, который остается в водной среде. Подробно описаны аналитические инструменты для оценки параметров микропузырьков, таких как распределение по размерам и концентрация, а также способность in vitro покрытых лигандом микропузырьков прилипать к рецепторам-мишеням.
Раскрытие информации
А. Клибанов является соучредителем и миноритарным акционером Targeson Inc, стартапа в области доклинических таргетных микропузырей, ныне ликвидированного. Его лаборатория UVA заключила субподряд через NIH R44 HL139241 с SoundPipe Therapeutics.
Благодарности
А.Л. Клибанов выражает благодарность за поддержку, в частности, через NIH R01EB023055, предоставленную Национальным институтом биомедицинской визуализации и биоинженерии Национальных институтов здравоохранения, субконтракт с Университетом Вирджинии через NIH R01NS076726, заключенный с UCSF Национальным институтом неврологических расстройств и инсульта Национальных институтов здравоохранения, и субконтракт с Университетом Вирджинии через грант NIH R44HL139241. присуждена компании SoundPipe Therapeutics от Национального института сердца, легких и крови. Содержание данной публикации является исключительной ответственностью автора и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Amalgamator | Lantheus, Billerica, MA. | Vialmix | ESPE Capmix, Wig-L-Bug or another amalgamator capable of 4300 rpm can be used. |
| biotin-PEG3400-DSPE | Laysan Bio, Arab, AL. | Biotin-PEG-DSPE-3400 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific, Waltham, MA | BP1600-100 or similar | |
| Ca-Mg-free PBS | Fisher Scientific, Waltham, MA | 14190-144 | |
| Centrifuge with a bucket rotor | IEC/Thermo, Fisher Scientific, Waltham, MA. | NH-SII | Any centrifuge with a bucket rotor |
| chloroform | Fisher Scientific, Waltham, MA | C297-4 | |
| cyclic (RGDfK) peptide | AnaSpec, Fremont, CA | AS-61111 | |
| Decafluorobutane | F2 Chemicals, Preston UK | CAS 355-25-9 | |
| DiI | Sigma-Aldrich, St. Louis, MO. | 468495-100MG | |
| DIPEA | Sigma-Aldrich, St. Louis, MO. | 387649 | |
| Disposable UV cuvette, 1.5 ml | BrandTech, Essex, CT. | 759150 | |
| DMSO | Sigma-Aldrich, St. Louis, MO. | 276855 | |
| Dry block heater, high temperature | Techne Cole Palmer, Staffordshire UK | DB-3A | |
| DSPC | Lipoid, Ludwigshafen, Germany | LIPOID PC 18:0/18:0 | |
| Fluorescence microplate reader | Molecular Devices, San Jose, CA. | Spectramax Gemini XS | No longer available, superceded by Gemini XPS; any fluorescence plate reader with red dye detection capability will work |
| Microscope with fluorescence epi-illumination. | Leica | Laborlux 11 | No longer available; any fluorescence microscope is sufficient; high-sensitivity video camera is required for image stream collection |
| NHS-PEG3400-DSPE | NOF-America, White Plains, NY. | SUNBRIGHT DSPE-034GS | Some of the alternative manufacturers provide material that is mostly, or completely, hydrolyzed on arrival |
| Ninhydrin spray for TLC plates | BVDA, Haarlem, The Netherlands | AS-72177 | |
| Normal saline irrigation solution (0.9% NaCl) | Baxter, Deerfield IL. | 2F7124 | |
| Parallel plate flow chamber, for 35mm Corning Petri Dish | Glycotech, Gaithersburg, MD. | 31-001 | May only work with Corning Petri dishes, but not necessarily with other makers, due to different dimensions |
| Particle sizing system | Beckman Coulter, Hialeah, FL | Multisizer 3 | No longer available, superceded by Multisizer 4, with similar electrozone sensing principle. Alternatively, optical methods, e.g., Accusizer, can be used. |
| PEG 6000 monostearate | Kessco Stepan, Joliet, IL. | CAS 9004-99-3 | |
| Petri Dishes, 35 mm diameter, 10 mm tall | Corning, Corning, NY. | 430165 | |
| Plastic coverslips, 22x22mm | Cardinal Health, McGaw Park, IL. | M6100 | |
| Propylene glycol | Sigma-Aldrich, St. Louis, MO. | P4347 | |
| Recombinant murine alphavbeta3, carrier-free | R&D Systems, Minneaposis, MN. | 7889-AV-050 | |
| Rubber stoppers, 13mm | Kimble-Chase, Vineland, NJ | W017900 | |
| Serum vials, 2 ml, 13mm | Kimble-Chase, Vineland, NJ | 223683 | |
| Silica TLC Plates, F254 | Analtech, Newark, DE | P02521 | |
| Sodium tetraborate | Sigma-Aldrich, St. Louis, MO. | S9640 | |
| Streptavidin | AnaSpec, Fremont, CA | AS-72177 | |
| Syringe pump, infuse/withdraw option | Harvard Apparatus, Holliston, MA | PHD2000, 70-2001 | |
| Ultrasound imaging system with contrast-specific mode. | Siemens/Acuson, Mountain View CA | Sequoia c512, 15L8 probe | Old generation Sequoia is out of production for more than a decade. Available as used equipment. CPS mode has to be unlocked for the 15L8 transducer. |
| UV Spectrophotometer | Beckman, Brea, CA. | DU640 | No longer available, may be replaced with any 260 nm ultraviolet-capable unit |
Ссылки
- Klibanov, A. L., et al. Targeting of ultrasound contrast material - An in vitro feasibility study. Acta Radiologica. 38, 113-120 (1997).
- Wright, W. H., et al. Evaluation of new thrombus-specific ultrasound contrast agent. Academic Radiology. 5, Suppl 1 240-242 (1998).
- Willmann, J. K., et al. Ultrasound Molecular Imaging With BR55 in Patients With Breast and Ovarian Lesions: First-in-Human Results. Journal of Clinical Oncology. 35, 2133-2140 (2017).
- Smeenge, M., et al. First-in-Human Ultrasound Molecular Imaging With a VEGFR2-Specific Ultrasound Molecular Contrast Agent (BR55) in Prostate Cancer: A Safety and Feasibility Pilot Study. Investigative Radiology. 52, 419-427 (2017).
- Unnikrishnan, S., Du, Z., Diakova, G. B., Klibanov, A. L. Formation of Microbubbles for Targeted Ultrasound Contrast Imaging: Practical Translation Considerations. Langmuir. 35, 10034-10041 (2019).
- Kaufmann, B. A., et al. High-resolution myocardial perfusion imaging in mice with high-frequency echocardiographic detection of a depot contrast agent. Journal Info. American Society of Echocardiography. 20, 136-143 (2007).
- Yeh, J. S. M., et al. A Targeting Microbubble for Ultrasound Molecular Imaging. Plos One. 10, (2015).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19, 759-765 (2008).
- Helfield, B. L., Huo, X., Williams, R., Goertz, D. E. The effect of preactivation vial temperature on the acoustic properties of Definity. Ultrasound in Medicine and Biology. 38, 1298-1305 (2012).
- Morgan, K. E., et al. Experimental and theoretical evaluation of microbubble behavior: effect of transmitted phase and bubble size. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 47, 1494-1509 (2000).
- Klibanov, A. L., et al. Targeting and ultrasound imaging of microbubble-based contrast agents. Magnetic Resonance Materials in Physics, Biology and Medicine. 8, 177-184 (1999).
- Takalkar, A. M., Klibanov, A. L., Rychak, J. J., Lindner, J. R., Ley, K. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow. Journal of Controlled Release. 96, 473-482 (2004).
- Hernot, S., et al. Nanobody-coupled microbubbles as novel molecular tracer. Journal of Controlled Release. 158, 346-353 (2012).
- Ferrante, E. A., Pickard, J. E., Rychak, J., Klibanov, A., Ley, K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release. 140, 100-107 (2009).
- Hochmuth, R. M., et al. Surface Adhesion, Deformation and Detachment at Low Shear of Red-Cells and White Cells. Transactions American Society for Artificial Internal Organs. 18, 325-334 (1972).
- Unger, E. C., et al. Method of preparing gas and gaseous precursor-filled microspheres. US patent. , US Patent 5,585,112 (1996).
- Segers, T., de Rond, L., de Jong, N., Borden, M., Versluis, M. Stability of Monodisperse Phospholipid-Coated Microbubbles Formed by Flow-Focusing at High Production Rates. Langmuir. 32, 3937-3944 (2016).
- Schneider, M., Brochot, J., Puginier, J., Yan, F. Stable microbubble suspensions comprising saturated phospholipids for ultrasound echography. US Patent. , US Patent 5,686,060A (1997).
- Breeman, W. A. P., et al. Radiolabelling DOTA-peptides with Ga-68. European Journal of Nuclear Medicine and Molecular Imaging. 32, 478-485 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены