Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
CD4 promotörünün yakınında CAS9 kaynaklı çift iplikçik kopmasının onarımıyla ilişkili mutasyonları tanımlamak için yeni nesil dizilemenin kullanılması
Bu Makalede
Özet
Burada sunulan sgRNA / CAS9 endonükleaz ve CD4 promotörünün yakınındaki çift iplikçik kopması onarımı ile ilişkili mutasyonları tanımlamak için kullanılabilecek yeni nesil dizileme protokolüdür.
Özet
DNA'daki çift iplikçik kırılmaları (DSB'ler) DNA hasarının en sitotoksik türüdür. Sayısız hakaret bu lezyonlara neden olabileceğinden (örneğin, replikasyon stresi, iyonlaştırıcı radyasyon, onarılmamış UV hasarı), DSB'ler her gün çoğu hücrede görülür. Hücre ölümüne ek olarak, onarılmamış DSB'ler genom bütünlüğünü azaltır ve ortaya çıkan mutasyonlar tümörigenezi tetikleyebilir. Bu riskler ve DSB'lerin prevalansı, hücrelerin bu lezyonları onarma mekanizmalarına yönelik araştırmaları motive etmektedir. Yeni nesil dizileme, DSB onarım kusurlarıyla ilişkili mutasyonları tam olarak tanımlamak için güçlü bir araç sağlamak üzere iyonlaştırıcı radyasyonla DSB'lerin indüksiyonu ile eşleştirilebilir. Bununla birlikte, bu yaklaşım, iyonlaştırıcı radyasyonla ilişkili rastgele oluşan DSB'lerin onarımını tespit etmek için hesaplama açısından zorlu ve maliyet engelleyici tüm genom dizilemesini gerektirir. I-Sce1 gibi nadir kesici endonükleazlar, tek bir DSB üretme yeteneği sağlar, ancak tanıma bölgeleri ilgilenilen genoma yerleştirilmelidir. Sonuç olarak, onarım bölgesi doğal olarak yapaydır. Son gelişmeler, kılavuz RNA'nın (sgRNA) bir Cas9 endonükleazını ilgilenilen herhangi bir genom lokusuna yönlendirmesine izin vermektedir. Bu, Cas9 kaynaklı DSB'yi çevreleyen DNA'ya odaklanmasına izin vererek yeni nesil dizilemeyi daha uygun maliyetli hale getiren DSB onarımı çalışmasına uygulanabilir. Makalenin amacı, CD4 geninin bir DSB yukarı akışının onarımından kaynaklanan mutasyonları tanımlayabilen bir protokol sunarak bu yaklaşımın uygulanabilirliğini göstermektir. Protokol, onarım inhibitörleri, viral protein ekspresyonu, mutasyonlar ve nispeten sınırlı hesaplama gereksinimlerine sahip çevresel maruziyetler gibi eksojen faktörlerle ilişkili DSB'nin mutajenik potansiyelindeki değişiklikleri belirlemek için uyarlanabilir. Bir organizmanın genomu dizilendikten sonra, bu yöntem teorik olarak herhangi bir genomik lokusta ve o organizmanın transfekte edilebilen herhangi bir hücre kültürü modelinde kullanılabilir. Yaklaşımın benzer uyarlamaları, aynı genetik arka plandaki farklı lokuslar arasındaki onarım sadakatinin karşılaştırılmasına izin verebilir.
Giriş
Genomik stabilitenin korunması, tüm canlı organizmalar için kritik öneme sahiptir. Doğru DNA replikasyonu ve sağlam bir DNA hasar yanıtı (DDR), genetik materyali sadık bir şekilde yaymak için gereklidir 1,2. DNA hasarları çoğu hücrede düzenli olarak meydana gelir 2,3. Bu hasarlar hissedildiğinde, hücre döngüsü ilerlemesi durdurulur ve DNA onarım mekanizmaları aktive edilir. DNA veya DSB'lerdeki çift iplikçik kırılmaları, DNA hasarının en toksik ve mutajenik türüdür 3,4.
Birkaç DDR sinyal yolu bu lezyonları onarabilirken, en iyi çalışılan DSB onarım yolları homolog rekombinasyon (HR) ve homolog olmayan uç birleştirmedir (NHEJ). HR, homolog bir şablon olarak kardeş kromatid kullanarak bir DSB'yi onaran büyük ölçüde hatasız bir yoldur. Bu, bir hücre döngüsünün S fazında ve G2 fazında 5,6,7 olma eğilimindedir. NHEJ hataya daha yatkındır, ancak hücre döngüsü 8,9 boyunca gerçekleşebilir. Belirli onarım mekanizmalarının verimliliğini ölçmek için çeşitli muhabir testleri geliştirilmiştir10,11,12. Bu tahliller, GFP veya mCherry'yi11,13 olarak kullanarak DSB onarım yolu aktivitesinin yüksek verim ölçümü için akış sitometrisine dayanma eğilimindedir. Son derece verimli olsalar da, yapay olarak tanıtılan bir DSB'de meydana gelen kanonik onarıma güvenirler.
DSB onarımını incelemek için kullanılan çeşitli başka yöntemler vardır. Bunların birçoğu immünofloresan (IF) mikroskopisi 1,14'e dayanmaktadır. IF mikroskopisi, DSB'ler genotoksik kimyasallara veya iyonlaştırıcı radyasyona maruz kalarak indüklendikten sonra onarım komplekslerini temsil eden ayrı nükleer odakları tespit eder15,16. Bu odakların oluşumunu ve çözünürlüğünü izlemek, sırasıyla14,17 onarımın başlatılması ve tamamlanmasının bir göstergesidir. Bununla birlikte, bu DSB indüksiyon yöntemleri (yani, kimyasallar veya iyonlaştırıcı radyasyon), genomda tanımlanmış yerlerde DSB'lere neden olmaz. Ayrıca, bunları DSB'lerin yalnızca küçük bir sayısını (örneğin, 2-4) tutarlı bir şekilde indüklemek için kullanmak işlevsel olarak imkansızdır. Sonuç olarak, DSB'leri indüklemek için en sık kullanılan yöntemler, genom boyunca rastgele dağılmış çok sayıda lezyona neden olur18. Nadir kesen bir endonükleaz için tanıma bölgesi yerleştirilerek ve I-Sce119 gibi ilgili endonükleazı eksprese ederek az sayıda DSB tanıtılabilir. Ne yazık ki, bir hedef bölgenin gerekli entegrasyonu, DSB'nin endojen genomik lokuslarda incelenmesini önler.
Bu makalede, kullanıcı tanımlı bir lokusta üretilen bir DSB'nin onarımı ile ilişkili mutasyonları tespit etmek için bir yöntem açıklanmaktadır. Bir viral proteinin bir DSB ile ilişkili mutasyon sayısını artırma yeteneğini değerlendirmek için uygulanan yaklaşımın temsili bir örneğini sunuyoruz. Spesifik olarak, bu makalede, vektör kontrolünü ifade eden insan sünnet derisi keratinositlerinde (HFK LXSN) ve insan papilloma virüsü tip 8'in (HFK 8E6) E6 proteinini eksprese eden HFK'da insan CD4 açık okuma çerçevesinde bir DSB'yi indüklemek için bir CAS9 endonükleazını yönlendirmek için tek bir kılavuz RNA'nın (sgRNA) kullanımı açıklanmaktadır. Kırılmayı çevreleyen bölgenin hedefli yeni nesil dizilimi (NGS), lezyonun onarımı ile ilişkili mutasyonların titizlikle tanımlanmasını sağlar. Bu veriler, viral proteinin DSB onarımı sırasında mutasyonlarda yaklaşık 20 kat artışa neden olduğunu göstermektedir. Ayrıca, tüm genom dizilemesine gerek kalmadan tek bir lokusta DSB'lerin mutajenik sonuçlarının tarafsız bir karakterizasyonunu sağlar. Prensip olarak, protokol, genom lokusları veya hücre hatları arasındaki göreceli mutasyon riskini karşılaştırmak için kolayca uyarlanabilir.
Protokol
1. Hücre kaplaması
- HFK LXSN ve HFK 8E6 hücrelerini, insan keratinosit büyüme takviyesi (HKGS) ve% 1 penisilin / streptomisin ile keratinosit kültür ortamında (10 mL / plaka) 10 cm'lik plakalarda büyütün. Hücreleri% 5 CO2 ile bir ceket inkübatöründe 37 ° C'de yaklaşık% 80 birleşime kadar büyütün.
- Kültür ortamını 3 mL tripsin-EDTA (% 0.05, etilendiamin tetraasetik asit) ile değiştirin. 3 dakika boyunca 37 ° C'de inkübe edin. Tripsini eşit hacimli fetal sığır serumu (FBS) takviyeli medya ile nötralize edin ve hücreleri 15 mL'lik bir santrifüj tüpüne aktarın. 5 dakika boyunca 300 x g'de santrifüj.
- HKGS ile 10 mL keratinosit kültür ortamı ile hücreleri yeniden askıya alın. Bir hemositometre ile hücrelerin konsantrasyonunu belirleyin.
- HKGS ve% 1 penisilin ve streptomisin içeren 4mL keratinosit kültür ortamında 4 x 105 hücreli / 6 cm'lik plakalar (HFK LXSN için iki plaka ve HFK 8E6 için iki plaka tohumlayın). % 5 CO 2 ile bir ceket inkübatöründe 37 ° C'debüyüyün.
NOT: HFK hücrelerinin analizi bu protokol için iki nedenden dolayı seçilmiştir. İlk olarak, HFK transfekt edilmesi zor bir hücre hattıdır. Böylece, protokolün bu hücre hattında çalıştığını göstererek, daha yaygın olarak kullanılan ve daha kolay transfekte edilen hücrelerde çalışacağına dair kanıtlar sağlanır. İkincisi, daha önce yayınlanan veriler, viral bir proteinin (8E6) DNA20,21,22'deki çift iplikçik kırılmalarının onarımını engellediğini göstermektedir. Bu nedenle, HFK LXSN ve HFK 8E6'yı karşılaştırmak, tahlilin hücresel onarım kapasitesindeki azalma ile ilişkili mutasyonlardaki artışları tespit etme yeteneğini göstermemizi sağlar.
2. Transfeksiyon
- Transfeksiyon gününde (kaplamadan 24 saat sonra), medyayı 3 mL antibiyotiksiz takviyeli medya ile değiştirin. Bir ceket inkübatöründe 37 ° C'de 2 saat inkübe edin.
- Üreticinin talimatlarına göre uygun lipid bazlı transfeksiyon reaktiflerine sahip transfekt hücreleri.
- Transfeksiyon reaktiflerini kullanmadan önce oda sıcaklığına ve pipete nazikçe ısıtın.
- Her hücre hattı (HFK LXSN ve HFK 8E6) için, steril 1,5 mL'lik bir santrifüj tüpüne (Tüp 1) uygun miktarda transfeksiyon tamponu (üretici tarafından yönlendirildiği şekilde) yerleştirin. Aynı miktarda transfeksiyon tamponuna sahip başka bir tüp ekleyin (sahte transfeksiyon veya Tüp 2).
- İnsan CD4'ünü (px330-CD4, 5'- GGCGTATCTGTGTGAGGACT) hedef alan CAS9 / sgRNA'yı eksprese eden 2 μg plazmid DNA'sını, adım 2.2.2'den Tüp 1'e ekleyin. Tamamen karıştırmak için hafifçe pipet alın. Tüp 2'ye eşit miktarda steril su ekleyin.
- Her hücre hattı için tek başına transfeksiyon reaktifleri içeren bir kontrol plakası ekleyin (plazmid yok).
NOT: İkinci plaka, deneyde negatif bir kontrol görevi görür ve kullanıcının CAS9 / sgRNA ile transfeksiyonun herhangi bir mutasyondan sorumlu olmadığını doğrulamasına izin verir. - Adım 2.2.3'ten itibaren DNA karışımı (Tüp 1) ve adım 2.2.2'den sahte transfeksiyon (Tüp 2) ile tüpe uygun miktarda transfeksiyon reaktifi (üretici tarafından yönlendirildiği şekilde) ekleyin. Tamamen karıştırmak için hafifçe pipet alın. Komplekslerin oluşması için yeterli zamana izin vermek için oda sıcaklığında 15-30 dakika boyunca inkübe edin.
- Transfeksiyon karışımını plakaya damla damla ekleyin. Transfeksiyon karışımını eşit olarak dağıtmak için kültürü 1 dakika boyunca yavaşça sallayın.
- CAS9 ifadesine izin vermek için transfeksiyondan sonra 48 saat boyunca inkübe edin.
- Tripsinizasyon ile hücreleri toplayın.
- Kültür ortamını 1 mL tripsin-EDTA (% 0.05, etilendiamin tetraasetik asit) ile değiştirin. 3 dakika boyunca 37 ° C'de inkübe edin. Tripsin eşit hacimde FBS takviyeli medya ile nötralize edin.
- Her hücre plakası için, hücre süspansiyonunu eşit alikotlara sahip iki mikrosantrifüj tüpüne aktarın. 5 dakika boyunca 300 x g'de santrifüj.
- Hücre peletini bir tüpten 2.4.2 adımında 1 mL fosfat tamponlu salin (PBS) içinde dizileme için yeniden askıya alın. İmmünoblot için buz gibi soğuk PBS ile diğer tüpü adım 2.4.2'den yeniden askıya alın.
- İmmünoblot için tüm hücre lizatlarını toplayın.
- Tüpü 5 dakika boyunca 300 x g'de santrifüj yapın. Süper natantı atın.
- Tüpe % 1 proteaz inhibitörü ve% 1 fosfataz inhibitörü ile karıştırılmış 100 μL radyoimmünopresipitasyon testi tamponu (RIPA lizis tamponu) ekleyin, bir pipetle iyice karıştırın ve buz üzerinde 10 dakika boyunca inkübe edin.
NOT: RIPA lizis tamponu 10 mM Tris-HCl, pH 8.0 içerir; 1 mM EDTA; 0,5 mM EGTA; % 1 Triton X-100; % 0.1 Sodyum Deoksikolat; %0,1 SDS; 140 mM NaCl ve deiyonize su. - Santrifüj, 10 dakika boyunca 13.000 x g'da lize olur. İmmünoblot için süpernatanlar toplayın.
3. İmmünoblot ile CAS9 ekspresyonunun ölçülmesi
- Protein konsantrasyonunu, üreticinin talimatlarına göre bir biskinkoninik asit (BCA) testi ile belirleyin.
- Her numunenin 20 μg proteinini, 150 dakika boyunca% 3-8'lik bir Tris-asetat jelinin kuyucuklarında çalıştırın ve yarı kuru transfer (30 dakika için 10 V ve daha sonra 12 dakika için 25 V) poliviniliden diflorür membrana aktarın.
- Oda sıcaklığında 1 saat boyunca %0,1 ara (PBST) ile PBS'de %5 yağsız kuru sütte membranı bloke ettikten sonra, anti-CAS9 (1:1000) ve anti-GAPDH (1:1000) antikorları ekleyin. Gece boyunca 4 ° C'de inkübe edin.
- Membranı PBST ile yıkadıktan sonra, membranı PBST'de% 5 yağsız kuru sütte ikincil antikor ile oda sıcaklığında 1 saat boyunca inkübe edin.
- Lekeyi görüntüleyin ve CAS9 seviyesini dansitometri23 ile belirleyin. Temsili bir leke için Şekil 1'e bakın.
NOT: İmmünofloresan mikroskopi ile fosforile H2AX (S139) odak oluşumunun saptanması, CAS9 aktivitesini doğrulamak için kullanılabilir14. Hücre döngüsü konumuna, CAS9 hedef bölgesindeki mutasyonların daha fazla kesimi engelleyip engellemediğine ve CAS9 kesim bölgesinin kaç kopyasının ilgili genomda bulunduğuna bağlı olarak düşük sayıda farklı odak (tipik olarak 1-4 odak) beklenir. Temsili bir resim Şekil 2'de gösterilmiştir.
4. Nükleik asit ekstraksiyonu ve amplikon üretimi
- Üretici tarafından belirtildiği gibi, yüksek moleküler ağırlıklı bir DNA ekstraksiyon kiti kullanarak adım 2.4.3'teki hücre örneklerinden DNA çıkarın.
- Astarları veri sayfasına göre belirtilen çözücü ile yeniden askıya alın. Aynı reaktifle 20 μM'ye kadar seyreltin ve belirtilen havuzlara 20 μM astarları bir araya getirin.
NOT: Astar havuzu Ek Tablo 1'de listelenmiştir. - Tablo 1'de belirtildiği gibi her 20 μM astar havuzu için uzun amplifikasyonlu Taq polimeraz kullanarak bir PCR Master karışımı oluşturun.
- PCR tüplerini ayırmak için 21 μL mastermix'ler ekleyin.
- Adım 4.1'den itibaren hedef numunenin 4 μL'sini (100 ng / μL) mastermix ve kapak tahlil tüpleri içeren PCR tahlil tüplerine ekleyin. Her astar havuzu için ayrı reaksiyonlar sağlayın.
- Tüp kapaklarından damlacıkları çıkarmak için PCR tahlil tüplerini ve santrifüjü (hızlı dönüş) karıştırmak için vorteks.
- PCR tüplerini geleneksel bir termal döngü makinesine yerleştirin.
- PCR makinesini Tablo 2'de belirtildiği gibi programlayın.
- Programı bir termal döngüleyicide çalıştırın.
5. PCR temizliği
- Boncuk bazlı bir PCR temizleme sistemi kullanarak PCR reaksiyonlarından primerleri çıkarın.
- Temizleme boncuklarını kullanmadan 30 dakika önce buzdolabından çıkarın.
- Vorteks boncuklarını kullanmadan çok önce ve tüm boncukların yeniden askıya alınmasını sağlayın.
- 96 delikli derin bir kuyu plakasının her bir kuyucuğuna 30 μL (1,2x) yeniden asılı boncuk ekleyin.
- Boncuk içeren kuyucuklara 25 μL PCR reaksiyonu ekleyin.
- Plakayı 2 dakika boyunca 2000 rpm'de bir plaka çalkalayıcıya yerleştirin.
- Sallamanın ardından plakanın 5 dakika oda sıcaklığında kalmasına izin verin.
- Derin kuyucuk plakasını 96 delikli bir plaka mıknatısına yerleştirin ve 2 dakika boyunca inkübe edin.
- Rahatsız edici boncuklar olmadan süpernatantı çıkarın ve atın.
- Plaka mıknatıs üzerinde kalırken, 180 μL% 80 etanol ekleyin ve 30 s boyunca inkübe edin. Süper natantı çıkarın ve atın.
- Adım 5.1.9'u yineleyin.
- 10 μL'lik bir pipet kullanarak, kalan sıvıyı kuyucuklardan çıkarın ve atın.
- Boncukların oda sıcaklığında 10 dakika kurumasını bekleyin.
- Boncuk içeren kuyucuklara 20 μL nükleaz içermeyen su ekleyin ve plakayı mıknatıstan çıkarın.
- Plakayı oda sıcaklığında 2 dakika boyunca 2000 rpm'de sallayın.
- Plakayı oda sıcaklığında 5 dakika boyunca inkübe edin.
- Plakayı bir mıknatıs standına yerleştirin ve oda sıcaklığında 2 dakika kuluçkaya yatırın.
- Süpernatantı ikinci bir PCR plakasına çıkarın. Bu, temizlenmiş DNA'yı içerir.
- Her reaksiyonun konsantrasyonunu bir Florometre ile ölçün.
- dsDNA Florometre reaktiflerinin oda sıcaklığında olduğundan emin olun.
- Standartlar için Florometrik tahlil tüpleri ve iki ek tüp kurun.
- İki tüp hariç hepsine 199 μL 1x dsDNA çalışma çözeltisi ekleyin. Son iki tüpe 190 μL çalışma çözeltisi ekleyin.
- Tahlil tüplerini ayırmak için iki standarttan 10 μL'sini ( Malzeme Tablosuna dahil) ekleyin.
- Florometre mastermix tüplerine her PCR reaksiyonundan 1 μL ekleyin.
- Oda sıcaklığında 2 dakika boyunca karıştırmak ve inkübe etmek için vorteks tüpleri.
- Florometrenin ana ekranında, tahlil kitin kullanımının (1x dsDNA) bulunduğu düğmeyi ve ardından Standartları Oku ve Örnekleri Çalıştır'ı seçin.
- Standart 1 tüp takın, Oku düğmesini seçin ve ardından standart 2 için tekrarlayın.
- Adım 5.2.6'yı takiben, bir numune için tekrarlayın, 1 μL'lik bir numune hacmi seçin ve elde edilen konsantrasyon sağlanacaktır.
- Kalan örnekler için adım 5.2.7'yi yineleyin.
- Aşağıdaki denklemi kullanarak tüm reaksiyonların öngörülen molaritesini hesaplayın ve aşağıdaki denklemi kullanarak her bir numuneden eşit konsantrasyonlarda reaksiyonları ayrı ayrı (numune başına bir son havuz) bir araya getirin.
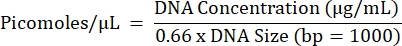
- Son havuz konsantrasyonunu elde etmek için 5.2.1 ile 5.2.7 arasındaki adımları yineleyin.
- Amplikon havuzunu, üretici tarafından belirtildiği gibi bir kılcal elektroforez makinesi / agaroz jeli üzerinde kontrol edin.
- Uygun sayıda numune için kılcal elektroforez tüpleri hazırlayın. Üretici tarafından belirtildiği gibi DNA tamponundan 7 μL ekleyin.
- DNA tamponu içeren tüpe amplikon havuzunun 4 μL'sini ekleyin.
- Tüpleri elektroforez makinesine yerleştirin ve makineyi dsDNA için üretici tarafından belirtildiği şekilde çalıştırın.
- Bantların ~ 5 kb'ye (amplikon boyutu) lokalize olmasını sağlayan elektroforez jel resimlerini görüntüleyin.
- Aşağıdaki denklemi kullanarak tüm reaksiyonların öngörülen molaritesini hesaplayın ve aşağıdaki denklemi kullanarak her bir numuneden eşit konsantrasyonlarda reaksiyonları ayrı ayrı (numune başına bir son havuz) bir araya getirin.
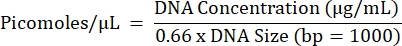
6. Kütüphane hazırlama
- Kütüphane hazırlığı için örnek havuzları adım 5.3.1'den 0.2 ng/μL'ye kadar seyreltin.
- Kısa dizilerle (300bp) uyumlu düşük girişli bir kitaplık hazırlama kiti kullanarak, üreticinin yönergelerini izleyerek adım 5.3'te oluşturulan her örnek havuzu için benzersiz dizin kombinasyonları kullanarak kitaplıklar hazırlayın.
NOT: Dizin dizilerini seçmek için üreticinin yönergelerini izleyin. Kitaplık hazırlık kitine uygun tüm dizinler örnekler için çalışacaktır. - Kütüphane hazırlığını takiben, tüm örnekleri üreticinin talimatlarına göre bir araya getirin.
NOT: Kitaplık havuzunu oluşturmadan önce, hedef dizinizin 250x kapsama alanı için gerekli okuma sayısını hesaplayın ve seçilen sıralama kartuşunun dahil edilen her örnek için yeterli kapsama alanı sağlayabildiğinden emin olun. Toplam 0,5 Mb için bu, 1 milyon okumaya eşit olacaktır.
- Kısa dizilerle (300bp) uyumlu düşük girişli bir kitaplık hazırlama kiti kullanarak, üreticinin yönergelerini izleyerek adım 5.3'te oluşturulan her örnek havuzu için benzersiz dizin kombinasyonları kullanarak kitaplıklar hazırlayın.
- Kitaplık havuzunu sıralama için hazırlayın.
- 300 döngülü bir kartuş ve sıralama reaktiflerini çözün ve hazırlayın.
- Adım 5.1.1'de oluşturulan sıralama havuzunu sıralayıcının üreticisinin talimatlarına göre denatüre edin ve seyreltin.
- Sıralama reaktiflerine denatüre edilmiş ve seyreltilmiş kitaplık havuzu ekleyin ve sıralama makinesini üretici tarafından belirtildiği şekilde çalıştırın .
NOT: Sorun giderme işlemleri için ekteki Tablo 3'e bakın.
7. Veri analizi
NOT: Tüm veri adımları genomik veri analiz yazılımında gerçekleştirilir. Parantezler kullanıcı girişini gösterir. İşaretten büyük, belirli bir adım için fare tıklamalarının sırasını gösterir (örneğin,1. fare tıklaması>2. fare tıklaması)
- Yazılımı Aç > Illumina'> İçe Aktar > Dosyaları Seç > İleri > Kaydetmek > Tamamlanacak konumu seç'e tıklayarak okumaları içe aktarın. Okumalar şimdi yazılımda görünecektir.
- Okumaları kırpın ve filtreleyin.
- Derin dizi veri analizi yazılımında, ham okuma varsayılan parametrelerini kırpın.
- Okumaları vurgulayın ve Araç Kutusu'na tıklayın > Sıralama Verilerini Hazırlama > Okumaları Kırpma Sonraki > Sonraki > Sonraki > Sonraki > Sonraki > Kaydet (Kaydedilecek konumu seç) > > Son'u >
- Kırpılmış okumaları referans olarak eşleyin.
- Harita kırpılmış, adım 4.1'de kullanılan referans dizisine 2 eşleşme puanı, 3 uyumsuzluk maliyeti ve 2 ekleme/silme maliyeti kullanılarak okunur. Uzunluk kesirinin 0,7'nin üzerinde ve benzerlik kesirinin 0,8'de veya üstünde olduğundan emin olun.
- Kırpılmış okuma dosyasını vurgulayın ve Toolbox > Resequencing Analysis (Referans Analizini Yeniden Sıralama Analizi> Eşleme Sonraki > (Referans sırasını seçin) > Sonraki > (Parametrelerin yukarıdaki gibi belirtildiğinden emin olun) > Sonraki > > Kaydet (Kaydedilecek konumu seç) > Son'> tıklayın.
- Varyantları ve indelleri ayıklayın.
- Uygun bir indel arayıcısı kullanarak, 0,005 veya daha düşük bir p değeri eşiği ve maksimum 3 uyumsuzluk sayısı kullanarak indel'leri ayıklayın.
- Eşlenen okuma dosyasını vurgulayın ve Toolbox > Resequencing Analysis > Indels and Structural Variants > Next > (Gerekli önemin girdi olduğundan emin olun Sonraki > > Kaydet (Kaydetmek için konum seçin) > Son>'> tıklayın.
- Uygun bir varyasyon arayıcısı kullanarak, %5'lik bir önem derecesi kullanarak varyasyonları okuma eşlemesinden çağırın.
- Eşlenen okuma dosyasını vurgulayın ve Toolbox > Resequencing Analysis > Variant Detection > Low frequency variant detection > Next > (Gerekli önemin girdi olduğundan emin olun Next > Next > Save > (Kaydetmek için konum seçin) > Finish'> tıklayın.
NOT: İndel ve varyant çağırıcılardaki konakçı genomunun ploidisini hesaba kattığınızdan emin olun. Mutantları% 5'in altında çıkarmayın. Bu eşik, PCR ve tahlille ilişkili sıralama hatalarını açıklar. Normalizasyon (CAS9'un immünoblot tespitine dayanarak), sıralama kapsamı ayarlanarak yapılmalıdır. Örneğin, A örneği, B örneğinin transfeksiyon verimliliğinin iki katına sahipse, A örneğinden gelen okumaların% 50'si analiz için kullanılmalıdır. Bu, rastgele örnekleme ile yapılmalı ve 100x'in altındaki herhangi bir numunenin kapsamını azaltmamalıdır.
Sonuçlar
Bu protokol için üç temsili sonuç sunulmuştur. Şekil 1 , HFK kontrolünde (LXSN) CAS9 ekspresyonunu doğrulayan bir immünoblot ve beta-HPV 8E6 (8E6) ekspresyonunu HFK'dır. Transfeksiyondan 48 saat sonra, tüm hücre lizatları toplandı ve daha sonra bir anti-CAS9 antikoru (veya yükleme kontrolü olarak GAPDH) ile incelendi. Sonuç, HFK LXSN ve HFK 8E6'nın, transfeksiyon verimliliğinin iki hücre hattı arasında benzer olduğunu gösteren benzer m...
Tartışmalar
Sağlanan bilgilerin derinliğine ek olarak, bu yöntemin birkaç avantajı vardır. İlk olarak, DSB onarımı, teoride, ilgili hücrenin genomunu değiştirmeden herhangi bir genomik lokusta değerlendirilebilir. İkincisi, onarımın NGS analizine erişim, tanımlanmış bir alanı hedefleyen tek bir DSB'nin yapılması ve analiz edilmesinin sağladığı düşük maliyet ve hesaplama çabası ile arttırılır. Son olarak, ek organizmaların genomlarının rutin olarak kullanılabilir hale gelmesi ve çeşitli memeli...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu makalede bildirilen araştırmalar, Ulusal Sağlık Enstitüleri Ulusal Genel Tıp Bilimleri Enstitüsü (P20GM130448) (NAW ve RP) tarafından desteklenmiştir; Ulusal Sağlık Enstitüleri Ulusal Kanser Enstitüsü (NCI R15 CA242057 01A1); Kansas Eyalet Üniversitesi'ndeki Johnson Kanser Araştırma Merkezi; ve ABD Savunma Bakanlığı (CMDRP PRCRP CA160224 (NAW)). KSU-CVM Konfokal Çekirdek ve Joel Sanannem'e immünofloresan mikroskopimiz için teşekkür ederiz. İçerik yalnızca yazarların sorumluluğundadır ve bu finansman kuruluşlarının resmi görüşlerini temsil etmek zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6 Well Tissue Culture Plate | Celltreat | 229106 | Cell culture plate |
| BCA Kit | VWR | 89167-794 | BCA assay kit |
| Centrifuge 5910 R | Eppendorf | 2231000772 | Tabletop Centrifuge |
| CLC Genomic Workbench | Qiagen | 832001 | deep sequence data analysis software/indel caller/variant caller |
| Digital Microplate Genie pulse | Scientific industries | SI-400A | Plate shaker |
| DYKDDDDK Tag Monoclonal Antibody (FG4R) | ThermoFisher Scientific | MA191878 | Anti-FLAG antibody |
| Epilife CF Kit | ThermoFisher Scientific | MEPICF500 | Cell cultrue media and supplements |
| Fetal Bovine Serum (FBS) | VWR | 89510-194 | Cell culture supplement |
| Goat anti-Rabbit IgG | ThermoFisher Scientific | A-11012 | Secondary antibody |
| HighPrep PCR Clean-up system | MagBio | AC-60005 | Bead-based PCR cleanup kit |
| KAPA HiFi HotStart ReadyMix PCR Kit | KAPA Biosystems | KK2600 | PCR mastermix/PCR assay |
| MagAttract HMW DNA kit | Qiagen | 67563 | High Molecular Weight DNA extraction kit |
| Magnetic Stand-96 | Thermo Fisher Scientific | AM10027 | 96-Well Magnetic Rack |
| MiniAmp Thermal Cycler | Applied Biosystems | A37834 | Thermal Cycler |
| Miseq | Illumina | SY-410-1003 | Sequencer |
| Miseq v2 300 cycle reagent kit | Illumina | MS-102-2002 | 300-cycle cartridge/sequencing reagents |
| Nextera XT DNA Library Prep kit | Illumina | FC-131-1024 | Library preparation kit |
| Nextera XT Kit v2 Set A | Illumina | 20027215 | Indexes |
| Nunc 96-well polypropylene DeepWell Stroage plates | Thermo Fisher Scientific | 260251 | deep well 96-well plates |
| Penicillin-Streptomycin Solution (100X) | Calsson Labs | PSL02-6X100ML | Antibiotics for cell culture |
| Phosphate Buffered Saline (PBS) | Bio Basic | PD8117 | PBS |
| px330-CD4 | Addgen | 136938 | SgRNA/CAS9 plasmids targeting 5’- GGCGTATCTGTGTGAGGACT |
| QIAxcel Advanced System | Qiagen | 9001941 | capillary electrophersis machine |
| QIAxcel DNA screening kit | Qiagen | 929004 | DNA buffer/ capillary electrophersis tubes |
| Qubit 1x ds HS Assay Kit | ThermoFisher Scientific | Q23851 | Fluorometer reagents/1x dsDNA solution |
| Qubit 4 Fluorometer | ThermoFisher Scientific | Q33238 | Fluorometer |
| Qubit Assay Tubes | Thermo Fisher Scientific | Q32856 | Fluorometer assay tubes |
| RIPA Lysis Buffer | VWR | VWRVN653-100ML | Lysis buffer for protein extraction |
| Trypsin-EDTA (0.05%), phenol red | ThermoFisher Scientific | 25300054 | Trypsin |
| Vortex-Genie 2 | Scientific industries | SI-0236 | Vortex |
| Xfect Transfection Reagent | Takara Bio | 631318 | Transfection reagent |
| genomic data analysis software | QIAGEN | CLC Workbench v21.0. | Data analysis software |
Referanslar
- Vítor, A. C., Huertas, P., Legube, G., de Almeida, S. F. Studying DNA double-strand break repair: an ever-growing toolbox. Frontiers in Molecular Biosciences. 7, (2020).
- Giglia-Mari, G., Zotter, A., Vermeulen, W. DNA damage response. Cold Spring Harbor Perspectives in Biology. 3 (1), 000745 (2011).
- Khanna, K. K., Jackson, S. P. DNA double-strand breaks: Signaling, repair and the cancer connection. Nature Genetics. 27 (3), 247-254 (2001).
- vanden Berg, J. G., et al. A limited number of double-strand DNA breaks is sufficient to delay cell cycle progression. Nucleic Acids Research. 46 (19), 10132-10144 (2018).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews Molecular Cell Biology. 18 (8), 495-506 (2017).
- Daley, J. M., Sung, P. 5. 3. B. P. 1. BRCA1, and the choice between recombination and end joining at DNA double-strand breaks. Molecular and Cellular Biology. 34 (8), 1380-1388 (2014).
- Godin, S. K., Sullivan, M. R., Bernstein, K. A. Novel insights into RAD51 activity and regulation during homologous recombination and DNA replication. Biochemistry and Cell Biology = Biochimie et Biologie Cellulaire. 94 (5), 407-418 (2016).
- Jette, N., Lees-Miller, S. P. The DNA-dependent protein kinase: a multifunctional protein kinase with roles in DNA double strand break repair and mitosis. Progress in Biophysics and Molecular Biology. 117, 194-205 (2015).
- Weterings, E., van Gent, D. C. The mechanism of non-homologous end-joining: A synopsis of synapsis. DNA Repair. 3 (11), 1425-1435 (2004).
- Bhargava, R., Lopezcolorado, F. W., Tsai, L. J., Stark, J. M. The canonical non-homologous end joining factor XLF promotes chromosomal deletion rearrangements in human cells. Journal of Biological Chemistry. 295 (1), 125-137 (2020).
- Gunn, A., Bennardo, N., Cheng, A., Stark, J. M. Correct end use during end joining of multiple chromosomal double strand breaks is influenced by repair protein RAD50, DNA-dependent protein kinase DNA-PKcs, and transcription context. Journal of Biological Chemistry. 286 (49), 42470-42482 (2011).
- Simsek, D., Jasin, M. Alternative end-joining is suppressed by the canonical NHEJ component Xrcc4-ligase IV during chromosomal translocation formation. Nature Structural & Molecular Biology. 17 (4), 410-416 (2010).
- Certo, M. T., et al. Tracking genome engineering outcome at individual DNA breakpoints. Nature Methods. 8 (8), 671-676 (2011).
- Murthy, V., et al. Characterizing DNA repair processes at transient and long-lasting double-strand DNA breaks by immunofluorescence microscopy. JoVE Journal of Visualized Experiments. (136), e57653 (2018).
- Wang, J. L., et al. Dissection of DNA double-strand-break repair using novel single-molecule forceps. Nature Structural & Molecular Biology. , (2018).
- Azzam, E. I., Jay-Gerin, J. -. P., Pain, D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury. Cancer Letters. 327, 48-60 (2012).
- Kuo, L. J., Yang, L. -. X. γ-H2AX - A novel biomarker for DNA double-strand breaks. In Vivo. 5, (2008).
- Sanders, J. T., et al. Radiation-induced DNA damage and repair effects on 3D genome organization. Nature Communications. 11 (1), 6178 (2020).
- Bellaiche, Y., Mogila, V., Perrimon, N. I-SceI endonuclease, a new tool for studying DNA double-strand break repair mechanisms in Drosophila. Genetics. 152 (3), 1037-1044 (1999).
- Wallace, N. A., Robinson, K., Howie, H. L., Galloway, D. A. β-HPV 5 and 8 E6 disrupt homology dependent double strand break repair by attenuating BRCA1 and BRCA2 expression and foci formation. PLOS Pathogens. 11 (3), 1004687 (2015).
- Hu, C., Bugbee, T., Gamez, M., Wallace, N. A. Beta human papillomavirus 8E6 attenuates non-homologous end joining by hindering DNA-PKcs activity. Cancers. 12 (9), 2356 (2020).
- Hu, C., Bugbee, T., Dacus, D., Palinski, R., Wallace, N. A. Beta human papillomavirus 8 E6 allows colocalization of non-homologous end joining and homologous recombination repair factors. PLOS Pathogens. 18 (3), 1010275 (2022).
- Butler, T. A. J., Paul, J. W., Chan, E. -. C., Smith, R., Tolosa, J. M. Misleading westerns: Common quantification mistakes in western blot densitometry and proposed corrective measures. BioMed Research International. 2019, 5214821 (2019).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX Phosphorylation on serine 139. Journal of Biological Chemistry. 273 (10), 5858-5868 (1998).
- Taning, C. N. T., Van Eynde, B., Yu, N., Ma, S., Smagghe, G. CRISPR/Cas9 in insects: Applications, best practices and biosafety concerns. Journal of Insect Physiology. 98, 245-257 (2017).
- Ghezraoui, H., et al. Chromosomal translocations in human cells are generated by canonical nonhomologous end-joining. Molecular Cell. 55 (6), 829-842 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır