Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Embriyonik Gelişimden Dejenerasyona Kadar Intervertebral Diskin Optik Kesitlenmesi ve Görselleştirilmesi
Bu Makalede
Özet
Intervertebral diskin anulus fibrozusunda optik kesit yöntemi kullanarak mekansal kondrosit organizasyonunu araştırmak için bir yöntem sunuyoruz.
Özet
Intervertebral disk (IVD) dejenerasyonu bel ağrısının önde gelen bir nedenidir ve etkilenen bireyler için yüksek derecede bozulma gerektirir. Disk dejenerasyonunun şifresini çözmek ve rejeneratif yaklaşımlar geliştirebilmek için IVD'nin hücresel biyolojisinin kapsamlı bir şekilde anlaşılması esastır. Bu biyolojinin hala cevapsız kalan bir yönü, hücrelerin fizyolojik bir durumda ve dejenerasyon sırasında nasıl mekansal olarak düzenlendiği sorusudur. IVD'nin biyolojik özellikleri ve mevcudiyeti bu dokunun analizini zorlaştırır. Bu çalışma anulus fibrozusunda erken embriyonik gelişimden son evre dejenerasyona kadar mekansal kondrosit organizasyonunu araştırmamaktadır. Omurga ameliyatı geçiren hastalardan elde edilen hayvan modeli ve insan disk dokusu olarak sığır embriyonik dokusu kullanılarak yüksek çözünürlüklü boyama analizleri yapmak için optik kesitleme yöntemi (Apotome) uygulanır. Erken embriyonik sığır diskinde çok yüksek bir kondrosit yoğunluğundan, gebelik, büyüme ve olgunlaşma sırasında hücre sayısı azalır. İnsan disklerinde, hücresel yoğunluktaki bir artış doku dejenerasyonu ilerlemesine eşlik etti. Eklem kıkırdaklarında daha önce de gösterildiği gibi, küme oluşumu gelişmiş disk dejenerasyonun karakteristik bir özelliğini temsil eder.
Giriş
Intervertebral disk (IVD), biyokimyasal olarak ve hücresel mimariye göre, ilk bakışta, eklem kıkırdağı1'ebirçok yönden benzeyen kıkırdak bazlı bir yapıdır. Nitekim, eklem kıkırdusunun hem IVD dejenerasyonu hem de osteoartrit (OA), kıkırdak aşınması, subkondral kist ve osteofit oluşumu ve subkondral skleroz2,3nedeniyle eklem alanı daralması ile karakterizedir. Bu görünüşte benzerliklere rağmen mimari ve her iki dokunun fonksiyonel rolü farklıdır. Eklem kıkırdak matrisi esas olarak bir arcade oluşturan kolajen tip II ağından oluşurken, IVD üç farklı doku türünden oluşur: merkezdeki kollajen tipi II bakımından zengin çekirdek pulposus eksenel yükleri kaplar ve bunları anulus fibrosus adı verilen yoğun paketlenmiş dairesel kollajen tipi I liflerinin kuşatıcı bir halkasına iletir. İşlevleri, proteoglikan ve su bakımından zengin çekirdeğin aldığı çevrilmiş eksenel basınçları, gerilme boyuna lif mukavemetleriyle emmektir. Her çekirdeğin ve anulusun üst ve alt kısmında bir hyaline kıkırdaklı uç plakası bitişik omurlar4 (Şekil 1)için birleşim oluşturur.
Eklem kıkırdaklarında dört farklı mekansal kondrosit deseni bulunabilir: çiftler, dizeler, çift telli, küçük sırasıyla büyük kümeler5,6,7 ( Şekil2). Bu desendeki değişiklikler OA başlangıcı ve ilerlemesi8,9ile ilişkilidir. Mekansal kondrosit organizasyonu, kıkırdağın doğrudan işlevsel bir özelliği, yani sertliği için de gösterge niteliğindedir ve bu görüntü tabanlı derecelendirme yaklaşımının işlevsel ilgisinin altını çizmektedir10,11. Bu desenler ayrıca zaten mevcut olan klinik olarak mevcut teknoloji12ile tanımlanabilir. IVD ve eklem kıkırdağı arasındaki benzerlikler nedeniyle, karakteristik kondrosit desenlerinin DE IVD'de mevcut olduğu varsayılabilir. Küme oluşumu dejenere IVD13,14'te de gözlenen bir olgudur.
IVD'deki mekansal hücresel organizasyonu analiz etmeye çalışırken, eklem kıkırdaklarını araştırırken mevcut olmayan birkaç teknik zorluğun üstesinden gelmek gerekir:
İlk olarak, dokunun kendisinin işlenmesi, büyük ölçüde kollajen tip II'den oluşan homojen hyaline kıkırdaktan çok daha zordur. IVD'nin ana lif bileşeni kollajen tip I'dir, bu da ince histolojik bölümler üretmeyi çok daha zor hale getirir. Hyaline eklem kıkırdağında, dokunun "cam benzeri" doğası nedeniyle kalın bölümler bile kolayca analiz edilebilirken, IVD'nin kollajen tipi I ağı optik olarak son derece aşılamazdır. Bu nedenle, güçlü bir arka plan gürültüsü IVD histolojisinde yaygın bir sorundur. Bu optik yoğun dokuya nüfuz etmenin hızlı ve ucuz bir yolu, örneğin bir Apotome aracılığıyla optik bir kesit cihazının kullanılmasıdır. Böyle bir Apotome'de, geleneksel bir floresan mikroskopunun aydınlatma yoluna bir ızgara yerleştirilir. Izgaranın önüne düzlem paralel bir cam plaka yerleştirilir. Bu, görüntüdeki ızgarayı üç farklı konumda yansıtarak ileri geri eğilir. Her z konumu için, yansıtılan ızgaraya sahip üç ham görüntü oluşturulur ve üst üste bindirilir. Özel yazılımlar vasıflı olarak, odak dışı ışık hesaplanabilir. Temel ilke, ızgara görünürse, bu bilgilerin odakta olmasıdır, değilse odak dışında olduğu kabul edilir. Bu teknikle, iyi odaklanmış ve yüksek çözünürlüklü görüntüler makul bir sürede elde edilebilir.
İkincisi, insan donörlerden doku bulmak zor. Total diz protezi yaparken ameliyat sırasında daha fazla analiz için eklemin tüm yüzeyi elde edilebilir. Diarthrodial eklemin osteoartriti aynı zamanda tüm eklemin bir hastalığı olmasına rağmen, kıkırdak kalitesinde güçlü odak farklılıkları vardır ve genellikle eklemin bazı bölgeleri hala bozulmamıştır, örneğin bu alanda yüklemenin azalması nedeniyle. Bu durum, ameliyatın genellikle sadece disk küresel olarak tahrip edildiğinde yapıldığı IVD'de farklıdır. Operasyon odasından insan donörlerden doku elde edilirken, doku da oldukça parçalıdır ve daha fazla analiz yapmadan önce dokuyu IVD'nin üç kıkırdak türünden birine doğru bir şekilde tahsis etmek gerekir. Daha büyük doku bölümlerinin daha ayrıntılı analizlerine izin vermek ve IVD'nin embriyonik gelişimine bakmak için bir hayvan modeli organizma seçimi gereklidir.
Böyle bir model organizma seçerken, anatomisi ve boyutları, mekanik yüklemesi, mevcut hücre popülasyonu ve doku bileşimi açısından insan diski ile karşılaştırılabilir bir sisteme sahip olmak önemlidir. Burada sunulan tekniğin amacı için sığır bel disk dokusunun kullanılmasını öneriyoruz: İnsan diskinin düşük rejeneratif potansiyeli ile sonuçlanan kritik bir özelliği, çekirdekteki olgunlaşma sırasında notochordal hücrelerin kaybıdır. Bununla birlikte, çok sayıda model organizmada notochordal hücreler tüm yaşamları boyunca tespit edilebilir. Koyun, keçi veya kondrodistrophig köpekleri gibi notochordal hücrelerini kaybeden az sayıda hayvanın çoğu, insan disklerinden çok daha küçük bir IVD'ye sahiptir. Sadece lumbar sığır diskleri, insanIVD'lerininkiylekarşılaştırılabilir bir sagittal disk çapına sahip 15 .
Erken disk dejenerasyonuna yol açan önemli bir faktör aşırı mekanik yüklemedir. Bel omurgasında duran bir intradiskal basınçları, omurga yatay olarak hizalanmış olarak 0,8 MPa civarındadır. Şaşırtıcı bir şekilde bu basınçlar, dik insan omurgası (0,5 MPa)15,16için bildirilen bel intradiskal basınçlarla karşılaştırılabilir. Ayrıca sığır disklerindeki su ve proteoglikan miktarı, genç insanlardan IVD ile karşılaştırılabilir17. Bu nedenle, hareket segmentlerinin gerçek hareket düzeni, iki ayaklı insandan dört katına çıkarken, toplam yükleme ve disk özellikleri açısından farklılık gösterse de, insan biyolojisine koyun ve köpek gibi IVD için diğer yerleşik hayvan modellerinden çok daha yakındır.
Bu protokolde, erken embriyonik gelişimden evre dejenerasyonuna kadar mekansal kondrosit organizasyonu açısından IVD'deki değişikliklerin nasıl analiz edeceğine dair bir teknik sunuyoruz.
Protokol
Embriyonik gelişim ve olgunlaşma analizi için sığır diskleri kullanıldı. IVD'nin dejenerasyonunu değerlendirmek için insan örnekleri analiz edildi.
Tübingen Üniversitesi Hastanesi ortopedi cerrahisi bölümü ve BG Travma Merkezi Tübingen'de bel disk dejenerasyonu, disk prolapsi veya spinal travma nedeniyle ameliyat olan hastalardan insan IVD dokusu elde edildi. Çalışma başlamadan önce tam etik kurul onayı alınmıştır (proje numarası 244/2013BO2). Katılımdan önce tüm hastalardan yazılı bilgilendirilmiş onam alındı. Yöntemler onaylanmış yönergelere uygun olarak gerçekleştirilmiştir.
Sığır dokusu Bavyera Eyalet Sağlık ve Gıda Güvenliği Ofisi/Oberschleißheim'dan ve Warthausen'deki (Almanya) bir işleme tesisinden elde edildi. Ölü hayvanlardan alınan dokular için yerel ve veteriner yetkililerin onayı alındı.
1. Örnek hasat
- İnsan IVD dokusu: İntraoperatif olarak elde edilen IVD örneklerini dulbecco'nun Modifiye Kartal Ortamına (DMEM) derhal % 2 (v/v) penisilin-streptomisin ve %1,2 (v/v) amfoterisin B. Store'a bir sonraki işleme kadar yerleştirin. Dokuyu 48 saat içinde işleyin. Alternatif olarak, dokuları birkaç hafta boyunca -20 ° C'de saklayın.
- Sığır IVD dokusu: Ölümden sonra 24 saat içinde hayvanlardan doku toplamayı sağlayın.
Sığır disklerini, ölü hayvanlar bloğundan çevredeki omurlarla resect. Donmuş dokuyu kuru buz üzerinde taşıyın ve bir sonraki işleme kadar -20 °C'de saklayın.
NOT: Sadece floresan analizleri amaçlanıyorsa ve ELISA veya PCR gibi başka biyokimyasal niceleme yöntemleri planlanmazsa, doku fiksasyonunu aşağıda açıklandığı gibi gerçekleştirin. Bu, dokunun işlenmesi gerekmeden önce depoda daha uzun süre kalmasını sağlar. Doku matrisinin bozulmasını önlemek için, doku doğrudan dondurulmadığı sürece hasat sonrası 48 saat içinde fiksasyon gerçekleştirin.
2. Numune hazırlama
- Donmuş dokuyu oda sıcaklığında çözün. Dokunun dijital nazik sıkıştırması üzerine artık hiçbir buz kristali hissedilemez.
NOT: DMEM'deki dokunun bir Petri kabında hazırlanmasını gerçekleştirin. - Kollajen yoğunluğu ve oryantasyonu gibi makroskopik özelliklere dayanarak insan IVD dokusunun kökenini (anulus fibrosus, ara bölge, çekirdek pulposus veya kıkırdaklı uç plaka) tanımlayın.
- İki bitişik omurlu sığır IVD diskinden oluşan hareket segmentini alın ve diski cerrahi bir bıçak kullanarak alt kemikten bir bütün olarak parçalara ayırın (bıçak numarası 15).
- Daha ortalanmış alanlara ulaşmak için diski çevirmek için iki anatomik tokmak kullanın. Diseksiyonu gerçekleştirin. Anulustan çok daha ince, yırtılmaya eğilimli ve kolayca tanımlanmış bir şekilde çıkmadığı için çekirdek pulposus'un en son rezeksiyonunu sağladığından emin olun.
- Kıkırdağın farklı bölgelerini tanımlayın.
- Cerrahi bir bıçak (20 veya 22 numaralı bıçak) kullanarak tüm diskten ilgi alanını kesin. Alternatif olarak, bir kriyotome bıçağı kullanın.
NOT: Sığır diskleri omurganın bir parçası olarak en-blok olarak geldiğinden, diskler toto olarak hazırlanabilir. Bu, farklı kıkırdak türlerinin doğru tanımlanmasını çok daha kolay hale getirir. Diski yukarıda açıklanan şekilde parçalarken, kıkırdaklı uç plakası omurlarda kalır. Bu bölge araştırılacaksa, en iyi alttaki kemikten hafif bükülmüş teğet bir yönde çalışan bir keski ile alınır.
- Embriyoların 20 cm'den daha küçük bir taç-rump uzunluğunda olması durumunda, IVD'nin doku mimarisini korumak için embriyoların toto olarak işlenmesini sağlayın. Bu durumlarda omurların diseksiyonunu yapmayın.
- Disk in-toto olarak yeniden seçildikten sonra, kıkırdağın farklı alanlarını tanımlayın.
- Etileniaminetetraasetik asitte (EDTA) (%20 (w/v); pH = 7,4) kireç çözmeyi oda sıcaklığında gerçekleştirin. Örnek boyutuna bağlı olarak hacmi seçin - tüm doku EDTA ile iyi kaplanmalıdır.
- Dokunun büyüklüğüne bağlı olarak 5 güne kadar gidebilen kireç çözme çözeltisini günlük olarak değiştirin.
- Kireç çözmenin, omurlara önemli bir direnç olmadan nüfuz eden 20 Gauge iğne ile başarılı olduğunu doğrulayın.
NOT: Şelat bağlayıcı EDTA'nın reaksiyon efektivitesini korumak için doygunluğunu önlemek için kireç çözme çözeltisinin günlük değişimi önemlidir. Ayrıca bakteriyel kolonizasyonu önler.
3. Örnek yaş, bütünlük ve dejenerasyon derecelendirmesi
- Klinik bilgilerin yanı sıra röntgen ve manyetik rezonans görüntüleme18 (Şekil 3)yardımıyla insan disk dokusunu aşağıdaki beş kategoriden birine sınıflandırın.
NOT: Kategori I: Sağlıklıya yakın örnek olarak hizmet vermek için akut spinal travmadan elde edilen IVD dejenerasyonuna dair herhangi bir radyolojik işaret olmadan anulus kullanın.
Kategori II: Başlangıç dejenerasyonu ile akut inflamasyon durumunu göstermek için, 4 haftadan kısa süreli klinik semptomları olan hastalardan ara bölgeden doku kullanın.
Kategori III: enflamatuar reaksiyonun dokuyu etkilemek için zaten zamanı olduğu ve hücrelerin nükleer prolapsi için ameliyat edilen ancak semptom süresi 4 haftayı aşan hastalardan doku aldığı bir durumu tanımlamak için.
Kategori IV: Orta derecede disk dejenerasyonu için manyetik rezonans görüntülemede Pfirrmann skoru 3 veya 4 olan dejeneratif disk hastalığı için interbody füzyonlu cerrahiden elde edilen anulus seçin19.
Kategori V: Pfirrmann skoru 5 olan dejeneratif disk hastalığı için interbody füzyon ile cerrahiden elde edilen son evre dejenerasyon süreci anulus için. - Sığır dokusunu, hayvanın gelişim evresine/yaşına göre Tablo 1'degösterildiği gibi sekiz kategoriden birine sınıflandırın.
- Keller tarafından önerilen formüle dayanarak embriyoların taç-rump uzunluğu üzerindeki gebelik yaşını hesaplayın:
Aylar içinde gebelik yaşı =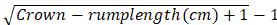
NOT: Gebelik ilk 4 haftasında hayvanlar 0.8-2.2 cm20taç-rump uzunluğu ile mevcuttur.
- Keller tarafından önerilen formüle dayanarak embriyoların taç-rump uzunluğu üzerindeki gebelik yaşını hesaplayın:
4. Doku fiksasyonu
- Numuneleri, 4 °C'de gece boyunca fosfat tamponlu salin (PBS) içinde% 4 (w/ v) formaldehit çözeltisi numunesinin hacmini 10 kat sabitleyin.
NOT: Formaldehit çözeltisi dokuya her yönden yaklaşık 1 mm/saat oranında nüfuz eder. Çok küçük veya çok büyük numuneler için maruz kalma süresinin ayarlanmasında gerekli olabilir. - Bir sonraki işleme kadar dokuyu PBS'de 4 °C'de saklayın.
5. Histolojik bölümleme
- Numuneleri suda çözünür gömme ortamına kriyotome düğmesine gömün.
- Dokuyu, eksenel bir düzlem veya kollajen tipi I lamel dik kesen bir düzlem (örneğin, ortanca sagittal kesit düzlemi) olacak şekilde düğmeye yerleştirin.
NOT: Doku, gömme ortamı tarafından tamamen kaplanmalıdır.
- Dokuyu, eksenel bir düzlem veya kollajen tipi I lamel dik kesen bir düzlem (örneğin, ortanca sagittal kesit düzlemi) olacak şekilde düğmeye yerleştirin.
- Gömülü dokuyu insan örneklerinde 70 μm ve sığır örneklerinde 40 μm kalınlığında standart bir kriyotome kullanarak bölümle.
NOT: Kesit kalınlığındaki fark, sağlam sığır diski ile son derece dejenere insan dokusu arasındaki doku bütünlüğündeki farkândan kaynaklanmaktadır. - Bölümleri cam slaytta toplayın.
- Doku bölümlerini hidrofobik bir kalemle çevrele.
- Suda çözünen gömme ortamını çıkarmak için bölümleri fosfat tamponlu salin (PBS) ile 3 kez durulayın.
6. Floresan boyama
- PBS'de %1 (v/v) DAPI (Exmax 358 nm, Emmax 461 nm) ve %1 (v/v) Actin Tracking boyama (Exmax 540 nm, Emmax 565 nm) 60 μL ekleyin ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
NOT: Burada açıklanan boyama protokolü, DAPI nükleer boyama (mavi) kullanarak çekirdeği ve Actin Takip Lekesi (kırmızı) kullanarak sitoplazma kullanarak çekirdeği görselleştirmektir. IVD, yeşil kanaldaki kolajen lifleri nedeniyle güçlü bir otoflüoresansa sahiptir. Bu protokoldeki bölümlere eklenen sıvı miktarı yaklaşık 5 mm x 5 mm büyüklüğündeki bölümler için tasarlanmıştır. Daha büyük bölümler için bu miktarın buna göre artırılması gerekir. Boyanın ağartmasını önlemek için tüm işleri doğrudan güneş ışığına maruz kalmadan ve karartılmış ışıklarla odalarda gerçekleştirin. - Boyama sıvısını bir pipetle çıkarın ve her seferinde 60 μL PBS ile üç kez yıkayın.
- Uygun bir montaj ortamı ekleyin ve bölümleri bir kapak kayması ile örtün.
NOT: Kapak fişini eklerken kapamış hava kabarcıkları olmadığından emin olun. Bu en iyi, kaymanın bir kenarda slaytla temasına başlayarak ve daha sonra kaymanın yavaşça aşağı inmesine izin vererek yapılır.
7. Mikroskobik görüntüleme ve işleme
- Mikroskopun örnek tutucusunun üzerine lekeli bir bölüm içeren bir slayt yerleştirin.
NOT: IVD'nin yoğun kollajen tipi I ağı nedeniyle, dağınık ışık geleneksel floresan mikroskopisi kullanılarak dokunun görselleştirilmesini zorlaştırır. Bu sorunu çözmenin bir yolu, yapılandırılmış aydınlatma kullanarak optik bölümleme yapmaktır. Bu aynı zamanda her iki kanalda da (mavi ve kırmızı) tüm numunenin üç boyutlu projeksiyonunun oluşturulmasını sağlar. Bu, en iyi şekilde, numuneye genel bir bakış ve bireysel desenlerin 3D rekonstrüksiyonlarını elde etmek için yapılandırılmış aydınlatma ayarı ve 10x büyütme objektif lensli Mozaik modu kullanılarak yapılır. - Yapılandırılmış aydınlatma cihazını başlatın.
- Uygun bir floresan mikroskobu, floresan filtreleri ve yeterli aydınlatma ile tek görüş alanı görüntüleme gerçekleştirin.
NOT: Görüntüleme alımını standartlaştırmak için kullanılan tüm filtrelerin pozlama süresini ayarlayın. Numunenin daha yüksek çözünürlüklü bir görüntüde doğru bir şekilde temsil edilmesini sağlamak için, daha yüksek büyütmeye sahip bölümler (örneğin, 20x hedefi). - Floresan mikroskobu ile uyumlu bir görüntü optimizasyonu yazılımı kullanarak yoğunluğu ve parlaklığı optimize ederek resimleri işle.
- Uygun bir floresan mikroskobu, floresan filtreleri ve yeterli aydınlatma ile tek görüş alanı görüntüleme gerçekleştirin.
- Bölümü bir bütün olarak görselleştirmek için mozaik görüntüleme tekniğini kullanın
- Araç çubuğu panelinden edinme ayarlarını açın (6D- Edinmetuşuna basın).
- Mozaik ayarlarını yapın (MosaiXRegister'da) ve daha sonra tek bir genel bakış görüntüsüyle birleştirilecek görünüm alanı görüntülerinin sütun ve satır sayısını tanımlayın.
- Kur'a basın ve tek tek kutucukların odak düzeltmesini ayarlayın.
NOT: Büyük bir doku bölümünün tüm doku yüzeyinin tek bir odak düzleminde olması neredeyse imkansızdır. Farklı odak seviyelerindeki görüntü karoları 'MosaiX Acquisition' tarafından alınabilir. - Görüntü kutucuklarının alımını başlatmak için Başlat 'abasın.
- Yazılıma %20 örtülen dikiş işlevini(Dikiş düğmesi) kullanarak görüntülenmiş fayansları dikin.
- Floresan mikroskobu ile uyumlu bir görüntü optimizasyonu yazılımı kullanarak yoğunluğu ve parlaklığı optimize ederek resimleri işle.
- Uzamsal kondrosit organizasyonunu analiz etmek için yazılıma dahil edilen 3B işlevi kullanın.
- z yığını ayarlarını yapın. Tarama parametrelerini tanımlayın: Başlat/Durdur düğmesini etkinleştirerek z eksenindeki başlangıç ve durdurma konumlarını ve dilim mesafesini tanımlayın.
NOT: Yazılım, dilim sayısını otomatik olarak hesaplar. - Görüntü z yığınlarının alınmasını başlatmak için Başlat 'abasın.
- Floresan mikroskobu ile uyumlu bir görüntü optimizasyonu yazılımı kullanarak yoğunluğu ve parlaklığı optimize ederek resimleri işle.
- z yığını ayarlarını yapın. Tarama parametrelerini tanımlayın: Başlat/Durdur düğmesini etkinleştirerek z eksenindeki başlangıç ve durdurma konumlarını ve dilim mesafesini tanımlayın.
- Resimleri görüntü işleme yazılımıyla uyumlu bir dosya biçimiyle dışa aktarın.
NOT: 3B rekonstrüksiyonları tek tek görüntüler veya/ve etkileşimli bir 3B model olarak veya video biçiminde dışa aktarın.
8. Hücresel desen tanımlama ve yoğunluk değerlendirmesi
- Tüm doku bölümünün dışa aktarılan mozaik resimlerini uygun bir görüntü işleme programında açın.
- Resimlerde 500 μm x 500 μm ilgi alanlarını tanımlayarak hücre yoğunluğu değerlendirmesine tabi tutulan alanları tanımlayın.
NOT: Yeterli görüntü kalitesine sahip olmayan tüm kutucuklar analiz dışıdır. - Tek tek hücresel kalıpları tanımlayın.
NOT: Tek hücreler tek tek hücreler olarak tanımlanır - bitişik matris içinde tamamen kapsüllenmiştir. Çiftler, hücrelerin matrisleri aracılığıyla birbirine bağlandığı yakın mesafedeki iki bitişik hücre (<25 μm) olarak tanımlanır (bkz. Şekil 2). Dize oluşumları hizaya hizalanmış en az üç kondrosittir (çekirdeğin ortasından <25 μm). Bu hücreler sağlam bir matris tarafından kuşatılmıştır ve her hücre arasında matris ara bağlantıları görülebilir. Kümeler, birbirine doğrudan yakın (<25 μm) bulunan ve matristen yoksun büyük bir lacuna içinde kapsüllenmiş birden fazla hücreyi temsil eder. - Hücresel desenlerin nicel analizi için bir hücre sayısı eklentisi kullanın.
NOT: Sitoplazma lekeleme, farklı uzamsal kalıpları tanımlamak için bir doğrulama yöntemini temsil eder. - Sayılan hücreleri seçilen ilgi alanına göre bölerek hücre yoğunluğunu hesaplayın.
Sonuçlar
Mozaik görüntüler kullanılarak, anulus ve daha yumuşak çekirdeklerdeki yoğun kolajen lif ağı ile IVD mimarisi açıkça tanınabilir (Şekil 4). Embriyonik gelişim sırasında hücresel yoğunlukta sürekli bir azalma gözlenebilir (Şekil 5). IVD gelişiminin ilk aşamalarında sığır anulus fibrosusunda 11.435 hücre/mm², sığır çekirdeği pulposusunda ise 17.426 hücre/mm² hücre yoğunluğu bulunabilirken, bu sayılar doğuma kadar hızla 1....
Tartışmalar
Mozaik görüntüleme ve optik kesit ile güçlendirilen floresan mikroskopiyi kullanarak, kondrositlerin bel IVD'nin anulusundaki mekansal düzenini gelişim, olgunlaşma ve dejenerasyon boyunca değerlendirdik. Disk dejenerasyonu için omurga ameliyatı alan hastalardan dejeneratif doku toplanabilirken, embriyonik dönem ve olgunlaşma evresinin analizi model bir organizma (sığır) kullanılmasını gerektirdi. Erken embriyonik gelişim sırasında anulusta yüksek hücresel yoğunluklar kaydedildi. Gelişimin ileris...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Orijinal yayınlardan ortak yazarlarımıza yardımları ve destekleri için teşekkür ederiz. Charlotte Emma Bamberger'e apotom görüntülerini elde etmesine yardımcı olduğu için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Referanslar
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır