Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптическое сечение и визуализация межпозвоночного диска от эмбрионального развития до дегенерации
В этой статье
Резюме
Представлен метод исследования пространственной организации хондроцитов в анальном волокнистом межпозвоночном диске с использованием метода оптического сечения.
Аннотация
Дегенерация межпозвоночного диска (IVD) является основной причиной боли в пояснице и влечет за собой высокую степень нарушения для пострадавших лиц. Чтобы расшифровать дегенерацию диска и иметь возможность развивать регенеративные подходы, необходимо глубокое понимание клеточной биологии IVD. Одним из аспектов этой биологии, который до сих пор остается без ответа, является вопрос о том, как клетки пространственно расположены в физиологическом состоянии и во время дегенерации. Биологические свойства IVD и его доступность затрудняют анализ этой ткани. Настоящее исследование исследует пространственную организацию хондроцитов в фиброзе анула от раннего эмбрионального развития до терминальной стадии дегенерации. Метод оптического сечения (Apotome) применяется для выполнения анализов окрашивания с высоким разрешением с использованием эмбриональной ткани крупного рогатого скота в качестве животной модели и ткани человеческого диска, полученной от пациентов, перенесших операцию на позвоночнике. От очень высокой плотности хондроцитов в раннем эмбриональном бычьем диске количество клеток уменьшается во время беременности, роста и созревания. В дисках человека увеличение клеточной плотности сопровождало прогрессирование дегенерации тканей. Как уже было продемонстрировано в суставном хряще, кластерное образование представляет собой характерную особенность прогрессирующей дегенерации диска.
Введение
Межпозвоночный диск (IVD) представляет собой структуру на основе хряща, которая биохимически и по отношению к клеточной архитектуре, на первый взгляд, во многом напоминает суставной хрящ1. Действительно, как IVD-дегенерация, так и остеоартрит (ОА) суставного хряща характеризуются сужением суставного пространства из-за износа хряща, субхондральной кисты и образования остеофита, а также субхондральным склерозом2,3. Несмотря на эти кажущиеся сходства, архитектура и функциональная роль обеих тканей различаются. В то время как матрица суставного хряща в основном состоит из аркадообразующей коллагеновой сети типа II, IVD состоит из трех различных типов тканей: богатое коллагеном ядро пульпозного ядра типа II в центре принимает осевые нагрузки и передает их в охватывающее кольцо плотно упакованных круглых коллагеновых волокон типа I, которое называется anulus fibrosus. Их функция состоит в том, чтобы поглощать переведенные осевые давления, получаемые протеогликан- и водой богатым ядром, с их прочностью на растяжение продольного волокна. В верхней и нижней части каждого ядра и анула гиалиновая хрящевая концевая пластина образует соединение с соседними позвонками4 (рисунок 1).
В суставном хряще можно найти четыре отчетливых пространственных хондроцитарных паттерна: пары, струны, двойные струны, маленькие соответственно большие кластеры5,6,7 (рисунок 2). Изменения в этой картине связаны с началом И прогрессированием ОА8,9. Пространственная организация хондроцитов также свидетельствует о прямом функциональном свойстве хряща, а именно его жесткости, подчеркивая функциональную актуальность этого подхода к классификации на основе изображений10,11. Эти закономерности могут быть дополнительно идентифицированы с помощью уже существующей клинически доступной технологии12. Из-за сходства между IVD и суставным хрящом можно предположить, что характерные хондроцитарные паттерны также присутствуют в IVD. Кластерообразование – явление, также наблюдаемое в вырожденных IVD13,14.
При попытке проанализировать пространственную клеточную организацию в IVD необходимо преодолеть несколько технических трудностей, которые отсутствуют при исследовании суставного хряща:
Во-первых, обработка самой ткани намного сложнее, чем с однородным гиалинным хрящом, который в значительной степени состоит из коллагена типа II. Основным компонентом волокна IVD является коллаген типа I, что значительно затрудняет создание тонких гистологических срезов. В то время как в гиалиновом суставном хряще даже толстые участки могут быть легко проанализированы из-за «стеклоподобной» природы ткани, коллагеновая сеть типа I IVD оптически очень непроницаема. По этой причине сильный фоновый шум является распространенной проблемой в гистологии IVD. Быстрым и дешевым способом проникновения в эту оптически плотную ткань является использование устройства оптического сечения, например, с помощью апотома. В таком апотоме сетка вставляется в путь освещения обычного флуоресцентного микроскопа. Перед сеткой размещена плоскопараллельная стеклянная пластина. Это наклоняется вперед и назад, таким образом, проецируя сетку на изображении в трех разных положениях. Для каждой z-позиции создаются и накладываются три необработанных изображения с проецируемой сеткой. С помощью специального программного обеспечения можно рассчитать свет вне фокуса. Основной принцип заключается в том, что, если сетка видна, эта информация находится в фокусе, если нет, она считается не в фокусе. С помощью этой техники хорошо сфокусированные изображения с высоким разрешением могут быть получены за разумное количество времени.
Во-вторых, ткань трудно получить от человеческих доноров. При проведении тотальной замены коленного сустава можно получить всю поверхность сустава для дальнейшего анализа во время операции. Хотя остеоартрит диартродиального сустава также является заболеванием всего сустава, тем не менее, существуют сильные очаговые различия в качестве хряща, причем обычно некоторые области сустава все еще неповреждены, например, из-за снижения нагрузки в этой области. Эта ситуация отличается в IVD, где операция обычно выполняется только тогда, когда диск глобально разрушен. При получении ткани от доноров человека из операционной, ткань также сильно фрагментирована и необходимо правильно распределить ткань к одному из трех типов хряща IVD перед проведением дальнейших анализов. Поэтому для более детального анализа более крупных участков тканей и изучения эмбрионального развития IVD необходим выбор животного модельного организма.
При выборе такого модельного организма важно иметь систему, сопоставимую с человеческим диском по анатомии и размерам, механической нагрузке, существующей клеточной популяции, а также по составу тканей. Для целей представленной здесь методики мы предлагаем использовать ткань поясничного диска крупного рогатого скота: критическим свойством диска человека, приводящим к его низкому регенеративному потенциалу, является потеря нотохордальных клеток при созревании в ядре. Однако в многочисленных модельных организмах нотохордальные клетки могут быть обнаружены на протяжении всей их жизни. Большинство из немногих животных, которые теряют свои нотохордальные клетки, такие как овцы, козы или хондродистрофические собаки, имеют IVD, который намного меньше, чем человеческие диски. Только поясничные бычьи диски имеют диаметр сагиттального диска, сопоставимый с диаметром ivD человека15.
Ключевым фактором, приводящим к ранней дегенерации диска, является чрезмерная механическая нагрузка. Внутридисковое давление стоящей коровы в поясничном отделе позвоночника составляет около 0,8 МПа, при этом позвоночник выровнен горизонтально. Удивительно, но эти давления сопоставимы с поясничным внутридисковым давлением, зарегистрированным для эрегированного позвоночника человека (0,5 МПа)15,16. Также количество воды и протеогликанов в бычьих дисках сопоставимо с таковым у IVD у молодых людей17. Поэтому, хотя фактическая картина движения сегментов движения может отличаться у четвероногих животных от двуногого человека, в отношении общей нагрузки и характеристик диска, корова гораздо ближе к биологии человека, чем другие установленные модели животных для IVD, такие как овцы и собаки.
В этом протоколе представлена методика анализа изменений IVD с точки зрения пространственной организации хондроцитов от раннего эмбрионального развития до терминальной стадии дегенерации.
протокол
Для анализа эмбрионального развития и созревания использовались бычьи диски. Чтобы оценить дегенерацию IVD, были проанализированы образцы человека.
Ткань IVD человека была получена от пациентов, перенесших операцию по поводу дегенерации поясничного диска, пролапса диска или травмы позвоночника в отделении ортопедической хирургии, университетской клинике Тюбингена и травматологическом центре BG в Тюбингене. Полное одобрение этического комитета было получено до начала исследования (проект No 244/2013BO2). Письменное информированное согласие было получено от всех пациентов до участия. Методы проводились в соответствии с утвержденными руководящими принципами.
Бычья ткань была получена из Баварского государственного управления по здравоохранению и безопасности пищевых продуктов /Oberschleißheim и на заводе по переработке в Вартхаузене (Германия). Было получено одобрение местных и ветеринарных властей на ткани от мертвых животных.
1. Образец урожая
- Ткань IVD человека: Поместите интраоперационно полученные образцы IVD немедленно в модифицированную орлиную среду Dulbecco (DMEM) с 2% (v / v) пенициллина-стрептомицина и 1,2% (v / v) амфотерицина B. Хранить при 4 ° C до дальнейшей обработки. Обработать ткань в течение 48 ч. Кроме того, храните ткани при -20 °C в течение нескольких недель.
- Бычья ткань IVD: Убедитесь, что ткань у животных собрана в течение 24 часов после смерти.
Резекция бычьих дисков с окружающими позвонками от мертвых животных en-bloc. Транспортируйте замороженную ткань на сухом льду и храните при -20 °C до дальнейшей обработки.
ПРИМЕЧАНИЕ: Если предназначены только флуоресцентные анализы и не планируются дальнейшие методы биохимической количественной оценки, такие как ИФА или ПЦР, выполните фиксацию ткани, как описано ниже. Это позволяет дольше удерживать ткань в хранилище до того, как ее нужно будет обработать. Чтобы предотвратить ухудшение тканевого матрикса, выполните фиксацию в течение 48 ч после сбора урожая, если ткань не заморожена напрямую.
2. Пробоподготовка
- Разморозить замороженную ткань при комнатной температуре. Обработайте ткань, как только кристаллы льда больше не могут ощущаться при цифровом мягком сжатии ткани.
ПРИМЕЧАНИЕ: Выполняют приготовление ткани в ДМЭМ в чашке Петри. - Определить происхождение ткани IVD человека (волокнистый анул, промежуточная зона, пульпозное ядро или хрящевая концевая пластина) на основе макроскопических свойств, таких как плотность и ориентация коллагена.
- Возьмите сегмент движения, состоящий из бычьего IVD диска с двумя соседними позвонками и рассекните диск целиком от субхондральной кости с помощью хирургического лезвия (лезвие No 15).
- Используйте два анатомических щипца, чтобы перевернуть диск, чтобы достичь областей, более центрированных. Выполните рассечение. Убедитесь, что резецирует пульпозное ядро последним, так как оно намного тоньше анула, склонно к разрыву, и оно не отрывается определенным образом легко.
- Определите различные участки хряща.
- Вырежьте интересующую область из всего диска с помощью хирургического лезвия (лезвие No 20 или 22). В качестве альтернативы можно использовать криотомное лезвие.
ПРИМЕЧАНИЕ: Поскольку бычьи диски входят в блок как часть позвоночника, диски могут быть подготовлены in-toto. Это значительно облегчает правильную идентификацию различных типов хряща. При рассечении диска описанным выше способом хрящевая концевая пластина остается на позвонках. Если эта область должна быть исследована, то ее лучше всего снять с подлежащей кости зубилом, работающим в слегка изогнутом тангенциальном направлении.
- В случае, если эмбрионы имеют длину коронки-крестца менее 20 см, убедитесь, что эмбрионы обработаны в тото, чтобы сохранить тканевую архитектуру IVD. Не выполняйте никакого рассечения позвонков в этих случаях.
- После того, как диск был резецирован in-toto, определите различные области хряща.
- Выполняют декальцификацию в этилендиаминтетрауксусной кислоте (ЭДТА) (20% (мас./об.); рН = 7,4) при комнатной температуре. Выбирайте объем в зависимости от размера выборки – вся ткань должна быть хорошо покрыта ЭДТА.
- Ежедневно меняйте декальцинационный раствор, который может длиться до 5 дней в зависимости от размера ткани.
- Убедитесь, что декальцинация успешна с помощью иглы 20 калибра, которая проникает в позвонки без заметного сопротивления.
ПРИМЕЧАНИЕ: Ежедневная смена декальцификационного раствора важна для предотвращения насыщения хелатного связующего ЭДТА для поддержания эффективности реакции. Он также предотвращает бактериальную колонизацию.
3. Классификация возраста выборки, целостности и дегенерации
- Классифицируйте ткань диска человека в одну из пяти следующих категорий с помощью клинической информации, а также рентгеновской и магнитно-резонансной томографии18 (рисунок 3).
ПРИМЕЧАНИЕ: Категория I: Для использования в качестве почти здорового образца используйте анулус без каких-либо радиологических признаков дегенерации IVD, полученной в результате острой травмы позвоночника.
Категория II: Для иллюстрации ситуации острого воспаления с началом дегенерации используют ткани из промежуточной зоны у пациентов с клиническими симптомами длительностью менее 4 недель.
Категория III: Описать ситуацию, когда воспалительная реакция уже успела воздействовать на ткани и клетки берут ткани у пациентов, которые были оперированы по поводу ядерного пролапса, но с длительностью симптома, превышающей 4 недели.
Категория IV: Для умеренной дегенерации диска выбирают анюлус, полученный в результате операции с межтелесным слиянием при дегенеративном заболевании диска с оценкой Пфиррманна 3 или 4 в магнитно-резонансной томографии19.
Категория V: Для эндолуса процесса дегенерации конечной стадии, полученного в результате операции с межтелесным слиянием при дегенеративном заболевании диска с оценкой Пфиррманна 5. - Классифицируйте бычью ткань на основе стадии развития /возраста животного в одну из восьми категорий, как показано в таблице 1.
- Рассчитайте возраст беременности по длине коронки эмбрионов на основе формулы, предложенной Келлером:
Возраст беременности в месяцах =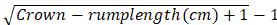
ПРИМЕЧАНИЕ: Животные в первые 4 недели беременности присутствуют с кроной-крестцом длиной 0,8-2,2 см20.
- Рассчитайте возраст беременности по длине коронки эмбрионов на основе формулы, предложенной Келлером:
4. Фиксация тканей
- Зафиксируйте образцы в 10-кратном объеме образца 4% (мас./об.) раствора формальдегида в фосфатно-буферном физиологическом растворе (PBS) в течение ночи при 4 °C.
ПРИМЕЧАНИЕ: Раствор формальдегида проникает в ткани со скоростью около 1 мм/час с каждого направления. Для очень маленьких или очень больших образцов может потребоваться корректировка времени экспозиции. - Храните ткань в PBS при температуре 4 °C до дальнейшей обработки.
5. Гистологическое секционирование
- Встраивайте образцы в водорастворимую среду для встраивания на криотомную ручку.
- Поместите ткань на ручку таким образом, чтобы образовалась либо осевая плоскость, либо плоскость, которая разрезает пластинки коллагена типа I перпендикулярно (например, срединную плоскость сагиттального сечения).
ПРИМЕЧАНИЕ: Ткань должна быть полностью покрыта встраивающей средой.
- Поместите ткань на ручку таким образом, чтобы образовалась либо осевая плоскость, либо плоскость, которая разрезает пластинки коллагена типа I перпендикулярно (например, срединную плоскость сагиттального сечения).
- Разрезание внедренной ткани толщиной 70 мкм в образцах человека и 40 мкм в образцах крупного рогатого скота с использованием стандартного криотома.
ПРИМЕЧАНИЕ: Разница в толщине сечения обусловлена разницей в целостности ткани между неповрежденным бычьим диском и сильно дегенеративной тканью человека. - Соберите секции на стеклянной горке.
- Обведите участки тканей гидрофобной ручкой.
- Промыть срезы 3 раза фосфатно-буферным физиологическим раствором (PBS) для удаления водорастворимой встраиваемой среды.
6. Флуоресцентное окрашивание
- Добавьте 60 мкл 1% (v/v) DAPI (Exmax 358 нм, Emmax 461 нм), а также 1% (v/v) окрашивания Actin Tracking (Exmax 540 нм, Emmax 565 нм) в PBS и инкубируйте в течение 5 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Протокол окрашивания, описанный здесь, заключается в визуализации ядра с использованием ядерного окрашивания DAPI (синий) и цитоплазмы с использованием Actin Tracking Stain (красный). IVD имеет сильную автофлуоресценцию благодаря коллагеновым волокнам в зеленом канале. Количество жидкости, добавляемой к секциям в этом протоколе, предназначено для секций размером около 5 мм х 5 мм. Для более крупных секций эта сумма должна быть соответственно увеличена. Выполняйте все работы в помещениях без воздействия прямых солнечных лучей и с приглушенным освещением, чтобы предотвратить отбеливание красителя. - Удалите окрашивающую жидкость пипеткой и трижды мойте 60 мкл PBS каждый раз.
- Добавьте подходящую монтажную среду и накройте секции крышкой.
ПРИМЕЧАНИЕ: Убедитесь, что при добавлении крышки крышки нет пузырьков воздуха. Лучше всего это сделать, начав контакт скольжения с затвором на одном ободе, а затем позвольте скольжению медленно опуститься.
7. Микроскопическая визуализация и обработка
- Поместите слайд с окрашенным участком на держатель образца микроскопа.
ПРИМЕЧАНИЕ: Из-за плотной коллагеновой сети типа I IVD рассеянный свет затрудняет визуализацию ткани с помощью обычной флуоресцентной микроскопии. Одним из способов решения этой проблемы является выполнение оптического сечения с использованием структурированного освещения. Это также позволяет отобразить трехмерную проекцию всего образца в обоих каналах (синем и красном). Лучше всего это делать с помощью структурированной настройки освещения и мозаичного режима с объективом с 10-кратным увеличением, чтобы получить обзор образца, а также 3D-реконструкции отдельных узоров. - Запустите устройство структурированного освещения.
- Выполняйте визуализацию с одним полем зрения с помощью подходящего флуоресцентного микроскопа, флуоресцентных фильтров и адекватного освещения.
ПРИМЕЧАНИЕ: Отрегулируйте время экспозиции для всех используемых фильтров, чтобы стандартизировать получение изображений. Для получения точного представления образца при более высоком разрешении изображения используются участки с более высоким увеличением (например, 20-кратный объектив). - Постобработка изображений путем оптимизации интенсивности и яркости с помощью программного обеспечения для оптимизации изображения, совместимого с флуоресцентным микроскопом.
- Выполняйте визуализацию с одним полем зрения с помощью подходящего флуоресцентного микроскопа, флуоресцентных фильтров и адекватного освещения.
- Для визуализации раздела в целом используйте технику мозаичной визуализации
- Откройте настройки сбора (нажмите на 6D-Acquisition)с панели инструментов.
- Настройте параметры мозаики (в регистре MosaiX)и определите количество столбцов и строк изображений поля зрения, которые впоследствии будут объединены в одно обзорное изображение.
- Нажмите «Настройка» и отрегулируйте коррекцию фокусировки отдельных плиток.
ПРИМЕЧАНИЕ: Для большого участка ткани практически невозможно иметь всю поверхность ткани в одной плоскости фокусировки. Изображения плиток на разных фокусных уровнях могут быть сделаны «MosaiX Acquisition». - Чтобы начать получение плиток изображения, нажмите кнопку Пуск.
- Сшивайте изображенные плитки с помощью функции сшивания(кнопка Stitching) с 20% перекрытием, встроенным в программное обеспечение.
- Постобработка изображений путем оптимизации интенсивности и яркости с помощью программного обеспечения для оптимизации изображения, совместимого с флуоресцентным микроскопом.
- Чтобы проанализировать пространственную организацию хондроцитов, используйте 3D-функцию, встроенную в программное обеспечение.
- Настройте параметры z-стека. Определите параметры сканирования: определите начальную и стоп-позицию по оси Z и расстояние до среза, активировав кнопку Start/Stop.
ПРИМЕЧАНИЕ: Программа автоматически вычисляет количество срезов. - Чтобы начать получение z-стеков изображения, нажмите кнопку Пуск.
- Постобработка изображений путем оптимизации интенсивности и яркости с помощью программного обеспечения для оптимизации изображения, совместимого с флуоресцентным микроскопом.
- Настройте параметры z-стека. Определите параметры сканирования: определите начальную и стоп-позицию по оси Z и расстояние до среза, активировав кнопку Start/Stop.
- Экспортируйте изображения в формате файла, совместимом с программным обеспечением для обработки изображений.
ПРИМЕЧАНИЕ: Экспортируйте 3D-реконструкции в виде отдельных изображений и/или в виде интерактивной 3D-модели или в видеоформате.
8. Идентификация клеточных паттернов и оценка плотности
- Откройте экспортированные мозаичные снимки всего участка ткани в соответствующей программе обработки изображений.
- Определите области, подвергаемые оценке плотности клеток, определив интересующие области размером 500 мкм х 500 мкм на снимках.
ПРИМЕЧАНИЕ: Все плитки, которые не имеют адекватного качества изображения, исключаются из анализа. - Определите отдельные клеточные паттерны.
ПРИМЕЧАНИЕ: Одиночные ячейки определяются как отдельные ячейки - полностью инкапсулированные в соседнюю матрицу. Пары определяются как две соседние ячейки в непосредственной близости (<25 мкм), в результате чего клетки связаны между собой через свои матрицы (см. Рисунок 2). Струнные образования представляют собой не менее трех хондроцитов, выровненных по линии (от середины ядер <25 мкм). Эти ячейки окружены неповрежденной матрицей, и между каждой ячейкой можно увидеть матричные взаимосвязи. Кластеры представляют собой множественные клетки, которые расположены в непосредственной близости друг от друга (<25 мкм) и инкапсулированы в большой лакун, лишенный матрицы. - Используйте плагин подсчета клеток для количественного анализа клеточных паттернов.
ПРИМЕЧАНИЕ: Окрашивание цитоплазмы представляет собой метод проверки для идентификации различных пространственных паттернов. - Рассчитайте плотность ячеек, разделив подсчитанные ячейки на размер выбранной интересующей области.
Результаты
Используя мозаичные изображения, можно четко распознать архитектуру IVD с его плотной коллагеновой волоконной сетью в ануле и более мягким ядром(рисунок 4). Непрерывное снижение клеточной плотности можно наблюдать во время эмбрионального развития(рисунок 5).
Обсуждение
Используя флуоресцентную микроскопию, дополненную мозаичной визуализацией и оптическим сечением, мы оценили пространственное расположение хондроцитов в ануле поясничного IVD на протяжении всего развития, созревания и дегенерации. В то время как дегенеративная ткань может быть собран...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим наших соавторов из оригинальных публикаций за помощь и поддержку. Мы благодарим Шарлотту Эмму Бамбергер за помощь в приобретении изображений апотома.
Материалы
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Ссылки
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409 (2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, 10 (2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), 1873-1878 (2001).
- Habermehl, K. H. . Die Altersbestimmung bei Haus- und Labortieren. , (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198 (2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15 (2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382 (2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены