Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Karbon Nanotüp Üzerinde Katkılı Co ve N Atomları ile Desteklenen Metal Nanopartiküllerin Sentezi ve Hidrojen Üretiminde Katalitik Uygulamaları
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, karbon nanotüpler üzerinde desteklenen Co nanopartiküllerini hidrojen üretimleri için Co- ve N- katkı maddeleri ile sentezlemek için bir protokol sunuyoruz.
Özet
Burada atomik olarak dağılmış kobalt ve azot katkısı olan karbon nanotüpler üzerinde desteklenen nanoyapılı katalizörlerin kolay sentezi için bir yöntem sunulmaktadır. Yeni strateji, kobalt (II) asetilasetonat ve azot bakımından zengin organik öncüllerin 800 ° C'de Ar atmosferi altında tek hazneli piroliz işlemine dayanmaktadır ve solucan benzeri morfolojiye sahip Co- ve N- ortak katkılı karbon nanotüp oluşumuna neden olmaktadır. Elde edilen katalizörün, Raman spektroskopisi ile doğrulandığı gibi, yüksek yoğunluklu kusur bölgelerine sahip olduğu bulunmuştur. Burada, kobalt (II) nanopartikülleri, atomik olarak dağılmış kobalt ve azot katkılı karbon nanotüpler üzerinde stabilize edildi. Katalizörün, devir sıklığının 5.87 mol H 2 · mol Co-1 · min-1 olduğu ve spesifik hidrojen üretim hızının2447 mL H 2 · g Co-1 · min-1 olduğu amonyak boranın katalitik hidrolizinde etkili olduğu doğrulandı. Co nanopartikül ve katkılı karbon nanotüpler arasında sinerjik bir fonksiyon, ilk kez hafif bir durumda amonyak boran reaksiyonunun katalitik hidrolizinde önerildi. Yüksek enerji yoğunluğu ve minimum yakıt ikmali süresi ile ortaya çıkan hidrojen üretimi, nakliye ve lojistikte karayolu kamyonları ve forkliftler gibi mobil ve sabit uygulamalar için enerji kaynakları olarak gelecekteki gelişim için uygun olabilir.
Giriş
Yenilenebilir enerji üretimi için düşük maliyetli ve yüksek verimli katalizörler geliştirmek, enerji krizini hafifletmek için en kritik ve zorlu sorunlardan biri olmaya devam etmektedir. Bununla birlikte, katalizörlerin hizmet ömrünü uzatmak için güvenilir performansa sahip büyük ölçekli üretim yöntemleri, yüksek üretim maliyeti ve uzun süredir devam eden stabilite gibi çeşitli endişeler nedeniyle pratik uygulamalardan uzaktır. Ulaştırma ve lojistik gibi sanayi sektörleri, verimli operasyonların gerçekleştirilmesinde uzun çalışma saatlerine, yüksek güçlü enerji kaynağına ve minimum yakıt ikmali süresine sahip araçlar ve ekipmanlar için enerji üretimine ihtiyaç duyar 1,2,3. Bu nedenle, yukarıdaki teknik zorlukları ele almak için etkili stratejilerden kapsamlı bir şekilde yararlanılmıştır. Örneğin, metal aktif bölgelerin ve katalizör desteklerinin elektronik yapısını düzenleyerek, metal nano-katalizörlerin spesifik mimarisini tasarlayarak, metal bileşimlerine ince ayar yaparak, ankrajlı desteğin fonksiyonel grup modifikasyonunu yaparak ve içsel aktif bölgelerin sayısını artırmak için morfolojiyi değiştirerek. Son birkaç on yılda, nanopartiküller (NP'ler) çeşitli heterojen kataliz alanlarına hakim olmuştur ve katalitik aktiviteler, NP'lerin boyutunu değiştirerek etkili bir şekilde ayarlanabilir. Sadece son yıllara kadar, yüksek oranda dağılmış tek atomlu katalizörlerin (SAC'ler), benzersiz elektronik yapıları ve koordinasyon ortamları nedeniyle birçok katalitik reaksiyona karşı mükemmel özelliklere sahip oldukları ortaya çıktı. Özellikle, SAC'ler elektrokimyasal reaksiyonlar (HER, ORR, OER) ve elektrokimyasal enerji sistemleri (örneğin, süper kapasitörler, şarj edilebilir piller) gibi enerji dönüşümünde üstün performanslar göstermiştir4,5,6. Hem NP'lerin hem de SAC'lerin katalitik uygulamalarda kendi avantajları ve sınırlamaları olsa da, katalitik reaktiviteyi artırmak için hem NP'lere hem de SAC'lere ihtiyaç duyan reaksiyonlar vardır. Örneğin, Ni ve N-ko-katkılı karbon nanotüp üstyapısında desteklenen Ru NP'ler, asetik asit7'nin yüksek katalitik ıslak hava oksidasyonunu kolaylaştırabilir. Bu sinerjik etki, oda sıcaklıklarında yüksek seçici keton ve aldehitler hidrojenasyonu için Pd1 + NP'ler / TiO2 katalizörleri tarafından da gösterilmiştir8. Sinerjik NP'ler ve SAC'ler kataliz alanını hızlandırmak ve katalitik uygulamaları hakkında daha fazla bilgi edinmek için, kolay bir katalizör sentezi yolu oldukça arzu edilir ve atomik olarak dağılmış aktif bölgenin yüksek yüklerinin getirilmesi, SAC'lerin9'un toplanmasının yüksek eğilimi nedeniyle bir zorluk olmaya devam etmektedir.
Nitroarenlerin hidrojenasyonunda 10, oksijen indirgeme reaksiyonu ve hidrojen evrim reaksiyonu 11,12, lityum-oksijen pillerinin 13'ünde uygulamalar için SAC'leri sentezlemek için çeşitli yöntemler kullanılmıştır. En yaygın strateji, metal öncüllerin emildiği, azaltıldığı ve karşılık gelen desteğin kusurları üzerinde hareketsiz hale getirildiği aşağıdan yukarıya yaklaşımdır. Mononükleer metal kompleksleri ayrıca ilk önce fonksiyonel destek grubuna bağlanabilir, ardından organik ligandların daha sonra çıkarılması ve böylece katalitik işlem için aktif metal bölgeleri oluşturulabilir. Atomik tabaka biriktirme (ALD) muhtemelen reaktanların tekrar tekrar maruz kalması ile substrat üzerinde ince bir film tabakası biriktirerek aşağıdan yukarıya imalat için en sık kullanılan prosedürdür. Katalizör boyutu hassas bir şekilde kontrol edilebilse ve reaktivite büyük ölçüde iyileştirilebilse de14, substratın saflığı oldukça zorlayıcıydı ve metal yükleme nispeten düşüktü, bu nedenle pratik uygulamalar için yüksek üretim maliyetleri ortaya çıktı. Doğrudan emprenye, birlikte çökeltme ve biriktirme-çökeltme gibi çeşitli yöntemler, metal nanopartikülleri yüzey şarj etkileri yoluyla metal oksit ve nitrür gibi destek yüzeylerine hareketsiz hale getirmek için kullanılmıştır. Bununla birlikte, artan metal yükü genellikle metal atomlarının veya nanopartiküllerin önemli aglomerasyonuna ve küme oluşumuna yol açar. Bu nedenle, genellikle, çok seyreltilmiş bir metal çözeltisi gereklidir, böylece katalizörlerin düşük SAC yüklemelerine yol açar15. Fenantrolin gibi amin ligandları, formik asidin seçici dehidrojenasyonu için yüksek derecede aktif Co-Nx aktif bölgelerine sahip atomik olarak dağılmış metal katalizörleri hazırlamak için metal öncüllerle pirolize tabi tutulmak üzere kullanılmıştır. Bununla birlikte, amin öncüllerinde sınırlı sayıda mevcut N atomu nedeniyle metal yükleme nispeten düşüktü (ağırlıkça% 2-316).
Son birkaç on yılda, hidrojen, fosil yakıtların veya kömür, doğal gaz ve benzin gibi hidrokarbonların yerini almak için potansiyel bir alternatif olarak kabul edildi. Şimdiye kadar, ticari hidrojenin yaklaşık% 94'ü, sürecin büyük miktarda sera gazı saldığı fosil yakıtların reform sürecinden hala üretilmektedir.17. Bu nedenle, su elektrolizi gibi yenilenebilir kaynaklardan hidrojen üretimi, tükenmiş fosil kaynaklar ve ciddi karbon emisyonları sorununu çözmenin bir yoludur. Bununla birlikte, düşük hidrojen üretim verimliliği, daha geniş uygulamalarını engellemiştir. Bu nedenle, su bölünmesi için bu kinetik enerji bariyerinin üstesinden gelmek için, son on yılda çok sayıda verimli elektrokatalizör keşfedilmiştir.18. Bir diğer konu ise ortam koşullarında hidrojen gazının gaz ve patlayıcı doğası nedeniyle depolama sorunudur. Sıkıştırma gibi fiziksel depolama yöntemleri, hidrojenin 700-800 bar'a kadar sıkıştırılmasını gerektirecek ve sıvılaştırma ile kriyojenik depolama, -253 ° C'de düşük sıcaklık gerektirecektir.19. Her ne kadar ticarileştirilmiş hidrojen yakıt hücresi ile çalışan araçlar başarılı bir şekilde gösterilmiş olsa da, teknoloji minyatür cihazlar ve mini yakıt hücreleri gibi daha geniş uygulamalarda kullanılacaksa, depolama sorunu henüz çözülmemiştir. Bu nedenle, kimyasal H malzemelerini kullanmanın depolama yöntemleri, hidrojen enerjisi araştırmalarında sıcak odaklardan biri olmuştur. Kimyasal H depolama malzemelerinin bazı örnekleri amonyak boranıdır (AB)20, formik asit (FA)21, amonyak gazı22, sodyum alanat23ve magnezyum hidrit24. Bunlar arasında, AB düşük bir moleküler ağırlığa sahiptir (30.7 g · mol-1), yüksek gravimetrik ve hacimsel yoğunluklar (196 gH2·kg-1 ve 146 gH2· L-1, sırasıyla). Ayrıca, hava ve neme dayanıklı bir bileşiktir, toksik değildir ve suda yüksek oranda çözünür. Çeşitli desteklenen malzemeler üzerindeki metal nanopartiküller, platin (Pt-), paladyum (Pd-), rutenyum (Ru-), kobalt (Co-) ve nikel (Ni-) bazlı katalizörler gibi AB'den hidrojenin üç eşdeğerini serbest bırakmak için yaygın olarak kullanılmıştır. Karbon malzemeler üzerinde desteklenen ko-bazlı heterojen katalizörler, düşük maliyetleri, yüksek bollukları ve iyileşme kolaylıkları nedeniyle özellikle dikkat çekmektedir. Dallanmış polietilenimin süslü grafen oksit üzerinde desteklenen Co NP'ler gibi çeşitli sentetik stratejiler bildirilmiştir.25. Geniş bir yüzey alanına sahip 3D yapı, 2-3 nm boyut aralığında kalan Co NP'lerin stabilizasyonunu sağlar ve NP'lerin toplanmasını önler. Diğer bir strateji, küçük boyutlu Co NP'leri desteklemek için N katkılı karbon malzemeler kullanmaktır. Co(salen) Kullanımı26 ve Co-MOF27 (metal organik çerçeve) öncüsü olarak, sırasıyla N katkılı gözenekli karbon malzemeler üzerinde desteklenen 9.0 nm ve 3.5 nm Co NP'ler hazırlanmıştır. AB hidrolizine karşı stabilite yüksektir ve reaktivite, 10 reaksiyon çalışmasından sonra ilk aktivitenin% 95'inden fazlasını koruyabilir. Son zamanlarda, içi boş mikro / nanoyapılara sahip katalizörler AB hidrolizi için kullanılmıştır. Bu malzemeler geleneksel olarak hidrotermal yöntemlerle hazırlanır ve lityum-iyon piller, süper kapasitörler, kimyasal sensörler ve heterojen kataliz araştırmaları için yaygın olarak kullanılmaktadır. Böylece, AB hidrolizine yönelik bakır-kobalt sinerjisi, içi boş CuMoO ile gösterilmiştir.4-CoMoO428, 104.7 dakikalık yüksek bir TOF verir-1. Diğer yüksek yapısal bağımlı örnekler arasında çekirdek kabuk CuO-NiO / Co bulunur3O429, CoxCu1−xCo2O4@CoyCu1−yCo2O4 yumurta sarısı kabuğu tipi30ve Ni0.4Cu0.6Co2O4 nanodiziler31 ayrıca AB hidrolizine karşı aktif olduğu bulunmuştur. MXenes ve katmanlı çift hidroksitler (LDH'ler) gibi heteroyapılı katalizörler olarak bilinen bir başka yeni tip yeni malzeme, elektrokatalitik ve fotokatalitik reaksiyon için giderek daha fazla kullanılmaktadır.32,33,34,35. NiFe katmanlı çift hidroksit gibi bu malzemeler36,37 ve N katkılı karbon-kobalt borür heteroarayüzlerine sahip CoB-N malzemeleri38 özellikle oksijen evrimi ve indirgeme reaksiyonu için aktiftir. Prensip olarak, amonyak boran gibi hidrojen depolama malzemelerinden hidrojen evrimi reaksiyonları için daha fazla kullanılabilirler.39. Katalizörler ve substratlar arasındaki etkileşimi en üst düzeye çıkarmak da AB hidrolizi için başka bir stratejidir. Chiang ve ark., AB ile başlatılan karmaşık bir tür oluşturmak için grafen oksidin yüzey oksit grubunu kullanmışlardır.40, böylece Ni0.8Pt0.2/GO ve rGO, AB hidrolizine karşı mükemmel reaktivite gösterdi. Co ve Ni bimetalik katalizörleri için destek olarak α-MoC'nin kullanılması, su moleküllerinin aktivasyonuna yardımcı oldu ve ticari Pt / C katalizöründen dört kat daha yüksek olan AB hidrolizine karşı yüksek TOF elde etti.41.
Dicyandiamide ve ilgiliC3N4 malzemelerinin yüksek N içeriğinden yararlanarak, yüksek oranda dağılmış Co- ve N-katkılı karbon nanotüpler üzerinde desteklenen kobalt NP'lerin kolay bir sentezini elde etmek için bir protokol burada sunulmuştur. C3 N4 malzemelerinin pirolizi sırasında oluşan atomik olarak dağılmış Co'dan Co NP'lerin kademeli olarak yerinde oluşumu, 1)Co NP'lerin ve Co katkılarının yüksek oranda dağılmasını sağlar; 2) Co NP'ler katkılı karbon destekleri üzerine güçlü bir şekilde sabitlenebilir ve 3) Co NP'lerin boyutu, pirolizin sıcaklığı ve zamanı ile dikkatlice kontrol edilebilir. Hazır Co / Co-N-CNT'nin, güçlü bir şekilde demirlenmiş Co NP'lerin ve Co katkı maddelerinin su moleküllerinin adsorpsiyon enerjisini düşürme yeteneğinin bir sonucu olarak, hidrojen üretimi için AB'nin hidrolizine karşı üstün stabiliteye sahip olduğu bulunmuştur. Katalizörlerin sentetik protokolünün detayları ve hidrojen üretiminin ölçümü bu raporun odak noktası olacaktır.
Protokol
DİKKAT: Okuyucuların, ilgili malzeme güvenlik bilgi formlarından (MSDS) uygun kimyasal işleme için bu makalede açıklanan kimyasalların özelliklerini ve toksisitelerini dikkatlice kontrol etmeleri önerilir. Kullanılan kimyasalların bazıları sağlığa zararlıdır ve özel bakımlar yapılmalıdır. Nanomalzemelerin insan sağlığı üzerindeki etkisi bilinmemektedir ve güvenlik ve sağlık riskleri oluşturabilir. Bu materyallerle cilt yoluyla solunması ve temasından kaçınılmalıdır. Katalizör sentezi sırasında atık gazın duman davlumbazına bırakılması ve hidrojen gazının uygun şekilde havalandırılmasıyla katalizör performans değerlendirmesi gibi güvenlik önlemleri de uygulanacaktır. Kişisel koruyucu ekipmanların her zaman giyilmesi tavsiye edilir. Hidrojen, havada% 4 ila% 74 arasında çok geniş bir yanıcılık aralığına sahip potansiyel olarak patlayıcı bir gazdır. Hidrojen gazının atmosfere düzgün bir şekilde havalandırılmasına özen gösterilmelidir.
1. Melem-C 3N4 materyallerinin sentezi
- 280 g dicyandiamid (yoğunluk = 1.4 g · cm-3) 800 mL'lik bir beherin içine tartın.
- Yukarıdaki katı ile beheri bir susturucu fırınına yerleştirin ve sıcaklığı oda sıcaklığından 5 ° C · dak-1'lik bir rampa ile yavaşça 350 ° C'ye yükseltin.
- Sıcaklığı 2 saat boyunca 350 ° C'de tutun, fırını doğal soğutma ile soğutun.
- Elde edilen beyaz katıları, melem formunda (DCD-350) C3N4 malzemeleri olarak ince toz halinde öğütün.
NOT: Verim 175 g'dır.
2. Melem-C 3N4 ve Co(acac)2 karışımlarının farklı sıcaklıklarda tavlanması
- 10.0 g melem-C 3 N 4'ü 0.218 g Co(acac)2 ile karıştırın [Co : melem-C3N4 = 1:200 (ağırlık oranı)]. Homojen renk gözlenene kadar iki katı maddeyi öğütün ve karıştırın.
- 6 mL sitrik asit çözeltisi ekleyin (su: etanol = 1:1, sitrik asit = 10 g· L-1) homojen karışıma ve malzemeleri daha da öğütün.
- Malzemeleri 60 °C'de bir fırında 6 saat kurutun.
- Malzemeleri kare şeklinde bir potaya yerleştirin ve ardından boru şeklindeki bir fırına koyun.
- Malzemeleri oda sıcaklığından 800 °C'ye kadar 2,6 °C·min-1 ısıtma hızında ısıtın ve 100 mL·min-1'lik bir Ar akışı altında 2 saat bekletin.
- Doğal soğutma ile fırını yavaşça soğutun.
- Katalizör numunelerinin ağırlığını boşaltın. Burada verim 0.65 g idi.
3. Amonyak boran hidrolizinden hidrojen salınımının ölçülmesi
- Su dolu ters silindir sistemini kurun (Ek Şekil 1).
- 0,1 M H2S04 yıkama solüsyonunu ayarlayın.
- Schlenk şişesini yıkama çözeltisine ve su dolu ters çevrilmiş silindire bağlayın.
- Su banyosu sıcaklığını 40 °C'ye ayarlayın.
- Schlenk şişesine 0.04 g katalizör yerleştirin.
- 0.948 mL suda 0.04 g amonyak boran içeren suda bir amonyak boran çözeltisi hazırlayın (konsantrasyon = 0.04 g · mL-1).
- Hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3BH3 çözeltisi (40 mg · mL-1) enjekte edin.
- Reaksiyon ilerledikçe su seviyesindeki düşüşü izleyin. Üretim hacmini belirlenen zamanlarda, örneğin her 5 saniyelik aralıklarla dikkatlice kaydedin.
- H2 üretiminin hacminin grafiğini dakika cinsinden zamana karşı çizin.
4. Kinetik çalışmalar
- Aktivasyon enerjisinin belirlenmesi
- Su banyosu sıcaklığını 40 °C'ye ayarlayın.
- Schlenk şişesine 0,04 g katalizör ve 10 mL su koyun ve su banyosuna daldırın. Çözümü 40 dakika boyunca ultrasonik bir banyoda 6 kHz'de sonikleştirin.
- Hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3BH3 çözeltisi (40 mg · mL-1) enjekte edin.
- Hidrojen salınımının tamamlanma süresini kaydedin.
- Su banyosu sıcaklığını 35 °C'ye ayarlayan 4.1.1-4.1.4 adımlarını tekrarlayın.
- Yukarıdaki deneyi sırasıyla 30 °C ve 25 °C'de tekrarlayın.
- Aşağıdaki denklemi kullanarak bir grafikte belirli bir oran sabitine karşı zamanı çizin. Ln k ve 1/T'lik bir grafik düz bir çizgi vermelidir.
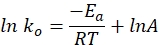
burada ko spesifik hız sabitini (mol H 2 · g Co-1 · min-1), R ideal gaz sabitidir (8.314 kJ · mol-1), T reaksiyon sıcaklığını (K) temsil eder ve A üstel öncesi faktördür (mol H2 gCo-1 · min-1).
- Ciro sıklığının ve spesifik hidrojen üretim hızının belirlenmesi
- Ciro frekansını aşağıdaki denkleme göre hesaplayın:
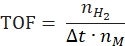
burada nH2 , üretilen hidrojenin molleridir, Δt tam hidrojen salınımı için gereken zamandır ve nM , katalizördeki molar metal miktarıdır. - Spesifik hidrojen üretim hızını aşağıdakidenklem 42,43'e göre hesaplayın:
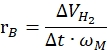
ΔVH2'nin üretilen hidrojenin hacmi olduğu yerde, t, başlatma ve stabilize etme aşamaları için gereken zamandır (örneğin, 40 mg amonyak boran için 70 mL hidrojenin üretildiği zaman, 80 mg amonyak boran için 140mL hidrojenin üretildiği zaman) ve ω M, katalizördeki metal kütlesidir.
- Ciro frekansını aşağıdaki denkleme göre hesaplayın:
- [Amonyak boranı] ile reaksiyon hızı arasındaki ilişkinin belirlenmesi
- Su banyosu sıcaklığını 40 °C'ye ayarlayın.
- Schlenk şişesine 40 mg katalizör ve 10 mL su koyun ve su banyosuna daldırın. Çözümü 40 dakika boyunca ultrasonik bir banyoda 6 kHz'de sonikleştirin.
- Hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3BH3 çözeltisi (40 mg · mL-1) enjekte edin.
- Hidrojen salınımının tamamlanma süresini kaydedin.
- Hidroliz reaksiyonunu başlatmak için NH 3 BH 3 çözeltisinin 2 mL'sini (yani, 2 mL başına 80 mg) reaktöre enjekte ederek adım4.3.3'ü tekrarlayın.
- Hidrojen salınımının tamamlanma süresini kaydetmek için sırasıyla NH3 BH 3çözeltisinin 0,5 mL ve 0,25 mL'si (40 mg/mL) ile 4.3.1-4.3.4 adımlarını tekrarlayın.
- Reaksiyon hızını aşağıdaki denklem44'e göre hesaplayın:
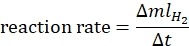
ΔmlH2'nin üretilen hidrojen hacmi olduğu yerde, Δt 70 mL hidrojen salınımı için gereken süredir. - Ln oranını ve ln[amonyak boranı] karşılaştırmasını çizin ve grafiğin eğimini belirleyin.
- [Katalizörler] ile üretim hızı arasındaki ilişkinin belirlenmesi
- Su banyosu sıcaklığını 40 °C'ye ayarlayın.
- Schlenk şişesine 40 mg katalizör ve 10 mL su koyun ve su banyosuna daldırın. Çözümü 40 dakika boyunca ultrasonik bir banyoda 6 kHz'de sonikleştirin.
- Hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3BH3 çözeltisi (40 mg · mL-1) enjekte edin.
- Hidrojen salınımının tamamlanma süresini kaydedin.
- Katalizör miktarını (20 mg, 40 mg, 60 mg, 80 mg) değiştiren 4.4.1-4.4.4 adımlarını tekrarlayın ve hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3 BH3 çözeltisini (yani, 40 mg · mL-1) enjekte edin.
- Yukarıdaki çeşitli katalizör miktarlarını kullanmak için hidrojen salınımının tamamlanma süresini kaydedin.
- Reaksiyon hızını aşağıdaki denklem44'e göre hesaplayın:
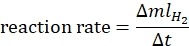
ΔmlH2'nin üretilen hidrojen hacmi olduğu yerde, Δt 70 mL hidrojen salınımı için gereken süredir. - Ln oranını ve ln[katalizör] karşılaştırmasını çizin ve grafiğin eğimini belirleyin.
5. Bisiklet performans testi
- Su banyosu sıcaklığını 40 °C'ye ayarlayın.
- Schlenk şişesine 0,04 g katalizör ve 10 mL su koyun ve su banyosuna daldırın. Çözümü 40 dakika boyunca ultrasonik bir banyoda 6 kHz'de sonikleştirin.
- Hidroliz reaksiyonunu başlatmak için reaktöre 1 mL NH3BH3 çözeltisi (40 mg · mL-1) enjekte edin.
- Hidrojen salınımının tamamlanma süresini kaydedin.
- Katalizörü süzün, üç kez suyla (5 mL) yıkayın ve ardından katalizörü fırında (60 ° C) 3 saat kurutun.
- Katalizörü 10 mL suya yerleştirin ve çözeltiyi ultrasonik bir banyoda 40 kHz'de sonikleştirin.
- 5.1.3-5.1.5 arasındaki adımları on kez yineleyin.
- Sırasıyla hidrojen üretim hacmini, TOF ve spesifik üretim hızını ve döngüleri çizin.
6. Saf metal SA'lar CNT elde etmek için metal NP'ler için liç deneyi
- Yağ banyosu sıcaklığını 80 °C'ye ayarlayın.
- Schlenk şişesine 0,15 g katalizör ve 50 mL 0,5 M H2SO4 yerleştirin ve yağ banyosuna daldırın.
- Reaksiyonu 2 saat boyunca karıştırın.
- Bir Buchner hunisi kullanarak katıyı filtreleyin ve katıyı deiyonize suyla yıkayın (her biri 10 mL'de 3x). Sızıntı suyunu 250 mL'lik hacimsel bir şişede 250 mL'ye kadar seyreltin.
- Metal nanopartiküller-süzülmüş katıları (sadece Eş katkılı CNT içeren) toplayın ve bir fırında 60 ° C'de kurutun.
7. Endüktif Eşleşmiş Plazma Optik Emisyon Spektroskopisi (ICP-OES) kullanılarak metal içeriği belirleme
- Toplam kobalt metal içeriğinin belirlenmesi
- Bölüm 2'den 50 mL'lik 2 M asit çözeltisine (HCl: HNO3 = 3:1 mol oranı)45,46 içine yaklaşık 0,02 g hazır katalizörü politetrafloroetilen kaplı paslanmaz çelik bir otoklavın içine yerleştirin.
- Politetrafloroetilen kaplı kabı paslanmaz çelik bombaya yerleştirin ve kapağı sabitleyin.
- Bombayı bir fırına yerleştirin, sıcaklığı 180 ° C'ye ayarlayın ve bombayı 12 saat ısıtın.
- Bombayı çıkarın ve içindekileri boşaltın. Katıyı filtreleyin ve çözünür maddeyi 200 mL deiyonize su ile 250 mL'lik hacimsel bir şişede seyreltin.
NOT: Seyreltmenin amacı, metal standart konsantrasyon aralığına, yani 0-40 ppm'ye uyacak şekilde ICP numunelerinin konsantrasyonunu ayarlamaktır. - Çözümün ICP-OES testini çalıştırın ve toplam Co miktarını ağırlıkça hesaplandı.
- CNT üzerindeki kobalt atomu içeriğinin belirlenmesi
- Adım 6.5'ten 50 mL'ye 2 M asit çözeltisi (HCl: HNO3 = 3: 1 mol oranı)45,46 içine yaklaşık 0,02 g hazır katalizörü politetrafloroetilen kaplı paslanmaz çelik bir otoklavın içine yerleştirin.
- Politetrafloroetilen kaplı kabı paslanmaz çelik bombaya yerleştirin ve kapağı sabitleyin.
- Bombayı bir fırına yerleştirin, sıcaklığı 180 ° C'ye ayarlayın ve bombayı 12 saat ısıtın.
- Bombayı çıkarın ve içindekileri boşaltın. Katıyı filtreleyin ve çözünür maddeyi 200 mL deiyonize su ile 250 mL'lik hacimsel bir şişede seyreltin.
NOT: Seyreltmenin amacı, metal standart konsantrasyon aralığına, yani 0-40 ppm'ye uyacak şekilde ICP numunelerinin konsantrasyonunu ayarlamaktır. - Çözümün ICP-OES testini çalıştırın ve Co atom içeriğinin miktarını ağırlıkça% olarak hesaplayın.
- Kobalt nanopartikül (NP) içeriğinin belirlenmesi
- 7.1.5 ve 7.2.5'in metal içeriği arasındaki fark, Co NP'lerin ağırlıkça% 'sidir.
Sonuçlar
Kobalt NP'lerin kristalliğini ve boyutunu belirlemek için X-ışını kırınım paternleri (XRD) elde edilmiştir. Şekil 1'de gösterildiği gibi, metalik kobaltın kübik fazının (111), (200) ve (220) düzlemlerine (sırasıyla 44.2 °, 51.5 ° ve 75.8 ° 'lik 2θ'da) karşılık gelen kırınım zirveleri, JCPDS (Toz Kırınım Standartları Ortak Komitesi) güç kırınım dosyası (kart # 15-0806)47 ile uyumlu olarak mevcuttu. Grafitik karbona (N-CNT'ler) ka...
Tartışmalar
Piroliz yöntemi, kontrollü NP boyutlarına sahip çeşitli heteroatom katkılı katı destekler üzerinde tek boyutlu nanomalzemenin sentezinde güçlü stratejilerden biri haline gelmiştir. Örneğin, nanouzay sınırlı piroliz stratejisi Guo ve ark.56 tarafından bildirilmiştir. Kısaca, önceden işlenmiş MWCNT'ler, kobalt ve fosfor öncülleri, N2 atmosferi altında 800 ° C'de pirolize edildi ve N-CNT'de desteklenen CoP NP'ler elde edilebilir. Mikro gözeneklerin varlığı, ...
Açıklamalar
Açıklayacak hiçbir şeyimiz yok.
Teşekkürler
Bu çalışma tamamen Hong Kong Üniversitesi Hibe Komitesi - Kurumsal Gelişim Programı (IDS) İşbirlikçi Araştırma Bursu, hibe numarası UGC / IDS (C) 14 / B (E) 01/19, Fakülte Geliştirme Programı (FDS), hibe numarası UGC / FDS25 / E08/20 tarafından finanse edildi ve kısmen Kurumsal Gelişim Programı (IDS), hibe numarası UGC / IDS (R) 25/20 tarafından finanse edildi.
.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
Referanslar
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243 (2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087 (2021).
- Sun, B. -. W., Li, H. -. J., Yu, H. -. Y., Qian, D. -. J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -. F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48 (2020).
- Yang, X. -. F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319 (2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576 (2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070 (2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4 (2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460 (2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422 (2021).
- Wang, H., Lee, J. -. M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426 (2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -. Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -. C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır