JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
도핑 된 Co 및 N 원자를 갖는 탄소 나노 튜브에지지 된 금속 나노 입자의 합성 및 수소 생산에서의 촉매 응용
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 수소 생산을 위해 Co- 및 N- 도펀트와 함께 탄소 나노 튜브에 담지된 Co 나노 입자를 합성하는 프로토콜을 제시합니다.
초록
원자적으로 분산된 코발트 및 질소 도펀트를 갖는 탄소 나노튜브 상에 지지된 나노구조 촉매의 용이한 합성을 위한 방법이 본원에 제시된다. 새로운 전략은 800 ° C의 Ar 분위기에서 코발트 (II) 아세틸 아세토 네이트 및 질소가 풍부한 유기 전구체의 손쉬운 1 냄비 열분해 처리를 기반으로하여 지렁이와 같은 형태를 가진 Co- 및 N- 공동 도핑 된 탄소 나노 튜브를 형성합니다. 수득된 촉매는 라만 분광법에 의해 확인된 바와 같이 높은 밀도의 결함 부위를 갖는 것으로 밝혀졌다. 여기서, 코발트 (II) 나노 입자는 원자 적으로 분산 된 코발트 및 질소 도핑 된 탄소 나노 튜브 상에 안정화되었다. 촉매는 암모니아 보란의 촉매 가수 분해에 효과적인 것으로 확인되었으며, 턴오버 빈도는 5.87 mol H 2·mol Co-1·min-1이었고 특정 수소 발생률은 2447 mL H2·g Co-1·min-1로 측정되었습니다. Co 나노 입자와 도핑 된 탄소 나노 튜브 사이의 상승 기능은 온화한 조건 하에서 암모니아 보란 반응의 촉매 가수 분해에서 처음으로 제안되었다. 높은 에너지 밀도와 최소한의 급유 시간으로 인한 수소 생산은 운송 및 물류의 도로 트럭 및 지게차와 같은 이동식 및 고정식 응용 분야의 에너지 원으로 향후 개발에 적합 할 수 있습니다.
서문
재생 에너지 생산을 위한 저비용 고효율 촉매 개발은 에너지 위기를 완화하기 위한 가장 중요하고 어려운 문제 중 하나입니다. 그러나 촉매의 수명을 연장하기 위해 신뢰할 수있는 성능, 높은 생산 비용 및 오랜 안정성을 갖춘 대규모 생산 방법과 같은 몇 가지 우려로 인해 실제 적용과는 거리가 멀다. 운송 및 물류와 같은 산업 분야에서는 효율적인 운영을 달성하기 위해 긴 작동 시간, 고출력 에너지 공급 및 최소한의 연료 보급 시간으로 차량 및 장비의 에너지 생산이 필요합니다 1,2,3. 따라서 위의 기술적 과제를 해결하기 위해 효과적인 전략이 광범위하게 활용되었습니다. 예를 들어, 금속 활성점 및 촉매 지지체의 전자 구조를 조절하고, 금속 나노 촉매의 특정 아키텍처를 설계하고, 금속 조성을 미세 조정하고, 고정 된 지지체의 작용기 변형, 및 고유 활성 부위의 수를 증가시키기 위해 형태를 변화시킨다. 지난 수십 년 동안 나노 입자 (NP)는 다양한 이종 촉매 분야를 지배했으며 NP의 크기를 변화시킴으로써 촉매 활성을 효과적으로 조정할 수 있습니다. 최근까지만 해도 고도로 분산된 단일 원자 촉매(SAC)는 고유한 전자 구조와 배위 환경으로 인해 많은 촉매 반응에 대해 우수한 특성을 갖는 것으로 나타났습니다. 특히, SAC는 이미 전기 화학 반응 (HER, ORR, OER) 및 전기 화학 에너지 시스템 (예 : 슈퍼 커패시터, 충전식 배터리)과 같은 에너지 변환에서 우수한 성능을 입증했습니다 4,5,6. NP와 SAC는 모두 촉매 응용 분야에서 각각의 장점과 한계가 있지만 촉매 반응성을 높이기 위해 NP와 SAC가 모두 필요한 반응이 존재합니다. 예를 들어, Ni- 및 N- 공동 도핑 된 탄소 나노 튜브 상부 구조상에지지 된 Ru NP는 아세트산7의 고 촉매 습식 공기 산화를 촉진 할 수있다. 이 시너지 효과는 실온8에서 고도로 선택적인 케톤 및 알데히드 수소화를위한 Pd1 + NP / TiO2 촉매에 의해서도 입증되었습니다. 상승 작용 NP 및 SACs 촉매 작용 분야를 가속화하고 촉매 응용 분야에 대해 더 많이 탐구하기 위해서는 촉매 합성의 손쉬운 방법이 매우 바람직하며 SACs9의 응집 경향이 높기 때문에 원자 적으로 분산 된 활성 부위의 높은 로딩을 도입하는 것이 과제로 남아 있습니다.
니트로 아렌 (10)의 수소화 반응, 산소 환원 반응 및 수소 발생 반응 (11, 12), 리튬-산소 배터리(13)에서의 응용을위한 SAC를 합성하기 위해 여러 가지 방법이 이용되었다. 가장 일반적인 전략은 상향식 접근법으로, 금속 전구체가 해당 지지체의 결함에 흡수, 감소 및 고정화되었습니다. 단핵 금속 착물은 또한 먼저 지지체의 작용기에 부착 된 다음 유기 리간드를 제거하여 촉매 공정을위한 활성 금속 부위를 생성 할 수 있습니다. 원자층 증착(ALD)은 아마도 반응물의 반복 노출로 기판에 박막 층을 증착함으로써 상향식 제조에 가장 자주 사용되는 절차일 것입니다. 촉매 크기를 정밀하게 제어 할 수 있고 반응성을 크게 향상시킬 수 있었지만14, 기판의 순도는 다소 까다 롭고 금속 로딩이 상대적으로 낮아 실제 적용을위한 높은 생산 비용이 발생했습니다. 표면 대전 효과를 통해 금속 나노 입자를 금속 산화물 및 질화물과 같은 지지체 표면에 고정화하기 위해 직접 함침, 공침 및 증착-침전과 같은 다양한 방법이 사용되었습니다. 그러나, 증가하는 금속 로딩은 일반적으로 금속 원자 또는 나노 입자의 상당한 응집 및 클러스터 형성을 유도한다. 따라서, 보통, 매우 희석된 금속 용액이 요구되고, 따라서 촉매(15)의 낮은 SACs 로딩을 유도한다. 페난 트롤린과 같은 아민 리간드는 포름산의 선택적 탈수 소화를위한 고 활성 Co-Nx 활성 부위를 갖는 원자 분산 금속 촉매를 제조하기 위해 금속 전구체로 열분해되는 데 사용되었습니다. 그러나, 금속 로딩은 아민 전구체16에서 이용가능한 N 원자의 제한된 수로 인해 상대적으로 낮았다(2-3 wt%).
지난 수십 년 동안 수소는 전자의 제로 배출의 이점으로 인해 석탄, 천연 가스 및 가솔린과 같은 화석 연료 또는 탄화수소를 대체 할 수있는 잠재적 인 대안으로 간주되었습니다. 지금까지 상업용 수소의 약 94 %는 여전히 화석 연료의 개질 공정에서 생산되며,이 과정에서 많은 온실 가스를 방출합니다.17. 따라서 물 전기분해와 같은 신재생 자원으로부터 수소를 생산하는 것은 화석자원의 고갈과 심각한 탄소 배출의 문제를 해결하는 방법이다. 그러나 낮은 수소 생산 효율은 더 넓은 응용 분야를 방해했습니다. 따라서 물 분해에 대한 이러한 운동 에너지 장벽을 극복하기 위해 지난 10 년 동안 수많은 효율적인 전기 촉매가 발견되었습니다.18. 또 다른 문제는 주변 조건에서 수소 가스의 가스 및 폭발성 특성으로 인한 저장 문제입니다. 압축과 같은 물리적 저장 방법은 수소를 700-800bar까지 압축해야 하며 액화에 의한 극저온 저장에는 -253°C에서 저온이 필요합니다.19. 상용화 된 수소 연료 전지 구동 차량이 성공적으로 입증되었지만 소형 장치 및 미니 연료 전지와 같은 더 넓은 응용 분야에서 기술이 사용된다면 저장 문제는 아직 해결되지 않았습니다. 따라서 화학적 H 물질을 사용하는 저장 방법은 수소 에너지 연구에서 뜨거운 초점 중 하나였습니다. 화학 H 저장 물질의 몇 가지 예는 암모니아 보란 (AB)20, 포름산 (FA)21, 암모니아 가스22, 알라산 나트륨23, 및 마그네슘 하이드라이드24. 이 중 AB는 저분자량(30.7g·mol-1), 높은 중량 및 체적 밀도 (196 gH2·kg-1 및 146 gH2· L-1, 각각). 게다가, 그것은 공기와 습기에 안정한 화합물, 무독성, 물에 잘 녹습니다. 다양한 담지 물질 상의 금속 나노입자는 백금-(Pt-), 팔라듐-(Pd-), 루테늄-(Ru-), 코발트-(Co-) 및 니켈-(Ni-)계 촉매와 같은 AB로부터 수소의 3당량을 방출하기 위해 널리 사용되어 왔다. 탄소 재료에 지지된 공동 기반 불균일 촉매는 특히 저렴한 비용, 높은 풍부함 및 회수 용이성으로 인해 많은 관심을 받고 있습니다. 분지형 폴리에틸렌이민으로 장식된 그래핀 옥사이드에 지지된 Co NP와 같은 몇 가지 합성 전략이 보고되었습니다.25. 표면적이 큰 3D 구조는 2-3nm 크기 범위에서 유지되는 Co NP의 안정화를 보장하고 NP의 응집을 방지합니다. 또 다른 전략은 N- 도핑 된 탄소 재료를 사용하여 작은 크기의 Co NP를 지원하는 것입니다. 공동 (살렌) 사용26 및 공동 MOF27 (금속 유기 프레임워크) 전구체로서, N이 도핑된 다공성 탄소 재료 상에 담지된 9.0 nm 및 3.5 nm의 CoNPs가 각각 제조되었다. AB 가수 분해에 대한 안정성이 높고 반응성은 10 회 반응 실행 후 초기 활성의 95 % 이상을 유지할 수 있습니다. 최근에, 중공 마이크로 / 나노 구조를 갖는 촉매가 AB 가수 분해를 위해 이용되었다. 이러한 재료는 일반적으로 열수 방법으로 제조되며 리튬 이온 배터리, 슈퍼 커패시터, 화학 센서 및 이종 촉매 연구에 널리 사용되었습니다. 따라서 AB 가수 분해를 향한 구리-코발트 시너지 효과는 중공 CuMoO에 의해 입증되었습니다.4-코모428, 104.7분의 높은 TOF를 제공합니다.1. 다른 고도로 구조적 의존적인 예로는 코어 쉘 CuO-NiO/Co가 있습니다.3O429, 공동xᄏᄏ��1−x공동2O4@Coyᄏᄏ��1−y공동2O4 노른자 껍질 유형30, 및 Ni0.4ᄏᄏ��0.6공동2O4 나노어레이31 또한 AB 가수 분해에 대해 활성인 것으로 밝혀졌습니다. MXenes 및 층상 이중 수산화물 (LDH)과 같은 헤테로 구조화 된 촉매로 알려진 또 다른 유형의 신흥 물질은 전기 촉매 및 광촉매 반응에 점점 더 많이 이용되고 있습니다.32,33,34,35. NiFe 층상 이중 수산화물과 같은 이러한 물질36,37 및 N- 도핑 된 탄소-코발트 붕화물 헤테로 계면을 갖는 CoB-N 물질38 특히 산소 발생 및 환원 반응에 활성입니다. 원칙적으로 암모니아 붕소와 같은 수소 저장 물질로부터의 수소 발생 반응에 추가로 활용 될 수 있습니다.39. 촉매와 기질 사이의 상호 작용을 최대화하는 것도 AB 가수 분해를위한 또 다른 전략입니다. Chiang et al. 그래 핀 옥사이드의 표면 산화물 그룹을 활용하여 AB와 함께 시작된 복합 종을 형성했습니다.40, 따라서 Ni0.8증권 시세 표시기0.2/GO 및 rGO는 AB 가수분해에 대한 우수한 반응성을 입증하였다. Co 및 Ni 바이메탈 촉매에 대한 지지체로 α-MoC를 사용하면 물 분자의 활성화를 지원하고 상용 Pt / C 촉매보다 4 배 높은 AB 가수 분해에 대한 높은 TOF를 달성했습니다.41.
디시안디아미드 및 관련C3N4물질의 높은 N 함량을 이용하여, 고도로 분산된 Co- 및 N-도핑된 탄소 나노튜브 상에 지지된 코발트 NP의 용이한 합성을 달성하기 위한 프로토콜이 본원에 제시된다. C3N4 물질의 열분해 동안 형성된 원자 분산 Co로부터 Co NP의 점진적인 현장 형성은 1) Co NP 및 Co 도펀트가 고도로 분산되도록하고; 2) Co NP는 도핑 된 탄소 지지체에 강하게 고정 될 수 있고 3) Co NPs 크기는 열분해의 온도 및 시간에 의해 조심스럽게 제어 될 수있다. 강하게 고정 된 Co NP와 물 분자의 흡착 에너지를 낮추는 Co 도펀트의 능력의 결과로서 제조 된 Co / Co-N-CNT는 수소 생산을위한 AB의 가수 분해에 대해 우수한 안정성을 갖는 것으로 밝혀졌다. 촉매의 합성 프로토콜과 수소 생산 측정에 대한 세부 사항이이 보고서의 초점이 될 것입니다.
프로토콜
주의 : 독자는 관련 물질 안전 보건 자료 (MSDS)에서 적절한 화학 물질 취급을 위해이 백서에 설명 된 화학 물질의 특성과 독성을주의 깊게 확인하는 것이 좋습니다. 사용 된 화학 물질 중 일부는 건강에 해롭기 때문에 특별한주의를 기울여야합니다. 나노 물질이 인체 건강에 미치는 영향은 알려져 있지 않으며 안전 및 건강 위험을 초래할 수 있습니다. 흡입 및 피부를 통한 접촉은 피해야합니다. 촉매 합성 중 폐가스를 흄 후드로 방출하고 수소 가스를 적절하게 배출하여 촉매 성능을 평가하는 등 안전 예방 조치도 취해야 합니다. 개인 보호 장비는 항상 착용하는 것이 좋습니다. 수소는 공기 중 4%-74%의 매우 넓은 가연성 범위를 가진 폭발 가능성이 있는 가스입니다. 수소 가스가 대기로 적절하게 배출되도록 주의해야 합니다.
1. 멜렘-C3N4물질의 합성
- 280 g의 디시안디아미드(밀도 = 1.4 g·cm-3)를 800 mL 비커에 넣습니다.
- 위의 고체가 담긴 비커를 머플로에 넣고 5°C·min-1의 램프로 실온에서 350°C까지 천천히 온도를 올립니다.
- 온도를 350 ° C에서 2 시간 동안 유지하고 자연 냉각으로 퍼니스를 식히십시오.
- 얻어진 백색 고체를 미분체로 분쇄하여 멜렘 형태의C3N4물질(DCD-350)로 한다.
참고: 수율은 175g입니다.
2. 상이한 온도에서 멜렘-C3N4및 Co(acac)2 혼합물을 어닐링
- 10.0g의 멜렘 -C 3 N 4 와 0.218g의 Co (acac) 2 [Co : melem-C3N4 = 1 : 200 (중량비)]를 혼합합니다. 균일 한 색상이 관찰 될 때까지 두 고체를 분쇄하고 혼합합니다.
- 구연산 용액 6mL를 추가합니다 (물 : 에탄올 = 1 : 1, 구연산 = 10g · L-1) 상기 물질을 균질하게 혼합하고 추가로 분쇄한다.
- 재료를 60 ° C의 오븐에서 6 시간 동안 건조시킵니다.
- 재료를 사각형 모양의 도가니에 넣은 다음 관형 용광로에 넣으십시오.
- 실온에서 800 °C까지 2.6 °C · min-1의 가열 속도로 재료를 가열하고 100 mL · min-1의 Ar 흐름에서 2 시간 동안 유지하십시오.
- 자연 냉각으로 퍼니스를 천천히 식히십시오.
- 촉매 샘플에 무게를 둡니다. 여기서, 수율은 0.65 g이었다.
3. 암모니아 보란 가수 분해로부터 수소 방출 측정
- 물이 채워진 역 실린더 시스템을 설정합니다(보충 그림 1).
- 0.1 MH2SO4세척액을 설정합니다.
- Schlenk 플라스크를 세척액과 물이 채워진 거꾸로 된 실린더와 연결합니다.
- 수조 온도를 40 °C로 설정하십시오.
- 0.04g의 촉매를 슐렝크 플라스크에 넣습니다.
- 물 0.948mL에 암모니아 보란 0.04g(농도=0.04g·mL-1)을 사용하여 암모니아 보란 용액을 물에 준비합니다.
- 1mL의 NH3BH3 용액(40mg·mL-1)을 반응기에 주입하여 가수분해 반응을 개시한다.
- 반응이 진행됨에 따라 수위가 떨어지는 것을 모니터링하십시오. 지정된 시간(예: 각 5초 간격)에 생산량을 주의 깊게 기록합니다.
- H2 생산량 대 시간 (분)의 그래프를 플로팅합니다.
4. 운동 연구
- 활성화 에너지의 결정
- 수조 온도를 40 °C로 설정하십시오.
- 0.04g의 촉매와 10mL의 물을 Schlenk 플라스크에 넣고 수조에 담그십시오. 초음파 수조에서 40kHz에서 6 분 동안 용액을 초음파 처리합니다.
- 1mL의 NH3BH3 용액(40mg·mL-1)을 반응기에 주입하여 가수분해 반응을 개시한다.
- 수소 방출 완료 시간을 기록하십시오.
- 수조 온도를 35°C로 설정하는 4.1.1-4.1.4단계를 반복합니다.
- 위의 실험을 각각 30°C 및 25°C에서 반복한다.
- 다음 방정식을 사용하여 그래프에 특정 속도 상수 대 시간을 플로팅합니다. ln k 및 1/T의 플롯은 직선을 생성해야 합니다.
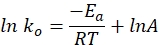
여기서ko는 비속도 상수 (mol H 2 · g Co-1·min-1), R은 이상 기체 상수 (8.314 kJ·mol-1), T는 반응 온도 (K), A는 사전 지수 계수 (mol H 2 g Co-1·min-1)입니다.
- 회전율 빈도 및 특정 수소 발생률 결정
- 다음 방정식에 따라 회전율 빈도를 계산하십시오.
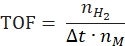
여기서nH2 는 생성 된 수소의 몰이고, Δt는 완전한 수소 방출에 필요한 시간이며, nm 은 촉매 내 금속의 몰량입니다. - 다음 방정식42,43에 따라 특정 수소 발생률을 계산합니다.
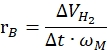
여기서,ΔVH2 는 생성된 수소의 부피이고, t는 개시 및 안정화 단계에 필요한 시간(예를 들어, 40mg 암모니아 보란에 대해 70mL의 수소가 생성되는 시간, 80mg 암모니아 보란에 대해 140mL의 수소가 생성되는 시간)이고,ωM 은 촉매 내의 금속 질량이다.
- 다음 방정식에 따라 회전율 빈도를 계산하십시오.
- [암모니아 보란]과 반응 속도의 관계 결정
- 수조 온도를 40 °C로 설정하십시오.
- 40mg의 촉매와 10mL의 물을 Schlenk 플라스크에 넣고 수조에 담그십시오. 초음파 수조에서 40kHz에서 6 분 동안 용액을 초음파 처리합니다.
- 1mL의 NH3BH3 용액(40mg·mL-1)을 반응기에 주입하여 가수분해 반응을 개시한다.
- 수소 방출 완료 시간을 기록하십시오.
- 반응기에 2 mL의 NH3BH3 용액(즉, 2 mL 당80 mg)을 주입하여 4.3.3 단계를 반복하여 가수분해 반응을 개시한다.
- 수소 방출 완료 시간을 기록하기 위해 각각 0.5mL 및 0.25mL의 NH3BH3 용액(40mg/mL)으로 4.3.1-4.3.4단계를 반복합니다.
- 하기 수학식44에 따라 반응 속도를 계산한다:
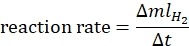
여기서 ΔmlH2 는 생성 된 수소의 부피이고, Δt는 70mL의 수소 방출에 필요한 시간입니다. - ln 비율 대 ln[암모니아 보란]을 플로팅하고 그래프의 기울기를 결정합니다.
- [촉매]와 생산 속도 간의 관계 결정
- 수조 온도를 40 °C로 설정하십시오.
- 40mg의 촉매와 10mL의 물을 Schlenk 플라스크에 넣고 수조에 담그십시오. 초음파 수조에서 40kHz에서 6 분 동안 용액을 초음파 처리합니다.
- 1mL의 NH3BH3 용액(40mg·mL-1)을 반응기에 주입하여 가수분해 반응을 개시한다.
- 수소 방출 완료 시간을 기록하십시오.
- 촉매의 양 (20 mg, 40 mg, 60 mg, 80 mg)을 변화시키는 단계 4.4.1-4.4.4를 반복하고 1 mL의NH3BH3용액 (즉, 40 mg · mL-1)을 반응기에 주입하여 가수 분해 반응을 시작한다.
- 상기 다양한 양의 촉매를 사용하기 위한 수소 방출의 완료 시간을 기록한다.
- 하기 수학식44에 따라 반응 속도를 계산한다:
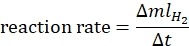
여기서 ΔmlH2 는 생성 된 수소의 부피이고, Δt는 70mL의 수소 방출에 필요한 시간입니다. - ln 비율 대 ln[촉매]을 플로팅하고 그래프의 기울기를 결정합니다.
5. 사이클링 성능 테스트
- 수조 온도를 40 °C로 설정하십시오.
- 0.04g의 촉매와 10mL의 물을 Schlenk 플라스크에 넣고 수조에 담그십시오. 초음파 수조에서 40kHz에서 6 분 동안 용액을 초음파 처리합니다.
- 1mL의 NH3BH3 용액(40mg·mL-1)을 반응기에 주입하여 가수분해 반응을 개시한다.
- 수소 방출 완료 시간을 기록하십시오.
- 촉매를 여과하고, 물(5 mL)로 3회 세척한 다음, 촉매를 오븐(60°C)에서 3시간 동안 건조시켰다.
- 촉매를 물 10mL에 넣고 초음파 수조에서 40kHz로 용액을 초음파 처리합니다.
- 5.1.3-5.1.5단계를 10번 반복합니다.
- 수소 생산량, TOF 및 특정 생성 속도 대 사이클을 각각 플로팅합니다.
6. 순수 금속 SA CNT를 얻기 위한 금속 NP의 침출 실험
- 오일 배스 온도를 80 °C로 설정합니다.
- 0.15 g의 촉매 및 50 mL의 0.5 MH2SO4를 슐렌크 플라스크에 넣고 오일 배스에 침지시킨다.
- 반응물을 2 시간 동안 저어줍니다.
- Buchner 깔때기를 사용하여 고체를 여과하고 탈이온수(각각 10mL에 3배)로 고체를 세척합니다. 침출수를 250mL 부피 플라스크에서 250mL로 더 희석합니다.
- 금속 나노입자 침출된 고형물(공동 도핑된 CNT만을 함유함)을 수집하고 오븐에서 60°C에서 건조시킨다.
7. 유도 결합 플라즈마 광 방출 분광법 (ICP-OES)을 사용한 금속 함량 측정
- 총 코발트 금속 함량 측정
- 섹션 2에서 약 0.02g의 준비된 촉매를 폴리테트라플루오로에틸렌 라이닝의 스테인리스 스틸 오토클레이브에 50mL의 2M 산 용액(HCl:HNO3 = 3:1 몰비)45,46에 넣습니다.
- 폴리테트라플루오로에틸렌 라이닝 용기를 스테인리스 스틸 폭탄에 넣고 캡을 고정합니다.
- 폭탄을 오븐에 넣고 온도를 180°C로 설정한 다음 폭탄을 12시간 동안 가열합니다.
- 폭탄을 제거하고 내용물을 비우십시오. 고체를 여과하고 250mL 부피 플라스크에서 200mL의 탈이온수로 용질을 희석합니다.
참고: 희석의 목적은 금속 표준 농도 범위, 즉 0-40ppm에 맞는 ICP 샘플의 농도를 조정하는 것입니다. - 용액의 ICP-OES 테스트를 실행하고 Co의 총량을 wt% 단위로 계산합니다.
- CNT 상의 코발트 원자 함량 측정
- 단계 6.5에서 제조된 촉매 약 0.02g을 폴리테트라플루오로에틸렌이 늘어선 스테인리스강 오토클레이브에 50mL의 2M 산 용액(HCl:HNO3 = 3:1 몰비)45,46에 넣습니다.
- 폴리테트라플루오로에틸렌 라이닝 용기를 스테인리스 스틸 폭탄에 넣고 캡을 고정합니다.
- 폭탄을 오븐에 넣고 온도를 180°C로 설정한 다음 폭탄을 12시간 동안 가열합니다.
- 폭탄을 제거하고 내용물을 비우십시오. 고체를 여과하고 250mL 부피 플라스크에서 200mL의 탈이온수로 용질을 희석합니다.
참고: 희석의 목적은 금속 표준 농도 범위, 즉 0-40ppm에 맞는 ICP 샘플의 농도를 조정하는 것입니다. - 용액의 ICP-OES 테스트를 실행하고 Co 원자 함량의 양을 wt% 단위로 계산합니다.
- 코발트 나노 입자 (NP) 함량의 결정
- 7.1.5와 7.2.5의 금속 함량의 차이는 Co NP의 wt %입니다.
결과
코발트 NP의 결정도 및 크기를 결정하기 위해 X선 회절 패턴(XRD)이 얻어졌다. 도 1에 도시된 바와 같이, 금속 코발트의 입방상의 (111), (200) 및 (220) 평면(각각 44.2°, 51.5°, 및 75.8°의 2θ에서)에 해당하는 회절 피크는 JCPDS(분말 회절 표준을 위한 공동 위원회) 전력 회절 파일(카드 # 15-0806)47과 일치하여 존재하였다. 흑연 탄소(N-CNTs)에 대응하는 약 26°의 2θ에서의 ?...
토론
열분해 방법은 제어 된 크기의 NP를 가진 다양한 헤테로 원자 도핑 된 고체 지지체에 1 차원 나노 물질을 합성하는 강력한 전략 중 하나가되었습니다. 예를 들어, 나노 공간 제한 열분해 전략은 Guo et al.56에 의해보고되었습니다. 간략하게, 전처리된 MWCNT, 코발트 및 인 전구체를N2 분위기 하에 800°C에서 열분해하고, N-CNT 상에 담지된 CoP NP를 얻을 수 있다. 미세 기공의 존재는...
공개
우리는 공개 할 것이 없습니다.
감사의 말
이 연구는 홍콩 대학 보조금 위원회 - 기관 개발 계획(IDS) 공동 연구 보조금, 보조금 번호 UGC/IDS(C)14/B(E)01/19, 교수 개발 계획(FDS), 보조금 번호 UGC/FDS25/E08/20에서 전액 자금을 지원했으며 기관 개발 계획(IDS), 보조금 번호 UGC/IDS(R)25/20에서 부분적으로 자금을 지원했습니다.
.
자료
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
참고문헌
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243 (2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087 (2021).
- Sun, B. -. W., Li, H. -. J., Yu, H. -. Y., Qian, D. -. J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -. F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48 (2020).
- Yang, X. -. F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319 (2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576 (2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070 (2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4 (2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460 (2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422 (2021).
- Wang, H., Lee, J. -. M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426 (2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -. Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -. C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유