Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese von Metallnanopartikeln, die auf Kohlenstoffnanoröhren mit dotierten Co- und N-Atomen unterstützt werden, und ihre katalytischen Anwendungen in der Wasserstoffproduktion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur Synthese von Co-Nanopartikeln vor, die auf Kohlenstoffnanoröhren mit Co- und N-Dotierstoffen für die Wasserstoffproduktion unterstützt werden.
Zusammenfassung
Ein Verfahren zur einfachen Synthese von nanostrukturierten Katalysatoren, die auf Kohlenstoffnanoröhren mit atomar dispergiertem Kobalt- und Stickstoffdotierungsstoff unterstützt sind, wird hierin vorgestellt. Die neuartige Strategie basiert auf einer einfachen Eintopf-Pyrolysebehandlung von Kobalt(II)-acetylacetonat und stickstoffreichen organischen Vorläufern unter Ar-Atmosphäre bei 800 °C, was zur Bildung von Co- und N-kodotierten Kohlenstoffnanoröhren mit regenwurmähnlicher Morphologie führt. Es wurde festgestellt, dass der erhaltene Katalysator eine hohe Dichte an Defektstellen aufweist, wie durch Raman-Spektroskopie bestätigt wurde. Hier wurden Kobalt(II)-Nanopartikel auf den atomar dispergierten Kobalt- und Stickstoff-dotierten Kohlenstoffnanoröhren stabilisiert. Es wurde bestätigt, dass der Katalysator bei der katalytischen Hydrolyse von Ammoniakboran wirksam ist, bei der die Umsatzfrequenz 5,87 mol H 2·mol Co-1·min-1 betrug und die spezifische Wasserstofferzeugungsrate 2447 ml H2·g Co-1·min-1 betrug. Eine synergistische Funktion zwischen dem Co-Nanopartikel und den dotierten Kohlenstoffnanoröhren wurde zum ersten Mal in der katalytischen Hydrolyse der Ammoniak-Boran-Reaktion unter einer milden Bedingung vorgeschlagen. Die daraus resultierende Wasserstoffproduktion mit ihrer hohen Energiedichte und minimalen Betankungszeit könnte sich für die zukünftige Entwicklung als Energieträger für mobile und stationäre Anwendungen wie Straßenfahrzeuge und Gabelstapler in Transport und Logistik eignen.
Einleitung
Die Entwicklung kostengünstiger und hocheffizienter Katalysatoren für die Erzeugung erneuerbarer Energien bleibt eines der kritischsten und herausforderndsten Probleme zur Linderung der Energiekrise. Es ist jedoch aufgrund mehrerer Bedenken weit von praktischen Anwendungen entfernt, wie z. B. großtechnische Produktionsmethoden mit zuverlässiger Leistung, hohen Produktionskosten und langjähriger Stabilität zur Verlängerung der Lebensdauer von Katalysatoren. Industriesektoren wie Transport und Logistik erfordern die Energieerzeugung für Fahrzeuge und Geräte mit langen Betriebsstunden, leistungsstarker Energieversorgung und minimaler Betankungszeit, um einen effizienten Betrieb zu erreichen 1,2,3. Daher wurden wirksame Strategien umfassend genutzt, um die oben genannten technischen Herausforderungen anzugehen. Zum Beispiel durch die Regulierung der elektronischen Struktur der metallaktiven Zentren und Katalysatorträger, das Entwerfen der spezifischen Architektur der Metallnanokatalysatoren, die Feinabstimmung der Metallzusammensetzungen, die funktionelle Gruppenmodifikation des verankerten Trägers und die Variation der Morphologie, um die Anzahl der intrinsischen aktiven Stellen zu erhöhen. In den letzten Jahrzehnten haben Nanopartikel (NPs) die Felder verschiedener heterogener Katalyse dominiert, und die katalytischen Aktivitäten können durch Variation der Größe der NPs effektiv abgestimmt werden. Erst in den letzten Jahren kristallisierten sich hochdisperse Einzelatomkatalysatoren (SACs) heraus, die aufgrund ihrer einzigartigen elektronischen Struktur und Koordinationsumgebung hervorragende Eigenschaften gegenüber vielen katalytischen Reaktionen aufweisen. Insbesondere SACs haben bereits überlegene Leistungen bei der Energieumwandlung wie elektrochemischen Reaktionen (HER, ORR, OER) und elektrochemischen Energiesystemen (z. B. Superkondensatoren, wiederaufladbaren Batterien) gezeigt4,5,6. Während sowohl NPs als auch SACs ihre jeweiligen Vorteile und Einschränkungen in katalytischen Anwendungen haben, gibt es Reaktionen, die sowohl NPs als auch SACs benötigen, um die katalytische Reaktivität zu steigern. Zum Beispiel könnten Ru-NPs, die auf Ni- und N-co-dotierten Kohlenstoff-Nanoröhrchen-Überkonstruktionen unterstützt werden, die hochkatalytische Nassluftoxidation von Essigsäure7 erleichtern. Dieser synergistische Effekt wurde auch durch Pd1+NPs/TiO2-Katalysatoren zur hochselektiven Keton- und Aldehydhydrierung bei Raumtemperatur8 nachgewiesen. Um das Feld der synergistischen NPs und SACs-Katalyse zu beschleunigen und mehr über ihre katalytischen Anwendungen zu erfahren, ist eine einfache Art der Katalysatorsynthese sehr wünschenswert, und die Einführung hoher Ladungen des atomar dispergierten aktiven Zentrums bleibt aufgrund der hohen Tendenz der Aggregation von SACseine Herausforderung 9.
Mehrere Methoden wurden verwendet, um SACs für Anwendungen in der Hydrierung von Nitroarenen10, Sauerstoffreduktionsreaktion und Wasserstoffentwicklungsreaktion 11,12, Lithium-Sauerstoff-Batterien13 zu synthetisieren. Die gebräuchlichste Strategie ist der Bottom-up-Ansatz, bei dem die Metallvorläufer absorbiert, reduziert und an den Defekten des entsprechenden Trägers immobilisiert wurden. Mononukleäre Metallkomplexe konnten auch zuerst an die funktionelle Gruppe der Träger gebunden werden, gefolgt von der anschließenden Entfernung der organischen Liganden, wodurch aktive Metallstellen für den katalytischen Prozess geschaffen wurden. Die Atomlagenabscheidung (ALD) ist wahrscheinlich das am häufigsten verwendete Verfahren für die Bottom-up-Herstellung, bei der eine dünne Filmschicht auf dem Substrat unter wiederholter Belichtung von Reaktanten abgeschieden wird. Obwohl die Katalysatorgröße präzise gesteuert und die Reaktivität stark verbessert werden konnte14, war die Reinheit des Substrats eher anspruchsvoll und die Metallbelastung relativ gering, was zu hohen Produktionskosten für praktische Anwendungen führte. Verschiedene Methoden wie direkte Imprägnierung, Co-Präzipitation und Abscheidungspräzipitation wurden eingesetzt, um Metallnanopartikel durch Oberflächenaufladungseffekte auf die Stützflächen wie Metalloxid und Nitrid zu immobilisieren. Eine zunehmende Metallbelastung führt jedoch in der Regel zu einer signifikanten Agglomeration und Clusterbildung der Metallatome oder Nanopartikel. Daher wird üblicherweise eine sehr verdünnte Metalllösung benötigt, was zu niedrigen SACs-Beladungen der Katalysatoren15 führt. Aminliganden wie Phenanthrolin wurden zur Pyrolyse mit Metallvorläufern eingesetzt, um atomar dispergierte Metallkatalysatoren mit hochaktivenCo-Nx-aktiven Zentren für die selektive Dehydrierung von Ameisensäure herzustellen. Die Metallbelastung war jedoch aufgrund der begrenzten Anzahl verfügbarer N-Atome in den Aminvorläufern16 relativ gering (2-3 Gew.-%).
In den letzten Jahrzehnten wurde Wasserstoff aufgrund des Vorteils der Null-Emissions-Emissionen als potenzielle Alternative angesehen, um fossile Brennstoffe oder Kohlenwasserstoffe wie Kohle, Erdgas und Benzin zu ersetzen. Bis heute werden noch etwa 94% des kommerziellen Wasserstoffs aus dem Reformierungsprozess fossiler Brennstoffe hergestellt, bei dem der Prozess viel Treibhausgas freisetzt17. Daher ist die Wasserstoffproduktion aus erneuerbaren Ressourcen wie der Wasserelektrolyse eine Möglichkeit, das Problem der erschöpften fossilen Ressourcen und der starken Kohlenstoffemissionen zu lösen. Die geringe Effizienz der Wasserstoffproduktion hat jedoch ihre breiteren Anwendungen behindert. Um diese kinetische Energiebarriere für die Wasserspaltung zu überwinden, wurden in den letzten zehn Jahren zahlreiche effiziente Elektrokatalysatoren entdeckt.18. Ein weiteres Problem ist das Speicherproblem aufgrund der gasförmigen und explosiven Natur von Wasserstoffgas unter Umgebungsbedingungen. Physikalische Speichermethoden wie die Kompression erfordern, dass der Wasserstoff auf 700-800 bar komprimiert wird, und die kryogene Speicherung durch Verflüssigung erfordert eine niedrige Temperatur bei -253 ° C.19. Obwohl kommerzialisierte Wasserstoff-Brennstoffzellenfahrzeuge erfolgreich demonstriert wurden, muss das Speicherproblem noch gelöst werden, wenn die Technologie in breiteren Anwendungen wie Miniaturgeräten und Mini-Brennstoffzellen eingesetzt werden soll. Speichermethoden zur Verwendung chemischer H-Materialien sind daher einer der heißen Schwerpunkte in der Wasserstoffenergieforschung. Einige Beispiele für chemische H-Speichermaterialien sind Ammoniak-Boran (AB)20, Ameisensäure (FA)21, Ammoniakgas22, Natriumalanat23und Magnesiumhydrid24. Unter diesen hat AB ein niedriges Molekulargewicht (30,7 g·mol-1), hohe gravimetrische und volumetrische Dichten (196 gH2·kg-1 und 146 gH2· L-1, bzw. Außerdem ist es eine luft- und feuchtigkeitsstabile Verbindung, ungiftig und gut wasserlöslich. Metallnanopartikel auf verschiedenen Trägermaterialien wurden häufig verwendet, um die drei Äquivalente von Wasserstoff aus AB freizusetzen, wie Platin- (Pt-), Palladium- (Pd-), Ruthenium- (Ru-), Kobalt- (Co-) und Nickel- (Ni-) basierte Katalysatoren. Co-basierte heterogene Katalysatoren, die auf Kohlenstoffmaterialien gelagert werden, ziehen aufgrund ihrer niedrigen Kosten, hohen Häufigkeit und einfachen Rückgewinnung besondere Aufmerksamkeit auf sich. Es wurden mehrere Synthesestrategien beschrieben, wie z. B. die Co-NPs, die auf verzweigtem Polyethylenimin-dekoriertem Graphenoxid unterstützt werden.25. Die 3D-Struktur mit einer großen Oberfläche gewährleistet die Stabilisierung von Co NPs im Größenbereich von 2-3 nm und verhindert die Aggregation von NPs. Eine weitere Strategie besteht darin, N-dotierte Kohlenstoffmaterialien zu verwenden, um Co-NPs mit kleinen Größen zu unterstützen. Verwendung von Co(salen)26 und Co-MOF27 (metallorganisches Gerüst) als Vorläufer wurden Co-NPs von 9,0 nm bzw. 3,5 nm hergestellt, die auf N-dotierten porösen Kohlenstoffmaterialien gelagert sind. Die Stabilität gegenüber AB-Hydrolyse ist hoch und die Reaktivität kann nach 10 Reaktionsläufen über 95% der ursprünglichen Aktivität aufrechterhalten. In jüngster Zeit wurden Katalysatoren mit hohlen Mikro-/Nanostrukturen für die AB-Hydrolyse genutzt. Diese Materialien werden konventionell mit hydrothermalen Methoden hergestellt und wurden häufig für Lithium-Ionen-Batterien, Superkondensatoren, chemische Sensoren und heterogene Katalyseforschung verwendet. So wurde die Kupfer-Kobalt-Synergie zur AB-Hydrolyse durch das hohle CuMoO nachgewiesen.4-CoMoO428, was eine hohe TOF von 104,7 min-1. Weitere stark strukturabhängige Beispiele sind die Kernschale CuO-NiO/Co3O429, die CoxCu1−xKo2O4@CoyCu1−yKo2O4 Dotterschalen-Typ30, und die Ni0.4Cu0.6Ko2O4 Nanoarrays31 wurden auch als aktiv gegenüber der AB-Hydrolyse gefunden. Eine andere Art von neuen Materialien, die als heterostrukturierte Katalysatoren bekannt sind, wie MXene und geschichtete Doppelhydroxide (LDHs), werden zunehmend für elektrokatalytische und photokatalytische Reaktionen genutzt.32,33,34,35. Diese Materialien wie das NiFe-schichtige Doppelhydroxid36,37 und die CoB-N-Materialien mit N-dotierten Kohlenstoff-Kobaltborid-Heterogrenzflächen38 sind besonders aktiv für die Sauerstoffentwicklung und Reduktionsreaktion. Prinzipiell könnten sie für Wasserstoffentwicklungsreaktionen aus Wasserstoffspeichermaterialien wie Ammoniak-Boran weiter genutzt werden.39. Die Maximierung der Wechselwirkung zwischen den Katalysatoren und Substraten ist eine weitere Strategie für die AB-Hydrolyse. Chiang et al. haben die Oberflächenoxidgruppe von Graphenoxid verwendet, um eine initiierte komplexe Spezies mit AB40, also Ni0.8Pt0.2/GO und rGO zeigten eine ausgezeichnete Reaktivität gegenüber AB-Hydrolyse. Die Verwendung von α-MoC als Unterstützung für Co- und Ni-Bimetallkatalysatoren unterstützte die Aktivierung von Wassermolekülen und erreichte eine hohe TOF in Richtung AB-Hydrolyse, die viermal höher ist als die des kommerziellen Pt / C-Katalysators.41.
Unter Ausnutzung hoher N-Gehalte des Dicyandiamids und verwandterC3N4-Materialienwird hierin ein Protokoll zur Erzielung einer einfachen Synthese von Kobalt-NPs vorgestellt, die auf hochdispersen Co- und N-dotierten Kohlenstoffnanoröhren unterstützt werden. Die allmähliche in-situ Bildung von Co-NPs aus dem gebildeten atomar dispergierten Co während der Pyrolyse von C3N4-Materialien stellt sicher, dass 1) Co-NPs und Co-Dotierstoffe stark dispergiert sind; 2) Co NPs können stark auf den dotierten Kohlenstoffträgern verankert werden und 3) Co NPs Größe kann sorgfältig durch die Temperatur und Zeit der Pyrolyse gesteuert werden. Das hergestellte Co/Co-N-CNT zeigte aufgrund der stark verankerten Co-NPs und der Fähigkeit der Co-Dotierstoffe, die Adsorptionsenergie von Wassermolekülen zu senken, eine überlegene Stabilität gegenüber der Hydrolyse von AB für die Wasserstoffproduktion. Die Details des Syntheseprotokolls der Katalysatoren und die Messung der Wasserstoffproduktion stehen im Mittelpunkt dieses Berichts.
Protokoll
ACHTUNG: Den Lesern wird empfohlen, die Eigenschaften und Toxizitäten der in diesem Dokument beschriebenen Chemikalien sorgfältig auf den richtigen Umgang mit Chemikalien anhand der einschlägigen Sicherheitsdatenblätter (MSDS) zu überprüfen. Einige der verwendeten Chemikalien sind gesundheitsschädlich, und es ist besonders darauf zu achten. Die Auswirkungen von Nanomaterialien auf die menschliche Gesundheit sind unbekannt und könnten Sicherheits- und Gesundheitsrisiken darstellen. Das Einatmen und der Kontakt durch die Haut mit diesen Materialien sollte vermieden werden. Es sind auch Sicherheitsvorkehrungen zu treffen, wie z. B. die Freisetzung des Abgases während der Katalysatorsynthese in den Abzug und die Bewertung der Katalysatorleistung bei ordnungsgemäßer Entlüftung des Wasserstoffgases. Es wird empfohlen, jederzeit persönliche Schutzausrüstung zu tragen. Wasserstoff ist ein explosionsfähiges Gas mit einem sehr breiten Entflammbarkeitsbereich von 4% -74% in Luft. Es ist darauf zu achten, dass das Wasserstoffgas ordnungsgemäß in die Atmosphäre entweichen kann.
1. Synthese von Melem-C3N4-Materialien
- 280 g Dicyandiamid (Dichte = 1,4 g·cm-3) werden in ein 800-ml-Becherglas eingewogen.
- Stellen Sie das Becherglas mit dem oben genannten Feststoff in einen Muffelofen und erhöhen Sie die Temperatur langsam von Raumtemperatur auf 350 °C mit einer Rampe von 5 °C·min-1.
- Halten Sie die Temperatur bei 350 °C für 2 h, kühlen Sie den Ofen durch natürliche Kühlung ab.
- Die erhaltenen weißen Feststoffe werden als C3N4-Materialienin Melemform (DCD-350) zu feinem Pulver gemahlen.
HINWEIS: Die Ausbeute beträgt 175 g.
2. Glühen der Melem-C3N4- und Co(acac)2-Gemische bei unterschiedlicher Temperatur
- Mischen Sie 10,0 g Melem-C3N4 mit 0,218 g Co(acac)2 [Co : Melem-C3N4 = 1:200(Gewichtsverhältnis)]. Mahlen und mischen Sie die beiden Feststoffe, bis die homogene Farbe beobachtet ist.
- 6 mL Zitronensäurelösung zugeben (Wasser: Ethanol = 1:1, Zitronensäure = 10 g· L-1) an die homogene Mischung anpassen und die Materialien weiter mahlen.
- Trocknen Sie die Materialien im Backofen bei 60 °C für 6 h.
- Die Materialien in einen quadratischen Tiegel geben und dann in einen Rohrofen geben.
- Die Materialien werden bei einer Heizgeschwindigkeit von 2,6 °C·min-1 von Raumtemperatur auf 800 °C erhitzt und 2 h bei einem Ar-Durchfluss von 100 mL·min-1 gelagert.
- Kühlen Sie den Ofen langsam durch natürliche Kühlung ab.
- Gewichten Sie die Katalysatorproben aus. Hier lag die Ausbeute bei 0,65 g.
3. Messung der Wasserstofffreisetzung aus der Ammoniak-Boran-Hydrolyse
- Richten Sie das wassergefüllte umgekehrte Zylindersystem ein (ergänzende Abbildung 1).
- Stellen Sie die 0,1 M H2SO4 Waschlösung ein.
- Verbinden Sie den Schlenkkolben mit der Waschlösung und dem wassergefüllten umgekehrten Zylinder.
- Stellen Sie die Wasserbadtemperatur auf 40 °C ein.
- 0,04 g des Katalysators in den Schlenkkolben geben.
- Eine Lösung von Ammoniakboran in Wasser mit 0,04 g Ammoniakboran in 0,948 ml Wasser (Konzentration = 0,04 g·ml-1) wird hergestellt.
- 1 ml derNH3BH3-Lösung(40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Überwachen Sie den Abfall des Wasserspiegels, während die Reaktion fortschreitet. Erfassen Sie das Produktionsvolumen sorgfältig zu festgelegten Zeitpunkten, z. B. alle 5 s Intervalle.
- Zeichnen Sie die Grafik des Volumens der H2-Produktion im Vergleich zur Zeit in Minuten.
4. Kinetische Studien
- Bestimmung der Aktivierungsenergie
- Stellen Sie die Wasserbadtemperatur auf 40 °C ein.
- 0,04 g des Katalysators und 10 mL Wasser in den Schlenkkolben geben und in das Wasserbad eintauchen. Spulieren Sie die Lösung bei 40 kHz in einem Ultraschallbad für 6 min.
- 1 ml derNH3BH3-Lösung(40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Notieren Sie die Zeit für den Abschluss der Wasserstofffreisetzung.
- Wiederholen Sie die Schritte 4.1.1-4.1.4, indem Sie die Wasserbadtemperatur auf 35 °C einstellen.
- Wiederholen Sie das obige Experiment bei 30 °C bzw. 25 °C.
- Zeichnen Sie die spezifische Ratenkonstante über die Zeit in einem Diagramm mit der folgenden Gleichung. Ein Diagramm von ln k und 1/T sollte eine gerade Linie ergeben.
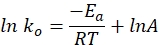
wobei ko die spezifische Geschwindigkeitskonstante (mol H 2·g Co-1·min-1), R die ideale Gaskonstante (8,314 kJ·mol-1), T die Reaktionstemperatur (K) und A den präexponentiellen Faktor (mol H2 gCo-1·min-1) bezeichnet.
- Bestimmung der Umschlagshäufigkeit und der spezifischen Wasserstofferzeugungsrate
- Berechnen Sie die Umschlagshäufigkeit nach folgender Gleichung:
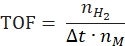
Dabei ist nH2 die Mole des erzeugten Wasserstoffs, Δt ist die Zeit, die für die vollständige Wasserstofffreisetzung benötigt wird, und nM ist die molare Menge an Metall im Katalysator. - Berechnen Sie die spezifische Wasserstofferzeugungsrate gemäß der folgenden Gleichung42,43:
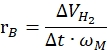
Dabei ist ΔVH2 das Volumen des erzeugten Wasserstoffs, t ist die Zeit, die für die Initiierungs- und Stabilisierungsstufen benötigt wird (z. B. die Zeit, in der 70 ml Wasserstoff für 40 mg Ammoniakboran erzeugt werden, die Zeit, in der 140 ml Wasserstoff für 80 mg Ammoniakboran erzeugt werden) und ωM die Metallmasse im Katalysator ist.
- Berechnen Sie die Umschlagshäufigkeit nach folgender Gleichung:
- Bestimmung des Zusammenhangs zwischen [Ammoniakboran] und Reaktionsgeschwindigkeit
- Stellen Sie die Wasserbadtemperatur auf 40 °C ein.
- 40 mg des Katalysators und 10 mL Wasser in den Schlenkkolben geben und in das Wasserbad eintauchen. Spulieren Sie die Lösung bei 40 kHz in einem Ultraschallbad für 6 min.
- 1 ml derNH3BH3-Lösung(40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Notieren Sie die Zeit für den Abschluss der Wasserstofffreisetzung.
- Wiederholen Sie Schritt 4.3.3, indem Sie 2 ml der NH3BH3-Lösung (d. h. 80 mg pro 2 ml) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Wiederholen Sie die Schritte 4.3.1-4.3.4 mit 0,5 ml bzw. 0,25 ml der NH3BH3-Lösung (40 mg/ml), um die Zeit für den Abschluss der Wasserstofffreisetzung aufzuzeichnen.
- Die Reaktionsgeschwindigkeit wird nach folgender Gleichung44 berechnet:
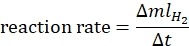
wobei ΔmlH2 das Volumen des erzeugten Wasserstoffs ist, ist Δt die Zeit, die für die Freisetzung von 70 ml Wasserstoff erforderlich ist. - Zeichnen Sie die ln-Rate vs. ln [Ammoniak-Boran] und bestimmen Sie die Steigung des Diagramms.
- Bestimmung des Zusammenhangs zwischen [Katalysatoren] und Produktionsrate
- Stellen Sie die Wasserbadtemperatur auf 40 °C ein.
- 40 mg des Katalysators und 10 mL Wasser in den Schlenkkolben geben und in das Wasserbad eintauchen. Spulieren Sie die Lösung bei 40 kHz in einem Ultraschallbad für 6 min.
- 1 ml derNH3BH3-Lösung(40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Notieren Sie die Zeit für den Abschluss der Wasserstofffreisetzung.
- Wiederholen Sie die Schritte 4.4.1-4.4.4, indem Sie die Menge des Katalysators (20 mg, 40 mg, 60 mg, 80 mg) variieren und 1 ml der NH3BH3-Lösung (d. h. 40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Notieren Sie die Zeit für die Fertigstellung der Wasserstofffreisetzung für die Verwendung der oben genannten verschiedenen Katalysatormengen.
- Die Reaktionsgeschwindigkeit wird nach folgender Gleichung44 berechnet:
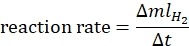
wobei ΔmlH2 das Volumen des erzeugten Wasserstoffs ist, ist Δt die Zeit, die für die Freisetzung von 70 ml Wasserstoff erforderlich ist. - Zeichnen Sie die ln-Rate vs. ln[Katalysator] und bestimmen Sie die Steigung des Diagramms.
5. Leistungstest Radfahren
- Stellen Sie die Wasserbadtemperatur auf 40 °C ein.
- 0,04 g des Katalysators und 10 mL Wasser in den Schlenkkolben geben und in das Wasserbad eintauchen. Spulieren Sie die Lösung bei 40 kHz in einem Ultraschallbad für 6 min.
- 1 ml derNH3BH3-Lösung(40 mg·ml-1) in den Reaktor injizieren, um die Hydrolysereaktion einzuleiten.
- Notieren Sie die Zeit für den Abschluss der Wasserstofffreisetzung.
- Den Katalysator abfiltrieren, dreimal mit Wasser (5 ml) waschen und anschließend im Ofen (60 °C) 3 h trocknen.
- Setzen Sie den Katalysator in 10 ml Wasser und beschallen Sie die Lösung bei 40 kHz in einem Ultraschallbad.
- Wiederholen Sie die Schritte 5.1.3-5.1.5 zehnmal.
- Zeichnen Sie das Wasserstoffproduktionsvolumen, die TOF und die spezifische Erzeugungsrate im Vergleich zu den Zyklen auf.
6. Laugungsversuch für Metall-NPs zur Gewinnung von reinen Metall-SAs CNT
- Stellen Sie die Ölbadtemperatur auf 80 °C ein.
- 0,15 g des Katalysators und 50 mL 0,5 MH2SO4 in den Schlenkkolben geben und in das Ölbad eintauchen.
- Rühren Sie die Reaktion für 2 h um.
- Filtern Sie den Feststoff mit einem Buchner-Trichter ab und waschen Sie den Feststoff mit entionisiertem Wasser (3x in je 10 ml). Das Sickerwasser wird in einem 250-ml-Messkolben weiter auf 250 ml verdünnt.
- Sammeln Sie die Metallnanopartikel-ausgelaugten Feststoffe (die nur Co-dotiertes CNT enthalten) und trocknen Sie sie bei 60 °C in einem Ofen.
7. Metallgehaltsbestimmung mittels optischer Emissionsspektroskopie mit induktiv gekoppeltem Plasma (ICP-OES)
- Bestimmung des Gesamtkobaltmetallgehalts
- Etwa 0,02 g des vorbereiteten Katalysators aus Abschnitt 2 werden in 50 mL 2 M Säurelösung (HCl: HNO 3 =3:1 Molverhältnis)45,46 in einen mit Polytetrafluorethylen ausgekleideten Edelstahlautoklaven gegeben.
- Legen Sie den mit Polytetrafluorethylen ausgekleideten Behälter in die Edelstahlbombe und sichern Sie die Kappe.
- Legen Sie die Bombe in einen Ofen, stellen Sie die Temperatur auf 180 °C ein und erhitzen Sie die Bombe für 12 Stunden.
- Entfernen Sie die Bombe und leeren Sie den Inhalt. Filtern Sie den Feststoff und verdünnen Sie den gelösten Stoff in einem 250-ml-Messkolben mit 200 ml entionisiertem Wasser.
HINWEIS: Der Zweck der Verdünnung besteht darin, die Konzentration der ICP-Proben einzustellen, die in den Metallstandardkonzentrationsbereich passen, d. h. 0-40 ppm. - Führen Sie den ICP-OES-Test der Lösung durch und berechnen Sie die Gesamtmenge an Co in Gew.-%.
- Bestimmung des Gehalts an Kobaltatomen auf der CNT
- Etwa 0,02 g des vorbereiteten Katalysators aus Schritt 6,5 in 50 mL 2 M Säurelösung (HCl: HNO 3 =3:1 Molverhältnis)45,46 in einen mit Polytetrafluorethylen ausgekleideten Edelstahlautoklaven geben.
- Legen Sie den mit Polytetrafluorethylen ausgekleideten Behälter in die Edelstahlbombe und sichern Sie den Verschluss.
- Legen Sie die Bombe in einen Ofen, stellen Sie die Temperatur auf 180 °C ein und erhitzen Sie die Bombe für 12 Stunden.
- Entfernen Sie die Bombe und leeren Sie den Inhalt. Filtern Sie den Feststoff und verdünnen Sie den gelösten Stoff in einem 250-ml-Messkolben mit 200 ml entionisiertem Wasser.
HINWEIS: Der Zweck der Verdünnung besteht darin, die Konzentration der ICP-Proben einzustellen, die in den Metallstandardkonzentrationsbereich passen, d. h. 0-40 ppm. - Führen Sie den ICP-OES-Test der Lösung durch und berechnen Sie die Menge an Co-Atom-Gehalten in Gew.-%.
- Bestimmung des Gehalts an Kobalt-Nanopartikeln (NPs)
- Die Differenz zwischen dem Metallgehalt von 7.1.5 und 7.2.5 beträgt den Gew.-% der Co NP.
Ergebnisse
Röntgenbeugungsmuster (XRD) wurden erhalten, um die Kristallinität und Größe der Kobalt-NPs zu bestimmen. Wie in Abbildung 1 gezeigt, waren Beugungspeaks, die den Ebenen (111), (200) und (220) (bei 2θ von 44,2°, 51,5° bzw. 75,8°) der kubischen Phase von metallischem Kobalt entsprechen, in Übereinstimmung mit der JCPDS-Leistungsbeugungsdatei (Karte # 15-0806)47 vorhanden. Der breite Peak bei 2θ von etwa 26°, der dem graphitischen Kohlenstoff (N-CNTs) entspri...
Diskussion
Die Pyrolysemethode hat sich zu einer der leistungsfähigsten Strategien bei der Synthese von eindimensionalem Nanomaterial auf verschiedenen heteroatom-dotierten Feststoffträgern mit kontrollierten NP-Größen entwickelt. Zum Beispiel wurde die Nanospace-beschränkte Pyrolysestrategie von Guo et al.56 berichtet. Kurz gesagt, die vorbehandelten MWCNTs, Kobalt- und Phosphorvorläufer wurden bei 800 °C unterN2-Atmosphäre pyrolysiert, und die auf N-CNT unterstützten CoP-NPs können erh...
Offenlegungen
Wir haben nichts zu enthüllen.
Danksagungen
Diese Arbeit wurde vollständig vom Hong Kong University Grants Committee finanziert - Institutional Development Scheme (IDS) Collaborative Research Grant, Fördernummer UGC / IDS (C) 14 / B (E) 01/19, dem Faculty Development Scheme (FDS), Fördernummer UGC / FDS25 / E08 / 20 und teilweise finanziert durch das Institutional Development Scheme (IDS), Fördernummer UGC / IDS (R) 25/20.
.
Materialien
| Name | Company | Catalog Number | Comments |
| Dicyandiamide | Sigma Aldrich | D76609 | |
| Borane-ammonia complex | Aladdin | B131882-100g | |
| Citric acid, 99% | Sigma Aldrich | C0759 | |
| Cobalt metal standard solution, traceable to SRM from NIST Co(NO3)2 in HNO3 0.5 mol/l 1000 mg/l Co Certipur | Sigma Aldrich | 1.19785 | |
| Cobalt(II) acetylacetonate, ≥ 99% | Sigma Aldrich | 727970 | |
| Hydrochloric acid, ACS reagent | Sigma Aldrich | 320331-2.5L | |
| ICP-OES | ICP-OES with dichroic spectral combiner (Agilent 5110) | ||
| Muffle furnace | High Performance Hybrid Muffle furnace, Chamber: (360 x 250 x 320) mm, Exterior: (610 x 545 x 500) mm, Power(3100W), Vulcan 3-1750) | ||
| Nitric acid, puriss. p.a., 65.0-67.0% | Sigma Aldrich | 84378 | |
| Sulphuric acid, ACS reagent 95-98% | Sigma Aldrich | 258105 | |
| Tubular furnace | OTF-1200X with tube size of 60 mm outer diameter (Hefei Kejing) | ||
| Ultrasonic bath | 10L Digital Single Frequency 40 kHz Ultrasonic Cleaner (Biobase) |
Referenzen
- Di Ilio, G., Di Giorgio, P., Tribioli, L., Bella, G., Jannelli, E. Preliminary design of a fuel cell/battery hybrid powertrain for a heavy-duty yard truck for port logistics. Energy Conversion and Management. , 243 (2021).
- Imdahl, C., et al. Potentials of hydrogen technologies for sustainable factory systems. 28th CIRP Conference on Life Cycle Engineering. , 583-588 (2021).
- Keller, A. V., Karpukhin, K. E., Kolbasov, A. F., Kozlov, V. N. Analysis of hydrogen use as an energy carrier in transport. IOP Conference Series: Materials Science and Engineering. 1159, 012087 (2021).
- Sun, B. -. W., Li, H. -. J., Yu, H. -. Y., Qian, D. -. J., Chen, M. In situ synthesis of polymetallic Co-doped g-C3N4 photocatalyst with increased defect sites and superior charge carrier properties. Carbon. 117, 1-11 (2017).
- Zhang, Y., et al. Biomass chitosan derived cobalt/nitrogen-doped carbon nanotubes for the electrocatalytic oxygen reduction reaction. Journal of Materials Chemistry A. 6 (14), 5740-5745 (2018).
- Sun, J. -. F., et al. Isolated single atoms anchored on N-doped carbon materials as a highly efficient catalyst for electrochemical and organic reactions. ACS Sustainable Chemistry & Engineering. 8 (39), 14630-14656 (2020).
- Jin, C., et al. Single-atom nickel confined nanotube superstructure as support for catalytic wet air oxidation of acetic acid. Communications Chemistry. 2 (1), (2019).
- Kuai, L., et al. Titania supported synergistic palladium single atoms and nanoparticles for room temperature ketone and aldehydes hydrogenation. Nature Communications. 11 (1), 48 (2020).
- Yang, X. -. F., et al. Single-atom catalysts: A new frontier in heterogeneous catalysis. Accounts of Chemical Research. 46 (8), 1740-1748 (2013).
- Sun, X., et al. Single cobalt sites in mesoporous N-doped carbon matrix for selective catalytic hydrogenation of nitroarenes. Journal of Catalysis. 357, 20-28 (2018).
- Sun, T., et al. Single-atomic cobalt sites embedded in hierarchically ordered porous nitrogen-doped carbon as a superior bifunctional electrocatalyst. Proceedings of the National Academy of Sciences of the United States of America. 115 (50), 12692-12697 (2018).
- Wan, G., et al. Engineering single-atom cobalt catalysts toward improved electrocatalysis. Small. 14 (15), 1704319 (2018).
- Wang, P., et al. Atomically dispersed cobalt catalyst anchored on nitrogen-doped carbon nanosheets for lithium-oxygen batteries. Nature Communications. 11 (1), 1576 (2020).
- Yan, H., et al. Bottom-up precise synthesis of stable platinum dimers on graphene. Nature Communications. 8 (1), 1070 (2017).
- Qiao, B., et al. Single-atom catalysis of CO oxidation using Pt1/FeOx. Nature Chemistry. 3 (8), 634-641 (2011).
- Tang, C., et al. A stable nanocobalt catalyst with highly dispersed CoNx active sites for the selective dehydrogenation of formic acid. Angewandte Chemie International Edition. 56 (52), 16616-16620 (2017).
- Gnanapragasam, N. V., Rosen, M. A. A review of hydrogen production using coal, biomass and other solid fuels. Biofuels. 8 (6), 725-745 (2017).
- Wang, S., Lu, A., Zhong, C. J. Hydrogen production from water electrolysis: role of catalysts. Nano Convergence. 8 (1), 4 (2021).
- Demirci, U. B. About the technological readiness of the H2 generation by hydrolysis of B(-N)-H compounds. Energy Technology. 6 (3), 470-486 (2018).
- Wu, H., et al. Metal-catalyzed hydrolysis of ammonia borane: Mechanism, catalysts, and challenges. International Journal of Hydrogen Energy. 45 (55), 30325-30340 (2020).
- Singh, A. K., Singh, S., Kumar, A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system. Catalysis Science & Technology. 6 (1), 12-40 (2016).
- Grinberg, A., Shter, G. E., Grader, G. S. Nitrogen-based alternative fuels: Progress and future prospects. Energy Technology. 4 (1), 7-18 (2016).
- Ley, M. B., Meggouh, M., Moury, R., Peinecke, K., Felderhoff, M. Development of hydrogen storage tank systems based on complex metal hydrides. Materials. 8 (9), 5891-5921 (2015).
- Wang, H., Lin, H. J., Cai, W. T., Ouyang, L. Z., Zhu, M. Tuning kinetics and thermodynamics of hydrogen storage in light metal element based systems - A review of recent progress). Journal of Alloys and Compounds. 658, 280-300 (2016).
- Li, M., Hu, J., Lu, H. A stable and efficient 3D cobalt-graphene composite catalyst for the hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (19), 7186-7192 (2016).
- Wang, H., Zhao, Y., Cheng, F., Tao, Z., Chen, J. Cobalt nanoparticles embedded in porous N-doped carbon as long-life catalysts for hydrolysis of ammonia borane. Catalysis Science & Technology. 6 (10), 3443-3448 (2016).
- Zhou, L., et al. Ultrasmall cobalt nanoparticles supported on nitrogen-doped porous carbon nanowires for hydrogen evolution from ammonia borane. Materials Horizons. 4 (2), 268-273 (2017).
- Feng, Y., et al. Sea-urchin-like hollow CuMoO4-CoMoO4 hybrid microspheres, a noble-metal-like robust catalyst for the fast hydrogen production from ammonia borane. ACS Applied Energy Materials. 4 (1), 633-642 (2021).
- Liao, J., et al. CuO-NiO/Co3O4 hybrid nanoplates as highly active catalyst for ammonia borane hydrolysis. International Journal of Hydrogen Energy. 45 (15), 8168-8176 (2020).
- Lu, D., et al. A simple and scalable route to synthesize Cox Cu1-x Co2O4@CoyCu1-yCo2O4 yolk-shell microspheres, a high-performance catalyst to hydrolyze ammonia borane for hydrogen production. Small. 15 (10), 1805460 (2019).
- Feng, Y., et al. Durable and high performing Ti supported Ni0.4Cu0.6Co2O4 nanoleaf-like array catalysts for hydrogen production. Renewable Energy. 169, 660-669 (2021).
- Prabhu, P., Jose, V., Lee, J. M. Heterostructured catalysts for electrocatalytic and photocatalytic carbon dioxide reduction. Advanced Functional Materials. 30 (24), (2020).
- Wang, H., et al. Electronic modulation of non-van der Waals 2D electrocatalysts for efficient energy conversion. Advanced Materials. 33 (26), 2008422 (2021).
- Wang, H., Lee, J. -. M. Recent advances in structural engineering of MXene electrocatalysts. Journal of Materials Chemistry A. 8 (21), 10604-10624 (2020).
- Prabhu, P., Lee, J. M. Metallenes as functional materials in electrocatalysis. Chemical Society Reviews. 50 (12), 6700-6719 (2021).
- Lin, Y., et al. Co-induced electronic optimization of hierarchical NiFe LDH for oxygen evolution. Small. 16 (38), 2002426 (2020).
- Li, M., et al. Gd-induced electronic structure engineering of a NiFe-layered double hydroxide for efficient oxygen evolution. Journal of Materials Chemistry A. 9 (5), 2999-3006 (2021).
- Jose, V., et al. Highly efficient oxygen reduction reaction activity of N-doped carbon-cobalt boride heterointerfaces. Advanced Energy Materials. 11 (17), (2021).
- Qiu, X., et al. Hydrogen generation from ammonia borane hydrolysis catalyzed by ruthenium nanoparticles supported on Co-Ni layered double oxides. Sustainable Energy & Fuels. 5 (8), 2301-2312 (2021).
- Prabu, S., Chiang, K. -. Y. Improved catalytic effect and metal nanoparticle stability using graphene oxide surface coating and reduced graphene oxide for hydrogen generation from ammonia-borane dehydrogenation. Materials Advances. 1 (6), 1952-1962 (2020).
- Ge, Y., et al. Maximizing the synergistic effect of CoNi catalyst on α-MoC for robust hydrogen production. Journal of the American Chemical Society. 143 (2), 628-633 (2020).
- Duan, S., et al. Magnetic Co@g-C3N4 core-shells on rGO sheets for momentum transfer with catalytic activity toward continuous-flow hydrogen generation. Langmuir. 32 (25), 6272-6281 (2016).
- Zhang, H., et al. Birdcage-type CoOx-carbon catalyst derived from metal-organic frameworks for enhanced hydrogen generation. ACS Sustainable Chemistry & Engineering. 7 (11), 9782-9792 (2019).
- Semiz, L. Dehydrogenation of ammonia borane by dealloyed ruthenium catalysts. Inorganic and Nano-Metal Chemistry. 51 (1), 20-26 (2020).
- Bulut, A., et al. Carbon dispersed copper-cobalt alloy nanoparticles: A cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane. Applied Catalysis B: Environmental. 180, 121-129 (2016).
- Akbayrak, S., Tonbul, Y., Özkar, S. Ceria supported rhodium nanoparticles: Superb catalytic activity in hydrogen generation from the hydrolysis of ammonia borane. Applied Catalysis B: Environmental. 198, 162-170 (2016).
- International Centre for Diffraction Data. Powder diffraction file PDF-2 data base international center for diffraction data JCPDS-ICDD 1999 in JCPDS database. International Centre for Diffraction Data. , (2021).
- Zhang, J., Zhao, Z., Xia, Z., Dai, L. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions. Nature Nanotechnology. 10 (5), 444-452 (2015).
- Cao, B., et al. Tailoring the d-band center of N-doped carbon nanotube arrays with Co4N nanoparticles and single-atom Co for a superior hydrogen evolution reaction. NPG Asia Materials. 13 (1), (2021).
- Varga, T., et al. Co4N/nitrogen-doped graphene: A non-noble metal oxygen reduction electrocatalyst for alkaline fuel cells. Applied Catalysis B: Environmental. 237, 826-834 (2018).
- Li, H., Gan, S., Wang, H., Han, D., Niu, L. Intercorrelated superhybrid of AgBr supported on graphitic-C3N4-decorated nitrogen-doped graphene: High engineering photocatalytic activities for water purification and CO2 reduction. Advanced Materials. 27 (43), 6906-6913 (2015).
- Zhao, S., et al. One-pot pyrolysis method to fabricate carbon nanotube supported Ni single-atom catalysts with ultrahigh loading. ACS Applied Energy Materials. 1 (10), 5286-5297 (2018).
- Dilpazir, S., et al. Cobalt single atoms immobilized N-doped carbon nanotubes for enhanced bifunctional catalysis toward oxygen reduction and oxygen evolution reactions. ACS Applied Energy Materials. 1 (7), 3283-3291 (2018).
- Cao, L., et al. Identification of single-atom active sites in carbon-based cobalt catalysts during electrocatalytic hydrogen evolution. Nature Catalysis. 2 (2), 134-141 (2018).
- Fu, Z. C., et al. Highly efficient hydrolysis of ammonia borane by anion (-OH, F-, Cl-)-tuned interactions between reactant molecules and CoP nanoparticles. Chemical Communications. 53 (4), 705-708 (2017).
- Hou, C. -. C., et al. Tailoring three-dimensional porous cobalt phosphides templated from bimetallic metal-organic frameworks as precious metal-free catalysts towards the dehydrogenation of ammonia-borane. Journal of Materials Chemistry A. 7 (14), 8277-8283 (2019).
- Peng, C. Y., et al. Nanostructured Ni2P as a robust catalyst for the hydrolytic dehydrogenation of ammonia-borane. Angewandte Chemie International Edition English. 54 (52), 15725-15729 (2015).
- Xu, Q., Chandra, M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature. Journal of Power Sources. 163 (1), 364-370 (2006).
- Kalidindi, S. B., Sanyal, U., Jagirdar, B. R. Nanostructured Cu and Cu@Cu2O core shell catalysts for hydrogen generation from ammonia-borane. Physical Chemistry - Chemical Physics. 10, 5870-5874 (2008).
- Ning, X., Yu, H., Peng, F., Wang, H. Pt nanoparticles interacting with graphitic nitrogen of N-doped carbon nanotubes: Effect of electronic properties on activity for aerobic oxidation of glycerol and electro-oxidation of CO. Journal of Catalysis. 325, 136-144 (2015).
- Li, Z., et al. Covalent triazine framework supported non-noble metal nanoparticles with superior activity for catalytic hydrolysis of ammonia borane: from mechanistic study to catalyst design. Chemical Science. 8 (1), 781-788 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten