Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dinamik Arayüzlerin Konfokal Mikroskopi Görselleştirmesi için Mikrotensiyometre
Bu Makalede
Özet
Bu yazıda, ara yüz morfolojisini görselleştirirken ara yüz gerilimi ve yüzey dilatasyonel reolojisinin eşzamanlı ölçümlerini yapmak için bir mikrotensiyometre/konfokal mikroskobun tasarımı ve çalışması anlatılmaktadır. Bu, teknoloji ve fizyolojide önemli olan arayüzlerin yapı-özellik ilişkilerinin gerçek zamanlı olarak inşasını sağlar.
Özet
Yüzey-aktif moleküllerin sıvı-sıvı arayüzlerine adsorpsiyonu doğada her yerde bulunur. Bu arayüzlerin karakterize edilmesi, yüzey aktif madde adsorpsiyon oranlarının ölçülmesini, denge yüzey gerilimlerinin toplu yüzey aktif madde konsantrasyonunun bir fonksiyonu olarak değerlendirilmesini ve yüzey geriliminin dengeyi takiben ara yüzey alanındaki değişikliklerle nasıl değiştiğini ilişkilendirmeyi gerektirir. Yüksek hızlı konfokal mikroskopla floresan görüntüleme kullanılarak arayüzün eşzamanlı olarak görselleştirilmesi, yapı-fonksiyon ilişkilerinin doğrudan değerlendirilmesini sağlar. Kılcal basınç mikrotensiyometresinde (CPM), kılcal damarın ucunda 1 mL hacimli bir sıvı haznesinde yarım küre şeklinde bir hava kabarcığı sabitlenir. Kabarcık arayüzü boyunca kılcal basınç, Laplace denklemine dayalı model tabanlı basınç, kabarcık eğriliği veya kabarcık alanı kontrolüne izin veren ticari bir mikroakışkan akış kontrolörü aracılığıyla kontrol edilir. Langmuir oluğu ve kolye damlası gibi önceki tekniklerle karşılaştırıldığında, ölçüm ve kontrol hassasiyeti ve tepki süresi büyük ölçüde geliştirilmiştir; kılcal basınç değişimleri milisaniyeler içinde uygulanabilir ve kontrol edilebilir. Kabarcık arayüzünün dinamik tepkisi, kabarcık genişledikçe ve büzüldükçe ikinci bir optik lens aracılığıyla görselleştirilir. Kabarcık konturu, kabarcık eğriliği yarıçapını, R'yi ve sonuçları geçersiz kılacak dairesellikten sapmaları belirlemek için dairesel bir profile uygundur. Laplace denklemi, arayüzün dinamik yüzey gerilimini belirlemek için kullanılır. Dengeyi takiben, dilatasyon modülünü belirlemek için kabarcık yarıçapını (0.001-100 döngü / dak frekansları) salınımına sokmak için bilgisayar kontrollü mikroakışkan pompa tarafından küçük basınç salınımları uygulanabilir Sistemin genel boyutları, mikrotensiyometrenin yüksek hızlı bir konfokal mikroskobun merceğinin altına sığacak kadar küçüktür.
Giriş
Yüzey aktif madde filmlerinin kapladığı hava-su arayüzleri günlük yaşamda her yerde bulunur. Yüzey aktif madde-su enjeksiyonları, tükenmiş alanlardan petrol geri kazanımını arttırmak için kullanılır ve kaya gazı ve petrol için hidrolik kırılma çözümleri olarak kullanılır. Gaz-sıvı köpükler ve sıvı-sıvı emülsiyonlar, yağlayıcılar ve temizlik maddeleri olarak birçok endüstriyel ve bilimsel proseste ortaktır ve gıdalarda yaygındır. Arayüzlerdeki yüzey aktif maddeler ve proteinler, paketleme, depolama ve uygulama sırasında antikor konformasyonlarını stabilize eder 1,2,3,4,5, gözdeki gözyaşı filmi stabilitesi 6,7,8 ve pulmoner mekanik9,10,11,12,13,14, 15.
Arayüzlere adsorbe olan yüzey aktif ajanların veya yüzey aktif maddelerin ve özelliklerinin incelenmesi, birçok farklı deneysel teknikle uzun bir geçmişe sahiptir 16,17,18,19,20,21,22,23,24,25,26,27 . Son zamanlarda ortaya çıkan bir gelişme, diğer yaygın yöntemlerden önemli ölçüde daha az malzeme kullanırken, çok daha küçük uzunluk ölçeklerinde, yüksek kavisli arayüzlerde ara yüzey özelliklerinin incelenmesine izin veren kılcal basınç mikrotensiyometresidir (CPM) 9,23,24,25. Konfokal floresan mikroskobu (CFM), CPM 22'deki hava-su arayüzlerinde veya Langmuir oluklarında 20,26,27,28,29'daki lipitlerin ve proteinlerin morfolojisini incelemek için kullanılabilir. Burada bir CPM ve CFM, biyolojik ve teknolojik arayüzler için yapı-işlev ilişkileri geliştirmek üzere morfolojik fenomenleri dinamik ve denge ara yüzey özelliklerine bağlamak için birleştirilmiştir.
CPM-CFM'nin erişebildiği ara yüzey aktif madde sistemlerinde çok sayıda önemli parametre vardır. CPM'de, 30-200 μm çapında bir hava kabarcığı bir cam kılcal tüpün ucuna sabitlenir. CPM'nin önceki versiyonlarında, kabarcığın içi ve dışı arasındaki kılcal basınç farkı bir su sütunu ve salınımlı şırınga pompası 9,30 ile kontrol edildi; burada açıklanan yeni versiyon, bunları daha yüksek hassasiyetli, bilgisayar kontrollü bir mikroakışkan pompa ile değiştiriyor. Yüzey gerilimi (γ), ΔP = 2γ / R Laplace denklemi aracılığıyla, pompa tarafından ayarlanan arayüz boyunca basınç düşüşünden, ΔP ve kabarcığın eğrilik yarıçapının optik analizinden, R'den belirlenir. Arayüzün dinamik yüzey gerilimi, çözünür bir yüzey aktif madde içeren dökme bir sıvı ile temas halinde yeni bir kabarcığın oluşturulmasını takiben 10 ms zaman çözünürlüğü ile belirlenebilir. Yüzey aktif madde adsorpsiyon dinamikleri, difüzyon, yüzey kapsamı ve kütle konsantrasyonu ile denge yüzey gerilimi arasındaki ilişki de dahil olmak üzere yüzey aktif maddenin temel özelliklerini belirlemek için klasik Ward-Tordai denklemi 10,31 ile tanımlanabilir. Bir denge yüzey gerilimi elde edildikten sonra, ara yüzey alanı, kabarcık yüzey alanındaki küçük değişikliklerin neden olduğu yüzey gerilimindeki değişiklikleri kaydederek, 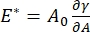 dilatasyonel modülü ölçmek için salınımlı olabilir, A32. Dolaşık polimerler veya proteinler gibi kendi iç yapılarını geliştiren daha karmaşık arayüzler için, yüzey gerilimi, daha genel bir yüzey gerilimi 4,33,
dilatasyonel modülü ölçmek için salınımlı olabilir, A32. Dolaşık polimerler veya proteinler gibi kendi iç yapılarını geliştiren daha karmaşık arayüzler için, yüzey gerilimi, daha genel bir yüzey gerilimi 4,33, 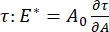 ile değiştirilir.
ile değiştirilir.
Solunum sırasındaki akciğer stabilitesi, alveolar hava-sıvı arayüzünde hem düşük yüzey geriliminin hem de yüksek dilatasyonel modülün korunmasına doğrudan bağlı olabilir 9,10. Tüm iç akciğer yüzeyleri, doku hidrasyonunu korumak için sürekli, mikron kalınlığında bir epitel astar sıvısı filmi ile kaplanmıştır34. Bu epitel astar sıvısı öncelikle sudur, tuzlar ve diğer çeşitli proteinler, enzimler, şekerler ve akciğer yüzey aktif maddesi içerir. Herhangi bir kavisli sıvı-buhar arayüzünde olduğu gibi, alveolusun (veya kabarcığın) iç kısmında daha yüksek olan basınçla kılcal bir basınç indüklenir. Bununla birlikte, yüzey gerilimi akciğerlerin her yerinde sabit olsaydı, Laplace denklemi, ΔP = 2γ / R, daha küçük alveollerin daha büyük alveollere göre daha yüksek bir iç basınca sahip olacağını ve daha küçük alveollerin gaz içeriğini daha büyük, daha düşük basınçlı alveollere akmaya zorladığını gösterir. Bu, "Laplace Kararsızlığı" olarak bilinir9,35. Net sonuç, en küçük alveollerin çökeceği ve sıvı ile doldurulacağı ve akciğerin bir kısmının çökmesine neden olacak şekilde yeniden şişirilmesi zorlaşacak ve diğer kısımların aşırı şişeceğidir, her ikisi de akut solunum sıkıntısı sendromunun (ARDS) tipik semptomlarıdır. Bununla birlikte, düzgün çalışan bir akciğerde, alveolus ara yüz bölgesindeki hava-epitelyal sıvı arayüzü solunum sırasında genişledikçe ve büzüldükçe yüzey gerilimi dinamik olarak değişir. Eğer 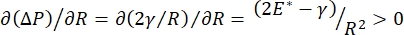 , veya
, veya 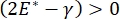 , Laplace basıncı azalan yarıçapla azalır ve Laplace dengesizliğini ortadan kaldırmak için artan yarıçapla artar, böylece akciğer9'u stabilize eder. Bu nedenle,
, Laplace basıncı azalan yarıçapla azalır ve Laplace dengesizliğini ortadan kaldırmak için artan yarıçapla artar, böylece akciğer9'u stabilize eder. Bu nedenle, 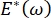 ve frekansa, tek katmanlı morfolojiye ve bileşime ve alveoler sıvı kompozisyonuna nasıl bağlı olduğu akciğer stabilitesi için gerekli olabilir. CPM-CFM ayrıca ara yüzey eğriliğinin yüzey aktif madde adsorpsiyonu25, tek katmanlı morfoloji 22 ve dilatasyonel modül9 üzerindeki etkilerinin ilk gösterimlerini sağlamıştır. CPM'deki rezervuarın küçük hacmi (~ 1 mL), sıvı fazın hızlı bir şekilde tanıtılmasına, çıkarılmasına veya değiştirilmesine izin verir ve gerekli miktarda pahalı protein veya yüzey aktif maddeyi en aza indirir10.
ve frekansa, tek katmanlı morfolojiye ve bileşime ve alveoler sıvı kompozisyonuna nasıl bağlı olduğu akciğer stabilitesi için gerekli olabilir. CPM-CFM ayrıca ara yüzey eğriliğinin yüzey aktif madde adsorpsiyonu25, tek katmanlı morfoloji 22 ve dilatasyonel modül9 üzerindeki etkilerinin ilk gösterimlerini sağlamıştır. CPM'deki rezervuarın küçük hacmi (~ 1 mL), sıvı fazın hızlı bir şekilde tanıtılmasına, çıkarılmasına veya değiştirilmesine izin verir ve gerekli miktarda pahalı protein veya yüzey aktif maddeyi en aza indirir10.
CPM-CFM görüntüsündeki kontrast, floresan olarak etiketlenmiş lipitlerin veya proteinlerin küçük fraksiyonlarınınarayüz 16,27'de dağılmasından kaynaklanmaktadır. İki boyutlu yüzey aktif madde monokatmanları genellikle yüzey gerilimi veya yüzey basıncının bir fonksiyonu olarak yanal faz ayrımı sergiler, π 0 γ temiz bir sıvı-sıvı arayüzünün yüzey gerilimi ile yüzey faktan kaplı bir arayüz arasındaki farktır γ. π, 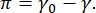 saf sıvı yüzey gerilimini düşürmek için hareket eden arayüzdeki yüzey aktif madde moleküllerinin etkileşimlerinin neden olduğu 2-D "basınç" olarak düşünülebilir. Düşük yüzey basınçlarında, lipit monokatmanları sıvı benzeri düzensiz bir durumdadır; bu, sıvı genişlemiş (LE) faz olarak bilinir. Yüzey basıncı arttıkça ve lipit molekülü başına düşen alan azaldıkça, lipitler birbirleriyle birlikte yönlendirilir ve uzun menzilli sıralı sıvı yoğunlaştırılmış (LC) faz 16,20,27'ye birinci dereceden bir faz geçişine geçebilir. LE ve LC fazları çeşitli yüzey basınçlarında bir arada bulunabilir ve floresan etiketli lipitler LC fazından dışlanıp LE fazına ayrıldığı için görselleştirilebilir. Böylece, CFM16 ile görüntülendiğinde LE fazı parlak ve LC fazı karanlıktır.
saf sıvı yüzey gerilimini düşürmek için hareket eden arayüzdeki yüzey aktif madde moleküllerinin etkileşimlerinin neden olduğu 2-D "basınç" olarak düşünülebilir. Düşük yüzey basınçlarında, lipit monokatmanları sıvı benzeri düzensiz bir durumdadır; bu, sıvı genişlemiş (LE) faz olarak bilinir. Yüzey basıncı arttıkça ve lipit molekülü başına düşen alan azaldıkça, lipitler birbirleriyle birlikte yönlendirilir ve uzun menzilli sıralı sıvı yoğunlaştırılmış (LC) faz 16,20,27'ye birinci dereceden bir faz geçişine geçebilir. LE ve LC fazları çeşitli yüzey basınçlarında bir arada bulunabilir ve floresan etiketli lipitler LC fazından dışlanıp LE fazına ayrıldığı için görselleştirilebilir. Böylece, CFM16 ile görüntülendiğinde LE fazı parlak ve LC fazı karanlıktır.
Bu makalenin amacı, kombine konfokal mikroskop mikrotensiyometresini oluşturmak ve çalıştırmak için gerekli adımları tanımlamaktır. Bu, okuyucunun adsorpsiyon çalışmaları yapmasına, yüzey gerilimini, reolojik davranışı ölçmesine ve mikron ölçekli bir hava / su veya yağ / su arayüzünde aynı anda ara yüzey morfolojisini incelemesine olanak tanır. Bu, gerekli kılcal damarların nasıl çekileceği, kesileceği ve hidrofobikleştirileceği, basınç, eğrilik ve yüzey alanı kontrol modlarının kullanımı için talimatlar ve çözünmeyen yüzey aktif maddenin mikrotensiyometre kavisli arayüze ara yüz transferi hakkında bir tartışmayı içerir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Kılcal tüplerin hazırlanması
- Kılcal damarı bir kılcal çektirmeye yerleştirin ve ucunda ~ 1 μm dış çapa (OD) sahip iki konik kılcal damar yapmak için istenen çekme programını çalıştırın.
NOT: Çekmeden önce kılcal damarın OD'si, mikrotensiyometre hücresindeki kılcal tutucuya sığacak şekilde belirtilen OD olmalıdır. Kılcal damarın iç çapı (ID) değişebilir, ancak çekmeyi takiben kılcal damarın kritik yarıçapını etkileyecektir. Bir çekme programı seçilir, böylece elde edilen konik başlangıçta kılcal OD ve ID'yi hızlı bir şekilde azaltır, daha sonra istenen kılcal OD ve ID'nin yakınında bir yarıçapa ulaşır ve daha sonra çapı daha yavaş azaltır. Bu, ID'de 30-100 μm'lik kullanılabilir bir kılcal damar elde etmek için puanlanabilen daha büyük bir kılcal uzunluk yaratacaktır. - 30-100 μm'lik bir kimlik elde etmek ve ucu kırmak için kılcal damarın ucunu istenen noktada puanlayın. Kılcal damar artık ucunda istenen yarıçapın bir OD'sine ve ID'sine sahip olacaktır (Şekil 1A). Kılcal damarlar 2. adıma kadar saklanabilir.
NOT: Kılcal damarın kesme kenarı 90° temiz bir mola olmalıdır. Kesme kenarındaki herhangi bir kusur, kabarcığın kılcal damar ve zayıf yüzey özelliği ölçümlerine kötü sabitlenmesine yol açacaktır. Konik kılcal uçlar çok hassastır. Çözeltilerden başka herhangi bir şeyle temas ederlerse (örneğin, şişe duvarları, hava nozulu) imha edilirler.
2. Kılcal damarların hidrofobikleşmesi
- Çekilmiş cam kılcal damarları, asit temizleme çözeltisini, plastik cımbızları, deiyonize (DI) suyu, hidrofobibizasyon çözeltisini (etanolde% 2 silane), vakum pompasını ve etanol çözeltisini toplayın. Ayrıntılar için Malzeme Tablosu'na bakın.
DİKKAT: Asit temizleme solüsyonu akut toksiktir, cilt ve göz korozyonuna / tahrişine neden olur, oksitleyicidir. Hidrofobizasyon çözeltisi bir cilt / göz / solunum tahriş edicidir. Göz koruyucu, laboratuvar önlükleri ve eldivenler giyin ve duman davlumbazındaki solüsyonlarla çalışın. - Kılcal damarı asitle temizleyin
NOT: Kılcal damarın asit ile temizlenmesi, kılcal damar içindeki organik kalıntıları giderir ve cam yüzeyi, kılcal hidrofobik hale getiren silanizasyon reaksiyonu için hazırlar.- Cımbızla geniş ucuna sıkıca yakın bir kılcal damar tutun.
- Konik ucu asit temizleme çözeltisine batırarak hortumu vakum pompasından kılcal damarın geniş ucuna takın. Bu, çözeltiyi kılcal damar içine emecektir.
NOT: Kılcal hortumun ucuna, kılcal uçla daha iyi oturması için bir pipet ucu takılabilir. - Asit temizleme çözeltisi kılcal damarın yaklaşık yarısını doldurduğunda durun.
NOT: Kılcal ucun asit temizleme çözeltisinden çıkarılmasından sonra, kılcal damarın dışındaki çözelti genellikle kılcal ucun yakınında bir boncuk oluşturur. Fazla çözeltiyi çıkarmak için kılcal damarı çözelti şişesinin boynuna hafifçe dokunun. - Asit temizleme çözeltisinin kılcal damarlarda en az 30 dakika kalmasına izin verin ve sıvının tıkaçının kılcal damarın konik ucunda kalmasını sağlayın.
- Kılcal damarı cımbızla sıkıca tutarak ve sıvıyı kılcal damarın büyük ucundan çıkarmak için vakum hortumunu kullanarak asit temizleme solüsyonunu kılcal damardan çıkarın.
- Kılcal damarı durulayın
- Kılcal damarın konik ucunu DI suyuna batırın, asit temizleme çözeltisine batırılmış herhangi bir dış yüzeyi kaplayacak kadar derine batırılmasını sağlayın. Uç suya batırılmışken, DI suyunu kılcal damardan çekmek için vakum hortumunu kullanın. Kılcal damarı sudan çıkarın ve kalan suyu vakum hortumuyla çıkarın.
- Yukarıdaki adımı en az 4 kat tekrarlayın.
- DI suyu yerine etanol koyarak adım 2.3'ü tekrar uygulayın.
- Etanol kılcal damarın içinden tamamen buharlaşana kadar sürekli olarak emme uygulayın. Kılcal damar, etanol buharlaşmaya başladığında dokunmak için bulanık ve serin hale gelecektir, ancak 30 ila 45 s'den sonra temizlenecektir.
- Kılcal damarı hidrofobikleştirme çözeltisi ile kaplayın
- Kılcal damarın geniş ucunu etanol çözeltisindeki ~% 2 silana kısaca batırın. Kılcal hareket, kaplama çözeltisinin kılcal damar içinde yükselmesine neden olur. Kılcal damar içinde ~ 1 cm boyutunda bir tıkaç yükseldikten sonra kılcal damarı çözeltiden çıkarın.
- Kılcal damarı, konik uç aşağı bakacak şekilde yönlendirin, böylece kaplama çözeltisinin yerçekimi ile konik uca doğru düşmesine izin verin.
- Kaplama çözeltisinin kılcal damarda en az 3 dakika kalmasına izin verin.
NOT: Konik ucun iç kısmıyla temas eden kaplama çözeltisinin tapasında hava kabarcıkları olmamalıdır. Bir hava kabarcığı varsa, kılcal iç kısım muhtemelen adım 2.5'te yeterince kurutulmamıştır. Bunu gidermek için, 2.4-2.6 arasındaki adımları gerektiği gibi yineleyin.
- Kılcal damarları etanol 1x ile adım 2.3 ile aynı şekilde durulayın.
- Hidrofobik kaplamayı kılcal damar üzerine yerleştirin
- Temiz ve kuru parıltılı şişeleri 120 °C'ye ayarlanmış bir vakumlu fırına yerleştirin. Kaplanmış kılcal damarları, şişenin tabanına dayanan geniş uçlu şişelere (ideal olarak şişe başına bir kılcal damar) yerleştirin. Hidrofobik silan tabakasının kılcal damarlara kalıcı olarak bağlanmasını sağlamak için kılcal damarların fırında en az 6 saat (gece boyunca tercih edilen) kalmasına izin verin. Kılcal damarlar 4. adıma kadar saklanabilir.
3. Numune hazırlama ve depolama
- Kirlenmeyi önlemek için yüzey aktif madde ve florofor çözeltilerini temiz asitle yıkanmış şişelerde karıştırın ve saklayın.
NOT: Ticari olarak temin edilebilen lipitler en yüksek saflıkta olmalı ve kullanım arasında - 20 ° C'de depolanmalıdır. Eski veya kontamine lipitler genellikle sonuçların çoğaltılmasının zor olmasına neden olur.
4. Mikrotensiyometrenin kurulması
- BGBM hücresini Şekil 2'de açıklandığı gibi birleştirin.
- Kılcal damarın büyük tarafını, hücrenin alt tarafına doğru itinceye kadar CPM hücresinin üstüne yerleştirin.
- Kılcal damarı sabitlemek için PEEK fişini yavaşça sıkın ve ardından tüpü mikroakışkan pompadan kılcal damarın büyük tarafına takın. Konik kılcal uca dokunmamaya dikkat edin.
- Gerektiğinde, rezervuar değişimi ve/veya sıcaklık kontrol hortumlarını CPM hücresi üzerindeki ilgili giriş ve çıkışlara takın (Şekil 2); aksi takdirde, kullanılmayan giriş ve çıkışları takın.
- CPM hücresini konfokal mikroskop aşamasına takın, kabaca CFM hedefi, CPM kamera ve CPM ışık kaynağı ile hizalayın (Şekil 3).
- Pompanın önerilen çalışma basıncında (burada kullanılan mikroakışkan pompa için 150 mbar) mikroakışkan pompaya gaz akışını açın ve kılcal damara akışın açık olduğundan emin olun.
- CPM sanal arabirimini (Ek Kodlama Dosyası 1: Mikrotensiyometre Sanal Interface.vi) kılcal basınç salınım frekansı ve genliği sıfıra ayarlanmış olarak Basınç Kontrolü modunda çalıştırmaya başlayın (Şekil 4-7). Şekil 4'te sanal arabirimin ekran görüntüsü gösterilmektedir. DI suyu ve ~35 μm'lik kılcal yarıçap için, ~20 mbar'lık bir basınç, kılcal damara su girmemesini sağlar.
- CPM hücresini pipet kullanarak suyla doldurun.
- Mikrotensiyometre kamerayı kullanarak kılcal uca odaklanın.
- CFM ile kılcal uca odaklanın. Kılcal damarı bulmakta zorluk çekiyorsanız, CFM hedefini bulmak için CPM kamerayı kullanın. Bu, CFM hedefi ile kabarcık arasındaki mesafeyi yaklaşık olarak belirlemeye yardımcı olacak ve doğru çalışma mesafesine ulaşacaktır.
- Anulus (yeşil sektör projeksiyonu) kabarcık üzerinde ortalandıktan sonra, odağı kabarcık kenarının net bir şekilde görülebilmesi için manuel olarak ayarlayın (Şekil 4-3).
NOT: Annulusun konumu, başlangıç ve bitiş açısı ile iç ve dış yarıçapları, görünüm penceresinin altındaki menüden ayarlanabilir. - Balonu Sıfırla'ya tıklayın ve yeni bir kabarcığın oluştuğundan emin olun (biri eski kabarcık patlamasını duyabilecek ve yeni kabarcık kontrol paneli görüntüleme penceresinden gözlemlenebilecektir; Şekil 4-3). Kabarcık açılmazsa, görüntüleme penceresinin altındaki Kabarcık Sıfırlama sekmesinde Sıfırlama Basıncını veya Sıfırlama Gecikme Süresi'ni artırın . Yüzey geriliminin yaklaşık 73 mN/m (tuzlu su veya su/hava kabarcıkları için) olup olmadığını kontrol edin (Şekil 4-9).
- Suyu doğrudan hücreye şırınga yoluyla çıkarın (Şekil 3-13), boşaltın ve tekrar takın. Örnek, denemeyi çalıştırmak için yüklenmeye hazırdır.
5. Adsorpsiyon çalışması
- CPM yazılımını Basınç Kontrolü modunda tutan otoklavlanmış bir pipet kullanarak hücreyi istediğiniz numuneyle doldurun. Yeni bir kabarcık arayüzü oluşturulduğunda ilk yüzey geriliminin yaklaşık 73 mN/m olduğundan emin olun.
- Yeni oluşturulan kabarcığın yarıçapını belirleyin ve bu değeri merkez çizgisi alan kontrolüne girin (Şekil 4-7) ve Alan Kontrolü sekmesine tıklayarak kontrol türünü alan kontrolü olarak değiştirin (Şekil 4-8).
NOT: Sabit basınç kontrolü de kullanılabilir, ancak bu, arayüzün yüzey gerilimi değiştikçe kabarcık yarıçapının sürekli değişmesine neden olur. Bu değişen alan, yüzey aktif madde adsorpsiyon oranlarının analizini zorlaştırabilir ve çalışma sırasında kabarcığın patlamasına neden olabilir. - Konfokal videoyu kaydetmeye başlayın.
- Balonu Sıfırla'ya tıklayın (Şekil 4-5) ve hemen Veri Topla'ya tıklayın (Şekil 4-6). Düğmedeki sinyal ışığı yeşile döner.
- Veri kayıt hızını, Şekil 4-6'da gösterilen çubuğu kaydırarak numunenin konsantrasyonuna göre ayarlayın. Daha yavaş adsorpsiyonlar için daha yavaş bir kayıt hızı kullanın. Bu, daha yüksek bir kayıt hızı erken dönemde istenirse bir çalıştırmanın ortasında ayarlanabilir, ancak dosya boyutunu küçültmek için uzun çalışmalar için daha yavaş bir hız tercih edilir.
- Deneyin bitiminden sonra (son bir yüzey gerilimi platosuna ulaşıldığında), doğru dosya yolunu seçerek (Şekil 4-1) ve Kaydet düğmesine tıklayarak (Şekil 4-2) dosyayı kaydedin.
- Kaydı CFM'de de durdurun ve kaydedin.
6. Salınım/gevşeme çalışması
- CPM yazılımını Basınç Kontrolü modunda tutan otoklavlanmış bir pipet kullanarak hücreyi numuneyle doldurun. Yeni bir kabarcık arayüzü oluşturulduğunda yüzey geriliminin yaklaşık 73 mN/m olduğundan emin olun.
- Örnek arayüze tamamen adsorbe edilene kadar bekleyin. Bu, yeni bir kabarcık arayüzü ile baştan başlamak yerine doğrudan bir adsorpsiyon çalışmasından sonra gerçekleştirilebilir.
- Uygun sekmeyi seçerek (Şekil 4-8) ve istenen taban çizgisi değerini, salınım yüzdesini ve salınım sıklığını girerek (Şekil 4-7) salınımın bir basınç salınımı mı, alan salınımı mı yoksa eğrilik salınımı mı olacağına karar verin.
NOT: Testere dişi, kare ve üçgen dalga alanı salınımlarına Diğer Alan Salınımı sekmesindeki açılır menüden de erişilebilir. - Konfokal videonun kaydını başlatın ve CPM yazılımında Veri Topla'ya (Şekil 4-6) tıklayın.
- Salınımı başlatın. En iyi sonuçlar için en az yedi döngü kaydettiğinizden emin olun. Her salınım döngüsü için yeterli sayıda veri noktası vermek üzere bir veri toplama hızı seçin (Şekil 4-6).
- Diğer salınım genlikleri veya frekansları isteniyorsa, deney sırasında değerleri değiştirin.
- Sonuçları adım 5.6 ve 5.7'deki gibi kaydedin.
7. Solvent değişim çalışması
- CPM yazılımını basınç kontrol modunda tutan otoklavlanmış bir pipet kullanarak hücreyi numuneyle doldurun. Yeni bir kabarcık arayüzü oluşturulduğunda yüzey geriliminin yaklaşık 73 mN/m olduğundan emin olun.
NOT: Solvent değişim çalışmasından önce adsorpsiyon ve/veya salınım çalışmaları yapılabilir. - Giriş tüpünü istenen değişim çözeltisinin şişesiyle (Şekil 3-11) peristaltik pompaya bağlayın (Şekil 3-10).
- Videonun kaydını konfokal yazılımda başlatın ve CPM yazılımında Veri Topla'ya (Şekil 4-6) tıklayın.
- Peristaltik pompa hızını ayarlayın. Bu, sıvı değişim hızını kontrol edecektir ve deneyin gerekliliklerine, yani çözücünün ne kadar hızlı değiştirilmesi gerektiğine göre seçilmelidir.
- Birden fazla sıvının değiştirilmesi gerekiyorsa, peristaltik pompayı durdurun ve girişi başka bir değişim çözümüne bağlayın.
- Değişim bittikten sonra (~20 dakika), sonuçları adım 5.6 ve 5.7'deki gibi kaydedin.
8. Çözünmeyen yüzey aktif madde adsorpsiyonu
NOT: Adsorbe edilecek yüzey aktif madde rezervuar sıvısında çözünür değilse, bu yöntem hücrenin hava/su arayüzünden kabarcık yüzeyine bir monolayer aktarmak için kullanılabilir. Birçok çift katmanlı oluşturan lipit, tuzlu su çözeltisinde neredeyse çözünmez ve rezervuar çözeltisinde asılı kaldığında kendiliğinden kabarcığa emilmez.
- CPM yazılımını Basınç Kontrolü modunda tutan otoklavlanmış bir pipet kullanarak hücreyi numuneyle doldurun. Yeni bir kabarcık arayüzü oluşturulduğunda yüzey geriliminin yaklaşık 73 mN/m olduğundan emin olun.
- Uçucu bir organik çözelti içindeki bir çözeltiden hücrenin hava-su arayüzünde tek katmanlı çözünmez bir yüzey aktif madde biriktirin. Bir şırınga kullanarak, arayüze küçük damlacıklar bırakın ve çözücünün lipiti ince bir film olarak geride bırakarak buharlaşmasına izin verin.
DİKKAT: Kloroform, fosfatidilkolinler ve yağ asitleri gibi fosfolipitler için bir çözücü olarak kullanılır. Serpme çözeltileri genellikle çözücünün mL'si başına 0.01-0.02 mg lipittir. Kloroform akut toksiktir, cilt ve göz tahrişine neden olabilir ve kanserojendir. Uygun göz koruması, laboratuvar önlüğü ve eldivenler giyin ve çözeltiyi bir duman başlığında yapın. - Kabarcığın merkez çizgisi basınç kontrolü (Şekil 4-7) ile yüzey alanını neredeyse düz olana kadar azaltın. Bu, yüzey aktif madde adsorbe edildikten sonra kabarcığın patlamasını önler.
- Hava/su arayüzü kılcal damarın ucundan geçene kadar rezervuar sıvısını doğrudan hücreye şırınga yoluyla hücreden çıkarın. Bir şırınga pompası kullanılabilirken, bu adım şırıngayı manuel olarak kullanarak elde edilebilir.
- Rezervuar sıvı yüksekliğini başlangıç seviyesine yükseltin.
NOT: Uç yeniden suya batırıldıktan sonra, şimdi arayüzde adsorbe edilen yüzey aktif madde nedeniyle kabarcık daha büyük olacaktır. Tek katman artık salınım veya çözücü değişim deneyleri için hazır olacaktır.
9. Temizle
- CFM'yi kapatın.
- Basınç Kontrolü moduna geçin.
- Pipet kullanarak numuneyi hücreden çıkarın. Hücreyi DI suyuyla yükleyin ve kabarcıkların kılcal damardan sürekli kaçmasına ve kılcal ucu temizlemesine neden olmak için basıncı ~ 50 mbar'a yükseltin. Bu işlemi 2 kat tekrarlayın.
- Sol üst köşedeki kırmızı düğmeye tıklayarak emniyet valfini kapatın ve CPM'yi kapatın, açık ve mavi basınç kontrol panelini kapatın ve basınç kaynağını kapatın.
- Hücreyi konfokal mikroskop aşamasından çıkarın. Hücreyi etanol ve DI suyu ile durulayın. Kılcal tüpü CPM hücresinden çıkarın.
10. Hücrenin temizlenmesi
- Hücreyi sökün. DI su altında durulamaya devam ederken iç duvarı bir diş fırçasıyla fırçalayın. Parçaları etanol içine batırın ve ~ 30 dakika boyunca sonikleştirin.
- Tüm parçaları birkaç kez DI suyuyla durulayın. Parçaları azot gazı ile üfleyerek veya vakumlu fırında kurutarak kurutun.
11. Salınım analizi
- CPM sanal arabiriminden kaydedilen istediğiniz dosyayı seçerek Dilatational_Rheology_Analysis.m kodunu (Ek Kodlama Dosyası 2) çalıştırın. Örnek veriler ek dosyalara dahil edilir.
- Basınç ve zaman grafiği Ek Şekil 1'de gösterildiği gibi görünecektir. Salınımın başladığı noktaya sol tıklayın ve salınımın bittiği yere tekrar sol tıklayın. Veriler birden çok salınım içeriyorsa, tüm salınımlar için bu işlemi yineleyin.
- Tüm başlangıç ve bitiş noktaları sol tıklatıldığında, fareyi herhangi bir yere sağ tıklatın. Örneğin, Ek Şekil 1'de gösterildiği gibi, 1, 2, 3 ve 4 numaralı noktalara sol tıklama ve ardından sağ tıklama yapılabilir.
NOT: Kod, dilatasyon modülünü ve faz açısını hesaplar ve sonuçlar orijinal dosya konumundaki yeni bir .csv dosyasına yazılır. Örnek verilerin sonuçları, Ek Kodlama Dosyası 2'de verilen kod sonuçlarında görülebilir. MATLAB ayrıca Ek Şekil 2'de gösterildiği gibi verilerin birkaç grafik gösterimini de oluşturacaktır.
- Tüm başlangıç ve bitiş noktaları sol tıklatıldığında, fareyi herhangi bir yere sağ tıklatın. Örneğin, Ek Şekil 1'de gösterildiği gibi, 1, 2, 3 ve 4 numaralı noktalara sol tıklama ve ardından sağ tıklama yapılabilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Ölçüm hatasının önemli bir kaynağı, kesme işleminden (Şekil 5A,B) veya kaplama işleminden (Şekil 5D) kusurları olan kılcal damarlardan kaynaklanmaktadır. Her iki kusur türü de optik görüntü analiz sistemi tarafından kabarcık şeklinin ve boyutunun belirlenmesinde hatalara yol açarak yanlış yüzey gerilimi değerlerine yol açar. Kılcal damarı CPM'ye yerleştirmeden önce optik mikroskop altında çekildikten ve kapland...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kombine CPM / CFM, ara yüz dinamiklerini, dengeyi ve morfolojiyi incelemek için güçlü bir araçtır. Bu protokol, CPM/CFM ile veri elde etmek için gerekli adımları açıklar.
Şekil 2 , belirtilen kılcal damar, çözücü ve ısı değişimi için kanallara sahip hücre tasarımını göstermektedir. Solvent değişimi için giriş hücrenin altında olmalı, çıkış ise en üstte olmalı ve değişim sırasında hücrenin taşmamasına izin vermelidir....
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Tüm konfokal mikroskopi görüntüleri Nikon A1RHD Multiphoton dik konfokal mikroskop kullanılarak elde edildi. Minnesota Üniversitesi Üniversite Görüntüleme Merkezi'ndeki destek personelinin, özellikle Guillermo Marques'in rehberliğini ve yardımını kabul ediyoruz. Bu çalışma NIH Grant HL51177 tarafından desteklenmiştir. SI, Ruth L. Kirschstein NRSA Kurumsal Araştırma Eğitim Hibe F32 HL151128 tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referanslar
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır