Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microtensiomètre pour la visualisation en microscopie confocale d’interfaces dynamiques
Dans cet article
Résumé
Ce manuscrit décrit la conception et le fonctionnement d’un microtensiomètre/microscope confocal pour effectuer des mesures simultanées de la tension interfaciale et de la rhéologie dilatationnelle de surface tout en visualisant la morphologie interfaciale. Cela fournit la construction en temps réel des relations structure-propriété des interfaces importantes en technologie et en physiologie.
Résumé
L’adsorption de molécules tensio-actives aux interfaces fluide-fluide est omniprésente dans la nature. Pour caractériser ces interfaces, il faut mesurer les taux d’adsorption des tensioactifs, évaluer les tensions superficielles d’équilibre en fonction de la concentration en vrac de tensioactifs et relier la façon dont la tension superficielle change avec les changements dans la zone interfaciale après l’équilibre. La visualisation simultanée de l’interface à l’aide de l’imagerie par fluorescence avec un microscope confocal à grande vitesse permet l’évaluation directe des relations structure-fonction. Dans le microtensiomètre à pression capillaire (CPM), une bulle d’air hémisphérique est épinglée à l’extrémité du capillaire dans un réservoir de liquide de volume de 1 mL. La pression capillaire à travers l’interface de bulle est contrôlée via un régulateur de débit microfluidique commercial qui permet un contrôle de la pression, de la courbure de bulle ou de la zone de bulle basé sur un modèle basé sur l’équation de Laplace. Par rapport aux techniques précédentes telles que l’auge de Langmuir et la goutte pendentive, la précision de mesure et de contrôle et le temps de réponse sont considérablement améliorés; les variations de pression capillaire peuvent être appliquées et contrôlées en quelques millisecondes. La réponse dynamique de l’interface à bulles est visualisée via une deuxième lentille optique à mesure que la bulle se dilate et se contracte. Le contour de la bulle est ajusté à un profil circulaire pour déterminer le rayon de courbure de la bulle, R, ainsi que tout écart par rapport à la circularité qui invaliderait les résultats. L’équation de Laplace est utilisée pour déterminer la tension superficielle dynamique de l’interface. Après l’équilibrage, de petites oscillations de pression peuvent être imposées par la pompe microfluidique contrôlée par ordinateur pour faire osciller le rayon de la bulle (fréquences de 0,001-100 cycles/min) pour déterminer le module dilatationnel Les dimensions globales du système sont suffisamment petites pour que le microtensiomètre passe sous la lentille d’un microscope confocal à grande vitesse permettant de suivre quantitativement les espèces chimiques marquées par fluorescence avec une résolution latérale submicronique.
Introduction
Les interfaces air-eau recouvertes de films tensioactifs sont omniprésentes dans la vie quotidienne. Les injections d’eau tensioactive sont utilisées pour améliorer la récupération du pétrole des champs épuisés et sont utilisées comme solutions de fracturation hydraulique pour le gaz et le pétrole de schiste. Les mousses gaz-liquides et les émulsions liquide-liquide sont communes à de nombreux procédés industriels et scientifiques en tant que lubrifiants et agents de nettoyage et sont courantes dans les aliments. Les tensioactifs et les protéines aux interfaces stabilisent les conformations d’anticorps pendant l’emballage, le stockage et l’administration 1,2,3,4,5, la stabilité du film lacrymal dans l’œil 6,7,8 et la mécanique pulmonaire 9,10,11,12,13,14, 15.
L’étude des agents tensioactifs ou des tensioactifs adsorbant les interfaces et de leurs propriétés a une longue histoire avec de nombreuses techniques expérimentales différentes 16,17,18,19,20,21,22,23,24,25,26,27 . Un développement récent est le microtensiomètre à pression capillaire (CPM), qui permet l’examen des propriétés interfaciales sur des interfaces très incurvées, à des échelles de longueur beaucoup plus petites, tout en utilisant beaucoup moins de matériaux que d’autres méthodes courantes 9,23,24,25. La microscopie confocale à fluorescence (CFM) peut être utilisée pour étudier la morphologie des lipides et des protéines aux interfaces air-eau dans le CPM22 ou sur les creux de Langmuir 20,26,27,28,29. Ici, un CPM et un CFM ont été combinés pour relier les phénomènes morphologiques aux propriétés interfaciales dynamiques et d’équilibre afin de développer des relations structure-fonction pour les interfaces biologiques et technologiques.
Il existe de nombreux paramètres importants dans les systèmes de tensioactifs interfaciaux accessibles au CPM-CFM. Dans le CPM, une bulle d’air de 30 à 200 μm de diamètre est épinglée à l’extrémité d’un tube capillaire en verre. Dans les versions antérieures du CPM, la différence de pression capillaire entre l’intérieur et l’extérieur de la bulle était contrôlée via une colonne d’eau et une pompe à seringue oscillatoire 9,30 ; la nouvelle version décrite ici les remplace par une pompe microfluidique de plus grande précision, contrôlée par ordinateur. La tension superficielle (γ) est déterminée par l’équation de Laplace, ΔP = 2γ/R, à partir de la chute de charge à travers l’interface définie par la pompe, ΔP, et l’analyse optique du rayon de courbure de la bulle, R. La tension superficielle dynamique de l’interface peut être déterminée avec une résolution temporelle de 10 ms suite à la génération d’une nouvelle bulle en contact avec un liquide en vrac contenant un tensioactif soluble. La dynamique d’adsorption du tensioactif peut être décrite par l’équation classiquede Ward-Tordai 10,31 pour déterminer les propriétés essentielles du tensioactif, y compris la diffusivité, la couverture de surface et la relation entre la concentration en vrac et la tension superficielle d’équilibre. Une fois qu’une tension superficielle d’équilibre est atteinte, la zone interfaciale peut être oscillée pour mesurer le module dilatationnel, 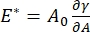 en enregistrant les changements de tension superficielle induits par de petits changements dans la surface de la bulle, A32. Pour les interfaces plus complexes qui développent leurs propres structures internes telles que des polymères ou des protéines intriqués, la tension superficielle, , est remplacée par une contrainte de surface plus générale 4,33,
en enregistrant les changements de tension superficielle induits par de petits changements dans la surface de la bulle, A32. Pour les interfaces plus complexes qui développent leurs propres structures internes telles que des polymères ou des protéines intriqués, la tension superficielle, , est remplacée par une contrainte de surface plus générale 4,33, 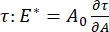 .
.
La stabilité pulmonaire pendant la respiration peut être directement liée au maintien d’une faible tension superficielle et d’un module dilatationnel élevé à l’interface air-liquide alvéolaire 9,10. Toutes les surfaces pulmonaires internes sont tapissées d’un film continu de liquide de la muqueuse épithéliale d’épaisseur pour maintenir l’hydratation des tissus34. Ce liquide de la muqueuse épithéliale est principalement de l’eau, avec des sels et diverses autres protéines, enzymes, sucres et tensioactifs pulmonaires. Comme c’est le cas pour toute interface liquide-vapeur incurvée, une pression capillaire est induite avec la pression plus élevée à l’intérieur de l’alvéole (ou bulle). Cependant, si la tension superficielle était constante partout dans les poumons, l’équation de Laplace, ΔP = 2γ/R, montre que les alvéoles plus petites auraient une pression interne plus élevée par rapport aux alvéoles plus grandes, forçant les teneurs en gaz des alvéoles plus petites à s’écouler vers des alvéoles plus grandes et plus basses. C’est ce qu’on appelle « l’instabilité de Laplace »9,35. Le résultat net est que les plus petites alvéoles s’effondreraient et seraient remplies de liquide et deviendraient difficiles à regonfler, provoquant l’effondrement d’une partie du poumon, et d’autres parties se gonfleraient à l’excès, deux symptômes typiques du syndrome de détresse respiratoire aiguë (SDRA). Cependant, dans un poumon qui fonctionne correctement, la tension superficielle change dynamiquement à mesure que l’interface air-liquide épithélial dans la zone interfaciale alvéole se dilate et se contracte pendant la respiration. Si 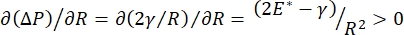 , ou
, ou 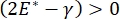 , la pression de Laplace diminue avec un rayon décroissant et augmente avec un rayon croissant de manière à éliminer l’instabilité de Laplace, stabilisant ainsi le poumon9. Par conséquent,
, la pression de Laplace diminue avec un rayon décroissant et augmente avec un rayon croissant de manière à éliminer l’instabilité de Laplace, stabilisant ainsi le poumon9. Par conséquent, 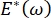 , et comment cela dépend de la fréquence, de la morphologie et de la composition de la monocouche, et de la composition du liquide alvéolaire peut être essentiel pour la stabilité pulmonaire. Le CPM-CFM a également fourni les premières démonstrations des effets de la courbure interfaciale sur l’adsorption du tensioactif25, la morphologie monocouche22 et le module dilatationnel9. Le petit volume (~1 mL) du réservoir dans le CPM permet l’introduction, l’élimination ou l’échange rapide de la phase liquide et minimise la quantité requise de protéines ou de tensioactifs coûteux10.
, et comment cela dépend de la fréquence, de la morphologie et de la composition de la monocouche, et de la composition du liquide alvéolaire peut être essentiel pour la stabilité pulmonaire. Le CPM-CFM a également fourni les premières démonstrations des effets de la courbure interfaciale sur l’adsorption du tensioactif25, la morphologie monocouche22 et le module dilatationnel9. Le petit volume (~1 mL) du réservoir dans le CPM permet l’introduction, l’élimination ou l’échange rapide de la phase liquide et minimise la quantité requise de protéines ou de tensioactifs coûteux10.
Le contraste dans une image CPM-CFM est dû à la distribution de petites fractions de lipides ou de protéines marqués par fluorescence à l’interface16,27. Les monocouches de tensioactifs bidimensionnels présentent souvent une séparation de phase latérale en fonction de la tension superficielle ou de la pression superficielle, 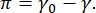 π est la différence entre la tension superficielle d’une interface fluide-fluide propre, γ 0, et une interface recouverte de tensioactif, γ. π peut être considérée comme la « pression » 2D causée par les interactions des molécules de tensioactif à l’interface qui agit pour abaisser la tension superficielle du fluide pur. À basse pression de surface, les monocouches lipidiques sont dans un état désorganisé semblable à un liquide; c’est ce qu’on appelle la phase d’expansion liquide (LE). Au fur et à mesure que la pression de surface augmente et que la surface par molécule lipidique diminue, les lipides s’orientent les uns avec les autres et peuvent subir une transition de phase de premier ordre vers la phasecondensée liquide ordonnée (LC) à longue distance 16,20,27. Les phases LE et LC peuvent coexister à différentes pressions de surface et peuvent être visualisées comme des lipides marqués par fluorescence sont exclus de la phase LC et se séparent de la phase LE. Ainsi, la phase LE est lumineuse et la phase LC est sombre lorsqu’elle est imagée avec CFM16.
π est la différence entre la tension superficielle d’une interface fluide-fluide propre, γ 0, et une interface recouverte de tensioactif, γ. π peut être considérée comme la « pression » 2D causée par les interactions des molécules de tensioactif à l’interface qui agit pour abaisser la tension superficielle du fluide pur. À basse pression de surface, les monocouches lipidiques sont dans un état désorganisé semblable à un liquide; c’est ce qu’on appelle la phase d’expansion liquide (LE). Au fur et à mesure que la pression de surface augmente et que la surface par molécule lipidique diminue, les lipides s’orientent les uns avec les autres et peuvent subir une transition de phase de premier ordre vers la phasecondensée liquide ordonnée (LC) à longue distance 16,20,27. Les phases LE et LC peuvent coexister à différentes pressions de surface et peuvent être visualisées comme des lipides marqués par fluorescence sont exclus de la phase LC et se séparent de la phase LE. Ainsi, la phase LE est lumineuse et la phase LC est sombre lorsqu’elle est imagée avec CFM16.
Le but de ce manuscrit est de décrire les étapes nécessaires à la construction et à l’exploitation du microtensiomètre combiné du microscope confocal. Cela permettra au lecteur d’effectuer des études d’adsorption, de mesurer la tension superficielle, le comportement rhéologique et d’examiner simultanément la morphologie interfaciale sur une interface air/eau ou huile/eau à l’échelle du micron. Cela comprend une discussion sur la façon de tirer, couper et hydrophober les capillaires requis, des instructions pour l’utilisation des modes de contrôle de la pression, de la courbure et de la surface, et le transfert interfacial de tensioactif insoluble à l’interface incurvée du microtensiomètre.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparation des tubes capillaires
- Placez le capillaire dans un extracteur capillaire et exécutez le programme de traction souhaité pour fabriquer deux capillaires coniques d’un diamètre extérieur (OD) d’environ 1 μm à la pointe.
REMARQUE: L’OD du capillaire avant de tirer doit être le OD spécifié pour s’adapter au support capillaire dans la cellule du microtensiomètre. Le diamètre intérieur (ID) du capillaire peut varier, mais affectera le rayon critique du capillaire après la traction. Un programme de traction est choisi de sorte que la conicité résultante réduise d’abord rapidement l’OD capillaire et l’ID, puis atteigne un rayon proche de l’OD et de l’ID capillaires souhaités, puis réduise le diamètre plus lentement. Cela créera une plus grande longueur capillaire qui peut être notée pour donner un capillaire utilisable de 30-100 μm en ID. - Marquez la pointe du capillaire à l’endroit souhaité pour obtenir un ID de 30-100 μm et cassez la pointe. Le capillaire aura maintenant un OD et un ID du rayon souhaité à l’extrémité (Figure 1A). Les capillaires peuvent être stockés jusqu’à l’étape 2.
REMARQUE: Le bord coupé du capillaire doit être une cassure propre de 90 °. Tout défaut dans le bord coupé entraînera une mauvaise épinglage de la bulle au capillaire et de mauvaises mesures des propriétés de surface. Les pointes capillaires effilées sont très délicates. Ils seront détruits s’ils entrent en contact avec autre chose que les solutions (p. ex., parois du flacon, buse d’air).
2. Hydrophobisation des capillaires
- Rassemblez les capillaires en verre tirés, la solution de nettoyage acide, les pinces à épiler en plastique, l’eau désionisée (DI), la solution d’hydrophobisation (2% de silane dans l’éthanol), la pompe à vide et la solution d’éthanol. Voir le tableau des matériaux pour plus de détails.
ATTENTION: La solution de nettoyage acide est toxique, provoque une corrosion / irritation de la peau et des yeux, est oxydante. La solution d’hydrophobisation est un irritant pour la peau, les yeux et les voies respiratoires. Portez une protection oculaire, des blouses de laboratoire et des gants et travaillez avec des solutions dans une hotte aspirante. - Nettoyez le capillaire à l’acide
REMARQUE: Le nettoyage à l’acide du capillaire élimine tous les résidus organiques à l’intérieur du capillaire et prépare la surface du verre à la réaction de silanisation qui rend le capillaire hydrophobe.- Attrapez un capillaire fermement près de son extrémité large avec la pince à épiler.
- Trempez la pointe effilée dans la solution de nettoyage acide tout en fixant le tuyau de la pompe à vide à l’extrémité large du capillaire. Cela aspirera la solution dans le capillaire.
REMARQUE: Une pointe de pipette peut être fixée à l’extrémité du tuyau capillaire pour permettre un meilleur ajustement avec l’extrémité capillaire. - Arrêtez lorsque la solution de nettoyage acide a rempli environ la moitié du capillaire.
REMARQUE: Après avoir retiré la pointe capillaire de la solution de nettoyage acide, la solution à l’extérieur du capillaire forme souvent une perle près de la pointe capillaire. Touchez doucement le capillaire jusqu’au cou du flacon de solution pour éliminer l’excès de solution. - Laissez la solution de nettoyage acide rester dans les capillaires pendant au moins 30 minutes, en veillant à ce que le bouchon du liquide reste à l’extrémité effilée du capillaire.
- Retirez la solution de nettoyage acide du capillaire en tenant fermement le capillaire avec la pince à épiler et en utilisant le tuyau d’aspiration pour extraire le liquide de la grande extrémité du capillaire.
- Rincer le capillaire
- Immergez l’extrémité effilée du capillaire dans l’eau DI en vous assurant qu’elle est immergée assez profondément pour couvrir tout extérieur qui a été immergé dans la solution de nettoyage acide. Pendant que la pointe est immergée, utilisez le tuyau d’aspiration pour tirer l’eau DI à travers le capillaire. Retirez le capillaire de l’eau et retirez l’eau restante avec le tuyau d’aspiration.
- Répétez l’étape ci-dessus au moins 4x.
- Effectuez à nouveau l’étape 2.3 en remplaçant l’éthanol par de l’eau DI.
- Appliquer l’aspiration en continu jusqu’à ce que l’éthanol s’évapore complètement de l’intérieur du capillaire. Le capillaire deviendra trouble et frais au toucher au fur et à mesure que l’éthanol commencera à s’évaporer, mais disparaîtra après 30 à 45 s.
- Enduire le capillaire avec la solution d’hydrophobisation
- Trempez brièvement l’extrémité large du capillaire dans le silane à ~ 2% dans la solution d’éthanol. L’action capillaire fera monter la solution de revêtement dans le capillaire. Retirez le capillaire de la solution une fois qu’un bouchon de taille ~ 1 cm s’est élevé dans le capillaire.
- Orientez le capillaire de manière à ce que la pointe effilée soit orientée vers le bas, ce qui permet à la solution de revêtement de tomber par gravité vers la pointe effilée.
- Laisser la solution de revêtement rester dans le capillaire pendant au moins 3 min.
REMARQUE: Il ne doit pas y avoir de bulles d’air dans le bouchon de la solution de revêtement qui est en contact avec l’intérieur de la pointe effilée. S’il y a une bulle d’air, l’intérieur capillaire n’a probablement pas été suffisamment séché à l’étape 2.5. Pour y remédier, répétez les étapes 2.4 à 2.6 au besoin.
- Rincez les capillaires avec de l’éthanol 1x de la même manière que l’étape 2.3.
- Réglez le revêtement hydrophobe sur le capillaire
- Placez les flacons de scintillation propres et secs dans un four à vide réglé à 120 °C. Placez les capillaires enduits dans les flacons (idéalement un capillaire par flacon) avec de larges extrémités reposant sur la base du flacon. Laisser les capillaires rester au four pendant au moins 6 h (de préférence pendant la nuit) pour obtenir une liaison permanente de la couche de silane hydrophobe aux capillaires. Les capillaires peuvent être stockés jusqu’à l’étape 4.
3. Préparation et stockage des échantillons
- Mélanger et stocker les solutions de tensioactifs et de fluorophores dans des flacons propres lavés à l’acide pour éviter toute contamination.
REMARQUE: Les lipides disponibles dans le commerce doivent être de la plus haute pureté et stockés entre les utilisations à - 20 ° C. Les lipides anciens ou contaminés rendent souvent les résultats difficiles à reproduire.
4. Configuration du microtensiomètre
- Assemblez la cellule CPM comme décrit à la figure 2.
- Placez le grand côté du capillaire dans le haut de la cellule CPM jusqu’à ce qu’il pousse à travers la face inférieure de la cellule.
- Serrez doucement le bouchon en PEEK pour fixer le capillaire, puis fixez le tube de la pompe microfluidique au grand côté du capillaire. Veillez à ne pas toucher la pointe capillaire effilée.
- Si nécessaire, fixez les tuyaux d’échange de réservoir et/ou de contrôle de la température aux entrées et sorties respectives de la cellule CPM (Figure 2); sinon, branchez les entrées et les sorties inutilisées.
- Fixez la cellule CPM à l’étage du microscope confocal, en l’alignant grossièrement avec l’objectif CFM, la caméra CPM et la source lumineuse CPM (Figure 3).
- Ouvrez le débit de gaz vers la pompe microfluidique à la pression de fonctionnement recommandée de la pompe (150 mbar pour la pompe microfluidique utilisée ici) et assurez-vous que le débit vers le capillaire est ouvert.
- Commencez à exécuter l’interface virtuelle CPM (Fichier de codage supplémentaire 1 : Microtensiomètre virtuel Interface.vi) en mode Contrôle de pression avec la fréquence et l’amplitude d’oscillation de la pression capillaire réglées sur zéro (Figure 4-7). La figure 4 montre une capture d’écran de l’interface virtuelle. Pour l’eau DI et un rayon capillaire d’environ 35 μm, une pression d’environ 20 mbar garantit qu’aucune eau ne pénètre dans le capillaire.
- Remplissez la cellule CPM avec de l’eau à l’aide d’une pipette.
- Concentrez-vous sur la pointe capillaire à l’aide de la caméra microtensiomètre.
- Concentrez-vous sur la pointe capillaire avec le CFM. S’il est difficile de trouver le capillaire, utilisez la caméra CPM pour trouver l’objectif CFM. Cela aidera à approximer la distance entre l’objectif CFM et la bulle, en atteignant la distance de travail correcte.
- Une fois que l’anneau (projection du secteur vert) est centré sur la bulle, ajustez manuellement la mise au point afin que le bord de la bulle puisse être vu clairement (Figure 4-3).
REMARQUE: La position, l’angle de début et de fin et les rayons intérieurs et extérieurs de l’anneau peuvent être ajustés via le menu situé sous la fenêtre de vue. - Cliquez sur Réinitialiser la bulle et assurez-vous qu’une nouvelle bulle est formée (on pourra entendre l’ancienne bulle éclater, et la nouvelle bulle sera observable à partir de la fenêtre de visualisation du panneau de configuration; Figure 4-3). Si la bulle n’apparaît pas, augmentez la pression de réinitialisation ou augmentez le délai de réinitialisation dans l’onglet Réinitialisation de la bulle sous la fenêtre d’affichage. Vérifiez si la tension superficielle est d’environ 73 mN/m (pour les bulles salines ou d’eau/air) (Figure 4-9).
- Retirez l’eau à l’aide de la seringue directe à la cellule (Figure 3-13), videz-la et rattachez-la. L’exemple est prêt à être chargé pour exécuter l’expérience.
5. Étude d’adsorption
- Remplissez la cellule avec l’échantillon souhaité à l’aide d’une pipette autoclavée en maintenant le logiciel CPM en mode contrôle de pression . Assurez-vous que la tension superficielle initiale est d’environ 73 mN/m lorsqu’une nouvelle interface à bulles est créée.
- Déterminez le rayon de la bulle nouvellement formée et entrez cette valeur dans le contrôle de zone de ligne médiane (Figure 4-7) et remplacez le type de contrôle par contrôle de zone en cliquant sur l’onglet Contrôle de zone (Figure 4-8).
REMARQUE: Un contrôle de pression constant peut également être utilisé, mais cela provoque un changement continu du rayon de la bulle à mesure que la tension superficielle de l’interface change. Cette zone changeante peut compliquer l’analyse des taux d’adsorption des tensioactifs et provoquer l’éclatement de la bulle pendant l’étude. - Commencez à enregistrer la vidéo confocale.
- Cliquez sur Réinitialiser la bulle (Figure 4-5) et cliquez immédiatement sur Collecter les données (Figure 4-6). Le voyant de signalisation sur le bouton devient vert.
- Ajustez le taux d’enregistrement des données en fonction de la concentration de l’échantillon en faisant glisser la barre illustrée à la figure 4-6. Pour des adsorptions plus lentes, utilisez un taux d’enregistrement plus lent. Cela peut être ajusté au milieu d’une exécution si un taux d’enregistrement plus élevé est souhaité dès le début, mais un taux plus lent est préférable pour les études longues afin de réduire la taille du fichier.
- Après la fin de l’expérience (lorsqu’un plateau de tension superficielle final a été atteint), enregistrez le fichier en choisissant le chemin de fichier correct (Figure 4-1) et en cliquant sur le bouton Enregistrer (Figure 4-2).
- Arrêtez et enregistrez également l’enregistrement sur le CFM.
6. Étude d’oscillation/relaxation
- Remplissez la cellule avec l’échantillon à l’aide d’une pipette autoclavée en maintenant le logiciel CPM en mode contrôle de pression . Assurez-vous que la tension superficielle est d’environ 73 mN/m lorsqu’une nouvelle interface à bulles est créée.
- Attendez que l’échantillon soit complètement adsorbé dans l’interface. Cela peut être effectué directement après une étude d’adsorption au lieu de recommencer avec une nouvelle interface à bulles.
- Décidez si l’oscillation sera une oscillation de pression, une oscillation de surface ou une oscillation de courbure en sélectionnant l’onglet approprié (Figure 4-8) et en entrant la valeur de référence souhaitée, le pourcentage d’oscillation et la fréquence d’oscillation (Figure 4-7).
REMARQUE: Les oscillations en dents de scie, carrées et triangulaires de la zone d’onde sont également accessibles à partir du menu déroulant de l’onglet Autre oscillation de zone . - Démarrez l’enregistrement de la vidéo confocale et cliquez sur Collecter les données (Figure 4-6) sur le logiciel CPM.
- Démarrez l’oscillation. Assurez-vous d’enregistrer au moins sept cycles pour de meilleurs résultats. Choisissez un taux d’acquisition de données (Figure 4-6) pour donner un nombre adéquat de points de données pour chaque cycle d’oscillation.
- Si d’autres amplitudes ou fréquences d’oscillation sont souhaitées, modifiez les valeurs pendant l’expérience.
- Enregistrez les résultats comme dans les étapes 5.6 et 5.7.
7. Étude d’échange de solvants
- Remplissez la cellule avec l’échantillon à l’aide d’une pipette autoclavée en maintenant le logiciel CPM en mode de contrôle de la pression. Assurez-vous que la tension superficielle est d’environ 73 mN/m, lorsqu’une nouvelle interface à bulles est créée.
REMARQUE : Des études d’adsorption et/ou d’oscillation peuvent être effectuées avant l’étude d’échange de solvants. - Raccordez le tube d’entrée avec la bouteille de la solution d’échange souhaitée (Figure 3-11) à la pompe péristaltique (Figure 3-10).
- Démarrez l’enregistrement de la vidéo dans un logiciel confocal et cliquez sur Collecter des données (Figure 4-6) sur le logiciel CPM.
- Réglez la vitesse de la pompe péristaltique. Cela permettra de contrôler le taux d’échange de fluide et doit être choisi en fonction des exigences de l’expérience, c’est-à-dire de la vitesse à laquelle le solvant doit être échangé.
- Si plusieurs fluides doivent être échangés, arrêtez la pompe péristaltique et connectez l’entrée à une autre solution d’échange.
- Une fois l’échange terminé (~20 min), enregistrez les résultats comme aux étapes 5.6 et 5.7.
8. Adsorption de tensioactif insoluble
REMARQUE: Si le tensioactif à adsorber n’est pas soluble dans le liquide réservoir, cette méthode peut être utilisée pour transférer une monocouche de l’interface air/eau de la cellule à la surface de la bulle. De nombreux lipides formant des bicouches sont presque insolubles dans une solution saline et n’absorbent pas spontanément dans la bulle lorsqu’ils sont en suspension dans la solution réservoir.
- Remplissez la cellule avec l’échantillon à l’aide d’une pipette autoclavée en maintenant le logiciel CPM en mode contrôle de pression . Assurez-vous que la tension superficielle est d’environ 73 mN/m, lorsqu’une nouvelle interface à bulles est créée.
- Déposer une monocouche de tensioactif insoluble sur l’interface air-eau de la cellule à partir d’une solution dans une solution organique volatile. À l’aide d’une seringue, déposez de petites gouttelettes à l’interface et laissez le solvant s’évaporer en laissant le lipide sous forme de film mince.
ATTENTION: Le chloroforme est utilisé comme solvant pour les phospholipides tels que la phosphatidylcholines et les acides gras. Les solutions d’épandage sont généralement de 0,01 à 0,02 mg de lipide par mL de solvant. Le chloroforme est extrêmement toxique, peut causer une irritation de la peau et des yeux et est cancérigène. Portez une protection oculaire, une blouse de laboratoire et des gants appropriés et fabriquez la solution dans une hotte aspirante. - Diminuez la surface via le contrôle de pression de la ligne médiane (Figure 4-7) de la bulle jusqu’à ce qu’elle soit presque plate. Cela empêche la bulle d’éclater après l’adsorbation du tensioactif.
- Retirez le liquide réservoir de la cellule via la seringue directe à la cellule jusqu’à ce que l’interface air/eau passe au-delà de l’extrémité du capillaire. Bien qu’une pompe à seringue puisse être utilisée, cette étape peut être réalisée en utilisant manuellement la seringue.
- Augmentez la hauteur du liquide du réservoir à son niveau initial.
REMARQUE: Une fois la pointe resoubmergedée, la bulle sera plus grande en raison du tensioactif qui est maintenant adsorbé sur l’interface. La monocouche sera maintenant prête pour des expériences d’oscillation ou d’échange de solvants.
9. Nettoyer
- Éteignez le CFM.
- Passez en mode contrôle de la pression .
- Retirez l’échantillon de la cellule à l’aide d’une pipette. Chargez la cellule avec de l’eau DI et augmentez la pression à ~ 50 mbar pour que les bulles s’échappent constamment du capillaire et nettoient la pointe capillaire. Répétez ce processus 2x.
- Fermez la soupape de sécurité et éteignez le CPM en cliquant sur le bouton rouge dans le coin supérieur gauche, éteignez le panneau de commande de pression bleu et lumineux et fermez la source de pression.
- Retirez la cellule de l’étage du microscope confocal. Rincez la cellule avec de l’éthanol et de l’eau DI. Retirez le tube capillaire de la cellule CPM.
10. Nettoyage de la cellule
- Démontez la cellule. Brossez le mur intérieur avec une brosse à dents tout en rinçant sous l’eau DI. Immergez les pièces dans de l’éthanol et soniquez-les pendant environ 30 min.
- Rincez toutes les pièces avec de l’eau DI plusieurs fois. Séchez les pièces en les soufflant avec de l’azote gazeux ou en les séchant à l’intérieur d’un four à vide.
11. Analyse des oscillations
- Exécutez le code Dilatational_Rheology_Analysis.m (fichier de codage supplémentaire 2), en choisissant le fichier souhaité enregistré à partir de l’interface virtuelle CPM. Des exemples de données sont inclus dans les fichiers supplémentaires.
- Le graphique pression vs temps apparaîtra comme illustré à la figure supplémentaire 1. Cliquez avec le bouton gauche de la souris sur le point où commence l’oscillation et cliquez à nouveau avec le bouton gauche de la souris à l’endroit où l’oscillation se termine. Si les données contiennent plusieurs oscillations, répétez ce processus pour toutes les oscillations.
- Lorsque tous les points de début et de fin ont été cliqués avec le bouton gauche, cliquez avec le bouton droit de la souris n’importe où. Par exemple, comme le montre la figure supplémentaire 1, on peut cliquer avec le bouton gauche aux points 1, 2, 3 et 4, suivi d’un clic droit.
REMARQUE: Le code calculera le module de dilatation et l’angle de phase et les résultats seront écrits dans un nouveau fichier .csv à l’emplacement du fichier d’origine. Les résultats des exemples de données sont visibles dans les résultats du code fournis dans le fichier de codage supplémentaire 2. MATLAB générera également plusieurs représentations graphiques des données, comme illustré à la figure supplémentaire 2.
- Lorsque tous les points de début et de fin ont été cliqués avec le bouton gauche, cliquez avec le bouton droit de la souris n’importe où. Par exemple, comme le montre la figure supplémentaire 1, on peut cliquer avec le bouton gauche aux points 1, 2, 3 et 4, suivi d’un clic droit.
Access restricted. Please log in or start a trial to view this content.
Résultats
Une source majeure d’erreur de mesure provient des capillaires qui présentent des défauts provenant soit du processus de coupe (Figure 5A, B), soit du processus de revêtement (Figure 5D). Les deux types de défauts entraînent des erreurs dans la détermination de la forme et de la taille de la bulle par le système d’analyse d’image optique, ce qui conduit à des valeurs de tension superficielle inexactes. Il est important d’examiner...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le CPM/CFM combiné est un outil puissant pour examiner la dynamique interfaciale, les équilibres et la morphologie. Ce protocole décrit les étapes nécessaires à l’obtention de données avec CPM/CFM.
La figure 2 montre la conception de la cellule avec les canaux pour le capillaire, le solvant et l’échange de chaleur indiqués. L’entrée pour l’échange de solvant doit être au bas de la cellule tandis que la sortie doit être en haut, ce qui permet ?...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Toutes les images de microscopie confocale ont été obtenues à l’aide du microscope confocal vertical Nikon A1RHD Multiphoton. Nous reconnaissons les conseils et l’assistance du personnel de soutien, en particulier Guillermo Marques, du Centre d’imagerie universitaire de l’Université du Minnesota. Ce travail a été soutenu par la subvention NIH HL51177. SI a été soutenu par une subvention de formation à la recherche institutionnelle de Ruth L. Kirschstein NRSA F32 HL151128.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Références
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon