È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Microtensiometro per microscopia confocale Visualizzazione di interfacce dinamiche
In questo articolo
Riepilogo
Questo manoscritto descrive la progettazione e il funzionamento di un microscopio microtensiometrico / confocale per eseguire misurazioni simultanee della tensione interfacciale e della reologia dilatazionale superficiale visualizzando la morfologia interfacciale. Ciò fornisce la costruzione in tempo reale di relazioni struttura-proprietà di interfacce importanti nella tecnologia e nella fisiologia.
Abstract
L'adsorbimento di molecole tensioattive in interfacce fluido-fluido è onnipresente in natura. La caratterizzazione di queste interfacce richiede la misurazione dei tassi di adsorbimento dei tensioattivi, la valutazione delle tensioni superficiali di equilibrio in funzione della concentrazione di tensioattivi di massa e la relazione su come la tensione superficiale cambia con i cambiamenti nell'area interfacciale dopo l'equilibrio. La visualizzazione simultanea dell'interfaccia utilizzando l'imaging a fluorescenza con un microscopio confocale ad alta velocità consente la valutazione diretta delle relazioni struttura-funzione. Nel microtensiometro a pressione capillare (CPM), una bolla d'aria emisferica viene bloccata all'estremità del capillare in un serbatoio liquido di volume di 1 mL. La pressione capillare attraverso l'interfaccia della bolla è controllata tramite un regolatore di flusso microfluidico commerciale che consente il controllo della pressione, della curvatura della bolla o dell'area della bolla basato su modello basato sull'equazione di Laplace. Rispetto alle tecniche precedenti come il trogolo Langmuir e la goccia pendente, la precisione di misurazione e controllo e il tempo di risposta sono notevolmente migliorati; le variazioni di pressione capillare possono essere applicate e controllate in millisecondi. La risposta dinamica dell'interfaccia a bolle viene visualizzata tramite una seconda lente ottica mentre la bolla si espande e si contrae. Il contorno della bolla è adatto a un profilo circolare per determinare il raggio di curvatura della bolla, R, nonché eventuali deviazioni dalla circolarità che invaliderebbero i risultati. L'equazione di Laplace viene utilizzata per determinare la tensione superficiale dinamica dell'interfaccia. Dopo l'equilibrio, piccole oscillazioni di pressione possono essere imposte dalla pompa microfluidica controllata dal computer per oscillare il raggio della bolla (frequenze di 0,001-100 cicli / min) per determinare il modulo dilatazionale Le dimensioni complessive del sistema sono sufficientemente piccole che il microtensiometro si adatta sotto la lente di un microscopio confocale ad alta velocità consentendo di tracciare quantitativamente le specie chimiche marcate con fluorescenza con risoluzione laterale submicronica.
Introduzione
Le interfacce aria-acqua coperte da pellicole tensioattive sono onnipresenti nella vita quotidiana. Le iniezioni di tensioattivi-acqua vengono utilizzate per migliorare il recupero del petrolio dai campi esauriti e vengono utilizzate come soluzioni di fratturazione idraulica per gas e petrolio di scisto. Le schiume gas-liquido e le emulsioni liquido-liquide sono comuni a molti processi industriali e scientifici come lubrificanti e detergenti e sono comuni negli alimenti. Tensioattivi e proteine alle interfacce stabilizzano le conformazioni anticorpali durante il confezionamento, lo stoccaggio e la somministrazione 1,2,3,4,5, la stabilità del film lacrimale nell'occhio 6,7,8 e la meccanica polmonare 9,10,11,12,13,14, 15.
Lo studio dei tensioattivi o tensioattivi adsorbenti alle interfacce e delle loro proprietà ha una lunga storia con molte tecniche sperimentali diverse 16,17,18,19,20,21,22,23,24,25,26,27 . Uno sviluppo recente è il microtensiometro a pressione capillare (CPM), che consente l'esame delle proprietà interfacciali su interfacce altamente curve, a scale di lunghezza molto più piccole, utilizzando significativamente meno materiali rispetto ad altri metodi comuni 9,23,24,25. La microscopia a fluorescenza confocale (CFM) può essere utilizzata per studiare la morfologia dei lipidi e delle proteine alle interfacce aria-acqua nel CPM22 o sulle depressioni di Langmuir 20,26,27,28,29. Qui un CPM e cfM sono stati combinati per collegare i fenomeni morfologici alle proprietà interfacciali dinamiche e di equilibrio per sviluppare relazioni struttura-funzione per interfacce biologiche e tecnologiche.
Esistono numerosi parametri importanti nei sistemi di tensioattivi interfacciali accessibili al CPM-CFM. Nel CPM, una bolla d'aria di 30-200 μm di diametro è bloccata sulla punta di un tubo capillare di vetro. Nelle versioni precedenti del CPM, la differenza di pressione capillare tra l'interno e l'esterno della bolla era controllata tramite una colonna d'acqua e una pompa oscillatoria a siringa 9,30 ; la nuova versione qui descritta li sostituisce con una pompa microfluidica controllata da computer a maggiore precisione. La tensione superficiale (γ) è determinata tramite l'equazione di Laplace, ΔP = 2γ/R, dalla caduta di pressione attraverso l'interfaccia impostata dalla pompa, ΔP, e l'analisi ottica del raggio di curvatura della bolla, R. La tensione superficiale dinamica dell'interfaccia può essere determinata con una risoluzione temporale di 10 ms a seguito della generazione di una nuova bolla a contatto con un liquido sfuso contenente un tensioattivo solubile. La dinamica di adsorbimento dei tensioattivi può essere descritta dalla classica equazionedi Ward-Tordai 10,31 per determinare le proprietà essenziali del tensioattivo, tra cui la diffusività, la copertura superficiale e la relazione tra concentrazione di massa e tensione superficiale di equilibrio. Una volta raggiunta una tensione superficiale di equilibrio, l'area interfacciale può essere oscillata per misurare il modulo dilatazionale, 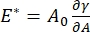 , registrando le variazioni della tensione superficiale, indotte da piccoli cambiamenti nella superficie della bolla, A32. Per interfacce più complesse che sviluppano proprie strutture interne come polimeri o proteine entangled, la tensione superficiale, , è sostituita da una più generale sollecitazione superficiale 4,33,
, registrando le variazioni della tensione superficiale, indotte da piccoli cambiamenti nella superficie della bolla, A32. Per interfacce più complesse che sviluppano proprie strutture interne come polimeri o proteine entangled, la tensione superficiale, , è sostituita da una più generale sollecitazione superficiale 4,33, 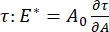 .
.
La stabilità polmonare durante la respirazione può essere direttamente legata al mantenimento sia di una bassa tensione superficiale che di un elevato modulo dilatazionale all'interfaccia aria-liquido alveolare 9,10. Tutte le superfici polmonari interne sono rivestite con un film continuo di fluido epiteliale di rivestimento denso di micron per mantenere l'idratazione dei tessuti34. Questo fluido di rivestimento epiteliale è principalmente acqua, con sali e varie altre proteine, enzimi, zuccheri e tensioattivi polmonari. Come nel caso di qualsiasi interfaccia liquido-vapore curva, viene indotta una pressione capillare con la pressione più alta all'interno dell'alveolo (o bolla). Tuttavia, se la tensione superficiale fosse costante ovunque all'interno dei polmoni, l'equazione di Laplace, ΔP = 2γ/R, mostra che gli alveoli più piccoli avrebbero una pressione interna più elevata rispetto agli alveoli più grandi, costringendo il contenuto di gas degli alveoli più piccoli a fluire verso alveoli più grandi e a bassa pressione. Questo è noto come "Instabilità di Laplace"9,35. Il risultato netto è che gli alveoli più piccoli collasserebbero e si riempirebbero di liquido e diventerebbero difficili da rigonfiare causando il collasso di parte del polmone, e altre parti si gonfierebbero eccessivamente, entrambi sintomi tipici della sindrome da distress respiratorio acuto (ARDS). Tuttavia, in un polmone correttamente funzionante, la tensione superficiale cambia dinamicamente quando l'interfaccia aria-liquido epiteliale nell'area interfacciale dell'alveolo si espande e si contrae durante la respirazione. Se 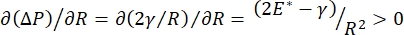 , o
, o 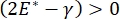 , la pressione di Laplace diminuisce con raggio decrescente e aumenta con l'aumentare del raggio in modo da eliminare l'instabilità di Laplace, stabilizzando così il polmone9. Quindi,
, la pressione di Laplace diminuisce con raggio decrescente e aumenta con l'aumentare del raggio in modo da eliminare l'instabilità di Laplace, stabilizzando così il polmone9. Quindi, 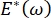 e come dipende dalla frequenza, dalla morfologia e dalla composizione del monostrato e dalla composizione del fluido alveolare può essere essenziale per la stabilità polmonare. Il CPM-CFM ha inoltre fornito le prime dimostrazioni degli effetti della curvatura interfacciale sull'adsorbimento dei tensioattivi25, sulla morfologia monostrato22 e sul modulo dilatazionale9. Il piccolo volume (~ 1 mL) del serbatoio nel CPM consente la rapida introduzione, rimozione o scambio della fase liquida e riduce al minimo la quantità richiesta di costose proteine o tensioattivi10.
e come dipende dalla frequenza, dalla morfologia e dalla composizione del monostrato e dalla composizione del fluido alveolare può essere essenziale per la stabilità polmonare. Il CPM-CFM ha inoltre fornito le prime dimostrazioni degli effetti della curvatura interfacciale sull'adsorbimento dei tensioattivi25, sulla morfologia monostrato22 e sul modulo dilatazionale9. Il piccolo volume (~ 1 mL) del serbatoio nel CPM consente la rapida introduzione, rimozione o scambio della fase liquida e riduce al minimo la quantità richiesta di costose proteine o tensioattivi10.
Il contrasto in un'immagine CPM-CFM è dovuto alla distribuzione di piccole frazioni di lipidi o proteine marcati fluorescentemente all'interfaccia16,27. I monostrati bidimensionali di tensioattivi spesso presentano una separazione di fase laterale in funzione della tensione superficiale o della pressione superficiale, 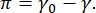 π è la differenza tra la tensione superficiale di un'interfaccia fluido-fluido pulita, γ0, e un'interfaccia ricoperta di tensioattivo, γ. π può essere pensato come la "pressione" 2D causata dalle interazioni delle molecole di tensioattivo all'interfaccia che agisce per abbassare la tensione superficiale del fluido puro. A basse pressioni superficiali, i monostrati lipidici sono in uno stato disorganizzato simile a un liquido; questa è nota come fase espansa liquida (LE). Man mano che la pressione superficiale aumenta e l'area per molecola lipidica diminuisce, i lipidi si orientano tra loro e possono subire una transizione di fase di primo ordine alla fasecondensata liquida ordinata (LC) a lungo raggio 16,20,27. Le fasi LE e LC possono coesistere a varie pressioni superficiali e possono essere visualizzate come lipidi marcati fluorescentemente sono esclusi dalla fase LC e si segregano nella fase LE. Pertanto, la fase LE è luminosa e la fase LC è scura quando viene visualizzata con CFM16.
π è la differenza tra la tensione superficiale di un'interfaccia fluido-fluido pulita, γ0, e un'interfaccia ricoperta di tensioattivo, γ. π può essere pensato come la "pressione" 2D causata dalle interazioni delle molecole di tensioattivo all'interfaccia che agisce per abbassare la tensione superficiale del fluido puro. A basse pressioni superficiali, i monostrati lipidici sono in uno stato disorganizzato simile a un liquido; questa è nota come fase espansa liquida (LE). Man mano che la pressione superficiale aumenta e l'area per molecola lipidica diminuisce, i lipidi si orientano tra loro e possono subire una transizione di fase di primo ordine alla fasecondensata liquida ordinata (LC) a lungo raggio 16,20,27. Le fasi LE e LC possono coesistere a varie pressioni superficiali e possono essere visualizzate come lipidi marcati fluorescentemente sono esclusi dalla fase LC e si segregano nella fase LE. Pertanto, la fase LE è luminosa e la fase LC è scura quando viene visualizzata con CFM16.
L'obiettivo di questo manoscritto è quello di descrivere i passaggi necessari per costruire e far funzionare il microscopio confocale combinato microtensiometro. Ciò consentirà al lettore di eseguire studi di adsorbimento, misurare la tensione superficiale, il comportamento reologico ed esaminare simultaneamente la morfologia interfacciale su scala micron aria/acqua o olio/acqua. Ciò include una discussione su come tirare, tagliare e idrofobizzare i capillari richiesti, istruzioni per l'utilizzo delle modalità di controllo della pressione, della curvatura e della superficie e trasferimento interfacciale del tensioattivo insolubile all'interfaccia curva del microtensiometro.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione dei tubi capillari
- Posizionare il capillare in un estrattore capillare ed eseguire il programma di trazione desiderato per creare due capillari affusolati con un diametro esterno (OD) di ~ 1 μm sulla punta.
NOTA: L'OD del capillare prima di tirare deve essere l'OD specificato per adattarsi al supporto capillare nella cella del microtensiometro. Il diametro interno (ID) del capillare può variare, ma influenzerà il raggio critico del capillare dopo la trazione. Viene scelto un programma di trazione in modo che il cono risultante riduca inizialmente rapidamente l'OD e l'ID capillare, quindi raggiunga un raggio vicino all'OD e all'ID capillare desiderato e quindi si riduca di diametro più lentamente. Ciò creerà una maggiore lunghezza capillare che può essere valutata per produrre un capillare utilizzabile di 30-100 μm in ID. - Segnare la punta del capillare nel punto desiderato per ottenere un ID di 30-100 μm e rompere la punta. Il capillare avrà ora un OD e un ID del raggio desiderato sulla punta (Figura 1A). I capillari possono essere conservati fino al passaggio 2.
NOTA: Il bordo tagliato del capillare deve essere una rottura netta a 90°. Qualsiasi difetto nel bordo tagliato porterà a un cattivo bloccaggio della bolla al capillare e a scarse misurazioni delle proprietà superficiali. Le punte capillari affusolate sono molto delicate. Saranno distrutti se entrano in contatto con qualcosa di diverso dalle soluzioni (ad esempio, pareti del flaconcino, ugello dell'aria).
2. Idrofobizzazione dei capillari
- Raccogliere capillari di vetro tirati, soluzione detergente acida, pinzette di plastica, acqua deionizzata (DI), soluzione di idrofobizzazione (silano al 2% in etanolo), pompa per vuoto e soluzione di etanolo. Vedere Tabella dei materiali per i dettagli.
ATTENZIONE: La soluzione detergente acida è acutamente tossica, provoca corrosione/irritazione della pelle e degli occhi, è ossidante. La soluzione di idrofobizzazione è irritante per la pelle/gli occhi/le vie respiratorie. Indossa protezioni per gli occhi, camici da laboratorio e guanti e lavora con soluzioni in una cappa aspirante. - Acido-pulire il capillare
NOTA: La pulizia acida del capillare rimuove eventuali residui organici all'interno del capillare e prepara la superficie del vetro per la reazione di silanizzazione che rende il capillare idrofobo.- Afferrare un capillare saldamente vicino alla sua estremità larga con le pinzette.
- Immergere la punta conica nella soluzione detergente acida mentre si collega il tubo dalla pompa per vuoto all'estremità larga del capillare. Questo risucchierà la soluzione nel capillare.
NOTA: una punta della pipetta può essere attaccata all'estremità del tubo capillare per consentire una migliore aderenza con l'estremità capillare. - Fermarsi quando la soluzione detergente acida ha riempito circa la metà del capillare.
NOTA: Dopo la rimozione della punta capillare dalla soluzione detergente acida, la soluzione all'esterno del capillare spesso forma una perla vicino alla punta capillare. Toccare delicatamente il capillare al collo del flaconcino della soluzione per rimuovere la soluzione in eccesso. - Lasciare che la soluzione detergente acida rimanga nei capillari per almeno 30 minuti, assicurandosi che il tappo del liquido rimanga all'estremità affusolata del capillare.
- Rimuovere la soluzione detergente acida dal capillare tenendo saldamente il capillare con le pinzette e utilizzando il tubo del vuoto per estrarre il liquido dall'estremità grande del capillare.
- Risciacquare il capillare
- Immergere l'estremità affusolata del capillare in acqua DI assicurandosi che sia immersa abbastanza in profondità da coprire qualsiasi esterno che è stato immerso nella soluzione di pulizia acida. Mentre la punta è sommersa, utilizzare il tubo del vuoto per tirare l'acqua DI attraverso il capillare. Rimuovere il capillare dall'acqua e rimuovere l'acqua rimanente con il tubo del vuoto.
- Ripetere il passaggio precedente almeno 4 volte.
- Eseguire nuovamente il passaggio 2.3 sostituendo l'etanolo con l'acqua DI.
- Applicare l'aspirazione continuamente fino a quando l'etanolo evapora completamente dall'interno del capillare. Il capillare diventerà torbido e fresco al tatto quando l'etanolo inizierà ad evaporare ma si schiarirà dopo 30-45 s.
- Rivestire il capillare con la soluzione di idrofobizzazione
- Immergere brevemente l'estremità larga del capillare nel silano ~ 2% in soluzione di etanolo. L'azione capillare farà salire la soluzione di rivestimento all'interno del capillare. Rimuovere il capillare dalla soluzione una volta che un tappo di circa 1 cm è salito all'interno del capillare.
- Orientare il capillare in modo che la punta affusolata sia rivolta verso il basso, consentendo alla soluzione di rivestimento di cadere con gravità verso la punta affusolata.
- Lasciare che la soluzione di rivestimento rimanga nel capillare per almeno 3 minuti.
NOTA: non devono esserci bolle d'aria nel tappo della soluzione di rivestimento che è a contatto con l'interno della punta affusolata. Se c'è una bolla d'aria, è probabile che l'interno capillare non sia stato sufficientemente asciugato nel passaggio 2.5. Per rimediare a questo, ripetere i passaggi 2.4-2.6 se necessario.
- Risciacquare i capillari con etanolo 1x nello stesso modo del passaggio 2.3.
- Impostare il rivestimento idrofobo sul capillare
- Introdurre flaconcini di scintillazione puliti e asciutti in un forno sottovuoto impostato a 120 °C. Posizionare i capillari rivestiti nei flaconcini (idealmente un capillare per flaconcino) con estremità larghe appoggiate sulla base del flaconcino. Lasciare che i capillari rimangano nel forno per almeno 6 ore (preferibilmente durante la notte) per ottenere un legame permanente dello strato di silano idrofobo ai capillari. I capillari possono essere conservati fino al passaggio 4.
3. Preparazione e conservazione dei campioni
- Mescolare e conservare le soluzioni di tensioattivi e fluorofori in flaconcini puliti lavati con acido per evitare la contaminazione.
NOTA: i lipidi disponibili in commercio devono essere della massima purezza e conservati tra l'uso a - 20 °C. I lipidi vecchi o contaminati spesso causano risultati difficili da riprodurre.
4. Impostazione del microtensiometro
- Assemblare la cella CPM come descritto nella Figura 2.
- Posizionare il lato grande del capillare nella parte superiore della cellula CPM fino a quando non si spinge verso la parte inferiore della cellula.
- Stringere delicatamente il tappo in PEEK per fissare il capillare, quindi collegare il tubo dalla pompa microfluidica al lato grande del capillare. Fare attenzione a non toccare la punta capillare affusolata.
- Se necessario, collegare lo scambio del serbatoio e/o i tubi di controllo della temperatura alle rispettive entrate e uscite sulla cella CPM (Figura 2); in caso contrario, collegare gli ingressi e le prese inutilizzati.
- Collegare la cellula CPM allo stadio del microscopio confocale, allineandola approssimativamente con l'obiettivo CFM, la telecamera CPM e la sorgente luminosa CPM (Figura 3).
- Aprire il flusso di gas alla pompa microfluidica alla pressione di esercizio raccomandata della pompa (150 mbar per la pompa microfluidica utilizzata qui) e assicurarsi che il flusso verso il capillare sia aperto.
- Iniziare a eseguire l'interfaccia virtuale CPM (Supplemental Coding File 1: Microtensiometer Virtual Interface.vi) in modalità Controllo della pressione con la frequenza e l'ampiezza dell'oscillazione della pressione capillare impostate su zero (Figura 4-7). La Figura 4 mostra uno screenshot dell'interfaccia virtuale. Per l'acqua DI e un raggio capillare di ~ 35 μm, una pressione di ~ 20 mbar assicura che nessuna acqua entri nel capillare.
- Riempire la cella CPM con acqua usando una pipetta.
- Mettere a fuoco la punta capillare utilizzando la fotocamera del microtensiometro.
- Concentrati sulla punta capillare con il CFM. Se c'è difficoltà a trovare il capillare, utilizzare la telecamera CPM per trovare l'obiettivo CFM. Ciò contribuirà ad approssimare la distanza tra l'obiettivo CFM e la bolla, ottenendo la corretta distanza di lavoro.
- Dopo che l'anulus (proiezione del settore verde) è centrato sulla bolla, regolare manualmente la messa a fuoco in modo che il bordo della bolla possa essere visto chiaramente (Figura 4-3).
NOTA: la posizione, l'angolo iniziale e finale e i raggi interni ed esterni dell'anulus possono essere regolati tramite il menu sotto la finestra di visualizzazione. - Fai clic su Ripristina bolla e assicurati che si formi una nuova bolla (si sarà in grado di sentire il vecchio scoppio della bolla e la nuova bolla sarà osservabile dalla finestra di visualizzazione del pannello di controllo; Figura 4-3). Se la bolla non si apre, aumentare la pressione di ripristino o aumentare il tempo di ritardo di ripristino nella scheda Ripristino bolle sotto la finestra di visualizzazione. Verificare se la tensione superficiale è di circa 73 mN/m (per bolle saline o acqua/aria) (Figura 4-9).
- Estrarre l'acqua tramite la siringa diretta alla cellula (Figura 3-13), svuotarla e ricollegarla. L'esempio è pronto per il caricamento per eseguire l'esperimento.
5. Studio di adsorbimento
- Riempire la cella con il campione desiderato utilizzando una pipetta autoclavata mantenendo il software CPM in modalità di controllo della pressione . Assicurarsi che la tensione superficiale iniziale sia di circa 73 mN/m quando viene creata una nuova interfaccia a bolle.
- Determinare il raggio della bolla appena formata e immettere tale valore nel controllo area asse di mezzeria (Figura 4-7) e modificare il tipo di controllo in controllo area facendo clic sulla scheda Controllo area (Figura 4-8).
NOTA: è possibile utilizzare anche il controllo della pressione costante, ma questo fa sì che il raggio della bolla cambi continuamente al variare della tensione superficiale dell'interfaccia. Questa area di cambiamento può complicare l'analisi dei tassi di adsorbimento dei tensioattivi e causare lo scoppio della bolla durante lo studio. - Inizia a registrare il video confocale.
- Fare clic su Reset Bubble (Figura 4-5) e fare immediatamente clic su Raccogli dati (Figura 4-6). La spia di segnalazione sul pulsante diventerà verde.
- Regolare la velocità di registrazione dei dati in base alla concentrazione del campione facendo scorrere la barra mostrata nella Figura 4-6. Per adsorbimenti più lenti, utilizzare una velocità di registrazione più lenta. Questo può essere regolato nel bel mezzo di una corsa se si desidera una velocità di registrazione più elevata all'inizio, ma una velocità più lenta è preferibile per studi lunghi al fine di ridurre le dimensioni del file.
- Dopo la fine dell'esperimento (quando è stato raggiunto un plateau di tensione superficiale finale), salvare il file scegliendo il percorso corretto del file (Figura 4-1) e facendo clic sul pulsante Salva (Figura 4-2).
- Interrompi e salva anche la registrazione sul CFM.
6. Studio dell'oscillazione/rilassamento
- Riempire la cella con il campione utilizzando una pipetta autoclavata mantenendo il software CPM in modalità di controllo della pressione . Assicurarsi che la tensione superficiale sia di circa 73 mN/m quando viene creata una nuova interfaccia a bolle.
- Attendere che il campione sia completamente adsorbito nell'interfaccia. Questo può essere eseguito direttamente dopo uno studio di adsorbimento invece di ricominciare da capo con una nuova interfaccia a bolle.
- Decidere se l'oscillazione sarà un'oscillazione di pressione, un'oscillazione di area o un'oscillazione di curvatura selezionando la scheda appropriata (Figura 4-8) e inserendo il valore di base desiderato, la percentuale di oscillazione e la frequenza di oscillazione (Figura 4-7).
NOTA: le oscillazioni dell'area d'onda a dente di sega, quadrata e triangolare sono accessibili anche dal menu a discesa nella scheda Oscillazione altra area . - Avviare la registrazione del video confocale e fare clic su Raccogli dati (Figura 4-6) sul software CPM.
- Avviare l'oscillazione. Assicurati di registrare almeno sette cicli per ottenere i migliori risultati. Scegliere una velocità di acquisizione dati (Figura 4-6) per fornire un numero adeguato di punti dati per ogni ciclo di oscillazione.
- Se si desiderano altre ampiezze o frequenze di oscillazione, modificare i valori durante l'esperimento.
- Salvare i risultati come nei passaggi 5.6 e 5.7.
7. Studio sullo scambio di solventi
- Riempire la cella con il campione utilizzando una pipetta autoclavata mantenendo il software CPM in modalità di controllo della pressione. Assicurarsi che la tensione superficiale sia di circa 73 mN/m, quando viene creata una nuova interfaccia a bolle.
NOTA: gli studi di adsorbimento e/o oscillazione possono essere eseguiti prima dello studio sullo scambio di solventi. - Collegare il tubo di ingresso con la bottiglia della soluzione di scambio desiderata (Figura 3-11) alla pompa peristaltica (Figura 3-10).
- Avviare la registrazione del video in software confocale e fare clic su Raccogli dati (Figura 4-6) sul software CPM.
- Impostare la velocità della pompa peristaltica. Questo controllerà la velocità di scambio del fluido e deve essere scelto in base ai requisiti per l'esperimento, cioè alla velocità con cui il solvente deve essere scambiato.
- Se è necessario sostituire più fluidi, arrestare la pompa peristaltica e collegare l'ingresso a un'altra soluzione di scambio.
- Al termine dello scambio (~ 20 min), salvare i risultati come nei passaggi 5.6 e 5.7.
8. Adsorbimento insolubile di tensioattivi
NOTA: se il tensioattivo da adsorbire non è solubile nel liquido del serbatoio, questo metodo può essere utilizzato per trasferire un monostrato dall'interfaccia aria/acqua della cella alla superficie della bolla. Molti lipidi che formano due strati sono quasi insolubili in soluzione salina e non assorbono spontaneamente la bolla quando sono sospesi nella soluzione del serbatoio.
- Riempire la cella con il campione utilizzando una pipetta autoclavata mantenendo il software CPM in modalità di controllo della pressione . Assicurarsi che la tensione superficiale sia di circa 73 mN/m, quando viene creata una nuova interfaccia a bolle.
- Depositare un monostrato di tensioattivo insolubile sull'interfaccia aria-acqua della cella da una soluzione in una soluzione organica volatile. Utilizzando una siringa, depositare piccole goccioline all'interfaccia e consentire al solvente di evaporare lasciando il lipide dietro di sé come un film sottile.
ATTENZIONE: Il cloroformio è usato come solvente per fosfolipidi come fosfatidilcoline e acidi grassi. Le soluzioni di diffusione sono solitamente 0,01-0,02 mg di lipidi per ml del solvente. Il cloroformio è acutamente tossico, può causare irritazione della pelle e degli occhi ed è cancerogeno. Indossare un'adeguata protezione per gli occhi, un cappotto da laboratorio e guanti e preparare la soluzione in una cappa aspirante. - Diminuire la superficie tramite il controllo della pressione della linea mediana (Figura 4-7) della bolla fino a quando non è quasi piatta. Ciò impedisce alla bolla di scoppiare dopo che il tensioattivo è adsorbito.
- Rimuovere il liquido del serbatoio dalla cella tramite la siringa diretta a cella fino a quando l'interfaccia aria/acqua non si sposta oltre la punta del capillare. Mentre è possibile utilizzare una pompa a siringa, questo passaggio può essere ottenuto utilizzando manualmente la siringa.
- Aumentare l'altezza del liquido del serbatoio al suo livello iniziale.
NOTA: dopo che la punta è stata ripresentata, la bolla sarà più grande a causa del tensioattivo che ora è adsorbito sull'interfaccia. Il monostrato sarà ora pronto per esperimenti di oscillazione o scambio di solventi.
9. Pulisci
- Disattivare il CFM.
- Passare alla modalità controllo pressione .
- Rimuovere il campione dalla cella utilizzando una pipetta. Caricare la cella con acqua DI e aumentare la pressione a ~ 50 mbar per far sì che le bolle fuoriescano costantemente dal capillare e puliscano la punta capillare. Ripeti questo processo 2x.
- Chiudere la valvola di sicurezza e spegnere il CPM facendo clic sul pulsante rosso nell'angolo in alto a sinistra, spegnere il pannello di controllo della pressione blu e della luce e chiudere la fonte di pressione.
- Rimuovere la cellula dallo stadio del microscopio confocale. Risciacquare la cella con etanolo e acqua DI. Rimuovere il tubo capillare dalla cellula CPM.
10. Pulizia della cella
- Smontare la cella. Spazzolare la parete interna con uno spazzolino da denti mentre si risciacqua sotto l'acqua DI. Immergere le parti in etanolo e sonicarlo per ~ 30 minuti.
- Risciacquare tutte le parti con acqua DI un paio di volte. Asciugare le parti soffiandole con gas azoto o asciugandole all'interno di un forno a vuoto.
11. Analisi dell'oscillazione
- Eseguire il codice Dilatational_Rheology_Analysis.m (Supplemental Coding File 2), scegliendo il file desiderato salvato dall'interfaccia virtuale CPM. I dati di esempio sono inclusi nei file supplementari.
- Il grafico pressione vs tempo apparirà come mostrato nella Figura supplementare 1. Fare clic con il pulsante sinistro del mouse sul punto in cui inizia l'oscillazione e fare nuovamente clic con il pulsante sinistro del mouse nel punto in cui termina l'oscillazione. Se i dati contengono più oscillazioni, ripetere questo processo per tutte le oscillazioni.
- Quando tutti i punti iniziale e finale sono stati cliccati con il pulsante sinistro del mouse, fare clic con il pulsante destro del mouse in un punto qualsiasi. Ad esempio, come mostrato nella Figura 1 supplementare, è possibile fare clic con il pulsante sinistro del mouse ai punti 1, 2, 3 e 4, seguito da un clic destro.
NOTA: il codice calcolerà il modulo dilatazionale e l'angolo di fase e i risultati verranno scritti in un nuovo file .csv nella posizione originale del file. I risultati per i dati di esempio possono essere visualizzati nei risultati del codice forniti nel file di codifica supplementare 2. MATLAB genererà anche diverse rappresentazioni grafiche dei dati come mostrato nella Figura supplementare 2.
- Quando tutti i punti iniziale e finale sono stati cliccati con il pulsante sinistro del mouse, fare clic con il pulsante destro del mouse in un punto qualsiasi. Ad esempio, come mostrato nella Figura 1 supplementare, è possibile fare clic con il pulsante sinistro del mouse ai punti 1, 2, 3 e 4, seguito da un clic destro.
Access restricted. Please log in or start a trial to view this content.
Risultati
Una delle principali fonti di errore di misurazione deriva dai capillari che presentano difetti sia dal processo di taglio (Figura 5A,B) che dal processo di rivestimento (Figura 5D). Entrambi i tipi di difetti portano a errori nel determinare la forma e la dimensione della bolla da parte del sistema di analisi ottica delle immagini, portando a valori di tensione superficiale imprecisi. È importante esaminare attentamente ogni nuovo capillare do...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il CPM /CFM combinato è un potente strumento per esaminare le dinamiche interfacciali, gli equilibri e la morfologia. Questo protocollo descrive i passaggi necessari per ottenere dati con CPM/CFM.
La Figura 2 mostra il design della cella con i canali per lo scambio capillare, solvente e termico indicati. L'ingresso per lo scambio di solventi dovrebbe essere nella parte inferiore della cella mentre l'uscita dovrebbe essere nella parte superiore, consentendo alla c...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Tutte le immagini al microscopio confocale sono state ottenute utilizzando il microscopio confocale verticale Multifotonico Nikon A1RHD. Riconosciamo la guida e l'assistenza del personale di supporto, in particolare Guillermo Marques, presso l'University Imaging Center dell'Università del Minnesota. Questo lavoro è stato supportato da NIH Grant HL51177. SI è stato supportato da un Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Riferimenti
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon