Method Article
E. coli'de Doğal Konjugatif Plazmidlerin Aracılık Ettiği Yatay Gen Transferinin Saptanması
Bu Makalede
Özet
Konjugasyon, plazmid DNA'sını iki farklı hücre boyunca harekete geçirerek yatay gen transferine aracılık eder ve faydalı genlerin yayılmasını kolaylaştırır. Bu çalışma, konjugatif plazmid, donör ve alıcıda transkonjugasyonu tespit etmek için diferansiyel belirteçlerin kullanımına dayanan konjugatif plazmid transferinin etkili tespiti için yaygın olarak kullanılan bir yöntemi açıklamaktadır.
Özet
Konjugasyon, Gram-negatif bakterilerde yatay gen transferini kolaylaştıran ana mekanizmalardan birini temsil eder. Bu çalışma, doğal olarak oluşan iki plazmidi örnek olarak kullanarak, doğal olarak oluşan konjugatif plazmidlerin mobilizasyonunun incelenmesi için yöntemleri açıklamaktadır. Bu protokoller, donör, alıcı ve konjugatif plazmiddeki seçilebilir belirteçlerin diferansiyel varlığına dayanır. Spesifik olarak, tarif edilen yöntemler arasında 1) doğal konjugatif plazmidlerin tanımlanması, 2) katı kültürde konjugasyon oranlarının nicelleştirilmesi ve 3) transkonjugant alıcılarda antibiyotik direnç genlerinin ve plazmid replikon tiplerinin polimeraz zincir reaksiyonu (PCR) ile tanısal olarak saptanması yer almaktadır. Burada açıklanan protokoller, yatay gen transferinin evrimsel ekolojisini incelemek ve çevrede bulunan bakterilerde antibiyotik dirençli genler taşıyan konjugatif plazmidlerin varlığını taramak için geliştirilmiştir. Bu deneylerde gözlenen konjugatif plazmidlerin kültüre etkin transferi, genel olarak yatay gen transferini ve özellikle antibiyotik direncinin yayılmasını teşvik eden bir mekanizma olarak konjugasyonun biyolojik uygunluğunu vurgulamaktadır.
Giriş
1946'da Lederberg ve Tatum1, Escherichia coli K-12'de şimdi konjugasyon olarak bilinen cinsel bir süreci tanımladı. Bakteriyel konjugasyon, bir bakteri hücresinin (donör) tek yönlü genetik materyali doğrudan hücreden hücreye temas yoluyla başka bir hücreye (alıcıya) aktardığı süreçtir. Konjugasyon, bakteri 2,3'te geniş bir şekilde dağılmıştır, ancak konjugasyon makinesini eksprese eden donör hücrelerin fraksiyonu tipik olarak çok küçüktür4.
Plazmidler otonom olarak çoğalan ekstrakromozomal DNA elementleridir. Plazmid replikasyonu ve bakımında yer alan genlere ek olarak, plazmidler sıklıkla ağır metaller veya antibiyotiklere maruz kalma gibi çevresel zorluklara adaptasyonda rol oynayan bir gen yükü taşırlar5. Konjugatif plazmidler, alıcı hücrelere transferlerine izin veren ve transfer6'yı takiben kalıcılıklarını destekleyen bir dizi özel gen içeren bir plazmid sınıfıdır. Konjugatif plazmidlerin büyüklüğü 21.8 kb ila 1.35 Mb arasında değişir ve filum Pseudomonadota'daki bakterilerde (Proteobacteria ile eşanlamlıdır), medyan yaklaşık 100 kb 5,7'dir. Ayrıca, muhtemelen konakçı üzerindeki metabolik yükü düşük tutmak için genellikle düşük bir kopya sayısına sahiptirler 8,9.
Tipik konjugatif aparat dört bileşenden oluşur: bir transfer kökeni (oriT), bir relaksaz, bir tip IV kuplaj proteini ve bir tip IV sekresyon sistemi (bağışçıların alıcılarla iletişim kurmasını sağlayan pilus adı verilen tüp benzeri bir yapı)6. Konjugatif plazmidler taşıyan hücrelerin sadece çok küçük bir kısmı konjugasyonmakinesini 4 ifade eder, ancak plazmidler bir uygunluk avantajı sağlarsa, transkonjuganlar popülasyonda hızla genişleyebilir. Farklı habitatlardan toplanan E. coli izolatlarının% 35 ila% 80'inden fazlası, en az bir antibiyotiğe direnç kazandıran genlere sahip konjugatif plazmidlere sahiptir10,11; bu nedenle, konjugatif plazmidlerin aracılık ettiği yatay gen transferi, antibiyotik direnci genlerinin küresel yayılımını yönlendiren önemli bir mekanizmadır12.
Laboratuvar kültüründe yapılan çiftleşme deneyleri, konjugasyon sıklığının, alıcı hücrelerin doğası, büyüme evresi, hücre yoğunluğu, donör-alıcı oranı, konjugasyonun sıvı veya katı ortamda yapılıp yapılmadığı, karbon, oksijen, safra tuzları, metal konsantrasyonları, memeli hücrelerinin varlığı, sıcaklık, pH ve çiftleşme süresi13,14 gibi birçok faktörden etkilendiğini göstermiştir. 15.
Bu çalışma, belirli bir konakçı suşunda konjugatif plazmidlerin varlığını tespit etmek, katı kültürdeki konjugasyon oranlarını ölçmek ve alıcı hücrelere transferlerini iki kez kontrol etmek için protokolleri açıklamaktadır. Bu protokoller, araştırmaya uygun doğal konjugatif plazmidlerin tanımlanması için ilk adım olarak kullanılabilir. Minimum sayıda basitleştirilmiş adım kullanırlar, çünkü birden fazla kaynaktan (çevresel, kommensal ve patojenik) elde edilen bakterilerde konjugatif plazmidlerin varlığını taramak için tasarlanmıştır (düzinelerce ila yüzlerce donör).
Ek olarak, belirli bir konjugatif plazmidin mobilizasyonunun tespit için kullanılan antibiyotikten bağımsız olup olmadığını (yani, seçim altındaki antibiyotik direnç geninin alaka düzeyi) tespit etmek ve farklı çevresel izolatlarda bulunan iki konjugatif plazmidin konjugasyon oranlarını karşılaştırmak için yapılan testler gösterilmiştir.
İlgili konjugatif plazmidlerin (plazmid replikonu ve antibiyotik direnci gen yapısı) genetik bileşimine dayanarak, protokolün her adımı, konjugasyon oranını etkilemesi muhtemel çeşitli faktörlerin etkisini incelemek için değiştirilebilir.
Genel deneysel tasarım:
Bir çiftleşme deneyi kurmak için gereken temel bileşenler, donör hücreleri, bir alıcı suşu ve donörleri (antibiyotik A), alıcıları (antibiyotik B) ve transkonjuganları (antibiyotik A ve B) seçmek için katı ortamlardır. Transkonjuganlar, donörün konjugatif plazmidini istikrarlı bir şekilde koruyan alıcı hücrelerdir.
Donör hücreler bir antibiyotiğe (antibiyotik A) dirençlidir ve alıcı hücreleri (antibiyotik B) seçmek için kullanılan belirteç veya belirteçlere duyarlıdır. Antibiyotik direnci geninin genomik lokalizasyonu (yani, kromozomda mı yoksa donör hücrenin plazmidinde mi bulunduğu) a priori olarak bilinmek zorunda değildir, çünkü antibiyotik direnç belirteçlerinin alıcıya mobilizasyonu (doğrudan bir donör-alıcı temasından sonra), donör tarafından sağlanan belirteçlerin bir plazmidde olduğu anlamına gelir.
Bir alıcı suşu (konjugatif plazmidler aldığı bilinmektedir) donörde bulunmayan stabil bir seçilebilir belirtece sahip olmalıdır; Bu seçilebilir belirteç genellikle kromozomda bulunan bir antibiyotik veya biyosite karşı dirençlidir. Çiftleşme deneylerinde kullanılacak alıcının seçimi kritiktir, çünkü bazı E. coli suşları konjugatif plazmidleri alma yeteneklerinde farklılık gösterir16.
Bu bileşenler kurulduktan sonra, bir donör-alıcı çifti temasından sonra her iki antibiyotik (A ve B) ile medyada büyüyen herhangi bir koloni, varsayılan bir transkonjuganttır (Şekil 1). Bu, donörlerin antibiyotik A ile medyada büyüyebileceğini, ancak antibiyotik B ile medyada büyüyemediğini ve alıcıların antibiyotik B ile medyada büyüyebildiklerini, ancak antibiyotik A ile büyüyemediklerini varsaymaktadır. transkonjugasyon iki tanı testi kullanılarak doğrulanabilir. İlk test, transkonjugant kolonilerde konjugatif plazmidde bulunan genlerin tespitinden (genlerin polimeraz zincir reaksiyonu [PCR] amplifikasyonu veya diğer yöntemlerle) oluşur. İkinci test, laktoz metabolizmasına dayalı diferansiyel koloni renk belirteçlerinin kullanımını içerir. Diferansiyel koloni rengi, MacConkey agar'ın kullanılmasıyla ortaya çıkar; agar içindeki laktoz, laktoz fermente edici (lak+) mikroorganizmalar tarafından fermantasyon kaynağı olarak kullanılabilir. Bu mikroorganizmalar, pH'ı düşüren organik asitler, özellikle laktik asit üretir. Nötr kırmızı, ortama dahil edilen ve pH 6,817'nin altına düştüğünde kirli beyazdan parlak kırmızı/pembeye dönüşen bir pH göstergesidir. Böylece, E. coli laktoz-pozitif suşlar MacConkey agar üzerinde daha büyük pembe koloniler üretirken, laktoz-negatif suşlar MacConkey agar üzerinde soluk sarı ve daha küçük koloniler üretir.
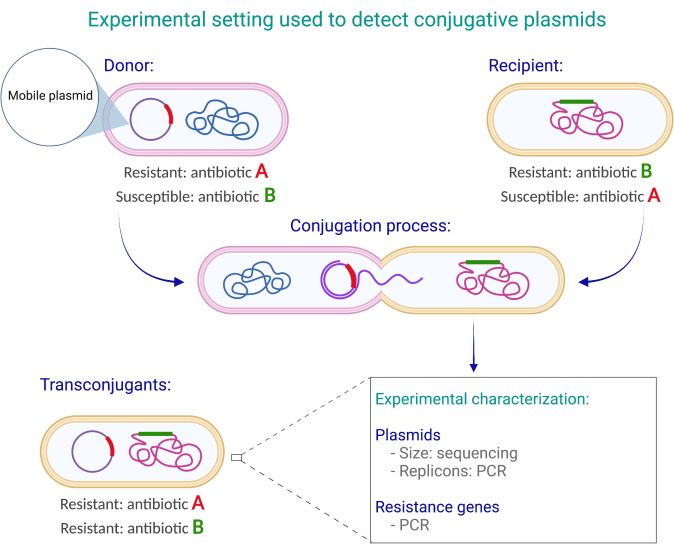
Şekil 1: Donör suşlarda konjugatif plazmidlerin varlığını saptamak için kullanılan deneysel tasarım. Bu örnekte, donör, antibiyotik A'ya direnç kazandıran bir antibiyotik direnç geni ile konjugatif bir plazmid taşır, ancak antibiyotik B'ye duyarlıdırlar. tersine, alıcının antibiyotik B'den koruma sağlayan bir kromozomal direnç belirleyicisi vardır, ancak antibiyotiğe duyarlıdır A. Transkonjuganlar her iki antibiyotiğe de dirençlidir (A ve B), çünkü donörün A antibiyotiğine direnç kazandıran konjugatif plazmidine ve alıcının B antibiyotiğinden koruma sağlayan kromozomuna sahiptirler.
Bir donör-alıcı çifti için konjugasyon oranı (belirli deneysel koşullar altında), transkonjugat sayısının donör sayısına veya alıcı sayısına bölünmesiyle hesaplanabilir; ilk oran, konjugasyon makinesinin donör tarafından fonksiyonel ekspresyonunu sergileyen donör hücrelerin fraksiyonunugösterir 16,18, ikinci oran ise alıcının konjugatif plazmidleri alma yeteneğini gösterir 19,20. Bu çalışmada, aksi belirtilmedikçe, konjugasyon oranı, transkonjugant haline gelen alıcı hücrelerin fraksiyonunu temsil etmektedir (yani, alıcı başına oran).
Burada, bir E. coli alıcısı ve iki E. coli donörünü içeren iki bağımsız çiftleşme deneyi bildirilmiştir. Ek olarak, konjugatif plazmidde bulunan antibiyotik direnç genlerinden herhangi biriyle tek bir çoklu ilaca dirençli plazmidin seçilebileceğini doğrulamak için donörlerden biri için transkonjuganları seçmek için farklı antibiyotikler kullanılmıştır.
Bu çalışmada kullanılan donör ve alıcı suşları, bu deneysel sistemin tüm bileşenlerini anlamak için tamamen sıralanmıştır; Bununla birlikte, bu protokoller bilinmeyen sekanstaki konakçılarda konjugatif plazmidlerin varlığını taramak için tasarlanmıştır ve bu deneysel bağlamda da kullanılabilir; ancak bu durumda önce ilgili genler dizilenir.
Protokolde kullanılan donör ve alıcı suşları şunlardır:
Donör 1. E. coli SW4955, Baton Rouge'daki (LA, ABD) bir gölde toplandı. IncFIC(FII) ve IncFIB (AP001918) replikonları ile 134.797 bp konjugatif plazmidine (p134797) sahiptir. Bu konjugatif plazmid, üçüncü nesil sefalosporinlere (blaCTX-M-55), aminoglikozitlere (aac (3)-IIa ve aadA1), fenikollere (catA2), tetrasiklinlere (tet (A)), trimetoprim (dfrA14) ve sülfonamidlere (sülfonamidler) direnç kazandıran genlere sahiptir. p134797'nin tam haritası için lütfen Şekil 2A'ya bakın. E. coli SW4955, laktoz pozitiftir ve MacConkey agarında pembe koloniler üretir.
Donör 2. E. coli SW7037, Erie Gölü'nde (Ottawa County, OH, ABD) toplandı. Bir IncI1-I (Alfa) replikon ile 101.718 bp konjugatif plazmid (p101718) taşır. Bu konjugatif plazmid, beta-laktamlara direnç kazandıran bir gene sahiptir (blaCMY-2). P101718'in tam haritası için lütfen Şekil 2B'ye bakın. E. coli SW7037 ayrıca laktoz pozitiftir ve MacConkey agarında pembe koloniler üretir.
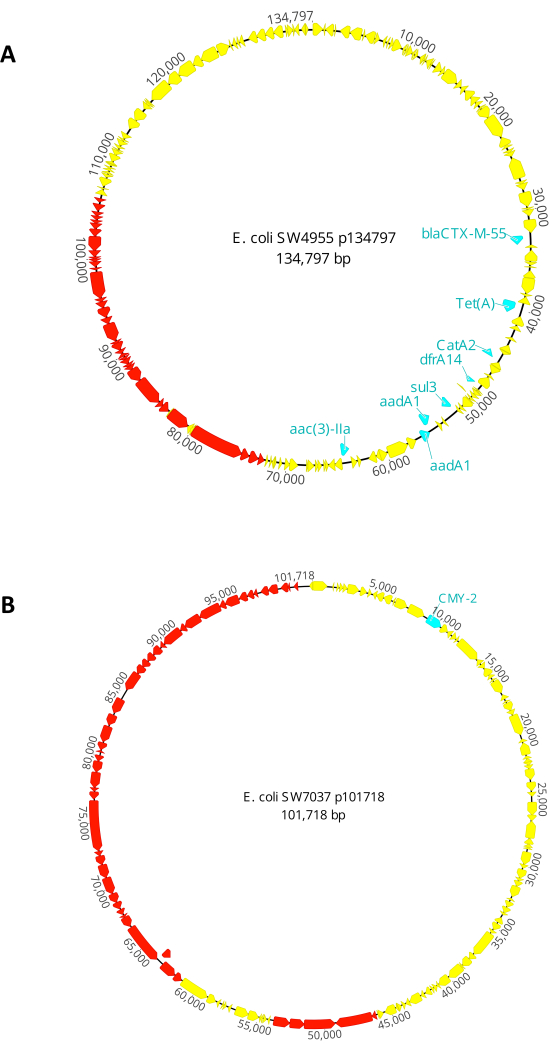
Şekil 2: Bu çalışmada kullanılan konjugatif plazmidlerin genetik haritası. (A) Plazmid p134797, E. coli suşu SW4955'te bulunan konjugatif plazmid. (B) Plazmid p101718, E. coli suşu SW7037'de bulunan konjugatif plazmid. Antibiyotik direnci genleri mavi renkte, konjugatif aparata ait genler ise kırmızı renkle vurgulanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Alıcı. E. coli LMB100 alıcı olarak kullanılır. Bu, rifampine (100 mg / L) ve streptomisin'e (100 mg / L) dirençli plazmidsiz bir suştur. İki antibiyotiğe direnç göstermek, donörde ortaya çıkan ve sonuçların yorumlanmasına müdahale edecek direnç mutasyonları olasılığını azaltır. Ek olarak, E. coli LMB100 laktoz negatiftir ve MacConkey agarında soluk sarı ve küçük koloniler (daha büyük, pembe kolonilerin aksine) ürettiği için iki donör suşundan ayırt edilebilir.
Donör laktoz negatif olduğunda, laktoz pozitif bir alıcı kullanmanızı öneririz (örneğin, E. coli J53). LMB100 ve J53 suşları diğer laboratuvarlarda da kullanılabilir. Lütfen Dr. Gerardo Cortés-Cortés'e adres ve FedEx numarası ile birlikte bir talep gönderin.
Bağışçıları, alıcıları ve transkonjuganları seçmek ve saymak için gereken katı ortam, 100 mm çapındaki Petri kaplarındaki MacConkey agar'dır. Aşağıdaki antibiyotiklerin eklenmesi gerekir: (i) Medya A: donörleri saymak ve alıcıların bu antibiyotikle büyüyememesini sağlamak için karbenisilin (100 mg / L). (ii) Medya B: Alıcıları saymak ve donörlerin bu iki antibiyotikte büyüyememesini sağlamak için rifampin (100 mg / L) + streptomisin (100 mg / L). (iii) Medya AB: transkonjuganları elde etmek ve saymak için karbenisilin (100 mg / L) + rifampin (100 mg / L) + streptomisin (100 mg / L). (iv) Medya C: İncelenen tüm izolatları çizecek antibiyotik yok.
E. coli SW4955 ve E. coli SW7037'den E. coli LMB100'e konjugatif plazmidlerin konjugasyon oranları karşılaştırılmıştır. Ek olarak, p134797 konjugatif plazmid (SW4955 suşu) durumunda, antibiyotik karbenisilin (100 mg / L), gentamisin (2 mg / L), kloramfenikol (25 mg / L), tetrasiklin (10 mg / L), trimetoprim (20 mg / L) veya sülfametoksazol (100 mg / L) ile değiştirilir.
Protokol
1. Yöntem 1: Konjugasyon
- 1. Gün: Bağışçıları ve alıcıyı çizgilendirin. C medyasındaki gliserol stoklarından ayrı olarak (antibiyotiksiz MacConkey agar) seriler ve gece boyunca 37 ° C'de inkübe edin.
NOT: Bu adım, deneyin saf izolatlarla yapılmasını sağlamak ve laktoz fenotipini kolonilerin rengine göre doğrulamak için gereklidir. - 2. Gün: Her donör ve alıcı için 14.0 mL'lik bir kültür tüpü etiketleyin. Her donör ve alıcının tek bir kolonisini seçin ve bunları 37 ° C'de 2 mL Mueller Hinton suyu içeren ve 200 rpm'de sallanan ayrı 14.0 mL kültür tüplerinde gece boyunca (18 saat) büyütün.
NOT: Kullanılan suşlarda, durağan faza 18 saatlik gece kültüründen sonra ulaşılır. - 3. Gün: 900 μL tuzlu su çözeltisinin 1:10 seyreltilmesi ve gece kültürünün 100 μL'sini kullanarak her bir donörün ve alıcının gecelik kültürünün 600 nm'sinde (OD600) optik yoğunluğunu (vorteks yok) ölçün.
- Her bir donörün ve alıcının optik yoğunluğunu, sterilize edilmiş tuzlu su çözeltisi (suda% 0.85 NaCl) ile 2.0'a (OD600 = 2.0) ayarlayın.
NOT: OD600 = 2.0 ile bir gecelik E. coli kültürü 1.6 x 109 CFU / mL'ye sahiptir. - Donör ve alıcı suşlarını gösteren 1,5 mL'lik bir mikrosantrifüj tüpünü "çiftleşme tüpü" olarak etiketleyin. Her donörün ve alıcının ayarlanmış (OD 600 = 2.0) süspansiyonunun500 μL'sini aktarın ve bunları çiftleşme tüpüne yerleştirin (bu çiftleşme tüpünde her donör ve alıcının 0.8 x 109 CFU / mL'si olacaktır). Çiftleşme tüpünü ters çevirerek yavaşça karıştırın.
- Çiftleşme tüpünü oda sıcaklığında 500 x g'da 10 dakika santrifüj yapın.
- Pelet rahatsız etmeden, konjugasyon tüpünün 800 μL'sini pipetleyin. Konjugasyon tüpünde 200 μL kalmalıdır.
NOT: Süspansiyondaki bakterileri etkisiz hale getirmek için süpernatantı %10'luk bir ağartıcı kabına atın. - Çiftleşme tüpünü bir inkübatörde 37 ° C'de 18 saat (geceleme) boyunca inkübe edin. Çiftleşme, kuluçka süresi boyunca gerçekleşir.
NOT: Konjugatif pili kırmamak için bu adım titremeden yapılmalıdır. - Negatif bir kontrol olarak, B medyasındaki bağışçıların ve A medyasındaki alıcıların gece kültürünü çizin. plakaları bir gecede 37 ° C'de inkübe edin
- 4. Gün: Çiftleşme tüpüne ve vortekse 800 μL tuzlu su çözeltisi ekleyerek yeniden askıya alın (bu, çiftleşme karışımını 1 mL'ye yeniden oluşturur).
NOT: Vorteks, çiftleşen bakterileri parçalara ayırır ve CFU / mL'yi ölçmek için kültürü homojenleştirir. - Çiftleşme karışımının 1:10 seyreltisini (1 x10 0 ila 1 x 10-7 arası) hazırlayın. Plaka 100 μL seyreltmeler 10-5 ila 10-7 A ve ortam B üzerinde ve tüm seyreltmeler AB medyasında.
NOT: Dlution 100, düzgün tüpü ifade eder. - Plakaları inkübatöre baş aşağı yerleştirmeden önce kurumasını bekleyin. Plakaları 37 ° C'de 18 saat (geceleme) boyunca inkübe edin.
- 5. Gün: Bağışçıların saf gece kültürlerinin çizgilerinin B medyasında büyümediğinden ve alıcıların saf gece kültürünün A medyasında büyümediğinden emin olmak için negatif kontrolleri inceleyin.
- Sayılabilecek koloni ve seyreltme sayısını kaydedin:
- A medyasındaki kolonileri sayın; bunlar bağışçılar. Koloniler pembe olmalıdır (Şekil 3A,B).
- B medyasındaki kolonileri sayın; bunlar alıcılar ve transkonjuganlardır. Koloniler soluk sarı renkte olmalıdır (Şekil 3C).
- AB medyasındaki kolonileri sayın; bunlar transkonjuganlardır. Koloniler soluk sarı olmalıdır.
NOT: Sayılabilir bir plaka seçin. Sayılabilir bir plakanın 30 ila 300 kolonisi vardır (300'den fazla koloninin sayılması zor olacaktır ve 30'dan az koloni, orijinal numunenin doğru bir temsilini sunmak için çok küçük bir örneklem büyüklüğü olarak kabul edilir).
- Donör başına veya alıcı başına konjugasyon sıklığını hesaplayın
Donör başına konjugasyon sıklığı = (Transkonjugant CFU/mL [media AB])/ (Donörlerin CFU/mL'si [media A]) x 100
Alıcı başına konjugasyon sıklığı = (Transkonjugant [media AB]'nin CFU/mL'si)/ (Alıcıların ve transkonjuganların CFU/mL'si [media B]) x 100
NOT: Bu protokol için konjugasyon frekansı, transkonjuganların alıcı sayısına bölünmesi ve 100 ile çarpılması şeklinde hesaplanmıştır. Literatüre göre, ortaya çıkan konjugasyon miktarı, ekskonjugant frekansı, gen transfer frekansı, konjugasyon frekansı, rekombinant verimi, plazmid transfer etkinliği, toplam bakteri sayısına dayalı konjugasyon frekansı, transkonjuganların oranı, alıcı popülasyondaki transkonjuganların fraksiyonu, transkonjugant frekansı, konjugasyon frekansı, konjugasyon hızının logaritması, transfer hızı sabiti, çiftleşme çifti başına konjugasyon hızı, konjugasyon katsayısı veya konjugasyon etkinliği20. Bu protokol, konjugasyon verimliliği terimini ifade eder. - Transkonjuganları gliserol stoklarında -80 ° C'de saklayın. Gliserol stoklarını hazırlamak için alt adımları izleyin.
- Tek bir transkonjugant kolonisi seçin ve bunları 37 ° C'de karbenikilin (100 mg / L) ile desteklenmiş 2 mL Mueller Hinton suyu içeren 5.0 mL kültür tüplerinde gece boyunca (18 saat) büyütün ve 200 rpm'de sallayın.
- Transkonjugan'ın adını gösteren kriyojenik şişeleri aşağıdaki gibi etiketleyin: Tc + donörün adı + A medyasında seçilim antibiyotiği (transkonjuganlar oldukları için, arka planlarının streptomisin ve rifampine zaten dirençli olan ancak ayrıca bir beta-laktam direnç geni taşıyan plazmidi barındıran alıcı suşu olduğu bilinmektedir); örneğin, TcU1Carb. Aynı donörden birden fazla transkonjugantın depolanması gerektiğinde sürekli sayılar ekleyin (örneğin, TcU1Carb1, TcU1Carb2, vb.).
- Gece kültürünün 1 mL'sini 1 mL% 50 gliserol (v / v; nihai gliserol konsantrasyonu% 25 olmalıdır) aktarın ve inversiyon ile hafifçe karıştırın. Kriyojenik şişeleri 15 dakika boyunca kuru buz üzerine koyun ve gelecekteki deneyler için kriyovalleri -80 ° C'de saklayın.
- DNA ekstraksiyonu için, karbenikilin (100 mg / L) ile desteklenmiş Mueller Hinton agar üzerindeki gliserol stoklarından trasnkonjuganları çizin ve gece boyunca 37 ° C'de inkübe edin; ardından adım 2.1'deki önerileri izleyin.
2. Yöntem 2: E. coli transkonjuganlarında antibiyotik direnç genlerini ve plazmid replikonlarını arttırmak için polimeraz zincir reaksiyonu (PCR)
NOT: Polimeraz zincir reaksiyonu (PCR) 1983 yılında Dr. Kary Mullis tarafından geliştirilmiştir. PCR, denatüre edilmiş, çift sarmallı bir DNA şablonunun zıt iplikçiklerine tavlanan ve termostabil bir DNA polimeraz yoluyla uzatılan spesifik primerlere (replikasyonun ilerleyebileceği bir nokta olarak işlev gören belirli bir DNA dizisini tamamlayan kısa bir DNA parçası, genellikle 20-40 nükleotid uzunluğunda ve ideal olarak% 40-60'lık bir guanin-sitozin içeriğine sahip) bağlıdır. böylece bir sonraki reaksiyon döngüsü için ek bir şablon oluşturarak orijinal şablon21'in üstel amplifikasyonuna yol açar. Bu protokolde, konjugatif plazmidlerde bulunan replikonlar ve direnç genleri, transkonjugant alıcı hücrelerdeki transferi doğrulamak için güçlendirildi.
- DNA ekstraksiyonu
- Konjugatif plazmidler tarafından taşınan direnç genlerinin transferini tespit etmek için, transkonjugant DNA'yı şablon olarak kullanın. Bakteriyel hücre duvarlarını lize etmek için basit kaynatma hazırlığı ekstraksiyonu kullanın.
NOT: Basit kaynatma hazırlığı ekstraksiyonu, bakteri hücre duvarlarını lize etmek için basit bir yaklaşımdır. Bu ekstraksiyon, genomik DNA ile karıştırılmış plazmid DNA'sı içerir, ancak primerler ilgilenilen spesifik DNA dizilerine göre tasarlandığından, bu şablon PCR için de yararlıdır. Plazmidler ayrıca özel olarak saflaştırılabilir, ancak verimler artan plazmid boyutu22 ile düşme eğilimindedir. Bu uygun bir durma noktasıdır. DNA -20 °C'de birkaç ay saklanabilir.
- Konjugatif plazmidler tarafından taşınan direnç genlerinin transferini tespit etmek için, transkonjugant DNA'yı şablon olarak kullanın. Bakteriyel hücre duvarlarını lize etmek için basit kaynatma hazırlığı ekstraksiyonu kullanın.
- PCR (Bilgisayar)
- Deneyin negatif ve pozitif bir kontrole sahip olduğu göz önüne alındığında, 1.5 mL'lik bir tüpteki tüm reaksiyonlar için bir havuz oluşturmak faydalıdır. 1.5 mL'lik bir tüpü "havuz" olarak ve gerekli PCR tüplerini gen ve numunenin adıyla (örneğin, OXA-U1) etiketleyin.
- PCR reaktiflerini aşağıdaki sırayla 1,5 mL'lik bir tüpe pipetleyin: steril su, 2x Master Mix, primerler ve polimeraz (şablon DNA hariç) (bkz. Tablo 1). En az 10 kez yukarı ve aşağı pipetle çekerek yavaşça karıştırın. Tüm zaman boyunca buzda tutun.
NOT: Reaksiyon karışımını veya reaktifleri kirletmekten kaçınmak için eldiven giyin. Reaktif kontaminasyonunu önlemek için reaktiflerin açılıp karıştırılmasından ve numunelerin aynı alanda işlenmesinden kaçının. Nükleaz aktivitesini ve spesifik olmayan astarlamayı bastırmak için reaktifleri buz kovasına yerleştirin. Bir reaksiyon oluşturmadan önce tamamen çözülmelerine izin verin. Reaktifleri deney boyunca buz üzerinde tutun. Taq Polimeraz sonunda eklenir çünkü pH değişikliklerine duyarlıdır; bozulmayı veya yanlış katlanmayı önlemek için tamponlanması gerekir. Primerlerin dizisi Tablo 2-antibiyotik direnç genleri-ve Tablo 3-replikonlar 23,24,25,26,27,28'de listelenmiştir. - Şablon DNA'yı karşılık gelen tüpe ekleyin. PCR tüplerine kabarcıklar ve güvenli kapaklar sokmaktan kaçının.
- PCR tüplerini termal döngüleyiciye yerleştirin.
- Programı başlatın. Tablo 2 (direnç genleri) ve Tablo 3'te (replikonlar) her gen için listelenen program ayarlarına bakın.
NOT: PCR programlarını, çalıştırmadan sonra örnekleri 4 °C'de tutacak şekilde ayarlayın.- Replikonlar için PCR koşulları: 5 dakika boyunca 94 ° C'de bir denatürasyon döngüsü, ardından 1 dakika boyunca 94 ° C'de 30 döngü denatürasyon, 30 s için 60 ° C'de tavlama, 1 dakika boyunca 72 ° C'de uzama ve 5 dakika boyunca 72 ° C'de bir döngünün son uzatılması.
NOT: Bunlar Carattoli ve ark.29 tarafından standartlaştırılmış koşullardır.
- Replikonlar için PCR koşulları: 5 dakika boyunca 94 ° C'de bir denatürasyon döngüsü, ardından 1 dakika boyunca 94 ° C'de 30 döngü denatürasyon, 30 s için 60 ° C'de tavlama, 1 dakika boyunca 72 ° C'de uzama ve 5 dakika boyunca 72 ° C'de bir döngünün son uzatılması.
- Program bittiğinde, PCR tüplerini 4 ° C'de saklayın.
NOT: Bu uygun bir durma noktasıdır. PCR ürünleri -20 °C'de birkaç ay saklanabilir - 250 mL'lik bir şişede 0.6 g agaroz tartarak ve 60 mL 1x Tris-asetat-EDTA (TAE) tamponu ekleyerek% 1'lik bir agaroz jeli hazırlayın (farklı bir jel boyutuna ihtiyaç duyulursa reaktifleri ayarlayın). Agarozun şişenin üzerine dökülmesini önlemek için agarozu dikkatlice ve yavaşça bir mikrodalgada eritin ve yaklaşık 55 ° C'ye (10-15 dakika) soğumaya bırakın.
- Tüm reaktifleri ultra saf deiyonize su ve analitik sınıf reaktifler kullanarak hazırlayın:
- TAE 50x Tampon (Tris baz, asetik asit ve EDTA) (1 L): 121.1 g Tris baz + 372.24 g EDTA karıştırın ve 500 mL damıtılmış su ekleyin. Manyetik bir karıştırıcı ile çözün. 57.1 mL asetik asit ekleyin ve toplam 1.000 mL hacme damıtılmış su ekleyin.
- 15 psi, 121 °C'de 15 dakika otoklav yapın ve 6 aya kadar hazır olana kadar oda sıcaklığında tutun.
- TAE 1x Tampon (1 L): 20 mL TAE 50x tamponu 980 mL damıtılmış su ile birleştirin ve karıştırın.
- Bir duman başlığının altında, erimiş agaroza 6 μL SYBR Green ekleyin, karıştırın ve dökülmeyi önlemek için daha önce yapışkan bantla kapatılmış tepsiye (ve tarak) dökün. Jeli bulanıklık görünene kadar 15-25 dakika bekletin.
NOT: Diğer alternatif boyalar damevcuttur 30,31,32,33. - Yapışkan bandı çıkarın ve jeli elektroforez odasına yerleştirin, jeli örtmek için yeterli 1x TAE tamponu ekleyin.
- 5 μL 6x DNA jel yükleme boyasını her reaksiyonun 25 μL'si ile karıştırın. En az 10 kez yukarı ve aşağı pipetle çekerek yavaşça karıştırın.
NOT: Beklenen ürünü görselleştirmek için tüm PCR ürünlerinin jele yüklenmesi gerekmez (boya miktarını karşılık geldiği şekilde ayarlayın). Kalan PCR örneği birkaç ay boyunca -20 ° C'de saklanabilir ve saklanabilir. - Karışımı kuyucuklara yerleştirin (kabarcıklar sokmaktan kaçının) ve oda kapağını aşağı indirin.
NOT: İlk numuneyi negatif kontrolden başlayarak ikinci kuyucuğa yükleyin (birincisini merdivene ayırın). - İlk kuyuya 4 μL 1 kb DNA merdiveni yükleyin.
- Elektroforezi 120 V, 400 mA ve 60 dakikada çalıştırın.
- Jeli UV ışığı altında görselleştirin (UV aydınlatıcısı ile) ve görüntüyü kaydedin.
NOT: Bir PCR ürünü varsa, lekelenmiş DNA bantları standart bir UV transilluminator, görünür ışık transilluminator veya lazer tabanlı bir tarayıcı kullanılarak tespit edilebilir.
| Reaktif | Stok Çözümü | 50 μL reaksiyona eklenen hacim (1x) | Son | Örnek: volume | Örnek: volume | Örnek: Her tüpe eklenen hacim Son Cilt 50 μL | Pozitif kontrole eklenen ses seviyesi | Negatif kontrole eklenen ses seviyesi |
| Konsantrasyon | 1x'e eklendi | 3x'e eklendi (havuz) | ||||||
| Steril su | - | 21,5 μL (q.s. ila 50 μL) | - | 21,5 μL | 64,5 μL | 49 μL/tüp | 49 μL/tüp | 49 μL/tüp |
| Ana Karışım | 2x | 25 μL | 1 adet | 25 μL | 75 μL | |||
| İleri Astar | 25 μM | 1 μL | 0,5 μM | 1 μL | 3 μL | |||
| Ters Astar | 25 μM | 1 μL | 0,5 μM | 1 μL | 3 μL | |||
| Şablon DNA | Değişken (100–200 ng/μL) | Değişken (1 μL) | Değişken | 0,5 μL | 1,5 μL | |||
| Polimeraz | 5 Birim/μL | 0,5 μL | 2.5 Birimler | - | - | 1 μL (transkonjugant) | 1 μL (donör) | 1 μL (alıcı) |
| NOT: q.s., kuantum satis için Latince bir kısaltmadır, yani ihtiyaç duyulan miktarı ifade eder. | ||||||||
Tablo 1: PCR reaktifleri ve üç reaksiyon için havuz (bir örnek).
| Astarlar (5' - 3' yönünde listelenen dizi) | PCR programı | Beklenen boyut |
| (bp) Ref. | ||
| blaCTX-M grup 1 | 94 oC 7 dk | (864) 23 adet |
| CTX-M: GGTTAAAAAATCACTGCGYC | 94 oC 50 s (35 devir) | |
| CTX-M: TTGGTGACGATTTTAGCCGC | 50 oC 40 sn | |
| 68 oC 1 dk | ||
| 68 oC 5 dk | ||
| blaCMY-2 | 95 oC 3 dk | (1855) 24 adet |
| CMY-2-F: GATTCCTTGGACTCTTCAG | 95 oC 30 s (30 devir) | |
| CMY-2-R: TAAAACCAGGTTCCCAGATAGC | 53 oC 30 s | |
| 72 oC 30 s | ||
| 72 oC 3 dk | ||
| aac(3')-II | 94 oC 5 dk | (237) 25 adet |
| aac(3')-II-F: ACTGTGATGGGATACGCGTC | 94 oC 30 s (32 devir) | |
| aac(3')-II-R: CTCCGTCAGCGTTTCAGCTA | 60 oC 45 s | |
| 72 oC 2 dk | ||
| 72 oC 8 dk | ||
| aadA | 94 oC 5 dk | (283) 26 adet |
| aadA1: GCAGCGCAATGACATTCTTG | 94 oC 1 dk (35 devir) | |
| aadA2: ATCCTTCGGCGCGATTTTG | 60 oC 1 dk | |
| 72 oC 1 dk | ||
| 72 oC 8 dk | ||
| sul-3 | 94 oC 5 dk | (799) 27 adet |
| sul-3-F: GAGCAAGATTTTTGGAATCG | 94 oC 1 dk (30 devir) | |
| sul-3-R: CATCTGCAGCTAACCTAGGGCTTTGGA | 51 oC 1 dk | |
| 72 oC 1 dk | ||
| 72 oC 5 dk | ||
| tet(A) | 95 oC 5 dk | (957) 28 adet |
| TETA-1: GTAATTCTGAGCACTGTCGC | 95 oC 30 s (23 devir) | |
| TETA-2: CTGCCTGGACAACATTGCTT | 62 oC 30 s | |
| 72 oC 45 s | ||
| 72 oC 7 dk | ||
| cesaret A | 95 oC 5 dk | (302) Bu Eser |
| dfrA-F: CATACCCTGGTCCGCGAAAG | 95 oC 1 dk (30 devir) | |
| 55 oC 1 dk | ||
| dfrA-R: CGATGTCGATCGTCGATAAGTG | 72 oC 1 dk | |
| 72 oC 7 dk | ||
| catA2 | 95 oC 5 dk | |
| catA2-F: GACCCGGTCTTTACTGTCTTTC | 95 oC 1 dk (25 devir) | (225) Bu eser |
| catA2-R: TCCGGTGATATTCAGATTAAAT | 60 oC 1 dk | |
| 72 oC 1 dk | ||
| 72 oC 7 dk |
Tablo 2: Tanısal direnç genlerini yükseltmek için kullanılan primerler ve PCR programları.
| Replicon | Astar (5' - 3' oryantasyonunda listelenen dizi) | Hedef | PCR programı | Beklenen boyut (bp) | |||
| İncFIB | F: TCTGTTTATTCTTTTACTGTCCAC | repA | 94 oC 5 dk | 683 | |||
| R: CTCCCGTCGCTTCAGGGCATT | 94 oC 1 dk (30 devir) | ||||||
| 60 oC 30 s | |||||||
| IncFIC (İncir) | F: GTGAACTGGCAGATGAGGAAGG | repA2 | 72 oC 1 dk | 262 | |||
| R: TTCTCCTCGTCGCCAAACTAGAT | 72 oC 5 dk | ||||||
| IncI1 | F: CGAAAGCCGGACGGCAGAA | RNAI (TRNAI) | 139 | ||||
| R: TCGTCGTTCCGCCAAGTTCGT | |||||||
Tablo 3: Plazmidler p134797 ve p101718'in PCR tabanlı replikon tiplemesi ile sınıflandırılmasında kullanılan primer ve PCR programı29.
Sonuçlar
SW4955 ve SW7037 donörlerinin dizilendiği göz önüne alındığında, bu iki donör suşunun genomik dizilimlerinde tanımlanan direnç gen profiline karşılık gelen direnç fenotiplerine sahip olması beklenmektedir. Plazmid p134797 (SW4955'ten), üçüncü nesil sefalosporinlere (blaCTX-M-55) direnç ve aminoglikozitlere (aac (3) -IIa ve aadA1), fenikollere (catA2), tetrasiklinlere (tet (A)), trimetoprim (dfrA14) ve sülfonamidlere (sülfin) direnç kazandıran genlere sahiptir; SW4955 kromozomunda antibiyotik direnç genleri bulunamadı. Plazmid p101718 (SW7037'den) sadece bir antibiyotik direnç geni (bla CMY-2) taşır ve üçüncü nesil sefalosporinlere (blaCTX-M-55) direnç kazandırması beklenir. Yine SW7037 kromozomunda antibiyotik direnci genleri bulunamadı.
Çiftleşmeyi takiben, yukarıda belirtilen tüm direnç genlerini taşıyan iki konjugatif plazmidin transferinin tespiti bekleniyordu. Pozitif konjugasyon tespiti, transkonjuganlar olarak tanımlanan alıcıların konjugatif plazmidleri edinmiş olmaları gerektiği anlamına gelir. Transkonjuganlardaki konjugatif plazmidler için tanısal direnç genlerinin varlığı da (PCR ile tespit edildiği gibi) bekleniyordu.
Burada açıklanan yöntemleri göstermek için, iki E. coli çevresel izolatının konjugasyon yoluyla plazmid DNA'sını transfer etme kabiliyeti test edilmiştir. Deney ortamının şematik bir temsili Şekil 1'de gösterilmiştir. İki donör (E. coli SW4955 ve SW7037) ve bir alıcı (E. coli LMB100) bağımsız olarak çiftleştirildi. E. coli SW4955 (p134797) ve SW7037'de (p101718) bulunan konjugatif plazmidlerin gen haritası Şekil 2'de gösterilmiştir.
Konjugatif plazmidler karbenisilin ile seçildi ve direnç belirleyicileri alıcının kromozomunda bulunan rifampin ve streptomisin kullanılarak karşı seçildi. MacConkey agar, laktoz pozitif donörleri (büyük, pembe koloniler üreten) alıcıdan ve transkonjuganlardan (laktoz negatif olan ve daha küçük, soluk sarı koloniler üreten) ayırt etmek için kullanıldı (Şekil 3).
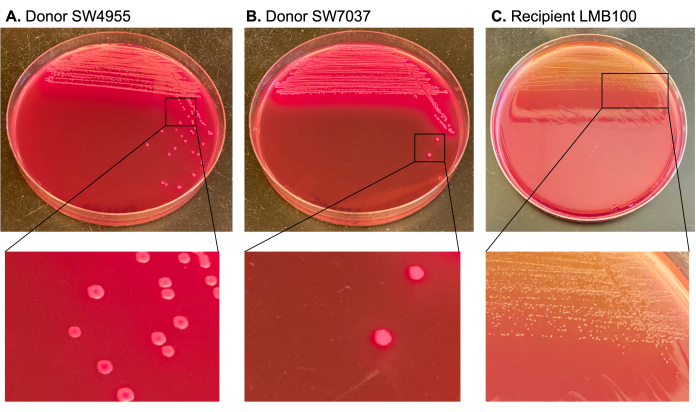
Şekil 3: MacConkey agar'daki donör ve alıcı kolonileri için diferansiyel renk belirteçlerinin gösterimi. Bağışçılara karşılık gelen koloniler laktoz pozitif oldukları için MacConkey agar'da pembedir. Bu, donörü soluk sarı ve daha küçük (laktoz negatif) olan alıcı kolonilerden ayırır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Konjugatif plazmid p134797'nin mobilizasyonu, plazmidde bulunan beş farklı direnç geni sınıfına karşılık gelen beş antibiyotiğin her biri ile tespit edildi.
SW4955 suşu için konjugasyon verimliliğinin (CE) nasıl hesaplanacağına dair bir örnek sunulmuştur. SW4955 suşu ile yapılan tahlilden, seyreltme 10-2'den plakada 172 CFU transkonjuganlar sayıldı; karşılık gelen seyreltmeden (10-2) alıcının sayısı 10.300.000 CFU / mL idi (Tablo 4).
CE aşağıdaki gibi hesaplanır:
CE = (174 CFU/mL)/(10.300.000 CFU/mL)
CE= 1.67 x 10-5 transkonjugan/alıcı
| LMB100 Serisi | SW4955 suşundan transkonjuganlar Karbelikillin ile seçildi | Konjugasyon Verimliliği | ||
| Seyreltme | CFU (sayılabilir plaka) | Yaklaşık CFU/mL | CFU (sayılabilir plaka) | |
| 100 | akıcılık | 1,03E+09 | ||
| 10-1 | akıcılık | 1,03E+08 | ||
| 10-2 | akıcılık | 10300000 | 172 | 1.67 x 10-5 transkonjugan/alıcı |
| 10-3 | akıcılık | 1030000 | ||
| 10-4 | akıcılık | 103000 | ||
| 10-5 | akıcılık | 10300 | ||
| 10-6 | akıcılık | 1030 | ||
| 10-7 yaş arası | 103 | 103 | ||
| CE'yi hesaplamak için kullanılan değerler kalın harflerle vurgulanır. | ||||
Tablo 4: SW4955 suşu için konjugasyon verimliliğinin (CE) nasıl hesaplanacağına dair bir örnek.
Sonuçlar, alıcı başına konjugasyon verimliliği olarak ifade edilen Tablo 5'te gösterilmiştir. Donör olarak SW4955 suşu kullanılarak elde edilen beş konjugasyon etkinliğinin hepsi aynı büyüklük sırasına sahipti. Bu sonuçlar, konjugatif plazmidin mobilizasyonunun, transkonjugant tanımlaması için kullanılan seçimden bağımsız olarak tespit edilebileceğini göstermektedir.
SW7037 suşunu donör olarak kullanarak, elde edilen konjugasyon verimliliği üç büyüklük sırasına göre daha düşüktü; Bu sonuçlar, farklı donörlerin ve plazmid tiplerinin konjugasyon verimliliklerinin aynı alıcılarla karşılaştırılmasına izin verir.
| Konjugasyon verimliliği | |||||
| Soy | Karbenisilin (100 mg/L) | Gentamisin (2 mg/L) | Kloramfenikol (25 mg/L) | Tetrasiklin (10 mg/L) | Trimetoprim (20 mg/L) |
| SW4955 Serisi | 1,67 x 10-5 | 5,67 x 10-5 | 2,17 x 10-5 | 7,62 x 10-5 | 1,36 x 10-5 |
| SW7037 Serisi | 2,14 x 10-6 | ||||
Tablo 5: E. coli donör suşlarının SW4955 ve SW7037 konjugasyon etkinlikleri, seçilimde kullanılan antibiyotiğe bağlı olarak.
Transkonjuganlarda, test edilen iki konjugatif plazmidde kodlanan replikonların ve tüm direnç genlerinin varlığı ve bunlara karşılık gelen replikonlar PCR ile kontrol edildi. Bu tanısal PCR reaksiyonları için kullanılan durumlar Tablo 3'te gösterilmiştir.
Teşhis jelleri Şekil 4'te gösterilmiştir. Bu jeller, transkonjuganlarda beklenen replikonların varlığını doğrular (p1347975'te IncFIC ve IncFIB ve p101718'de IncI1). Ayrıca, beklenen antibiyotik direnci genlerinin, yani bla CTX-M-55 grubu (beta-laktam), aac (3) -II ve aadA (aminoglikozit), catA2 (fenikol), tet (A) (tetrasiklin), dfrA14 (trimetoprim) ve p1347975 için sülfoamid ve p101718 için blaCMY-2 (Şekil 4) varlığını doğrulamaktadırlar.
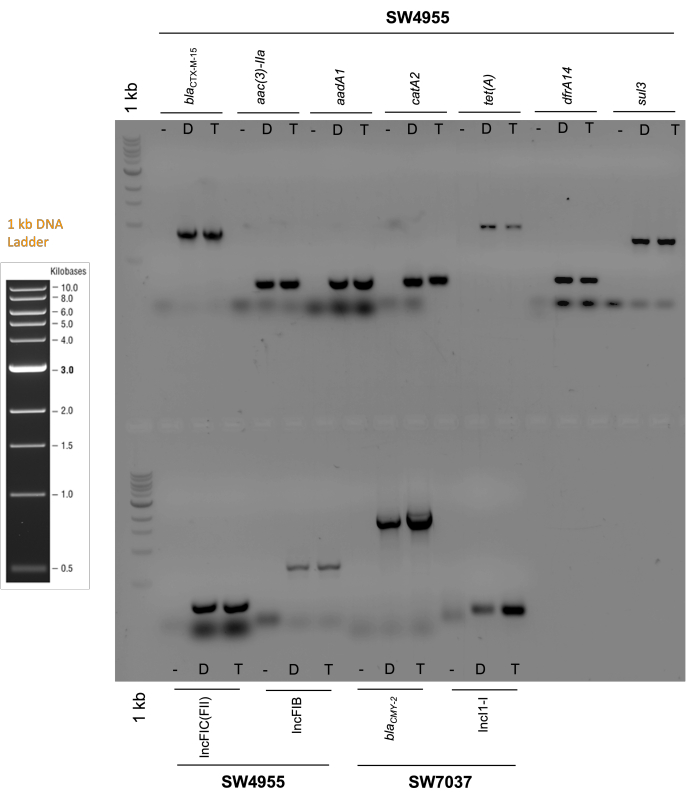
Şekil 4: Tanısal elektroforez jelleri. Donör hücrelerde (sırasıyla SW4955 ve SW7037 suşları) ve karşılık gelen LMB100 transkonjuganlarında konjugatif plazmidler p134797 ve p101718'de bulunan antibiyotik direnç genlerinin ve plazmid replikonlarının PCR ürünlerinin jel elektroforezi. Plazmid seçiminde karbenisilin kullanıldı. Kısaltma. -: negatif kontrol (LMB100 suşunun DNA'sı negatif kontrol olarak kullanılmıştır); D: donör; T: transkonjugan. Beklenen amplikon boyutları: blaCTX-M-55: 864 pb; aac(3)-IIa: 237 bp; aadA1: 283 bp; catA2 : 225 bp; tet(A): 957 bp; dfrA14: 302 bp; sul3: 799 bp; IncFIC(FII): 262 bp; IncFIB: 683 bp; blaCMY-2: 1.855 bp; IncI1-I: 139 bp. Jel% 1 agaroz vardır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Konjugatif plazmidler, rekombinasyon ve yatay gen transferi yoluyla belirli bir çevresel ortamda ortak bir gen havuzuna erişim sağlar34. Bu nedenle, konjugatif plazmidler, bakterilerin zamansal bir saat ölçeği içinde çoklu koşullara (antibiyotiklere direnç, metallere direnç, metallerin edinimi, biyofilm oluşumu ve patojenik genler dahil) uyum sağlamasına izin veren işlevleri edinebilen ve verebilen evrimsel varlıklardır.
Bu çalışma, bakterilerde konjugatif plazmidlerin tanımlanması için bir protokol sunmaktadır. Protokolün çalışması için, kullanılan belirteçlerin, A ve B ortamlarındaki kontrollerde gösterildiği gibi, donör ve alıcı suşlarını ayırt etmesi gerekir. Ayrıca plazmidi taşıyan hücreleri etkili bir şekilde seçmeleri gerekir. Çiftleşme reaksiyonu kritiktir. Bu reaksiyonda, konjugasyonun gerçekleşmesi için donörlerin ve alıcıların uzun süreli temas (pili yoluyla) yapmaları gerekir. Yetersiz kuluçka süresi veya kültürü sallamak veya karıştırmak gibi hücreden hücreye teması bozabilecek herhangi bir şey, böylece konjugasyonun verimliliğini azaltır. Bazı alıcı suşları konjugasyona dirençli olduğu için alıcı seçimi de kritiktir35,36. LMB100, çoklu uyumsuzluk tiplerinin plazmidlerini alabildiği için tercih edilen alıcı olarak önerilmektedir.
Konjugasyon hızı her plazmid-donör kromozom çifti, alıcı ve çevresel durum için spesifiktir. Spesifik plazmidlerin konjugasyonunun, büyüme fazı, hücre yoğunluğu, donör-alıcı oranı, konjugasyonun sıvı veya katı ortamda yapılıp yapılmadığı, karbon, oksijen, safra tuzları, metal konsantrasyonları, memeli hücrelerinin varlığı, sıcaklık, pH ve çiftleşme süresi dahil olmak üzere çok sayıda değişkene duyarlı olduğu bulunmuştur13,14,15 . Bu etkileşimlerin incelenmesi, derinlemesine incelenecek konjugatif bir plazmidin ilk tespitine bağlıdır. Bu nedenle, burada açıklanan protokol, farklı deneysel değişkenlerin etkisini araştırmak için de değiştirilebilir, ancak bu, taranan bağışçıların sayısını kısıtlama pahasına gelir. Ayrıca, yardımcı plazmidlere sahip konakçılardaki mobilize edilebilir plazmidleri de tanımlayabilir (yani, trans6'daki mobilize edilebilir plazmidlerden eksik fonksiyonları sağlayarak konjugasyonu sağlayan plazmidler).
Konjugatif plazmidin sırasını bilmek önerilir (ancak yukarıda tartışıldığı gibi konjugasyonu tespit etmek için gerekli değildir). Donörler laktoz negatif olduğunda (MacConkey agar'da sarı koloniler üreten), gerçek transkonjuganları transkonjuganları seçmek için medyada büyüyebilen donör hücrelerden ayırt etmek için laktoz pozitif bir alıcı (MacConkey agar'da pembe koloniler üreten) kullanılabilir. Burada açıklanan protokol, Enterobacteriaceae familyasının çevresel, kommensal ve patojenik üyelerinden konjugatif plazmidleri tespit etmek için tasarlanmıştır; Bununla birlikte, uygun bir donör, alıcı, antibiyotik (ler) ve renk belirteçleri olan herhangi bir bakteri türü ile kullanılabilir. Bu kritik bileşenlerin diğer bakterilerde tanımlanması, birden fazla donör, alıcı ve belirteç (antibiyotikler ve renkler) kullanan sistematik çalışmalar gerektirir. Bu protokol Gram-pozitif bakterilerde test edilmemiştir.
Burada sunulan yöntemin çeşitli varyantları literatürde bildirilmiş, yakın zamanda gözden geçirilmiş20. Nitel sonuç farklı şekillerde de ifade edilebilir (örneğin, ekskonjugant frekansı ve gen transfer frekansı) ve konjugasyon verimliliğini (mL / CFU x h)20 raporlamak için boyutsuz birimler kullanılabilir.
Burada açıklanan protokol, daha önce mevcut yöntemlerle ele alınmayan çeşitli sınırlamaları çözer16,18,19,20. İlk olarak, uygun bir alıcı tespit edilmiştir. İkincisi, gerçek transkonjuganları seçmek için iki antibiyotiğin (rifampin ve streptomisin) kullanılması, donörlerin spontan mutagenez yoluyla transkonjuganları seçmek için kullanılan antibiyotiklerden birine direnç geliştirme olasılığını en aza indirir. Yanlış transkonjuganlar, donör tarafından büyük miktarlarda üretilen enzimler (örneğin, beta-laktamaz) tarafından transkonjuganları seçmek için kullanılan antibiyotiğin hidrolizi ile seyirci korumasından da kaynaklanabilir. Üçüncüsü, çiftleşme ürününün gerçek bir transkonjugant (yani, donörün konjugatif plazmidini istikrarlı bir şekilde birleştiren bir alıcı hücre) olduğundan emin olmak için birkaç deneysel kontrol dahil edilmiştir. Burada, transkonjuganların gerçekliğini test etmek için iki bağımsız yöntem, yani MacConkey agar'da kolorimetrik bir belirteç ve alıcıdaki konjugatif plazmidin replikonlarının ve antibiyotik direnç genlerinin PCR tespiti sunulmuştur. Ayrıca, burada açıklanan protokol, konjugatif plazmidleri Enterobacteriaceae familyasının çevresel, kommensal ve patojenik üyelerinden (Escherichia, Klebsiella, Enterobacter, Citrobacter, Salmonella, Shigella ve diğer türler) izole etmek ve karakterize etmek için tasarlanmıştır.
Konjugasyon mekaniğini anlamak için, deneysel gözlemler bilgisayar simülasyonları kullanılarak modellenmiştir. Bu öngörücü modeller, donörlerin, alıcıların ve transkonjuganların belirli büyüme yoğunlukları için plazmid transferinin sıklığını tahmin eder. Son nokta modeli olarak bilinen bir model, sıvı kültürde plazmid transfer hızının üzerinde olduğu eşikler buldu ve transfer hızının hücre yoğunluğu, donör: alıcı oranı ve çiftleşme süresi19'dan etkilenmediği sonucuna vardı. Floresan in situ hibridizasyon (FISH), transkonjugant plazmid tespitinde alternatif bir yöntem olarak kullanılmıştır. FISH, bir DNA probunun ve bir hedef DNA'nın hibridizasyonu yoluyla floresan mikroskobu kullanılarak plazmid görselleştirmesine izin verir. Böylece, FISH, farklı hücre popülasyonları arasında plazmid akışlarının görsel olarak algılanmasına izin verir37, ancak transkonjuganlar seleksiyonun aksine görsel tarama ile tespit edilirse, burada sunulan yöntemle aynı hassasiyet seviyesine sahip değildir.
Antibiyotik direnç genlerini ekosistemin farklı bileşenleri (klinik, tarım, kanalizasyon, vahşi yaşam, evcil hayvanlar, topraklar, nehirler ve göller) aracılığıyla dağıtan konjugatif plazmidlerin biyolojisini anlamak için muazzam bir ihtiyaç vardır. Özetle, burada açıklanan protokollerde sunulan basitleştirilmiş deneysel koşullar, donörlerin ölçekli olarak taranmasını kolaylaştırır ve bu nedenle, çeşitli kaynaklardan konjugatif plazmidlerden kaynaklanan yatay gen transferinin incelenmesi için kilit bir aracı temsil eder. Birden fazla kaynaktan ve bakteriden konjugatif plazmidlerde antibiyotik dirençli genlerin veya klinik olarak ilgili diğer genlerin prevalansını araştırmak için kullanılabilirler. Ayrıca in vivo konjugasyon çalışması için (örneğin, omurgalıların bağırsağında) ve konjugasyonun verimliliğini modüle eden koşulları incelemek için uyarlanabilirler. Tüm bu çalışmalar, çoklu ilaca dirençli konjugatif plazmidlerin mobilizasyonunun çoklu ilaç direncinin yayılmasına nasıl katkıda bulunduğunu anlamaya büyük ölçüde katkıda bulunacaktır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
LM-B, IMG, AT ve IS, LM-B'ye verilen NIH hibe GM055246 tarafından desteklenmiştir. GC-C, UC MEXUS-CONACYT Doktora Sonrası Bursu'na iki yıl üst üste layık görüldü: AY 2017-18 ve 2018-19. Genentech-Foundation sponsorluğundaki Akademik İlham Ağı (GAIN) mentorluk programından öğrenciler Sage Chavez ve Pepper St. Clair'e deneylerdeki teknik destekleri için çok teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube racks | Thermo Fisher Scientific | 22-313630 | It can be replaced for another brand |
| 2.0 mL Cryogenic vials | Corning | 430659 | It can be replaced for another brand |
| 14 mL conical tubes | FALCON | 149597 | It can be replaced for another brand |
| 14 mL tube racks | Thermo Fisher Scientific | 8850 | It can be replaced for another brand |
| 1 kb DNA ladder | New England Biolabs | N0552G | |
| 250 mL sterile flasks | PYREX | 5320 | It can be replaced for another permanent marker brand |
| Acetic acid | Fisher Scientific | A38SI-212 | It can be replaced for another brand |
| Agarose (molecular biology grade, multipurpose) | Fisher Scientific | BP160-500 | It can be replaced for another brand |
| Carbenicillin | GOLD BIOTECHNOLOGY | C-103-50 | It can be replaced for another brand |
| Disposable inoculating loops: 1 µL | Fisherbrand | 22-363-595 | It can be replaced for another brand |
| DNA gel loading dye 6x | New England Biolabs | B7024S | It can be replaced for another brand |
| EDTA | Fisher Scientific | BP119-500 | It can be replaced for another brand |
| Electronic digital scale | Denver Instrument | APX-2001 | It can be replaced for another brand |
| Eppendorf conical tubes: 1.5 mL | Eppendorf | 14-282-302 | It can be replaced for another brand |
| Equipment for agarose gel electrophoresis | Fisher Scientific | FP300 | It can be replaced for another brand |
| Ethanol-resistant markers | Sharpie | 37001; 37002; 37003 | It can be replaced for another brand |
| Gel documentation systems (UVP GelSolo) | Analytakjena | SP-1108; 849-97-0936-01; 95-0612-01 | It can be replaced for another brand |
| Gloves | X-GEN | 44-100M | Any nitrile gloves brand works |
| Ice bucket | Thermo Fisher Scientific | 432128 | It can be replaced for another brand |
| MacConkey agar | BD DIFCO | 212123 | |
| Master Mix | BioLabs | M0496S | It can be replaced for another brand |
| Methanol | Fisher Scientific | A452-4 | It can be replaced for another brand |
| Microcentrifuge tubes: 2.0 mL | Fisherbrand | 05-408-138 | It can be replaced for another brand |
| Mueller Hinton agar | BD DIFCO | DF0479-17-3 | |
| Mueller Hinton broth | BD DIFCO | 275730 | |
| NucleoSpin Plasmid, Mini kit for plasmid DNA | Takara Bio USA, Inc., MACHEREY-NAGEL | 740588. 250 | |
| PCR tube racks | AXYGEN | R96PCRFSP | It can be replaced for another brand |
| PCR tubes (0.2 mL) | AXYGEN | PCR-02-C | It can be replaced for another brand |
| Rifampicin | Fisher Scientific | 50-164-7517 | |
| Set of micropipettes that dispense between 1 - 10 μL (P10), 2–20 μL (P20), 20–200 μL (P200) and 200–1000 μL (P1000) | RAININ | 17008648; 17008650; 17008652; 17008653 | Micropipettes should be calibrated; can be replaced for another brand |
| Sodium chloride | Fisher Scientific | S671-3 | It can be replaced for another brand |
| Spectrophotometer | Thermo Scientific | 335905P | It can be replaced for another brand |
| Sterilized tips for 10 μL, 200 μL and 1000 μL | Eclipse | 1011-260-000-9; 1018-260-000; 1019-260-000-9 | It can be replaced for another brand |
| Streptomycin | Fisher Scientific | BP910-50 | |
| SYBR Safe DNA gel stain | Thermo Fisher Scientific | S33102 | |
| Taq DNA Polymerase | BioLabs | M0273S | |
| Thermal cycler C1000 Touch | Bio-Rad | 1851196 | It can be replaced for another brand |
| Tris | Fisher Scientific | BP153-500 | It can be replaced for another brand |
Referanslar
- Lederberg, J., Tatum, E. Gene recombination in Escherichia coli. Nature. 158 (4016), 558 (1946).
- de la Cruz, F., Frost, L. S., Meyer, R. J., Zechner, E. L. Conjugative DNA metabolism in Gram-negative bacteria. FEMS Microbiology Reviews. 34 (1), 18-40 (2010).
- Grohmann, E., Muth, G., Espinosa, M. Conjugative plasmid transfer in gram-positive bacteria. Microbiology and Molecular Biology Reviews. 67 (2), 277-301 (2003).
- Koraimann, G., Wagner, M. A. Social behavior and decision making in bacterial conjugation. Frontiers in Cellular and Infection Microbiology. 4, 54 (2014).
- Dziewit, L., et al. Diversity and role of plasmids in adaptation of bacteria inhabiting the Lubin copper mine in Poland, an environment rich in heavy metals. Frontiers in Microbiology. 6, 152 (2015).
- Smillie, C., Garcillán-Barcia, M. P., Francia, M. V., Rocha, E. P., de la Cruz, F. Mobility of plasmids. Microbiology and Molecular Biology Reviews. 74 (3), 434-452 (2010).
- Balbuena-Alonso, M. G., et al. Genomic analysis of plasmid content in food isolates of E. coli strongly supports its role as a reservoir for the horizontal transfer of virulence and antibiotic resistance genes. Plasmid. 123-124, 102650 (2022).
- San Millan, A., MacLean, R. C. Fitness costs of plasmids: A limit to plasmid transmission. Microbiol Spectrum. 5 (5), (2017).
- Coluzzi, C., Garcillán-Barcia, M. P., de la Cruz, F., Rocha, E. P. C. Evolution of plasmid mobility: Origin and fate of conjugative and nonconjugative plasmids. Molecular Biology and Evolution. 39 (6), 1-23 (2022).
- Bevan, E. R., et al. Molecular characterization of plasmids encoding blaCTX-M from faecal Escherichia coli in travellers returning to the UK from South Asia. The Journal of Hospital Infection. 114, 134-143 (2021).
- Minja, C. A., Shirima, G., Mshana, S. E. Conjugative plasmids disseminating CTX-M-15 among human, animals and the environment in Mwanza Tanzania: a need to intensify one health approach. Antibiotics. 10 (7), 836 (2021).
- Carattoli, A. Plasmids and the spread of resistance. International Journal of Medical Microbiology. 303 (6-7), 298-304 (2013).
- Sengupta, M., Austin, S. Prevalence and significance of plasmid maintenance functions in the virulence plasmids of pathogenic bacteria. Infection and Immunity. 79 (7), 2502-2509 (2011).
- Alderliesten, J. B., et al. Effect of donor-recipient relatedness on the plasmid conjugation frequency: a meta-analysis. BMC Microbiology. 20 (1), 135 (2020).
- Neil, K., Allard, N., Rodrigue, S. Molecular mechanisms influencing bacterial conjugation in the intestinal microbiota. Frontiers in Microbiology. 12, 673260 (2021).
- Liu, G., Bogaj, K., Bortolaia, V., Olsen, J. E., Thomsen, L. E. Antibiotic-induced, increased conjugative transfer is common to diverse naturally occurring ESBL plasmids in Escherichia coli. Frontiers in Microbiology. 10, 2119 (2019).
- Suchman, E. Polymerase chain reaction protocol. American Society for Microbiology. , 1-14 (2011).
- Watanabe, T. Infective heredity of multiple drug resistance in bacteria. Bacteriological Reviews. 27 (1), 87-115 (1963).
- Simonsen, L., Gordon, D. M., Stewart, F. M., Levin, B. R. Estimating the rate of plasmid transfer: an end-point method. Journal of General Microbiology. 136 (11), 2319-2325 (1990).
- Huisman, J. S., et al. Estimating plasmid conjugation rates: A new computational tool and a critical comparison of methods. Plasmid. 121, 102627 (2022).
- Jung, B., Hoilat, G. J. MacConkey medium. StatPearls. , (2022).
- . NucleoSpin Plasmid DNA purification Available from: https://www.mn-net.com/media/pdf/45/51/02/Instruction-NucleoSpin-Plasmid.pdf (2022)
- Jiang, X., et al. Detection of extended-spectrum beta-lactamases in clinical isolates of Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 50 (9), 2990-2995 (2006).
- Stapleton, P. D., Shannon, K. P., French, G. L. Carbapenem resistance in Escherichia coli associated with plasmid-determined CMY-4 beta-lactamase production and loss of an outer membrane protein. Antimicrobial Agents and Chemotherapy. 43 (5), 1206-1210 (1999).
- Ben Yahia, H., et al. Detection of CTX-M-15 harboring Escherichia coli isolated from wild birds in Tunisia. BMC Microbiology. 18 (1), 26 (2018).
- Madsen, L., Aarestrup, F. M., Olsen, J. E. Characterisation of streptomycin resistance determinants in Danish isolates of Salmonella Typhimurium. Veterinary Microbiology. 75 (1), 73-82 (2000).
- Perreten, V., Boerlin, P. A new sulfonamide resistance gene (sul3) in Escherichia coli is widespread in the pig population of Switzerland. Antimicrobial Agents and Chemotherapy. 47 (3), 1169-1172 (2003).
- Guardabassi, L., Dijkshoorn, L., Collard, J. M., Olsen, J. E., Dalsgaard, A. Distribution and in-vitro transfer of tetracycline resistance determinants in clinical and aquatic Acinetobacter strains. Journal of Medical Microbiology. 49 (10), 929-936 (2000).
- Carattoli, A., et al. Identification of plasmids by PCR-based replicon typing. Journal of Microbiological Methods. 63 (3), 219-228 (2005).
- Green, M. R., Sambrook, J. Agarose gel electrophoresis. Cold Spring Harbor protocols. 2019 (1), (2019).
- Singer, V. L., Lawlor, T. E., Yue, S. Comparison of SYBR Green I nucleic acid gel stain mutagenicity and ethidium bromide mutagenicity in the Salmonella/mammalian microsome reverse mutation assay (Ames test). Mutation Research. 439 (1), 37-47 (1999).
- Tuma, R. S., et al. Characterization of SYBR Gold nucleic acid gel stain: a dye optimized for use with 300-nm ultraviolet transilluminators. Analytical Biochemistry. 268 (2), 278-288 (1999).
- Oatey, P. Imaging fluorescently stained DNA with CCD technology How to increase sensitivity and reduce integration times. Biotechniques. 42 (3), 376-377 (2007).
- Norman, A., Hansen, L. H., Sørensen, S. J. Conjugative plasmids: vessels of the communal gene pool. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 364 (1527), 2275-2289 (2009).
- Du, L., Liu, R. H., Ying, L., Zhao, G. R. An efficient intergeneric conjugation of DNA from Escherichia coli to mycelia of the lincomycin-producer Streptomyces lincolnensis. International Journal of Molecular Sciences. 13 (4), 4797-4806 (2012).
- Kirk, J. A., Fagan, R. P. Heat shock increases conjugation efficiency in Clostridium difficile. Anaerobe. 42, 1-5 (2016).
- Esteves, G. M., Pereira, J. A., Azevedo, N. F., Azevedo, A. S., Mendes, L. Friends with benefits: An inside look of periodontal microbes' interactions using fluorescence in situ hybridization-Scoping review. Microorganisms. 9 (7), 1504 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır