Method Article
Primer Rhesus Macaque B Hücrelerinin Gen Düzenlemesi
Bu Makalede
Özet
B hücre tedavilerinin incelenmesi için CRISPR / Cas9 ve rekombinant adeno ilişkili virüs serotip 6 kullanarak primer rhesus makak B hücrelerinin kültürlenmesi ve gen düzenlenmesi için bir yöntem sunuyoruz.
Özet
B hücreleri ve soyları, yüksek oranda eksprese edilen antikorların kaynaklarıdır. Yüksek protein ekspresyon yetenekleri, bollukları, periferik kan yoluyla kolay erişilebilirlikleri ve basit evlat edinme transferlerine uygunlukları, onları rekombinant antikorları veya diğer terapötik proteinleri ifade etmek için gen düzenleme yaklaşımları için çekici bir hedef haline getirmiştir. Fare ve insan birincil B hücrelerinin gen düzenlemesi verimlidir ve in vivo çalışmalar için fare modelleri umut vaat etmiştir, ancak daha büyük hayvan modelleri için fizibilite ve ölçeklenebilirlik şu ana kadar gösterilmemiştir. Bu nedenle, bu tür çalışmaları mümkün kılmak için rhesus makak primer B hücrelerini in vitro olarak düzenlemek için bir protokol geliştirdik. CRISPR / Cas9 kullanarak periferik kan mononükleer hücrelerinden veya splenositlerden primer rhesus makak B hücrelerinin in vitro kültürü ve gen düzenlemesi için koşullar bildirilmiştir. Büyük (<4.5 kb) kasetlerin hedeflenen entegrasyonunu sağlamak için, tetrasiklin özellikli kendi kendini susturan adenoviral yardımcı vektör kullanılarak homolojiye yönelik bir onarım şablonu olarak rekombinant adeno ilişkili virüs serotip 6'nın hazırlanması için hızlı ve etkili bir protokol dahil edilmiştir. Bu protokoller, rhesus makaklarında prospektif B hücresi terapötiklerinin incelenmesini sağlar.
Giriş
B hücreleri humoral bağışıklığın temelidir. Konyak antijeni ve ikincil sinyaller tarafından aktivasyon üzerine, naif B hücreleri germinal merkez B hücrelerine, hafıza B hücrelerine ve plazma hücrelerine yol açar1. İkincisi, şu anda mevcut olan aşıların çoğunun koruyucu işlevlerine aracılık eden salgılanan antikorların kaynağıdır2. Plazma hücreleri, seruma çok miktarda antikor salgıladıkları için antikor fabrikaları olarak tanımlanmıştır - yaklaşık 2 ng / gün / hücre3, 7-16 g / L serum tutarındadır ve antikorları serum4'teki en bol üç proteinden biri haline getirir. B hücreleri kanda bol miktarda bulunur ve bu nedenle kolayca elde edilebilir ve bir bireye geri enjekte edilebilir.
Bu özellikler, B hücrelerini, B hücresi reseptörünü (BCR) gen düzenleme ve insan immün yetmezlik virüsüne (HIV) karşı geniş ölçüde nötralize edici antikorları (bNAbs) ifade etme çabalarının bir hedefi haline getirmiştir 5,6,7,8,9,10,11,12,13,14,15 ve diğer proteinler 16, 17,18,19,20,21. Bu tür yaklaşımlar, in vivo 7,8,10,11,16,22 numaralı fare çalışmalarında potansiyel göstermiştir. Bununla birlikte, klinik çeviri 9,15,23 için, aralarında terapötik etkinliğin güvenliği, süresi ve büyüklüğünün yanı sıra insan olmayan primatlar (NHP'ler) gibi daha büyük hayvanlara ölçeklendirme gibi çeşitli engellerin üstesinden gelinmelidir. Gerçekten de, NHP'ler ve özellikle antikor ve HIV araştırmalarında uzun bir geçmişe sahip olan rhesus makakları24,25, bu parametreleri test etmek için en uygun modeldir.
Burada, bu sorunların ele alınmasını sağlayan protokoller geliştirdik. Bugüne kadar, az sayıda çalışma rhesus makak B hücrelerini ex vivo olarak kültürlemeye çalışmıştır ve rhesus makak B hücrelerinin saflaştırılması için sadece CD20 kullanılarak pozitif seleksiyon bildirilmiştir26,27,28. El değmemiş rhesus makak B hücrelerinin diğer hücre tiplerinin negatif tükenmesi ile izolasyonu için bir protokol oluşturduk. Ayrıca, rhesus makak B hücrelerinin hedeflenen gen düzenlemesi için kültürleme koşulları tanımlanmıştır. Bu protokol, kültürlenmiş rhesus makak B hücrelerini gen düzenlemek için homolojiye yönelik onarım şablonu (HDRT) olarak CRISPR / Cas9 ribonükleoproteinlerin (RNP'ler) ve rekombinant adeno ilişkili virüs serotip 6'nın (rAAV6) kullanımını özetlemektedir. Bu protokol kullanılarak, büyük (~1,5 kb) kesici uçlarla %40'a varan düzenleme verimlilikleri elde edildi. Ayrıca, HDRT'lerin bu formatta hızlı bir şekilde test edilmesini sağlamak için tetrasiklin etkin, kendi kendini susturan bir adenoviral yardımcı29 kullanarak rAAV6 üretmek için hızlı ve uygun maliyetli bir yöntem sunuyoruz. Kombine olarak, bu protokoller rhesus makak B hücrelerinin gen düzenlemesi için etkili bir iş akışını tanımlar (Şekil 1), B hücresi terapilerinin bir NHP modelinde değerlendirilmesini sağlar.
Deneylere başlamak için, donör materyali ticari kaynaklardan sipariş edilebilir veya flebotomiler veya splenektomi ile elde edilebilir. Bu çalışmada, flebotomiler ve kan toplanması daha önce tarif edildiği gibi30 antikoagülan EDTA kullanılarak gerçekleştirildi. Dallak, primer rhesus makak B hücrelerini elde etmek için, parsiyel (%25-%50) veya total splenektomiler daha önce bildirilen teknikler kullanılarak gerçekleştirildi31. Hayvanlar ameliyattan önce bir gecede oruç tutuldu. Kısaca, ameliyat sırasında, karın kırpıldı ve üç kez alternatif klorheksidin ve% 70 izopropil alkol ovma ile hazırlandı. Dalağı tanımlamak ve izole etmek için karın içinde bir kesi (5-10 cm) yapıldı. Dalağın vaskülatürü dikişlerle veya vasküler kelepçelerle bağlandı. Kesi 4-0 PDS polidioksanon sütürlerle iki kat halinde kapatıldı. Splenektomi bireysel bir hayvan için tek bir kez yapıldı. Tek hücreli süspansiyonlar makak dalaklarından hücre süzgeçleri vasıtasıyla maserasyon yoluyla hazırlandı. Kan ve dalak hücre süspansiyonlarından elde edilen mononükleer hücreler, yoğunluk gradyanı santrifüjleme kullanılarak hazırlandı ve sıvı azotta depolandı.
Protokol
Tüm hayvan prosedürleri ve deneyleri, Ulusal Sağlık Enstitüleri, Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü'nün Kurumsal Hayvan Bakımı ve Kullanım Komitesi tarafından onaylanan protokollere göre gerçekleştirilmiştir. Aşağıdaki protokollerin bir özeti Şekil 1'de sunulmuştur. 2-8 yaşları arasındaki Hint genetik kökenli erkek ve dişi rhesus makakları (Macaca mulatta), biyogüvenlik seviye 2 tesisinde Laboratuvar Hayvanlarının Bakımı ve Kullanımı Komitesi'nin yönergelerine uygun olarak barındırıldı ve bakımı yapıldı.
DİKKAT: Tüm deneyler, kan yoluyla bulaşan patojenler için evrensel önlemlere uygun olarak, laminer akış davlumbazlarında steril / aseptik teknikler ve uygun biyogüvenlik seviye 2 ekipmanı ile gerçekleştirilmiştir.
1. rAAV6 üretimi
- Reaktifleri rAAV6 üretimi için hazırlayın.
- Standart teknikleri kullanarak pAAV vektöründeki AAV2'nin ters terminal tekrarları (ITR'ler) arasında homolojiye yönelik onarım şablonunu tasarlayın ve klonlayın. Homoloji kollarının her iki tarafta da en az ~ 250 bp olduğundan emin olun, ancak yapı tasarımı izin veriyorsa daha uzun homoloji kolları tercih edilmesine rağmen, 60 bp kadar az yeterli olabilir. Kullanılan sgRNA'lardan herhangi birinin hedef dizileri HDRT'de mevcutsa, hedef bölgenin protospacer bitişik motifinde veya tohum bölgesinde en etkili olan sessiz mutasyonları kullanarak bunları çıkarın.
NOT: Verimli klonlama32 için Gibson tertibatı ile kombine gen sentezi gerçekleştirilebilir. Transfeksiyon için doğru bir klonun Maxiprep'ini hazırlayın. SgRNA tasarımı için CHOPCHOP33 önerilir ve https://zlab.bio/guide-design-resources daha fazla aletin bir listesi bulunabilir. ITR'ler dahil AAV için maksimum paketleme kapasitesi ~ 4,7 kb'dir. AAV6, hematopoetik hücreleri, özellikle B hücrelerini düzenlemek için en sık kullanılan serotiptir9. Rhesus makak B hücrelerinin gen düzenlemesi için diğer AAV serotipleri test edilmemiştir, ancak fare çalışmalarında AAV28 ve AAV-DJ10,11 kullanılmıştır. - 293AAV kültür ortamını ve üretim ortamını Tablo 1 ve Tablo 2'ye göre hazırlayın. 0,2 μm polietersülfon (PES) membran filtre ünitesi ile steril filtre. 4 °C'de saklayın.
- 1x polietilenimin (PEI) çözeltisi hazırlayın (1 mg / mL, 100 mL).
- 250 mL'lik bir cam beherde, ~ 30 s boyunca bir mikrodalgada ~ 70 mLH2O ısıtın ve ardından 100 mg PEI ekleyin. Manyetik bir karıştırıcı ekleyin ve PEI çoğunlukla çözülene kadar karıştırın.
- 1 M HCl ile pH'ı 7'ye ayarlayın, ardındanH2O ile 100 mL'ye kadar doldurun, 10 dakika bekleyin, pH'ı tekrar kontrol edin ve gerekirse ayarlayın.
- PEI çözeltisini 0,2 μm PES membran filtre ünitesi, aliquot ile steril filtreleyin ve -20 °C depolayın. Çözüldükten sonra, çözelti 2 aya kadar 4 ° C'de saklanabilir.
- 5x polietilen glikol (PEG) / NaCl çözeltisi hazırlayın.
- 400 g PEG 8.000 ve 24 g NaCl ağırlığındadır.
- 2 L'lik bir cam behere manyetik bir karıştırıcı ekleyin, tartılmış PEG 8.000 ve NaCl'yi ekleyin ve ~ 550 mL deiyonize su ile durulayın.
- Isıtma ile karıştırın ve tamamen eriyene kadar kaynatın veya 80-90 ° C'ye getirin.
- 1 M NaOH ile pH'ı ~7,4'e ayarlayın, ardından bir ölçüm silindiri kullanarak ses seviyesini 1 L'ye ayarlayın ve manyetik karıştırıcı ile 2 L'lik bir cam şişeye aktarın.
- Şişeyi, manyetik karıştırıcıyı ve çözeltiyi 121 ° C'de 30 dakika boyunca bir su banyosunda otoklavlayın.
- Otoklavlamadan sonra, farklı fazlara ayrılmayı önlemek için manyetik karıştırıcıyı kullanarak karıştırırken çözeltiyi soğuk bir odada soğutun. Gerekirse Aliquot ve 4 ° C'de saklayın.
- Formülasyon tamponunu hazırlayın.
- 500 mL DPBS'yi 50 μL %10 Pluronic F-68 ile karıştırın. 0,2 μm PES membran filtre ünitesi ile steril filtre uygulayın ve oda sıcaklığında (RT) saklayın.
- Standart teknikleri kullanarak pAAV vektöründeki AAV2'nin ters terminal tekrarları (ITR'ler) arasında homolojiye yönelik onarım şablonunu tasarlayın ve klonlayın. Homoloji kollarının her iki tarafta da en az ~ 250 bp olduğundan emin olun, ancak yapı tasarımı izin veriyorsa daha uzun homoloji kolları tercih edilmesine rağmen, 60 bp kadar az yeterli olabilir. Kullanılan sgRNA'lardan herhangi birinin hedef dizileri HDRT'de mevcutsa, hedef bölgenin protospacer bitişik motifinde veya tohum bölgesinde en etkili olan sessiz mutasyonları kullanarak bunları çıkarın.
- Hücre kültürü, transfeksiyon ve rAAV6 üretimi için transdüksiyon
- Çözme, kültür ve dondurma 293AAV hücreleri, yukarıdaki 293AAV kültür ortamını ve bölme için Tripsin-EDTA'yı kullanarak üretici tarafından tarif edildiği gibi. Bazı erken pasajların dondurulması ve hücrelerin 40. pasaja ulaşmadan önce AAV üretimi için kullanılması önerilir.
- rAAV6 üretimi için, her biri 30 mL'de 5 x 106 hücreli dört adet 15 cm'lik hücre kültürü kabı tohumlayın. Hücreler genellikle tohumlamadan 1-2 gün sonra% 80-90 birleşmeye ulaştıklarında transfeksiyona hazırdır.
- AAV6'ya paketlenmek üzere HDRT içeren bir pAAV plazmidinin Maxiprep'ini çözün. 85.6 μg pAAV plazmidini 3 mL saf DMEM ortamında yeniden askıya alın.
- 342 μL 1 mg/mL PEI çözeltisini 3 mL saf DMEM ortamında çözün. Her iki çözeltiyi de RT'de 10 dakika boyunca inkübe edin.
- Her iki 3 mL tüpü ~ 6.4 mL transfeksiyon karışımından oluşan bir tüpe karıştırın ve RT'de 20 dakika boyunca inkübe edin.
- Bu arada, tetrasiklin etkin, kendiliğinden susturulan yardımcı vektör RepCap6'yı 37 ° C'lik bir su banyosunda -80 ° C'lik dondurucudan çözün. 293AAV hücrelerini dönüştürmek için, medyan doku kültürü enfeksiyöz dozunu (TCID 50) kullanarak ve 1.15 x 107 hücre / çanak varsayarak 25'in çok sayıda enfeksiyonuna (MOI) yardımcı vektörü ekleyin; tipik olarak, 15 cm'lik çanak başına 2-10 μL kullanılır. Bulaşıkları dağıtmak için hafifçe sallayın ve döndürün.
- Transfeksiyon karışımının inkübasyonundan sonra, dört 15 cm'lik kabın her birine damla damla 1.6 mL ekleyin. Gece boyunca 37 °C ve %5 CO2'de inkübe edin.
NOT: Alternatif olarak, ilgilenilen rAAV6 vektörleri zaten mevcutsa, bu vektörler paketlenecek viral genomu sağlamak için kullanılabilir, bu da bu sistemle herhangi bir plazmid ihtiyacını ortadan kaldırır ve karşılaştırılabilir rAAV6 titreleri verir. Bu yaklaşım için, 293AAV hücreleri, yardımcı vektörle birlikte 50'lik bir MOI'de (rAAV6 genom kopyalarına [GC] / mL'ye dayanarak) istenen rAAV6 ile birlikte dönüştürülür. - Ertesi gün, kültür ortamını dikkatlice aspire edin ve atın ve 30 mL önceden ısıtılmış üretim ortamı ile değiştirin. Hasattan önce 96 saat daha kuluçkaya yatırın. Verimi en üst düzeye çıkarmak için başka bir ortam değişikliği önerilmez.
- Rekombinant AAV6'nın ortamdan toplanması ve saflaştırılması
- Hücreleri çanaktan çıkarmadan, tüm hücre süpernatantını, filtrelenecek ortamın hacminden en az% 50 daha büyük 0.2 μm PES membranına sahip bir filtre ünitesinde toplayın. Ardından, süpernatanı filtreleyin.
NOT: Daha yüksek rAAV6 verimi isteniyorsa, hücreler toplanabilir ve rAAV, ticari kitler veya belirlenmiş protokoller34,35 kullanılarak hücre peletinden çıkarılabilir. AAV6 çoğunlukla36 ortamına salgılandığından, sadece süpernatant kullanıldı ve işçilik, maliyet ve zaman azaltıldı. - Toplanan hacmin% 25'inde filtrelenmiş süpernatanta 5x PEG / NaCl çözeltisi ekleyin; 30 mL'lik dört adet 15 cm'lik tabak kullanılıyorsa bu tipik olarak 30 mL'dir.
- Ters çevirerek iyice karıştırın ve daha sonra viral parçacıkları çökeltmek için gece boyunca 4 ° C'de inkübe edin.
NOT: AAV partikülleri bu çözeltide 2 güne kadar stabildir. - 250 mL boru uçlu bir salıncak kovası santrifüjünü 4 °C'ye kadar önceden soğutun. RT'de en az 1 saat boyunca her bir membranı 2 mL% 10 Pluronic F-68 ile ön işlemden geçirerek 100 kDa kesim ve 0,22 μm hidrofilik PES şırınga filtresine sahip 4 mL'lik bir santrifüj filtre ünitesi hazırlayın.
- AAV-PEG / NaCl karışımını 250 mL'lik bir tüpe aktarın, 4 ° C'de 1 saat boyunca 2.500 x g'de santrifüj yapın ve ardından tüm süpernatantı aspirasyonla dikkatlice çıkarın.
- Tamamen yeniden askıya alınana kadar 4 mL 1 M HEPES'te vorteks yaparak bejden beyaz viral pelete yeniden askıya alın. Gerekirse, 5 dakika bekletin ve tekrar girdap yapın. 5 mL'lik bir serolojik pipet kullanarak yeniden askıya alın ve toplam hacmi 15 mL'lik bir tüpe aktarın.
- Bir duman davlumbazında, virüs süspansiyonuna eşit miktarda kloroform ekleyin - tipik olarak 4 mL.
- 2 dakika boyunca kuvvetli bir şekilde vorteks yapın ve daha sonra RT'de 5 dakika boyunca 1.000 x g'de santrifüj.
- Üst tabakayı (AAV içeren süpernatan) yeni bir 50 mL tüpte toplayın ve alt tabakayı (kloroform) atın.
DİKKAT: Kloroform içeren çözeltiler tehlikeli atıklardır. İmhası için kurumsal yönergelere uyun. - AAV içeren süpernatantı bir duman davlumbazının altına yerleştirin ve kalan kloroformun 30 dakika boyunca buharlaşmasına izin verin.
- Bu arada, önceden işlenmiş santrifüj filtre ünitesini ve şırınga filtresini yıkayın.
- Ön işlemden geçirilmiş santrifüj filtre ünitesine 1,5 mL formülasyon tamponu ekleyin. Sallanan kova rotorunda 15 °C'de 10 dakika boyunca 3.500 x g'de santrifüj. Membranı yıkamak için bu adımı 4 mL formülasyon tamponu ile tekrarlayın.
- Şırınga filtresini 5 mL'lik bir şırınga kullanarak 5 mL formülasyon tamponu ile iki kez durulayın.
- Kloroform ekstraksiyonundan ~ 4 mL AAV içeren süpernatantı 5 mL'lik bir şırıngaya yükleyin, yıkanmış şırınga filtresini takın ve doğrudan santrifüj filtre ünitesine filtreleyin.
- 15 °C'de 25 dakika boyunca 3.500 x g'de santrifüj yapın ve ardından filtredeki AAV çözeltisinin 50-100 μL arasında olduğunu doğrulayın. Çözeltinin hacmi >100 μL ise, santrifüj yapmaya devam edin.
- Filtreyi çıkardıktan sonra, santrifüjlü filtre ünitesinin kabının içine 4 mL formülasyon tamponu ekleyin ve çözeltiyi pipetleme ile eşit şekilde karıştırın. 15 °C'de 25 dakika boyunca 3.500 x g'de santrifüj yapın ve ardından filtredeki AAV çözeltisinin 50-100 μL arasında olduğunu onaylayın. Çözeltinin hacmi >100 μL ise, santrifüj yapmaya devam edin. Başka bir yıkama için bu adımı tekrarlayın.
- Son santrifüjlemeden sonra, çözeltinin hacminin 50-70 μL olduğunu onaylayın; değilse, santrifüj yapmaya devam edin. Preparatı 1,5 mL'lik bir tüpe aktarın. İstenirse Aliquot ve -80 ° C'de saklayın.
- Hücreleri çanaktan çıkarmadan, tüm hücre süpernatantını, filtrelenecek ortamın hacminden en az% 50 daha büyük 0.2 μm PES membranına sahip bir filtre ünitesinde toplayın. Ardından, süpernatanı filtreleyin.
- qPCR ile rekombinant AAV6 titre tayini
NOT: qPCR primerleri ITR bölgesinde tavlanır ve bu nedenle pAAV'ye klonlanan tüm yapılar için uygun olmalıdır.- Titre edilecek rAAV6'nın bir alikotunu ve AAV6 referans malzemesinin bir alikotunu çözün. AAV6 referans materyali 4 x 1011 GC/mL'ye yakın olmalıdır; Aksi takdirde, seyreltmeleri buna göre ayarlayın.
- Numunenin 2.0 μL'sini veya AAV6 referans materyalini 15.6 μL nükleaz içermeyenH2O, 2.0 μL 10x DNaz I tamponu ve 0.4 μL DNaz I tamponu ile birleştirerek rAAV6 preparatında kalan serbest plazmid DNA'sını çıkarmak için bir DNaz I sindirimi gerçekleştirin.
- Yavaşça karıştırın ve 37 ° C'de 30 dakika boyunca inkübe edin ve ardından buza aktarın. Bu seyreltme 1'dir (bkz. Tablo 3).
- Tüm numunelerin ve AAV6 referans materyalinin beş kat seri seyreltisini aşağıdaki Tablo 3'te olduğu gibi su ile hazırlayın.
- Bir SYBR Green qPCR master mix hazırlayın. Kuyu başına, 4,7 μL nükleaz içermeyen suyu, 10 μL SYBR Green ana karışımı, 100 μM'de 0,15 μL ITR astarı ileri ve 100 μM'de 0,15 μL ITR astarı ters yönde karıştırın.
NOT: Her numune, referans standardı için 16 kuyucuk, numune başına 8 kuyucuk ve şablonsuz kontrol için 2 kuyucuk ile çift olarak ölçülür. Pipetleme hatasını hesaba katmak için %10 daha fazla ana karışım hazırlayın. - Optik 96 delikli veya 384 delikli bir reaksiyon plakasında, SYBR Green qPCR ana karışımının 15 μL/kuyusunu yükleyin.
- Ardından, şablonsuz kontrol için 5 μL numune ve AAV6 referans malzemesi veya nükleaz içermeyen su yükleyin. AAV6 referans standardı için, yük seyreltme 2 ila seyreltme 9. Numuneler için, seyreltme 5'i seyreltme 8'e kadar yükleyin. Her seyreltmeyi çift olarak ölçün. Kabarcıklardan kaçının.
- Yüklü plakayı optik şeffaf filmle kapatın, RT'de 1 dakika boyunca 800 x g'de santrifüj yapın ve plakayı uygun 96 delikli veya 384 delikli kurulumla qPCR cihazına yükleyin.
- Aşağıdaki çevrim koşullarında SYBR algılamasını kullanarak qPCR cihazını kurun ve çalıştırın: 3 dakika boyunca 98 °C, daha sonra 15 s için 98 °C'lik 40 döngü ve 30 sn için 58 °C, ardından bir erime eğrisi.
- Standart eğri olarak milimetre başına genom kopyalarındaki (GC/mL) AAV6 referans materyalinin konsantrasyonunu kullanarak verileri cihazın yazılımıyla analiz edin (bkz. Tablo 3). Seyreltme faktörü ile çarparak numunenin nihai konsantrasyonunu hesaplayın.
- Standart eğri R2'nin 1.0'a yakın olduğundan, PCR verimliliğinin% 90 -% 110 olduğundan, taban çizgisinin kaldırıldığından, erime eğrisinin tek bir tepe noktası gösterdiğinden, C t değerlerinin seyreltmelere göre değiştiğinden ve kopyaların 0.5 Ct içinde olduğundan emin olun; aksi takdirde, aykırı değerleri hariç tutun. Şekil 2'deki gibi verim bekleyin.
2. B hücre ortamı ve uyaranlarının hazırlanması
- Çözme ortamını hazırlayın: RPMI-1640'ı %20 FCS ile birleştirin. 0,2 μm PES membran filtre ünitesi ile steril filtre. 4 °C'de saklayın.
- B hücre kültürü ortamını hazırlayın: Reaktifleri Tablo 4'te birleştirin ve ardından 0,2 μm PES membran filtre ünitesi ile steril filtreleyin. 4 °C'de saklayın.
- Tablo 5'teki B hücresi uyarıcılarının her birini, nükleaz içermeyen suda yeniden askıya alınması gereken CpG ODN hariç, B hücre kültürü ortamındaki stok konsantrasyonlarında yeniden askıya alın. −80 °C'de saklayın.
- B hücresi olmayan negatif tükenme gerçekleştiriyorsanız (isteğe bağlı adım 4), DPBS'yi (kalsiyum yok, magnezyum yok) %2 FCS (DPBS, %2 FCS) ile hazırlayın. 0,2 μm PES membran filtre ünitesi ile steril filtre. 4 °C'de saklayın.
3. Rhesus makak B hücrelerinin hazırlanması ve kültürü
NOT: Kriyokorunmuş rhesus makak PBMC'ler veya splenositler hücre kültürünü oluşturmak için kullanılır30,31.
- 37 ° C'lik bir su banyosunda önceden ısıtılmış çözme ortamı ve B hücre kültürü ortamı. B hücresi uyarıcılarını Tablo 5'teki buz üzerinde çözün.
- Önceden ısıtılmış çözme ortamı içeren uygun boyutta bir tüp hazırlayın. Bu ideal olarak çözülmüş hücrelerin hacminin 10 katından fazla olmalıdır.
- 37 ° C'lik bir su banyosunda bir seferde bir ila iki PBMC veya splenosit kriyoviyal çözün ve önceden ısıtılmış ortamla hazırlanan tüpe boşaltın. Tüm hücreleri toplamak için kriyotüpleri durulayın.
- RT'de 10 dakika boyunca hücreleri 200 x g'de santrifüj edin.
NOT: Bu santrifüjleme ayarları, PBMC verimini korurken trombosit kontaminasyonunu azaltır. 5 dakika boyunca 350 x g gibi daha yüksek hızlar kullanılabilir. - Hücreleri yıkama için 10 mL çözme ortamında tekrar askıya alın.
- Donma ortamını kaldırmak için toplam üç santrifüjleme için adım 3.4 ve adım 3.5'i tekrarlayın. Son santrifüjlemeden sonra, B hücre kültürü ortamında hücreleri tahmini ~ 5 x 106 hücre / mL'de yeniden askıya alın.
NOT: Yukarıdaki protokol, diğer hücreler tarafından kontaminasyona sahip tüm PBMC veya splenosit preparatlarını kültüre alır. Daha saf B hücre kültürleri gerekiyorsa, toplam B hücre veriminde önemli ölçüde azalmış olsa da, adım 4 ile devam edin. İki yöntem arasında düzenleme verimliliklerinde herhangi bir fark gözlenmemiştir. - Sayma için B hücre kültürü ortamı ile gerektiğinde 10 μL hücreden oluşan bir alikotu seyreltin. Bir hemositometre ve tripan mavisi boyama kullanarak, eşit hacimlerde askıya alınmış hücreleri ve% 0.4 tripan mavisi çözeltisini birleştirerek sayın.
- Hücre konsantrasyonunu, hücre sayısına göre B hücre kültürü ortamı ile 3 x 106 hücre / mL'ye ayarlayın. Ardından, B hücresi uyarıcılarını Tablo 5'e göre son konsantrasyonlarına ekleyin ve karıştırın.
- Hücreleri uygun bir hücre kültürü kabına aktarın. Genel olarak, 0.6 x 10 6-0.7 x 106 hücre /cm2 önerilir. Hücreleri 37 ° C'de 48 saat ± 2 saat boyunca% 5 CO2 ile inkübe edin.
4. B olmayan hücrelerin isteğe bağlı negatif tükenmesi
NOT: Verim ve saflık, PBMC'ler arasındaki B hücrelerinin giriş yüzdesine bağlıdır ve bu da bireysel rhesus makakları27 arasında büyük ölçüde farklılık gösterebilir. 1 x 107 PBMC'den %80-95 saflık, %60 verimlilik ve 1 x 106-1,5 x 106 hücre bekleyin.
- Son yıkamadan sonra (adım 3.6), hücreleri DPBS% 2 FCS'de 1 x 108 hücre / mL'de ve insan Fc bloğu seyreltilmiş 1:200'de yeniden askıya alın. Hücre sayımları, çözülmüş hücrelerin sayısına dayanır.
- Fc reseptörlerini bloke etmek için buz üzerinde 15 dakika inkübe edin ve daha sonra biyotinile antikorları Tablo 6'ya ekleyin. Buz üzerinde 20 dakika daha kuluçkaya yatırın.
- Tüpü DPBS% 2 FCS ile doldurun ve 4 ° C'de 10 dakika boyunca 200 x g'de döndürün.
- DPBS'deki hücreleri adım 4.1'den itibaren hacmin %80'inde %2 FCS'de yeniden askıya alın (yani, 1 x 107 hücre başına 80 μL).
- Adım 4.1'den itibaren hacmin% 20'sinde hücre süspansiyonuna manyetik streptavidin boncukları ekleyin (yani, 1 x 107 hücre başına 20 μL boncuk).
- Hücreleri buz üzerinde 15 dakika boyunca inkübe edin ve ara sıra çalkalayın.
- Bu arada, 1 x 108 hücre başına, büyük bir manyetik tükenme sütunu ve bir ön ayırma filtresi ile manyetik bir ayırıcı hazırlayın. Ön ayırma filtresini ve kolonunu yerçekimi akışıyla 2 mL DPBS, %2 FCS ile durulayın ve akışı atın. 15 mL'lik bir toplama tüpü takın.
NOT: Pozitif seleksiyon sütunları veya diğer manyetik boncuk arıtma sistemleri gibi diğer sütunların kullanılması, saflığı önemli ölçüde azaltabilir. - İnkübasyondan sonra, hacim <0.5 mL ise, hücreleri DPBS% 2 FCS ile 0.5 mL'ye doldurun. Hacim ≥0,5 mL ise, devam etmeniz yeterlidir.
- Hücre süspansiyonunu hazırlanan kolon üzerindeki ön ayırma filtresine yükleyin ve akışı 15 mL tüpe toplayın.
- Ön ayırma filtresine 1 mL DPBS, %2 FCS ekleyerek bağlanmamış zenginleştirilmiş B hücrelerini iki kez temizleyin. Bağlanmamış hücreleri yerçekimi akışı ile aynı tüpe toplayın.
NOT: Ek elüsyon, verimi marjinal olarak artırabilir. Saflık ve verimlilik, giriş hücrelerinin, zenginleştirilmiş hücrelerin ve kolon üzerinde tutulan hücrelerin akış sitometrisi ile değerlendirilebilir. Kolon üzerinde tutulan hücreleri elde etmek için, sütunu mıknatıstan çıkarın ve sağlanan pistonu kullanarak 3 mL DPBS% 2 FCS ile yıkayın. İstenirse, Tablo 7'deki reaktifleri kullanarak saflığı Şekil 3'teki gibi akış sitometrisi ile değerlendirin. - Zenginleştirilmiş B hücrelerini 200 x g'de 4 °C'de 10 dakika boyunca santrifüj edin.
- B hücre kültürü ortamında hücreleri tahmini ~ 5 x 106 hücre / mL'de yeniden askıya alın ve adım 3.7'de devam edin.
5. Primer rhesus makak B hücre gen düzenleme
- Rhesus makak B hücrelerini 48 saat ± 2 saat boyunca aktive ettikten sonra, reaktifleri elektroporasyon ve transdüksiyon için hazırlayın.
- DMSO'yu önceden ısıtın, nükleaz içermeyen dubleks tampon, tampon T ve tampon E (10 μL elektroporasyon kiti) veya E2 (100 μL elektroporasyon kiti) elektroporasyon kitinden RT'ye.
- Tablo 5'teki rAAV6 HDRT ve B hücre uyarıcılarını buz üzerinde çözün.
- CRISPR-Cas9 sgRNA'larını dubleks tamponda 100 μM'de yeniden askıya alın. RT'de 10 dakika boyunca yeniden oluşturun ve vorteks ve titreşimle karıştırın. Yeniden yapılandırılmış sgRNA'ları kullanana kadar buz üzerinde tutun. −80 °C'de saklayın.
NOT: CRISPR-Cas9 sgRNA'lar çeşitli çevrimiçi araçlarla tasarlanabilir (bkz. 1.1.1) ve kesme verimliliklerinde büyük farklılıklar gösterebilir. Kesme verimliliğinin ampirik testi, TIDE37 veya ICE38 gibi testler kullanılarak önerilir. - 10 μL elektroporasyon başına, Tablo 5'teki tüm uyarıcılarla birlikte 550 μL B hücre kültürü ortamı hazırlayın ve% 1 DMSO ekleyin. 100 μL elektroporasyonlar için hacimleri 10 kat ölçeklendirin. İsteğe bağlı olarak, bu ortamın% 10'u antibiyotik-antimikotik olmadan hazırlanabilir, bu da transfeksiyondan sonra hücre canlılığını biraz arttırır.
- 10 μL elektroporasyon başına, 50 μL B hücre kültürü ortamı ile uyarıcılarla ve kullanıyorsanız antibiyotik-antimikotik içermeyen 48 delikli bir hücre kültürü plakası kuyucuğu hazırlayın. 100 μL elektroporasyonlar için, 6 delikli bir plakanın kuyucuklarına 500 μL pipet yapın.
- Kuyulardaki ortama, kuyudaki hacmin% 20'sine kadar rAAV6 HDRT ekleyin. Transfeksiyon başına hücre sayısına (10 μL elektroporasyon: 5 x 10 5 hücre; 100 μL elektroporasyon: 5 x 10 6 hücre) ve rAAV6 preparatındaki GC'yebağlı olarak 1 x 105-1 x 106 arasında değişen MOI'leri hedefleyin. Düşük hacimli yüksek MOI'ler elde etmek için 5 x 1013 GC/mL ila 5 x 1014 GC/mL arasında yüksek rAAV6 stok konsantrasyonları önerilir.
NOT: Düşük MOI'ler düzenleme verimliliğinin düşmesine neden olabilir ve 5 x 105'lik MOI'ler genellikle gördüğümüz maksimum düzenleme verimliliğine yakındır. Değişen MOI'lerin B hücresi canlılığı üzerindeki etkisi gözlenmemiştir. rAAV6 HDRT içermeyen, RNP transfeksiyonu olmayan ve her ikisi de olmayan kontrollerin dahil edilmesi önerilir. - Hazırlanan yemekleri ve kalan ortamı% 5 CO2 ile 37 ° C'de bir inkübatöre aktararak önceden ısıtın.
- 10 μL elektroporasyon başına 1,15 μL ribonükleoprotein (RNP) hazırlayın: Dubleks tamponda 0,75 μL 100 μM sgRNA ile 0,4 μL 61 μM Cas9'u karıştırın. Pipetleme hatası nedeniyle ve elektroporasyon uçlarını yüklerken kabarcıkları önlemek için ekstra hazırlık yapın (tek bir elektroporasyon için %30 daha fazla tavsiye edilir). 100 μL uçlar için 10 kat ölçeklendirin.
- Hücrelerle karıştırmadan önce RNP'yi RT'de en az 15 dakika inkübe edin. İnkübasyondan sonra, aynı anda birden fazla lokus hedeflenecekse birden fazla RNP birleştirilebilir. Aynı anda üç lokusa kadar verimlilikte önemli bir fark gözlenmemiştir.
- Bu arada, hücreleri elektroporasyon için hazırlayın. Sıcaklık şoklarını önlemek için hücreleri her zaman RT'de tutun. Hücreleri 48 saat ± 2 saat kültürden sonra uygun bir kaba toplayın. Maksimum hücre sayısını toplamak için bulaşıkları DPBS ile durulayın.
- RT'de 10 dakika boyunca hücreleri 200 x g'de santrifüj edin. süpernatanı atın ve DPBS'deki hücreleri ~ 2 x 106 hücre / mL'de yeniden askıya alın.
- 10 μL tripan mavisi% 0.4 çözeltisini 10 μL hücre süspansiyonu ile birleştirin ve bir hemositometre kullanarak sayın.
NOT: Bu noktada, hasat ve yıkama sırasındaki kayıp nedeniyle, 48 saat ± 2 saat önce kültüre konan hücrelerin yaklaşık% 60'ını bekleyin. - Bu arada, hücreleri RT'de 10 dakika boyunca 200 x g'de santrifüj edin. Yukarıdaki hücre sayısına bağlı olarak önceden ısıtılmış (RT) tampon T'deki hücreleri 5,55 x 107 hücre/mL'de yeniden askıya alın.
- Makineyi açıp 1.350 V, 15 ms ve 1 darbeye ayarlayarak transfeksiyon sistemini kurun. Pipet istasyonunu laminer akış davlumbazının içine yerleştirin
- Her 10 elektroporasyon seti için, 3 mL tampon E (10 μL transfeksiyon için) veya E2 (100 μL transfeksiyon için) içeren bir transfeksiyon tüpü hazırlayın. Tüpü pipet istasyonuna yerleştirin.
- 10 μL elektroporasyon başına, 1.15 μL RNP'yi 9 μL hücre ile birleştirin. Elektroporasyon ucuna hava girmesini önlemek için yeterli hacme (+ %30) sahip olduğunuzdan emin olun. Elektroporasyondan önce RT'de 1-2 dakika inkübe edin.
- 10 μL veya 100 μL RNP ve hücre karışımını bir elektroporasyon pipeti üzerindeki uygun boyuttaki elektroporasyon ucuna aspire edin, yüklü pipeti pipet istasyonuna yerleştirin ve elektroporasyonu başlatın. Arklanmayı önlemek için uçların tamamen hava kabarcıklarından arındırılmış olduğundan emin olun. Arklanmanın oluşmadığını doğrulamak için elektroporasyon sırasında izleyin.
- Elektropora hücreleri derhal 48 delikli (10 μL transfeksiyonlar) veya 6 delikli plaka (100 μL transfeksiyonlar) içinde rAAV6 ile veya rAAV6 olmadan hazırlanmış, önceden ısıtılmış, küçük hacimli ortama çıkarın. 5.15-5.17 arasındaki adımları kalan örneklerle yineleyin. Kültür kuyularına transfeksiyon olmadan kontrol numuneleri ekleyin.
- Hücreleri 37 ° C'de 4 saat ± 2 saat boyunca% 5 CO2 ile inkübe edin ve ardından uyarıcılar, DMSO ve antibiyotik / antimikotik içeren hazırlanmış, önceden ısıtılmış B hücre kültürü ortamını ekleyin: 10 μL transfeksiyonlar için 450 μL veya 100 μL transfeksiyonlar için 4.5 mL.
- Kuluçka işlemine 37 ° C'de 12-24 saat boyunca% 5 CO2 ile devam edin. Daha sonra, genişletilmiş kültürleme isteniyorsa, ortamı uyarıcılar ve DMSO içermeyen antibiyotik / antimikotik içeren B hücre kültürü ortamına değiştirin. Genomik DNA'nın analizi 24 saat sonra yapılabilir. Homoloji kolunun dışında bir astar ve kesici ucun içinde bir astar kullanan dijital damlacık PCR, düzenleme verimliliğini ölçmek için kullanılabilir39. Ekleme bölgesini yükseltmek için PCR'ler ve doğru düzenlemeyi doğrulamak için Sanger dizilimini gerçekleştirin.
- Protein seviyelerinin analizi için, protein ekspresyonu değişikliklerine izin vermek için elektroporasyondan sonra hücreleri 40-48 saat boyunca kültürleyin ve Tablo 7'deki reaktifleri kullanarak akış sitometrisi ile bir analiz yapın.
Sonuçlar
Tetrasiklin etkin, kendi kendini susturan adenoviral yardımcının kullanımı ile rAAV6 üretimi, ortalama 4 x 10 10 GC / mL hücre kültürü ortamının üretilmesiyle sonuçlandı, böylece standart, yardımcı içermeyen üçlü transfeksiyon kullanılarak üretimden 30-40 kat daha iyi performans gösterdi (Şekil 2).
Rhesus makak B hücrelerinin isteğe bağlı saflaştırılması, CD3 + T hücrelerinin ve CD14 + ve / veya CD16 + miyeloid hücrelerin büyük çoğunluğunun elimine edilmesiyle sonuçlandı ve% 80 -% 95 CD20 + B hücrelerinin saflıkları rutin olarak elde edildi (Şekil 3). Murin B hücreleri7'deki önceki tasarımlarımıza dayanarak, rhesus makak B hücrelerinin B hücresi reseptör özgüllüğünü düzenlerken, aynı zamanda endojen antikor hafif zincirlerini sabit bölgelerinin bozulmasıyla silerek B hücrelerinin büyük çoğunluğunda allelik dışlamayı korumak için bir yöntem geliştirdik. Son IGHJ geni ile rhesus makak B hücrelerinin Eμ arttırıcısı arasındaki IGH lokusuna yerleştirilecek promotörsüz bir HDRT oluşturduk (Şekil 4). Bu yapı, olgun B hücrelerinde doğal olarak yeniden düzenlenmiş yukarı akış VDJ bölgesinin endojen VH promotörünü kullanır ve bu nedenle epizomal AAV genomları tarafından ifade edilmez. Dahası, bu yapı, hücre yüzeyinde eksprese edilmek üzere aşağı akış antikoru ağır zincir sabit bölgelerine eklenmesini gerektirir. Bu nedenle, akış sitometrisi ile gösterilen hücre yüzeyindeki spesifik antijen bağlanması, doğru hedef lokus entegrasyonunu ve yerleştirilen dizinin işlevsel olduğunu gösterir.
Rhesus makak türevi bir anti-HIV bNAb40 olan Ab1485 antikoru kodlayan böyle bir yapıyı rAAV6'ya paketledik ve yukarıda tarif edildiği gibi aktive edilmiş primer rhesus makak splenosit veya PBMC kültürlerini düzenlemek için kullandık (Şekil 5A). Protokol, yüksek hücre canlılığını (~% 90) korurken, aynı zamanda B hücrelerinin ~% 80'indeki hafif zincir ekspresyonunu da siler. B hücrelerinin çoğunluğu hala IgM izotipini ifade ediyordu (Şekil 5B). Ab1485 HDRT'yi kodlayan rAAV6'nın eklenmesi, B hücrelerinin %16-21'inde (Şekil 5A), antikor zincirleri için düzenlenmemiş B hücrelerine göre daha düşük floresan yoğunluğunda olmasına rağmen, gen düzenleme ve Ab1485 yüzey ekspresyonu ile sonuçlandı (Şekil 5A, sağ panel, Şekil 5C). Bu, antijen boyası ile akış sitometrisinde yüzey BCR'sini tespit etmek için kullanılan monoklonaller arasındaki epitop rekabetinin yanı sıra, HDRT'nin polisistronik doğası ve daha az verimli ekleme nedeniyle gerçek azaltılmış protein ekspresyonunun bir sonucu olabilir. %1 DMSO ilavesi ve rAAV6 HDRT ile genişletilmiş, konsantre inkübasyonlar genellikle düzenleme verimliliğini arttırmıştır (Şekil 6A-C). Bu özel yöntem kullanılarak, tipik olarak% 5 -% 20 ve% 40'a kadar, düzenleme verimliliği, bireysel rhesus makakına (Şekil 5A, Şekil 6A-E) ve rAAV6 HDRT partisinin kalitesine (Şekil 6E) bağlı olarak elde edilir. Genel olarak, verimli rAAV6 üretiminin yanı sıra rhesus makak B hücrelerinin kültürlenmesi, saflaştırılması ve gen düzenlenmesi için protokoller sunuyoruz.
| Reaktif | Hacim | Stok | Son konsantrasyon |
| DMEM, Yüksek Glikoz | 500 mL | 1 x | ~ 88.5% |
| FCS, ısı ile inaktive edilmiş | 50 mL | 1 x | ~ 8.85% |
| Antibiyotik/Antimikotik | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodyum Piruvat | 5 mL | 100 mM | 1 mM |
Tablo 1: 293AAV hücre kültürü ortamı.
| Reaktif | Hacim | Stok | Son konsantrasyon |
| DMEM, Yüksek Glikoz | 500 mL | 1 x | ~ 95.2% |
| FCS, ısı ile inaktive edilmiş | 10 mL | 1 x | ~ %1.9 |
| Antibiyotik/Antimikotik | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodyum Piruvat | 5 mL | 100 mM | 1 mM |
Tablo 2: 293AAV hücre üretim ortamı.
| Seyreltme Serisi | Numune hacmi (μL) | Seyreltici ve hacim | Seyreltme faktörü | Toplam seyreltme | Referans AAV6 |
| GC/mL | |||||
| Seyreltme 1 | 4,1 x 1011 GC/mL'de 2 μL numune veya AAV referans standardı | 18 μL DNAseI tamponu ve enzimi | 10 x | 10 x | 4.1 x 1010 |
| Seyreltme 2 | 15 μL Dil. 1 | 60 μL Y2O | 5 x | 50 x | 8.2 x 109 |
| Seyreltme 3 | 20 μL Dil. 2 | 80 μL Y2O | 5 x | 250 x | 1,6 x 109 |
| Seyreltme 4 | 20 μL Dil. 3 | 80 μL Y2O | 5 x | 1250 x | 3,3 x 108 |
| Seyreltme 5 | 20 μL Dil. 4 | 80 μL Y2O | 5 x | 6250x | 6.6 x 107 |
| Seyreltme 6 | 20 μL Dil. 5 | 80 μL Y2O | 5 x | 31250 x | 1.3 x 107 |
| Seyreltme 7 | 20 μL Dil. 6 | 80 μL Y2O | 5 x | 156250 x | 2,6 x 106 |
| Seyreltme 8 | 20 μL Dil. 6 | 80 μL Y2O | 5 x | 781250 x | 5,24 x 105 |
| Seyreltme 9 | 20 μL Dil. 7 | 80 μL Y2O | 5 x | 3906250 x | 1,05 x 105 |
Tablo 3: qPCR seyreltme tablosu.
| Reaktif | Hacim | Stok | Son konsantrasyon |
| RPMI-1640 Devir Sayısı | 420 mL | 1 x | 84% |
| FCS, ısı ile inaktive edilmiş | 50 mL | 1 x | 10% |
| Antibiyotik/Antimikotik | 5 mL | 100 x | 1 x |
| Glutamine | 5 mL | 200 mM | 2 mM |
| Sodyum Piruvat | 5 mL | 100 mM | 1 mM |
| HEPES | 5 mL | 1 milyon | 10 mM |
| 2-B-merkapto-etanol | 550 μL | 55 mM | 55 μM |
| Esansiyel olmayan amino asitler | 5 mL | 100 x | 1 x |
| İnsülin-Transferin-Selenyum | 5 mL | 100 x | 1 x |
Tablo 4: B hücre kültürü ortamı.
| Reaktif | Seyreltme | Stok | Son konsantrasyon |
| MegaCD40L | 1:1000 | 100 μg/mL | 100 ng/mL |
| CpG ODN | 1:300 | 1 mg/mL | 3,33 μg/mL |
| İnsan BAFF | 1:1000 | 40 μg/mL | 40 ng/mL |
| İnsan IL-2 | 1:1000 | 50 μg/mL | 50 ng/mL |
| İnsan IL-10 | 1:1000 | 50 μg/mL | 50 ng/mL |
Tablo 5: B hücre uyarıcıları.
| Antikor | Klon | Seyreltme | Son Conc. |
| insan karşıtı CD3 | FN-18 | 1:40 | 2,5 μg/mL |
| insan karşıtı CD8a | RPA-T8 | 1:200 | 2,5 μg/mL |
| insan karşıtı CD14 | M5E2 | 1:200 | 2,5 μg/mL |
| insan karşıtı CD16 | 3G8 | 1:200 | 2,5 μg/mL |
| insan karşıtı CD33 | AC104.3E3 | 1:50 | 1 test |
| insan karşıtı CD64 | 10.1 | 1:800 | 0,625 μg/mL |
| insan karşıtı CD66 | TET2 | 1:11 | 1 test |
| insan karşıtı CD89 | A59 | 1:800 | 0,625 μg/mL |
Tablo 6: B olmayan hücrelerin isteğe bağlı tükenmesi için antikorlar.
| Reaktif | Tip/klonlama | Çalışma seyreltme/konsantrasyon |
| insan karşıtı CD14 AlexaFluor647 | M5E2 | 1:50 |
| insan karşıtı CD16 AlexaFluor700 | 3G8 | 1:50 |
| insan karşıtı CD20 PECy7 | 2H7 | 1:50 |
| insan karşıtı CD3 PE | SP34-2 | 1:50 |
| Zombi-NIR | - | 1:500 |
| insan karşıtı HLA-DR BV605 | L243 | 1:200 |
| insan karşıtı Ig hafif zincirli lambda APC | MHL-38 | 1:50 |
| insan karşıtı Kappa Hafif Zincir FITC | poliklonal | 1:500 |
| insan karşıtı IgM BV421 | MHM-88 | 1:50 |
| RC1 antijeni, rastgele biyotinile edilmiş | - | 5 μg/mL |
| Streptavidin-PE | - | 1:500 |
Tablo 7: Analiz için akış sitometrik reaktifleri.
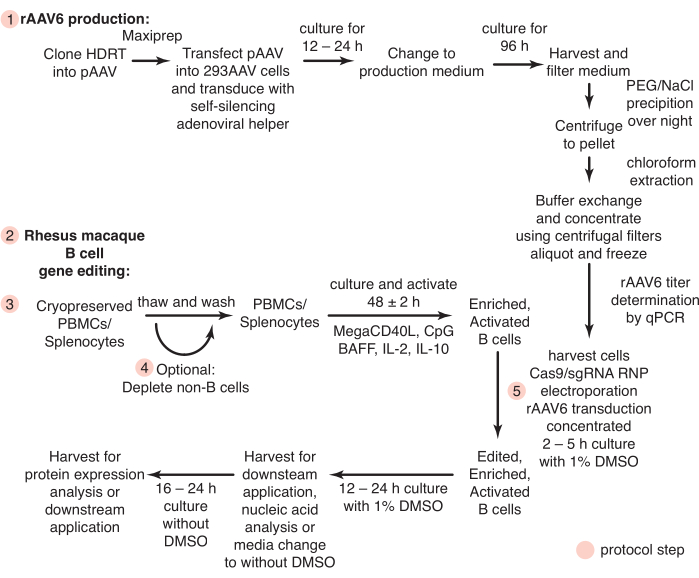
Şekil 1: rAAV6 üretimine şematik genel bakış ve primer rhesus makak B hücrelerinin gen düzenlemesi. Protokoller, B olmayan hücrelerin tükenmesi için isteğe bağlı bir adım (adım 4) dahil olmak üzere rAAV6 üretimine (adım 1) ve rhesus makak B hücrelerinin gen düzenlemesine (adım 2-5) ayrılmıştır. Protokollerdeki adımlar kırmızı dairelerle gösterilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
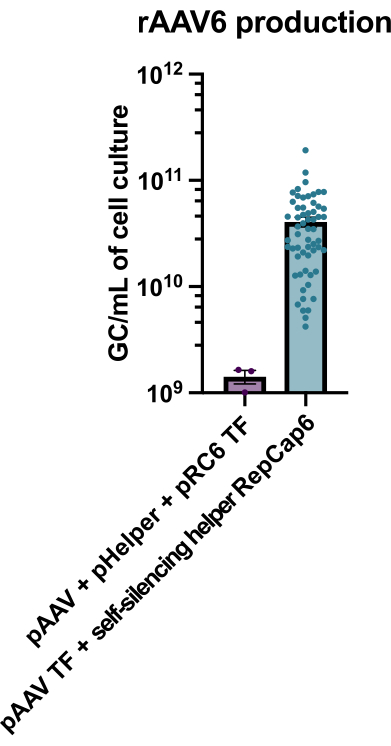
Şekil 2: Kendi kendini susturan bir adenoviral yardımcı kullanılarak yüksek rAAV6 verimleri. rAAV6, burada açıklanan yöntemler (pAAV transfeksiyonu [TF] + kendi kendini susturan yardımcı RepCap6, kendi kendini susturan adenoviral yardımcı) veya pAAV, pHelper ve pRepCap6'nın (pRC6) tipik yardımcısız üçlü transfeksiyonu kullanılarak üretilmiştir. rAAV6 sadece hücre süpernatantından saflaştırıldı. Kendiliğinden susturulan adenoviral yardımcı vektörleri kullanan yöntemler, yukarıda açıklandığı gibi, qPCR tarafından titre edilen 30-40 kat daha fazla rAAV üretti. Her nokta, 2 ila 20 bağımsız deneyden çeşitli pAAV yapılarını kullanan bireysel bir rAAV üretimini temsil eder. Ortalama ± SEM çizilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
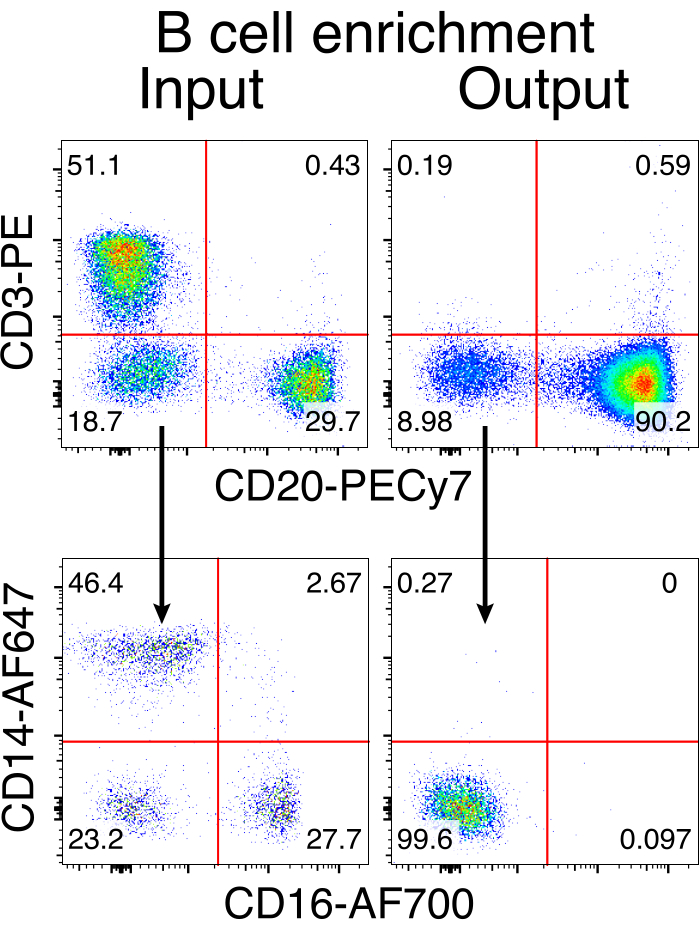
Şekil 3: B olmayan hücrelerin negatif tükenmesi ile B hücresi zenginleştirmesi. Rhesus makak B hücreleri, tarif edilen protokol kullanılarak PBMC'lerden zenginleştirildi ve% 90 saflığa kadar zenginleştirildi. Zenginleştirme öncesi giriş ve zenginleştirme sonrası çıkış gösterilir. Canlı, singlet PBMC'lerde kapılı. Beş bağımsız deneyin temsilcisi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
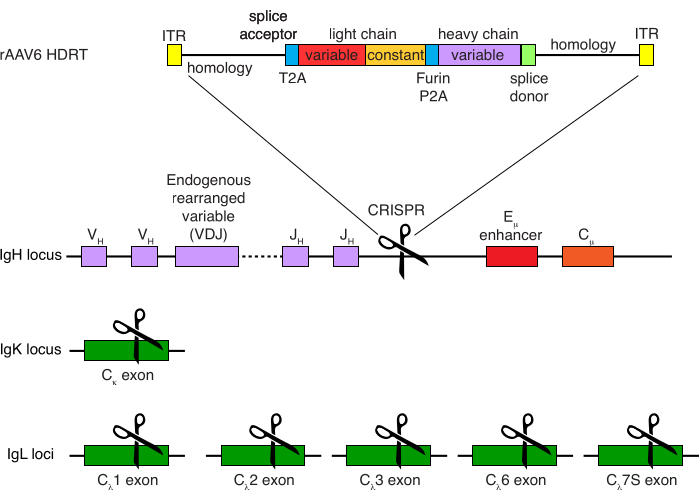
Şekil 4: Rhesus makak B hücrelerinin B hücre reseptörü özgüllüğünü düzenlemek için kullanılan hedefleme stratejisi. rAAV6, gösterilen HDRT'yi içeren üretilmiştir. HDRT, 266 bp 5' homoloji kolundan oluşur, bunu 111 bp rhesus makak IGHM ekzon 1 ekleme alıcısı, daha sonra Thosea asigna virüsü kendiliğinden yaran 2A peptid dizisi (T2A) ile bir GSG-bağlayıcı, ardından bir lider dizisi ve rhesus makak antikoru Ab1485'in rhesus makak IGLC1 olarak tam hafif zinciri izler. Bunu bir furin bölünme bölgesi, bir GSG bağlayıcı ve bir domuz teschovirus kendiliğinden yaran 2A peptid dizisi (Furin-P2A), ardından başka bir lider dizisi ve Ab1485 ağır zincir değişkeni, ardından aşağı akış antikoru ağır zincir sabit bölgelerine eklemeye izin vermek için rhesus makak IGHJ4 ekleme donör dizisinin 52 bp'si ve 514 bp homoloji kolu izler. Bu yapı, sgRNA hedef dizisi GAGATGCCAGAGCAAACCAG kullanılarak son IGHJ geni ile Eμ arttırıcı arasındaki IGH lokusuna hedeflendi. Her iki homoloji kolu da bu sgRNA'nın kesim bölgesinde bitecek şekilde tasarlandı, böylece hedef dizisi ortadan kaldırdı ve optimum entegrasyon verimliliğine izin verdi. Aynı zamanda, allelik dışlamayı ve tek bir B hücre reseptörünün ekspresyonunu korumak için, hedef dizi CTGATCAGTGACTTCTACCC kullanarak GGCGGGAAGATGAAGACAGA ve IGLC1, IGLC2, IGLC3, IGLC6 ve IGLC7S hedef dizisi ile rhesus makak IGKC'yi hedef alan sgRNA'ları kullanarak endojen hafif zincirleri sildik. HDRT, IGLC1 dizisinin bu sgRNA tarafından bölünmesini önleyen sessiz mutasyonlar içeriyordu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
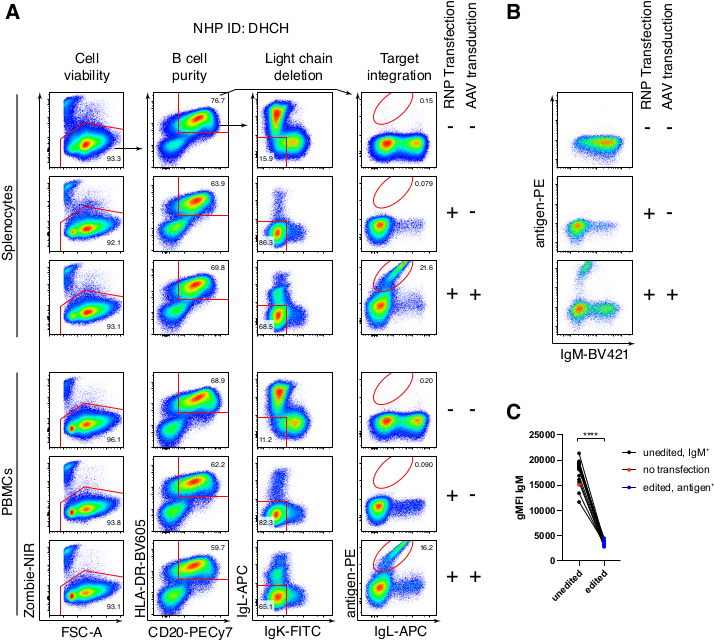
Şekil 5: Primer rhesus makak B hücrelerinin gen düzenlemesi . (A) Aynı rhesus makakından birincil splenositler (üst panel) veya PBMC'ler (alt panel), B olmayan hücrelerin tükenmesi olmadan kültürlendi ve yukarıda açıklandığı gibi düzenlendi. Hedefleme stratejisi Şekil 4'te gösterildiği gibidir. Elektroporasyondan iki gün sonra, hücreler toplandı ve akış sitometrik analizi için yüzey boyandı. Sol sütun tekli hücreler üzerine kapatıldı ve diğer sütunlar daha sonra üst satırda belirtildiği gibi geçitlendi. Hücrelerin yaşayabilirliği, B hücrelerinin saflığı, hafif zincirlerin delesyon etkinliği ve spesifik antijen RC141 ile boyanarak Ab1485'in knock-in etkinliği, tedavi edilmemiş, RNP transfekte veya RNP transfekte + rAAV6 transdüe edilmiş örneklerde belirtilmiştir (MOI = 5 x 105). Farklı rhesus makaklarından hücrelerle yapılan altı bağımsız deneyin temsilcisi. (B) Kültürlenmiş rhesus makak B hücre kontrollerinde veya düzenleme sonrasında IgM ekspresyonu ve (C) IgLC ve IgKC hedeflemesi (düzenlenmemiş) veya beklenen antijeni bağlayan B hücreleri (düzenlenmiş) nedeniyle Ig ekspresyonunu kaybetmemiş B hücrelerinde IgM'nin geometrik ortalama floresan yoğunluğu (gMFI). Kırmızı nokta, kültürlenmiş transfekte edilmemiş kontrol B hücrelerinin gMFI'sini gösterir. Eşleştirilmiş bir t-testinde p < 0.0001'i gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
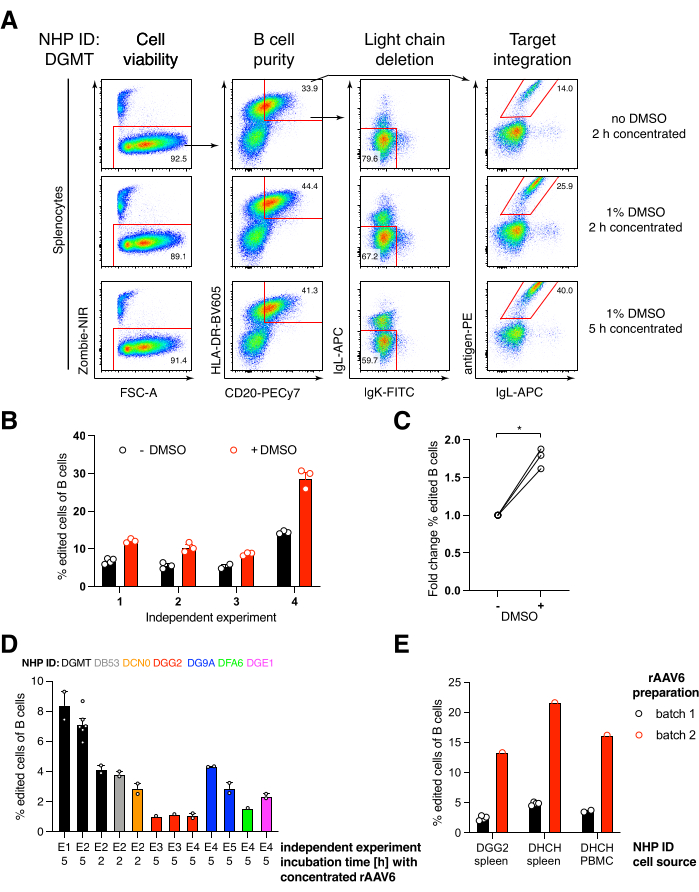
Şekil 6: DMSO'nun, rAAV6 HDRT ile uzun süreli konsantre inkübasyonun, rAAV parti kalitesinin ve farklı donör NHP'ler arasında tekrarlanabilirliğin primer rhesus makak B hücrelerinde gen düzenleme etkinliği üzerindeki etkileri. (A) Splenositler tarif edildiği gibi kültürlenmiş ve düzenlenmiştir. Elektroporasyondan sonra, 5 x 10 5 hücre,% 1 DMSO içeren veya içermeyen ortamda kültürlendi ve başka bir 450 μL ortam eklenmeden önce 2 saat veya 5 saat boyunca 5 x 105'lik bir MOI'de rAAV6 HDRT içeren 50 μL ortamda inkübe edildi. Hücreler elektroporasyondan 2 gün sonra Şekil 5'te olduğu gibi flow sitometri ile analiz edildi. Dört bağımsız deneyin temsilcisi. (B) Dört bağımsız deney üzerinden (A)'nın nicelleştirilmesi. Noktalar, 1.350 V, 10-20 ms ve 1 darbe elektroporasyon süresi transfeksiyon ayarlarına ve %0.75 ile %1.25 arasında değişen DMSO konsantrasyonlarına sahip teknik replikaları göstermektedir. (C) (B)'den düzenleme verimliliğindeki ortalama kat değişimi. * p > Mann-Whitney U testinde 0.05. (D) Daha düşük verimli bir ticari rAAV6 partisi kullanarak farklı makaklarla yapılan bağımsız deneyler üzerindeki verimlilikleri düzenlemek. (E) Aynı yapının aynı deneyde iki farklı NHP'nin B hücrelerinde paketlendiği iki farklı ticari rAAV6 partisi kullanılarak verimliliği düzenlemek. Noktalar, 1.350 V, 10-20 ms ve 1 darbe elektroporasyonu transfeksiyon ayarlarına sahip teknik replikaları gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan protokoller, HDRT'ler olarak rAAV6'ların yüksek verimini ve titrelerini üretmek için hızlı ve verimli bir yöntem ve in vitro olarak primer rhesus makak B hücrelerini verimli bir şekilde gen düzenlemek için yeni yöntemler sağlar.
rAAV6 üretim protokolü nispeten basit ve hızlıdır ve aşırı emek harcamadan aynı anda birçok farklı yapının üretilmesine ve test edilmesine olanak tanır. İstenirse, rAAV6, tampon değişimi ve konsantrasyonundan önce iyodiksanol gradyanı ultrasantrifüjleme34 veya sulu iki fazlı bölümleme35 gibi yerleşik protokoller kullanılarak daha da saflaştırılabilir.
Genel verimi azaltmasına rağmen, rAAV6'nın çoğunluğu ortam 36'ya salındığından ve hücre peletinden saflaştırma daha fazla maliyet ve işçilik eklediğinden, rAAV6 saflaştırması için sadece serumla indirgenmiş hücre kültürü ortamını kullanmayı tercih ettik. Kendiliğinden inaktive olan adenoviral yardımcının kullanımı, verimi ortalama 30-40 kat artırdı ve AAV6'ya paketlenmiş yapıların tek bir 15 cm'lik tabakta test edilmesine izin verdi. Saflaştırma yöntemimiz temel olmasına rağmen, bu yöntemi kullanarak, çeşitli hücre hatları veya diğer birincil hücreler kullanılarak transdüksiyondan sonra gen düzenleme verimliliğinde veya hücre canlılığında nispeten az partiden partiye varyasyon elde ediyoruz (veriler gösterilmemiştir).
İstenmeyen popülasyonların negatif tükenmesini kullanarak el değmemiş birincil B hücrelerini elde etmek için bir rhesus makak B hücre saflaştırma protokolü geliştirdik. Bu hücrelerin gen düzenlemesi için gerekli olmasa da, diğer hücre tiplerinin deneysel hedeflere müdahale etmesi durumunda, bu veya diğer uygulamalar için nispeten saf bir primer rhesus makak B hücresi popülasyonu elde etmenin bir yolunu sağlar. Bununla birlikte, saflık, genel B hücresi veriminin azalması pahasına gelir. Özellikle, hem zenginleştirilmiş hem de zenginleştirilmemiş B hücre kültürleri için, ilk PBMC veya splenosit preparatlarındaki B hücrelerinin fraksiyonu çok önemlidir. Özellikle PBMC'ler için, deneyler için yüksek sayıda B hücresi elde etmek için periferik kanda yüksek oranda B hücresi bulunan bireyler için farklı makakların taranmasını öneririz, çünkü bu değer bireyler arasında önemli ölçüde farklılık gösterebilir27. PBMC'ler düzenli kanama veya lökoferez42 ile elde edilebilir.
Gen düzenleme protokolü, tipik olarak nakavtın %60-80'i ve nakavt B hücrelerinin %5-20'si arasında etkili gen düzenlemesine yol açar, ancak %90'a kadar BCR nakavt ve %40 BCR knock-in B hücrelerine ulaştık (Şekil 5 ve Şekil 6).
Rhesus makak B hücrelerinin verimli bir şekilde düzenlenmesi için ana parametreler, sgRNA'nın kesme verimliliği, elektroporasyon parametreleri, MOI ve rAAV6 preparatının kalitesidir. Aday sgRNA'ların kesme verimlilikleri, HDRT'nin optimum düzenlenmesine ve tasarımına izin vermek için ampirik olarak belirlenmelidir. Burada sunulan elektroporasyon parametreleri, düzenlenmiş B hücrelerinin en yüksek yüzdesi yerine maksimum toplam düzenlenmiş B hücresi sayısını elde etmek için verimliliği uygulanabilirlikle dengeler. Düzenlenmiş hücrelerin daha yüksek bir yüzdesi gerekiyorsa, daha fazla hücre ölümü gözlenebilse de, artan voltajlar (1.750 V'a kadar) veya değiştirilmiş darbe uzunlukları (10-30 ms) önerilir. Ayrıca, aynı bireyden PBMC'lerden gelen B hücrelerine kıyasla dalak B hücrelerinde biraz daha yüksek düzenleme verimlilikleri kaydettik (Şekil 5); Ancak, bunun altında yatan neden şu anda bilinmemektedir.
Elektroporasyondan sonra% 1 DMSO ilavesinin, diğer hücrelerdeki raporlara paralel olarak, hücre canlılığını etkilemeden rhesus makak B hücrelerinde gen düzenleme verimliliğini ~% 40 oranında önemli ölçüde artırdığını bulduk (Şekil 6A-C)43. Bununla birlikte,% 1 DMSO'da genişletilmiş kültürden kaçınılmalıdır ve hücre canlılığını etkileyebilir. İstenirse DMSO tamamen çıkarılabilir.
Hücrelerin rAAV6 ile birlikte birkaç saat elektroporasyondan sonra küçük bir hacimde kültürlenmesi, muhtemelen HDRT'nin rAAV6 tarafından daha iyi transdüksiyonu ve dolayısıyla Cas9'un aktif olduğu ilgili zamanda daha yüksek hücre içi HDRT konsantrasyonu nedeniyle daha yüksek düzenleme verimliliğine yol açar. Hücrelerin 8 saate kadar bu şekilde kültürlenmesinin hücre canlılığını etkilemediğini, ancak düzenleme verimliliklerinin 5 saatin ötesinde önemli ölçüde artmadığını bulduk (Şekil 6). Knock-in yerine yalnızca knock-out gerekiyorsa, bu adım atlanabilir.
Sonuç olarak, rhesus makak B hücrelerinin in vitro gen düzenlemesi ve istenen yapıların verimli bir şekilde knock-in edilmesi için gerekli olan rAAV6 HDRT üretimi için kapsamlı protokoller sunuyoruz. Bu protokoller, rAAV6 olarak paketlenmiş birçok yapının hızlı, uygun maliyetli bir şekilde test edilmesini sağlar ve B hücresi terapilerinin fizibilitesinin ve ölçeklenebilirliğinin daha alakalı bir insan dışı primat modelinde klinik öncesi testini sağlar.
Açıklamalar
Hiçbir rakip çıkar beyan edilmez.
Teşekkürler
RC1 antijenini sağladıkları için Harry B. Gristick ve Pamela Bjorkman'a ve eleştirel tartışmalar için tüm Nussenzweig ve Martin laboratuvarlarına teşekkür ederiz. Bu çalışma, Bill ve Melinda Gates Vakfı hibesi INV-002777 (M.C.N.'ye) ve Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü, Ulusal Sağlık Enstitüleri Intramural Araştırma Programı tarafından desteklenmiştir. (R.G. ve M.A.M). M.C.N. bir HHMI Araştırmacısıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
Referanslar
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır