Method Article
Kriyo-Elektron Mikroskobu ile Mikrotübül Protein Komplekslerini İncelemek için Memeli Hücrelerinden Modifiye Mikrotübüllerin Çıkarılması
Bu Makalede
Özet
Burada, spesifik bir modifikasyon için zenginleştirilmiş mikrotübüller elde etmek için spesifik mikrotübül modifiye edici enzimlerden yoksun veya içerebilen memeli hücrelerinden endojen tübülin çıkarmak için bir protokol tarif ediyoruz. Daha sonra, ekstrakte edilen mikrotübüllerin, kriyo-elektron mikroskobu için ızgaralar hazırlamak üzere saflaştırılmış mikrotübül bağlayıcı proteinlerle nasıl dekore edilebileceğini açıklıyoruz.
Özet
Mikrotübüller hücre iskeletinin önemli bir parçasıdır ve hücre içi organizasyon, hücre bölünmesi ve göçte rol oynarlar. Posttranslasyonel modifikasyonlara bağlı olarak, mikrotübüller çeşitli etkileşimli proteinlerle kompleksler oluşturabilir. Bu mikrotübül protein kompleksleri genellikle insan hastalıklarında rol oynar. Bu tür komplekslerin yapısını anlamak, etki mekanizmalarını aydınlatmak için yararlıdır ve kriyo-elektron mikroskobu (kriyo-EM) ile incelenebilir. Yapısal çalışmalar için bu tür kompleksleri elde etmek için, spesifik posttranslasyonel modifikasyonlar içeren veya içermeyen mikrotübüllerin çıkarılması önemlidir. Burada, genetiği değiştirilmiş memeli hücrelerinden endojen tübülin çıkarmak için mikrotübül polimerizasyonunu ve ardından ultrasantrifüjleme kullanılarak çökeltmeyi içeren basitleştirilmiş bir protokolü açıklıyoruz. Ekstrakte edilen tübülin daha sonra, saflaştırılmış bir mikrotübül bağlayıcı proteine bağlı mikrotübüllerle kriyo-elektron mikroskop ızgaraları hazırlamak için kullanılabilir. Örnek olarak, bilinen üç tübülin-detirozinasyon enziminden yoksun olacak şekilde tasarlanmış hücre hatlarından tamamen tirozinlenmiş mikrotübüllerin ekstraksiyonunu gösteriyoruz. Bu mikrotübüller daha sonra kriyo-EM ızgaralarında enzimatik olarak inaktif mikrotübül ile ilişkili tübülin detirozinaz içeren bir protein kompleksi yapmak için kullanılır.
Giriş
Mikrotübüller hücre iskeletinin önemli bir parçasıdır; Hücre göçü ve bölünmesi gibi farklı işlevlerde rol oynarlar, ancak hücre içi organizasyona da katkıda bulunurlar. Farklı fonksiyonel kaderlere uyum sağlamak için, mikrotübüller, toplu olarak "mikrotübül ile etkileşime giren proteinler" olarak adlandıracağımız çeşitli mikrotübül ilişkili proteinler (MAP'ler), enzimler ve diğer proteinlerle etkileşime girer. Bu proteinlerin mikrotübül bağlanması, genellikle "tübülin kodu"1 olarak adlandırılan farklı tübülin modifikasyonları ile yönlendirilebilir. Bu tercihin örnekleri, tercihen tirozinli tübülin ile ilişkili mitotik sentromerle ilişkili kinesin (MCAK)2 ve p1503'ün dinein-dinaktin CAP-Gly alanıdır; kinesin motorları sentromerle ilişkili protein E (CENP-E)4 ve kinesin-25, C-terminal tirozinden yoksun tübülinleri tercih eder.
Mikrotübül-protein etkileşimlerini incelemek için çeşitli yöntemler kullanılabilirken, kriyo-elektron mikroskobu (kriyo-EM) genellikle bu etkileşimleri atomik çözünürlüğe yakın 6,7'de incelemek için kullanılır. Son yıllarda, kriyo-EM yapıları, dinein 8,9,10 ve kinesin 11 gibi büyük motor proteinlerin, EB312,13 ve MCAK14 gibi +TIP proteinlerinin, Tau15,16 gibi diğer proteinlerin ve hatta paklitaksel, pelorusid ve zampanolid 17 gibi küçük moleküllerin ne kadar büyük olduğunu ortaya koymuştur mikrotübüllerle etkileşime girer. Mikrotübül-protein etkileşimlerini incelemek için, mikrotübüller tipik olarak domuz beyninden çıkarılır18. Bunu takiben, kriyo-EM mikrotübül yapıları da dahil olmak üzere çoğu in vitro çalışma, domuz beyin tübülinleri kullanılarak gerçekleştirilir. Bu nedenle, bu çalışmaların sonuçları, dokular ve hücre tipleri arasındaki tübülin modifikasyonlarının heterojen doğasının önemini gizlemektedir19. Bu, mikrotübüllere bağlanmak için belirli bir modifikasyon gerektiren veya tercih eden bir proteini araştırırken belirli bir sorun yaratır. Bu, mikrotübül detirozinaz MATCAP için substrat olan tirozinli tübülin ile gösterilebilir.
Detirozinasyon, α-tübülinin C-terminal amino asit tirozininin eksik olduğu, mitotik, kardiyak ve nöronal fonksiyon20 ile ilişkili bir tübülin modifikasyonudur. Tamamen tirozinlenmiş mikrotübüller MATCAP için ideal substrat olsa da, bu dokudaki vazohibinler 21,22 ve MATCAP 23 detirozinazların işlevi nedeniyle domuz beyninden ticari olarak temin edilebilen mikrotübüllerde bu büyük ölçüde yoktur 22,23,24,25,26. Ticari olarak temin edilebilen HeLa tübülinleri çoğunlukla tirozinli mikrotübüller içermesine rağmen, detirozinasyon meydana gelebilir ve bu nedenle bu tübülin kaynağı, kriyo-EM analizi için tek tip bir numune oluşturmak için daha az uygundur.
MATCAP'ın mikrotübüllere bağlanmasını teşvik etmek ve yapısal analiz için homojen bir numune oluşturmak için, tamamen tirozinlenmiş bir mikrotübül kaynağı aradık. Bu amaçla, tamamen tirozinli mikrotübülleri çıkarmak için kullanılan bir MATCAP ve vazohibin eksikliği olan hücre hattı oluşturuldu. Ekstraksiyon prosedürü, beyin dokusundan veya 18,27,28,29,30 hücrelerinden tübülin çıkarmak için tekrarlanan polimerizasyon ve mikrotübüllerin depolimerizasyonu döngülerini kullanan iyi kurulmuş protokollere dayanıyordu, sadece tek bir polimerizasyon adımı ve bir gliserol yastığı üzerinde santrifüjleme ile. MATCAP'ı örnek olarak kullanarak, bu mikrotübüllerin kriyo-EM çalışmaları için nasıl kullanılabileceğini gösteriyoruz. Kriyo-EM ızgaralarını hazırlamak için, düşük tuz konsantrasyonunda iki aşamalı bir uygulama protokolü açıklanmaktadır. Bu yazıdaki yöntemler, kriyo-EM analizi yapmak için özelleştirilebilir mikrotübüllerin yeterli miktarda ve saflıkta ekstraksiyonunu açıklamakta ve kriyo-EM ızgaralarında protein-mikrotübül kompleksleri oluşturmak için bu mikrotübüllerin nasıl kullanılacağına dair ayrıntılı bir protokol sunmaktadır.
Protokol
NOT: Bu protokolde kullanılan tüm malzeme ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakınız.
1. Hücre kültürü
NOT: Tüm hücre kültürü steril laminer akış başlığında yapılmalıdır.
- Bu protokolü takip etmek için, önce 37 ° C'lik bir su banyosunda donmuş hücrelerin bir şişesini çözün. Burada, tirozinli tübülin oluşturmak için bilinen üç detirozinasyon enzimi olan VASH1, VASH2 ve MATCAP'tan yoksun genetiği değiştirilmiş bir HCT116 hücre hattı kullanıyoruz.
- 10 mL'lik uygun hücre kültürü ortamını içeren Ø 10 cm'lik bir plaka hazırlayın.
NOT: Bu protokolde, genetiği değiştirilmiş HCT116 hücre hattı için %10 v/v FCS (fetal buzağı serumu) ve penisilin/streptomisin antibiyotik (kültür ortamı) ile desteklenmiş DMEM (Dulbecco'nun modifiye Eagle besiyeri) kullanılmıştır. - Hücreleri sayın ve hazırlanan 10 cm'lik plakada ~ 2.5 × 106 canlı hücre (~% 20 birleşim) tohumlayın. Hücreleri eşit şekilde dağıtmak için plakayı hafifçe sallayın. Çanağı, hücreler %80-%90 birleşime ulaşana kadar %5 (v/v) CO2 ile gazlanmış 37 °C'lik bir hücre kültürü inkübatöründe inkübe edin.
NOT: Tipik olarak, bu HCT116 hücreleri için 3 gün sürer, ancak süre, kullanılan spesifik tohumlama yoğunluğuna ve hücre hattına bağlı olabilir. - Hücre kültürü ortamını bir pipet veya vakum aspiratörü kullanarak atın ve kabı 2 x 5 mL PBS yıkayın.
NOT: PBS'yi hücre tek katmanına çok zorla dağıtmamaya dikkat edin, çünkü bu, hücreleri plakadan ayırabilir. - 1-2 mL tripsin ekleyin ve hücreleri ayırmak için inkübatördeki hücreleri 2-5 dakika inkübe edin.
- Tripsini söndürmek için plakaya 2 mL kültür ortamı ekleyin.
- Hücre süspansiyonunu üç ila beş eşit parçaya bölün ve 6-12 birleşen 15 cm'lik plakalar elde edilene kadar hücreleri kültür ortamında genişletmek için bunları yeniden tohumlayın.
2. Hasat
- Herhangi bir hücre kültürü ortamını çıkarmak için hücreleri 10 mL PBS (1x) ile nazikçe yıkayın.
- 5 mM EDTA (steril / filtrelenmiş) ile desteklenmiş 3 mL buz gibi soğuk PBS ile hücreleri oda sıcaklığında 5 dakika boyunca inkübe ederek ve daha sonra bir hücre kazıyıcı kullanarak hücreleri plakalardan ayırın.
- Hücreleri buz üzerinde 50 mL'lik bir tüpte toplayın ve aşağı doğru döndürün (10 dakika, 250 × g).
- Hasat edilen hücrelerin hacmine, 50 mL tüp üzerindeki hacimsel ölçekle dikkat edin.
NOT: Beklenen hacim ~0,5 mL ile 4 mL arasında herhangi bir yerde olabilir. DURAKLATMA ADIMI: Hücre peletini LN2'de flaşla dondurun ve kullanıma kadar -20 ° C'de saklayın. Hücre peletinin sadece birkaç hafta veya ay saklanabileceğini unutmayın. Pelet daha uzun süre tutulursa, verimin düşmesine veya hiç mikrotübülün olmamasına neden olabilir.
- Hasat edilen hücrelerin hacmine, 50 mL tüp üzerindeki hacimsel ölçekle dikkat edin.
3. Mikrotübül ekstraksiyonu
NOT: 3.1-3.5 arasındaki adımlar için her şeyi buz üzerinde tutun; Adım 3.6'dan itibaren her şey sıcak tutulmalıdır (30-37 ° C).
- 100 mM BORU/KOH (pH 6.9), 2 mM EGTA/KOH, 1 mM MgCl2, 1 mM PMSF ve bir proteaz inhibitörü tablet (mini) içeren 10 mL buz gibi soğuk lizis tamponu hazırlayın.
- Hasat edilen hücre peletini 1: 1 v / v lizis tamponunda tekrar askıya alın (tam hacim hakkında şüpheniz varsa, daha fazla yerine daha az lizis tamponu alın).
- Hücreleri sonikasyonla lize edin: 15 s açık, 45 s kapalı, amper 30, dört döngü (koşulları deneysel olarak belirleyin ve sonikatöre göre değiştirin).
- Sonikasyondan sonra, SDS-PAGE analizi için bir örnek toplayın: 2 μL lizat + 18 μL su + 5 μL 5x SDS numune tamponu.
NOT: Standart bir ışık mikroskobu altında, hücrelerin gerçekten tamamen lize olup olmadığını kontrol edin.
- Sonikasyondan sonra, SDS-PAGE analizi için bir örnek toplayın: 2 μL lizat + 18 μL su + 5 μL 5x SDS numune tamponu.
- Lize hücreleri santrifüj tüpüne pipetleyin. Lizatı temizlemek için ultra santrifüj rotorunda 4 °C'de 100.000 × g'da 1 saat döndürün.
NOT: Santrifüjün doğru şekilde dengelendiğinden emin olmak için rotordaki tüm ceplerin kuru ve temiz olduğundan emin olun. - Temizlenmiş lizatı çıkarmak için bir şırınga kullanın. Peletin yanı sıra üstteki yüzen tabakayı rahatsız etmemeye dikkat edin.
- Temizlenmiş lizatın bir örneğini toplayın: 2 μL lizat + 18 μL su + 5 μL 5x SDS numune tamponu.
- Peletleri dikkatlice durulayın ve bir P10 pipet ucunu pelet boyunca döndürerek peletin bir kısmını toplayın; 200 μL su ve 50 μL SDS tamponu ekleyin.
- Mikrotübülleri polimerize etmek için süpernatantı önceki adımdan 1 mM GTP ve 20 μM paklitaksel ile tamamlayın; 1 mL'lik bir hacim için, 10 μL 2 mM paklitaksel ve 10 μL 100 mM GTP ekleyin.
DİKKAT: Paklitaksel cilt tahrişine, ciddi göz hasarına, solunum yolu tahrişine, genetik kusurlara, doğmamış bir çocuğa zarar verebilir ve organlarda hasara neden olabilir. Uzun süreli veya tekrarlanan maruz kalma organlara zarar verir. Maddeyi hiçbir şekilde solumayın, püskürtmeyin veya tozlamayın. Cilt temasını önlemek için lastik nitril eldiven giyin. - Mikrotübüllerin bir araya gelmesine izin vermek için GTP / paklitaksel takviyeli süpernatantı 37 ° C'de 30 dakika boyunca inkübe edin.
- Bu inkübasyon adımı sırasında, rotorun ve ultrasantrifüjün 30 ° C'ye kadar ısınmasına izin verin.
- Yastık tamponunu hazırlayın: 0.4 mL lizis tamponuna 0.6 mL gliserol ekleyin ve karışımı 20 μM paklitaksel ile destekleyin. Yastık tamponunu önceden 37 °C'ye ısıtın.
- Bir ultrasantrifüj tüpüne 800 μL yastık tamponu ekleyin. GTP/paklitaksel takviyeli lizatı yastık tamponunun üzerine dikkatlice pipetleyin.
NOT: Çok nazik bir şekilde pipetleyerek yastık tamponunun ve lizatın karışmasını önleyin. - Ultra santrifüj rotorunda 30 °C'de 100.000 × g'da 30 dakika döndürün. Mikrotübül peletinin nerede oluşması gerektiğini kolayca tanımak için santrifüjleme tüpünün dışa bakan kenarını işaretleyin.
- Mikrotübül peletini rahatsız etmemeye dikkat ederek bir pipet kullanarak yastık tamponunu dikkatlice çıkarın.
- Yastık tamponunun bir örneğini toplayın: 2 μL + 18 μL su + 5 μL 5x SDS numune tamponu.
- Gliserolü çıkarmak için peleti ılık lizis tamponu ile 3 kat dikkatlice yıkayın. Sıcak tamponu peletin yanına yavaşça dağıtın (sıvıyı doğrudan pelet üzerine yıkamayın), peletten ve tüpün duvarlarından mümkün olduğunca fazla gliserol çıkarmak için tüpü birkaç kez döndürün ve ardından aspire edin ve tekrarlayın.
NOT: Gliserol düzgün bir şekilde yıkanmazsa, ızgara elektron aydınlatması altında çok hızlı bir şekilde eriyecektir. Bu, bulanık görüntüler oluşturan yüksek parçacık hareketi ile kanıtlanabilir. - Aşağıdaki bileşenlerle süspansiyon tamponu hazırlayın: 100 mM BORULAR/KOH (pH 6.9), 2 mM EGTA/KOH ve 1 mM MgCl2 ve tamponu 37 °C'ye ısıtın.
- Yıkanmış peleti ~ 50 μL önceden ısıtılmış yeniden süspansiyon tamponunda kesilmiş bir uçla nazikçe askıya alın ve tüpü 37 ° C'de tutun.
- Yeniden askıya alınmış pelet fraksiyonunun bir örneğini toplayın: 2 μL + 18 μL su + 5 μL 5x SDS numune tamponu.
İPUCU: Kesilen uç, mikrotübüllerin kırılmasını önler. 37 ° C'ye kadar bir metal ısıtma bloğu hazırlayın ve bunu bir polistiren kutuda saklayın, böylece numune tüpleri oda sıcaklığına soğutulmadan kolayca taşınabilir.
- Yeniden askıya alınmış pelet fraksiyonunun bir örneğini toplayın: 2 μL + 18 μL su + 5 μL 5x SDS numune tamponu.
4. Cryo-EM ızgara hazırlığı
- Kurutma kağıdını takarak daldırma dondurucu cihazını hazırlayın. Daldırma dondurucuyu 30 ° C'ye kadar ısıtın ve nemlendirmeyi% 100'e ayarlayın. Sıcaklık ve nemi dengelemek için ~ 30 dakika bekleyin.
- Dalma dondurucunun ayarlarını iki uygulamaya hazırlayın ve ayarların doğru şekilde ayarlandığından emin olmak için tüm programı bir kez çalıştırın. İlk uygulamanın 10, 2 s leke süresi ve 0 s bekleme süresine sahip olduğundan ve ikinci uygulamanın 10, 6,5 s leke süresi ve 10 s bekleme süresine sahip olduğundan emin olun.
- Kriyo-EM ızgaralarını 60 s boyunca 30 mA'da kızdırın-boşaltın.
- Polistiren konteyner tertibatını LN2 ile soğutun ve etan gazını soğuk metal bir kaba yoğunlaştırarak metal bir kapta sıvı etan hazırlayın.
- Aşağıdaki bileşenlerle bir seyreltme tamponu hazırlayın: 100 mM BORULAR/KOH (pH 6.9), 2 mM EGTA/KOH ve 1 mM MgCl2 ve 37 °C'ye ısıtın.
- Tuz konsantrasyonunun düşürülmesini sağlamak için mikrotübül ile etkileşime giren protein 1: 1 v / v'yi ızgaralara uygulamadan hemen önce seyreltme tamponu ile seyreltin (50 mM NaCl'lik bir nihai tuz konsantrasyonu kullandık). Karışımı 37 °C'de tutun.
- Dalma cımbızlı parıltılı bir ızgara alın ve bunları dalma dondurucusuna tıklayın.
- Polistiren kabı dalma dondurucusuna sıvı etan ile yerleştirin ve hazırlanan programdan geçirin: önce ızgaraya 3.5 μL mikrotübül çözeltisi uygulayın, daldırma dondurucusunun ızgarayı lekelemesine izin verin, sonra hemen 3.5 μL taze seyreltilmiş protein uygulayın ve son olarak, pistonun lekelenmesine ve ızgarayı sıvı etan içinde dondurmasına izin verin.
- Izgaraları bir ızgara depolama kutusuna aktarın ve görüntüleyene kadar LN2 dewar'da saklayın.
Sonuçlar
Kriyo-EM ile tirozinli mikrotübüllere bağlı tübülin detirozinaz MATCAP'ı araştırdık. Bunu yapmak için, bilinen üç detirozinasyon enzimi, VASH1/2 ve MATCAP'tan yoksun olan genetiği değiştirilmiş bir HCT116 hücre hattından tamamen tirozinlenmiş mikrotübülleri çıkardık. Mikrotübülleri yaklaşık 0.5-4 mL hücre peletinden çıkarmak için 6-12 adet akıcı 15 cm'lik tabak kullandık (Şekil 1). İkinci santrifüjleme adımından sonra (adım 3.11), bu görünür ancak küçük ve şeffaf bir pelet verir (Şekil 1I). Mikrotübül verimi tipik olarak ~ 75 μg'dir. Pelet görünmüyorsa, bu, yanlış bir mikrotübül polimerizasyon sıcaklığı, kullanılan GTP veya paklitakselin kalitesiyle ilgili sorunlar veya çok fazla lizis tamponunun eklenmesi gibi önceki adımlardan birinde bir soruna işaret edebilir ve polimerizasyon için çok düşük bir tübülin konsantrasyonuna neden olabilir. Ekstrakte edilen mikrotübüllerin kalitesini ve konsantrasyonunu değerlendirmek için, Coomassie boyalı SDS jel üzerindeki numuneleri analiz ettik (Şekil 2A). Bu analizler, ekstrakte edilen mikrotübüllerin nispeten saf olduğunu göstermiştir. BSA niceliğinden elde edilen interpolasyonlu mikrotübül konsantrasyonu ~ 1.4 mg / mL idi. Bu, bir spektrofotometre ile ölçülen sayı ile iyi uyuşmaktadır (Şekil 2B, C).
Yeni ekstrakte edilen mikrotübüller, kriyo-EM için numune yapmak için doğrudan kullanılabilir. Mikrotübüller mikrograflarda sağlam ve bol görünmelidir. Daha fazla kriyo-EM analizi için, mikrotübüllerin birbirleri üzerinden geçmesini önlemek için mikrograf başına düşük bir mikrotübül yoğunluğuna sahip olmak önemlidir (Şekil 3A). Kırık mikrotübüller veya görünür olmayanlar, mikrotübüllerin depolimerize olduğunu (örneğin, düşük sıcaklık veya GTP hidrolizi nedeniyle) veya lekelenme ve daldırma donma parametrelerinin doğru ayarlanmadığını gösterebilir. Mikrotübüllerin etrafındaki arka plan, muhtemelen polimerize edilmemiş tübülin ile yoğundur.
MATCAP'ın moleküler ağırlığı 53 kDa'dır ve bir tübülin monomerinin boyutunun hemen altında küresel bir katalitik alana sahiptir. Bu nedenle, MATCAP'ın mikrotübül üzerindeki dekorasyonu görsel olarak tespit edilebilir. MATCAP'ı bağlamayan mikrotübüller "pürüzsüz" kenarlar gösterirken, MATCAP'ı bağlayan mikrotübüller, mikrotübül yüzeyinde elektron yoğun noktalarla karakterize edilen "pürüzlü" kenarlara sahipti (Şekil 3B). MATCAP'a bağlı ve MATCAP'a bağlanmamış mikrotübüller, hesaplanan 2D sınıflarında da ayırt edilebilir, ancak şekil ve boyut nedeniyle, bu diğer mikrotübül etkileşen proteinler için farklı olabilir (Şekil 3C). Yoğunluğun gerçekten ilgilenilen proteine ait olduğunu doğrulamak için, deneysel olarak belirlenmiş veya tahmin edilen yapılardan yararlanılabilir. Ayrıca, yalnızca karşılaştırma için mikrotübüller içeren bir kontrol ızgarası yapmanızı öneririz. Bu, mikrotübüllerin polimerize edilip edilmediğini ve yeterince yüksek bir konsantrasyonda bozulmadan ekstrakte edilip edilmediğini ve daldırma dondurma işleminin doğru şekilde gerçekleştirildiğini gösterir. İkinci bir MATCAP uygulaması ile ızgaralarda mikrotübül bolluğunun azaldığını fark ettik.
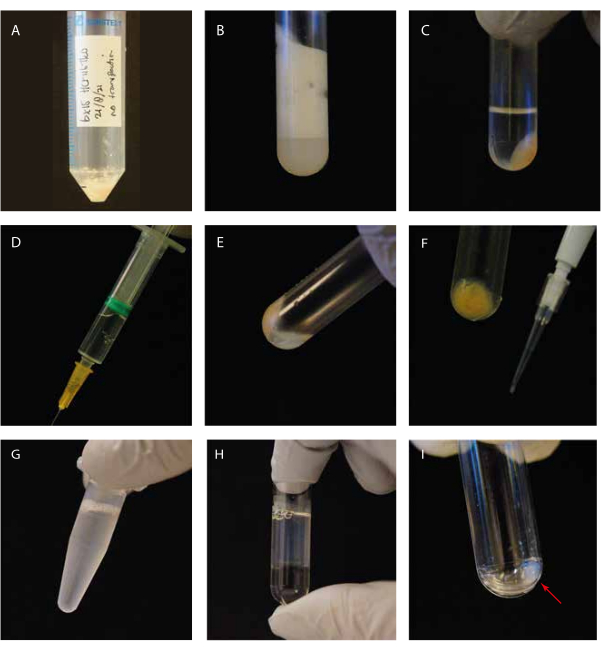
Şekil 1: Deneysel adımların görsel rehberliği. (A) Lizizden önce hücre peleti; (B) santrifüjlemeden önce bir ultrasantrifüj tüpünde soniklenmiş hücreler; (C) santrifüjlemeden sonra bir ultrasantrifüj tüpünde sonikleştirilmiş hücreler; (D) temizlenmiş süpernatan ile şırınga; (E) "beyaz yüzer tabaka" da dahil olmak üzere süpernatant gideriminden sonra kalan pelet; (F) SDS Coomassie jeli için hücre enkazı peletli P10 ucu; (G) İnkübasyondan önce GTP/paklitaksel takviyeli süpernatant; (H) Bir ultrasantrifüj tüpünde bir gliserol yastığının üstünde GTP/paklitaksel inkübe edilmiş süpernatant; (I) İkinci santrifüjleme adımından sonra mikrotübül peletini temizleyin. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
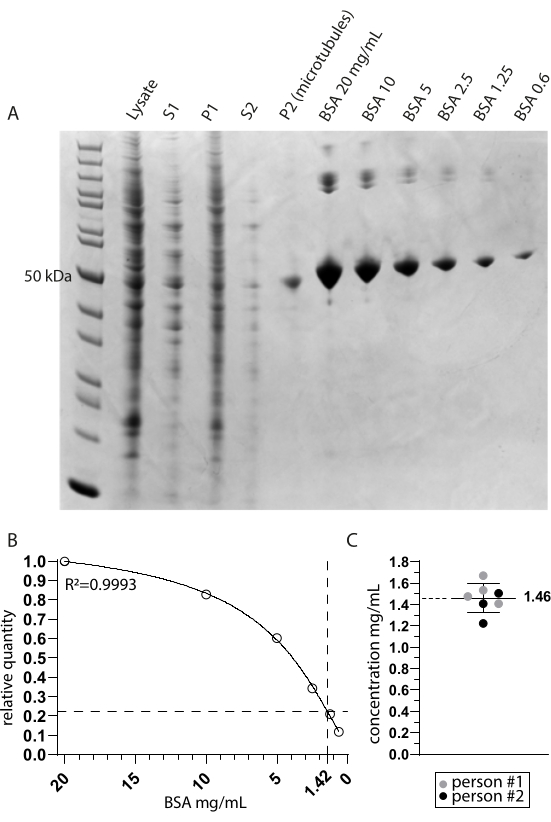
Şekil 2: Mikrotübül saflığı ve konsantrasyon tayini . (A) Ekstraksiyon protokolü sırasında alınan numuneleri ve BSA konsantrasyon karşılaştırmasını gösteren Coomassie boyalı SDS sayfa jeli. S1 ve P1, sırasıyla ilk santrifüjleme adımından sonra süpernatant ve pelete karşılık gelir. S2 ve P2 benzer şekilde ikinci santrifüjleme adımına karşılık gelir. (B) A'dan türetilen göreli BSA miktarlarının doğrusal olmayan regresyon çizgisi. Mikrotübül bandının P2 (mikrotübüller) şeridinde yaklaşık 50 kDa interpolasyonu, 1.42 mg / mL'lik bir nihai konsantrasyonu gösterir. (C) İki kişi tarafından ölçülen ve TUBA1A ve TUBB3'ün (0.971) birleşik yok olma katsayısı için düzeltilen yeniden askıya alınmış mikrotübüllerin (P2) spektrofotometrik analizi, 1.46 mg / mL ± 0.14 mg / mL'lik bir ortalama ve standart sapma konsantrasyonunu gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: Örnek mikrograflar. (A) MATCAP'a bağlı mikrotübülleri gösteren örnek mikrograflar. Yeşil bir kutu ile gösterilen mikrotübüller sağlamdır, dekore edilmiştir ve kriyo-EM analizi için kullanılabilir. Turuncu kutu ile gösterilen mikrotübül, sağlam ve dekore edilmiş bir mikrotübüldür, ancak solundaki mikrotübüllere yakın konumlandırılmıştır; bu nedenle, kriyo-EM analizine dahil etmek daha az uygundur. Kırmızı kutudaki mikrotübüller geçiyor ve kırılıyor. Bunlar kriyo-EM analizinden çıkarılmalıdır. (B) Sol panelin yeşil çevrelenmiş mikrotübülünün yakınlaştırılmış görünümü. Kırmızı ok uçları, yalnızca MATCAP uygulaması olan mikrograflardaki mikrotübüllerde görünen siyah noktaları gösterir ve bu nedenle muhtemelen mikrotübüle bağlı MATCAP'a karşılık gelir. (C) A'dan seçilen mikrotübül parçacıklarının yüksek ve düşük dekorasyon gösteren 2B sınıfı örneği ve MATCAP (en sağdaki panel) tarafından dekorasyon gözlemlemediğimiz farklı bir veri kümesinden bir 2B sınıfı. Ölçek çubukları = (A) 50 nm, (B) 25 nm, (C) 10 nm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: MATCAP eksikliği olan ve VASH1/2 eksikliği olan üçlü nakavt (TKO) HCT116 hücrelerinden, ticari domuz beyninden ve HeLa tübülininden türetilen mikrotübüllerin immünoblot analizi. Kısaltmalar: TKO = üçlü nakavt; mAb = monoklonal antikor; pAb = poliklonal antikor. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntem, endojen tübülinin hücre hatlarından nasıl hızlı bir şekilde çıkarılacağını ve daha sonra bu mikrotübüllerin kriyo-EM ızgaralarında nasıl süsleneceğini açıklar. Mikrotübüller sıcaklığa duyarlıdır. Soğuk bir ortamda depolimerize olurlar ve sıcak bir ortamda polimerize olurlar31. Bu nedenle, tübülini çözündürmek için sonikasyon ve temizleme spinini (adım 1.1-1.5) 4 ° C'de yürütmek çok önemlidir. Herhangi bir faktör mikrotübülleri bu adımda depolimerize etmeyecek kadar iyi stabilize ediyorsa, bu mikrotübüller ve stabilize edici faktörler ilk klirens dönüşünden sonra pelet içinde atılacaktır. Mikrotübülleri (yeniden) polimerize ettikten sonra, polimerize mikrotübülleri içeren çözeltiyi her zaman sıcak tutmak önemlidir. Mikrotübülleri, VASH1, VASH2 ve MATCAP proteinlerinde eksik olan HCT116 hücrelerinden çıkardık. Diğer hücre hatları ve dokular, mikrotübülleri29'u çıkarmak için kullanılabilir, ancak kirleticiler, tübülin izotipleri ve verim burada tarif edilenden çok farklı olabilir. Modifiye edici enzimler içeren aşırı eksprese edici plazmidler, spesifik tübülin modifikasyonlarını tanıtmak için de kullanılabilir.
Diğer protokoller 18,27,28,29,30, diğer etkileşimli proteinlerden yoksun mikrotübüller elde etmek için mikrotübüllerin çoklu polimerizasyon ve depolimerizasyon döngülerini kullanır. Burada, bu protokolleri basitleştirdik ve mikrotübülleri sadece bir kez polimerize ettik. Bu tek polimerizasyon nedeniyle, bu mikrotübüllerin diğer mikrotübül ile etkileşime giren proteinlerle birlikte çökelmesi mümkündür. Bununla birlikte, bu protokolün kriyo-EM amaçları için yeterince saf mikrotübüller verdiğini bulduk. Spesifik tahliller için daha saf bir numuneye ihtiyaç duyulursa, ek polimerizasyon ve depolimerizasyon döngüleri daha saf bir numune verebilir, ancak bu mikrotübül verimi pahasına olabilir. Bu protokolde, mikrotübülleri polimerize etmek için paklitaksel kullandık. Bununla birlikte, paklitaksel, mikrotübül kafesini belirli bir bükülme ve yükselmeye doğru yönlendirebilir, bu da ilgilenilen proteinin mikrotübül afinitesine müdahale edebilir. Paklitaksel uygun değilse diğer mikrotübül stabilize edici reaktifler kullanılabilir; Bu reaktiflerin örnekleri, pelorusid gibi taksan olmayan moleküller veya GMPCPP17,32 gibi hidrolize edilemeyen GTP varyantlarıdır.
Kriyo-EM ızgaralarındaki mikrotübüllere bağlanan proteinleri yapısal olarak araştırmak için, ilgilenilen proteinin yeterli miktarda mikrotübüllere bağlanması gerekir. Yaygın olarak ortaya çıkan bir sorun, çözeltide kararlı olan protein komplekslerinin ızgarada parçalanmasıdır. Izgara üzerinde protein kompleksi oluşturmak için, önce mikrotübülleri katmanlamak ve daha sonra mikrotübül kaplı ızgaraya düşük tuz konsantrasyonuna sahip mikrotübül bağlayıcı proteini uygulamak ve böylece protein kompleksini doğrudan ızgaraya monte etmek çok önemliydi. Diğerleri benzer şekilde başarılı mikrotübül dekorasyonu için düşük tuzlu33,34 protokolü ve iki adımlı bir uygulama34,35,36 protokolü bildirmiştir. Daha düşük bir tuz konsantrasyonunun, azalan elektrostatik yükler nedeniyle protein kompleksini daha kararlı bir etkileşime doğru yönlendirmesi muhtemeldir. Bununla birlikte, düşük tuz konsantrasyonu nedeniyle, ilgilenilen protein çökelme riski altındadır. Bu nedenle, ızgaraları vitrifiye etmeden kısa bir süre öncesine kadar proteinin fizyolojik olarak ilgili tuz konsantrasyonlarında veya çevresinde tutulması şiddetle tavsiye edilir. Bu iki aşamalı uygulama protokolü muhtemelen protein kompleksinin lekeleme veya daldırma dondurma adımları sırasında parçalanmasını önler. Bu protokolde Vitrobot'u kullandık. Bununla birlikte, daha hızlı vitrifikasyon yöntemleri (VitroJet) veya lekesiz ızgaraların (Puffalot) veya her iki özelliğe de sahip cihazların (bukalemun) kullanılması, iki aşamalı uygulamanın üstesinden gelebilir, ancak bunlar şu anda test için yaygın olarak mevcut değildir.
Yeniden yapılandırılmış kriyo-EM yoğunluğunun nihai çözünürlüğü, mikrotübül bağlayıcı proteinin mikrotübüle göre hareketi ve elde edilebilecek dekorasyon seviyesi de dahil olmak üzere bir dizi faktörden etkilenebilir. Daha yüksek mikrotübül dekorasyonu, 3D yoğunluk rekonstrüksiyonunda elde edilen nihai çözünürlüğe muhtemelen faydalıdır. Bu, mikrotübül bağlayıcı proteinin saflaştırılması sırasında elde edilen en yüksek protein konsantrasyonu, mikrotübül ile etkileşime giren proteinin toplanmadan dayanabileceği en düşük tuz konsantrasyonu ve mikrotübül ile etkileşime giren proteinin bağlanma modu (örneğin, protein birden fazla tübül dimerini kapsayabilir, böylece 1: 1 bağlanma oranını engelleyebilir) gibi birkaç faktörle sınırlandırılabilir. Kriyo-EM rekonstrüksiyonunun çözünürlüğü seyrek olarak dekore edilmiş mikrotübüller tarafından tehlikeye atılabilse de, hesaplamalı analiz, son derece seyrek olarak dekore edilmiş yakın zamanda bildirilen bir mikrotübül-protein kompleksi yapısı ile örneklendiği gibi, birçok problemin üstesinden gelebilir8.
Burada tarif ettiğimiz protokol, kriyo-EM amaçlarına uygun mikrotübüller elde etmek için hızlı, düşük maliyetli bir yöntem sunmaktadır. Ticari olarak temin edilebilen domuz beyin tübülininin aksine, MATCAP eksikliği olan ve vazohibin eksikliği olan HCT116 hücrelerinden türetilen mikrotübüller tamamen tirozinlenir (Şekil 4). Pahalı bir reaktif olan ticari HeLa tubulin, prensip olarak, nispeten homojen bir şekilde tirozinlenir ve glutamilasyon gibi çok az başka modifikasyon4 içerir, ancak partiler değişebilir ve modifikasyon sadece in vitro olarak elde edilebilir. Mikrotübüllerin ısmarlama hücre hatlarından çıkarılmasının bir avantajı, daha homojen bir mikrotübül havuzu oluşturmak için tübülin detirozinazları gibi tübülin modifiye edici enzimleri aşırı eksprese etme veya silme esnekliğidir. Bu, kriyo-EM numunesinin dekorasyonuna ve homojenliğine fayda sağlayabilir ve sonuçta kriyo-EM yoğunluk haritalarının ve bu numuneden türetilen moleküler yapıların kolaylığına ve kalitesine fayda sağlayacaktır.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Sixma, Brummelkamp ve Perrakis gruplarının tüm üyelerine verimli bilimsel tartışmaları ve hoş bir çalışma ortamı sağladıkları için teşekkür ederiz ve özellikle Jan Sakoltchik'e ("kişi 2") Şekil 3C'de gösterilen protein konsantrasyonunu belirlemeye yardımcı oldukları için teşekkür ederiz. Ayrıca NKI cryo-EM tesisine ve Leiden Üniversitesi'ndeki Hollanda Elektron Nanoskopi Merkezi'ne (NeCEN) destekleri için teşekkür ederiz. Bu çalışma T.R.B.'ye verilen NWO Vici hibesi 016.Vici.170.033 tarafından desteklenmiştir. A.P. ve T.R.B. Oncode araştırmacılarıdır ve NWO ENW'DEN (OCENW. M20.324). L.L., Avusturya Bilim Fonu'ndan (FWF JB4448-B) fon aldı. Bu araştırma, Hollanda Kanser Derneği ve Hollanda Sağlık, Refah ve Spor Bakanlığı'nın kurumsal bir hibesi ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material | |||
| 0.05% trypsin-EDTA | Gibco | 25300-054 | Cell culture |
| 10 cm plate | Falcon | 353003 | Cell culture |
| 15 cm plate | Thermo FisherScientific | 168381 | Cell culture |
| 50 mL tubes | Sarstedt | 62.547255 | Cell culture |
| 300 mesh quantifoil holey carbon copper grid R1.2/1.3 | Quantifoil Micro Tools | N1-C14nCu30-01 | Cryo-EM grid preparation |
| Cell scrapers | Falcon | 353085 | Cell culture |
| DMEM | Gibco | 41966-029 | Cell culture |
| EDTA | Merck | 108418 | Cell culture |
| EGTA | Sigma Aldrich | E3899 | Microtubule extraction |
| Ethane gas | Cryo-EM grid preparation | ||
| FCS | Serana | s-FBS-EU-015 | Cell culture |
| Glycerol | VWR | 24.397.296 | Microtubule extraction |
| GTP | Fisher Scientific | G8877-1G | Microtubule extraction |
| HCT116 VASH1 VASH2 MATCAP KO cells | self made | Wild type HCT116 cells RRID: CVCL_0291 | Cell culture |
| KOH | Merck | 1.05033 | Microtubule extraction |
| MgCl2 | Merck | 105833 | Microtubule extraction |
| Microtubule binding protein | self made | Cryo-EM grid preparation | |
| Needle | BD microlance | 300600 | Microtubule extraction |
| Paclitaxel | Santa Cruz Biotechnology | sc-212517 | caution toxic, microtubule extraction |
| PBS | Fisher Scientific | BP399 | Cell culture |
| Penicillin and streptomycin | Sigma Aldrich | P0781-100mL | Cell culture |
| PIPES | Merck | P8203 | Microtubule extraction |
| PMSF (in EtOH) | Roche | 16837091001 | Microtubule extraction |
| SDS sample buffer | self made | Quality assessment | |
| Syringe | BD plastipak | 309658 | Microtubule extraction |
| Ultra protease tables mini | Fisher Scientific | NC0975224 | Microtubule extraction |
| Whatman blotting paper | Whatman | 47000-100 | Cryo-EM grid preparation |
| Equipment | |||
| Flow hood | cell culture | ||
| GloQube | Quorum | Cryo-EM grid preparation | |
| Grid storage box | SWISSCI | 41018 | Cryo-EM grid storage |
| Heating block, electric or metal | to warm the buffers | ||
| Incubator, cell culture | NUAIR | cell culture | |
| LN2 dewar | Cryo-EM grid storage | ||
| Plunge-tweezers | Electron Microscopy Sciences | 0508-L5-PS | Cryo-EM grid preparation, hole drilled in top to fit the vitrobot |
| Polystyrene box | to keep the buffers warm | ||
| Sonicator | Qsonica | Q700 | Microtubule extraction |
| Standard light microscope | Olympus | CKX 41 | Quality assessment |
| TLA 100.3 rotor | Beckman Coulter | Microtubule extraction | |
| TLA 120.2 rotor | Beckman Coulter | Microtubule extraction | |
| Tubes for TLA 100.3 rotor | Beckman Coulter | 326819 | Microtubule extraction |
| Tubes for TLA 120.2 rotor | Beckman Coulter | 347356 | Microtubule extraction |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | Microtubule extraction |
| Vitrobot | FEI, ThermoFischer Scientific | mark IV | Cryo-EM grid preparation |
| Vitrobot polystyrene container assembly with metal ethane cup | ThermoFisher Scientific | 200703 | Cryo-EM grid preparation |
| Water bath | cell culture |
Referanslar
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Peris, L., et al. Motor-dependent microtubule disassembly driven by tubulin tyrosination. Journal of Cell Biology. 185 (7), 1159-1166 (2009).
- McKenney, R. J., Huynh, W., Tanenbaum, M. E., Bhabha, G., Vale, R. D. Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes. Science. 345 (6194), 337-341 (2014).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Sirajuddin, M., Rice, L. M., Vale, R. D. Regulation of microtubule motors by tubulin isotypes and post-translational modifications. Nature Cell Biology. 16 (4), 335-344 (2014).
- Nogales, E., Kellogg, E. H. Challenges and opportunities in the high-resolution cryo-EM visualization of microtubules and their binding partners. Current Opinion in Structural Biology. 46, 65-70 (2017).
- Manka, S. W., Moores, C. A. Microtubule structure by cryo-EM: Snapshots of dynamic instability. Essays in Biochemistry. 62 (6), 737-751 (2018).
- Chaaban, S., Carter, A. P. Structure of dynein-dynactin on microtubules shows tandem adaptor binding. Nature. 610 (7930), 212-216 (2022).
- Lacey, S. E., He, S., Scheres, S. H., Carter, A. P. Cryo-EM of dynein microtubule-binding domains shows how an axonemal dynein distorts the microtubule. eLife. 8, 47145 (2019).
- Walton, T., Wu, H., Brown, A. Structure of a microtubule-bound axonemal dynein. Nature Communications. 12, 477 (2021).
- Sindelar, C. V., Downing, K. H. An atomic-level mechanism for activation of the kinesin molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 107 (9), 4111-4116 (2010).
- Zhang, R., Alushin, G. M., Brown, A., Nogales, E. Mechanistic origin of microtubule dynamic instability and its modulation by EB proteins. Cell. 162 (4), 849-859 (2015).
- Maurer, S. P., Fourniol, F. J., Bohner, G., Moores, C. A., Surrey, T. EBs Recognize a nucleotide-dependent structural cap at growing microtubule ends. Cell. 149 (2), 371-382 (2012).
- Benoit, M. P. M. H., Asenjo, A. B., Sosa, H. Cryo-EM reveals the structural basis of microtubule depolymerization by kinesin-13s. Nature Communications. 9, 1662 (2018).
- Kellogg, E. H., et al. Near-atomic model of microtubule-tau interactions. Science. 360 (6394), 1242-1246 (2018).
- Brotzakis, Z. F., et al. A structural ensemble of a Tau-microtubule complex reveals regulatory Tau phosphorylation and acetylation mechanisms. ACS Central Science. 7 (12), 1986-1995 (2021).
- Kellogg, E. H., et al. Insights into the distinct mechanisms of action of taxane and non-taxane microtubule stabilizers from cryo-EM structures. Journal of Molecular Biology. 429 (5), 633-646 (2017).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Wloga, D., Joachimiak, E., Louka, P., Gaertig, J. Posttranslational modifications of tubulin and cilia. Cold Spring Harbor Perspectives in Biology. 9 (6), 028159 (2017).
- Nieuwenhuis, J., Brummelkamp, T. R. The tubulin detyrosination cycle: Function and enzymes. Trends in Cell Biology. 29 (1), 80-92 (2019).
- Nieuwenhuis, J., et al. Vasohibins encode tubulin detyrosinating activity. Science. 358 (6369), 1453-1456 (2017).
- Aillaud, C., et al. Vasohibins/SVBP are tubulin carboxypeptidases (TCPs) that regulate neuron differentiation. Science. 358 (6369), 1448-1453 (2017).
- Landskron, L., et al. Posttranslational modification of microtubules by the MATCAP detyrosinase. Science. 376 (6595), (2022).
- Erck, C., et al. A vital role of tubulin-tyrosine-ligase for neuronal organization. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7853-7858 (2005).
- Pagnamenta, A. T., et al. Defective tubulin detyrosination causes structural brain abnormalities with cognitive deficiency in humans and mice. Human Molecular Genetics. 28 (20), 3391-3405 (2019).
- Peris, L., et al. Tubulin tyrosination regulates synaptic function and is disrupted in Alzheimer's disease. Brain. 145 (7), 2486-2506 (2022).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14 (5), 1634-1660 (2019).
- Gell, C., et al. Purification of tubulin from porcine brain. Methods in Molecular Biology. 777, 15-28 (2011).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled posttranslational modifications and isotypes from limited sources by polymerization-depolymerization cycles. Journal of Visualized Experiments. (165), e61826 (2020).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue. GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Sindelar, C. V., Downing, K. H. The beginning of kinesin's force-generating cycle visualized at 9-Å resolution. Journal of Cell Biology. 177 (3), 377-385 (2007).
- Kellogg, E. H., et al. Near-atomic cryo-EM structure of PRC1 bound to the microtubule. Proceedings of the National Academy of Sciences of the United States of America. 113 (34), 9430-9439 (2016).
- Maurer, S. P., Bieling, P., Cope, J., Hoenger, A., Surrey, T. GTPγS microtubules mimic the growing microtubule end structure recognized by end-binding proteins (EBs). Proceedings of the National Academy of Sciences of the United States of America. 108 (10), 3988-3993 (2011).
- Manka, S. W., Moores, C. A. Pseudo-repeats in doublecortin make distinct mechanistic contributions to microtubule regulation. EMBO Reports. 21 (12), 51534 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır