Method Article
Extraction de microtubules modifiés de cellules de mammifères pour étudier les complexes microtubule-protéine par cryomicroscopie électronique
Dans cet article
Résumé
Ici, nous décrivons un protocole pour extraire la tubuline endogène de cellules de mammifères, qui peuvent manquer ou contenir des enzymes modificateurs de microtubules spécifiques, pour obtenir des microtubules enrichis pour une modification spécifique. Nous décrivons ensuite comment les microtubules extraits peuvent être décorés avec des protéines purifiées de liaison aux microtubules pour préparer des grilles pour la cryo-microscopie électronique.
Résumé
Les microtubules sont une partie importante du cytosquelette et sont impliqués dans l’organisation intracellulaire, la division cellulaire et la migration. Selon les modifications post-traductionnelles, les microtubules peuvent former des complexes avec diverses protéines en interaction. Ces complexes microtubule-protéine sont souvent impliqués dans les maladies humaines. Comprendre la structure de tels complexes est utile pour élucider leurs mécanismes d’action et peut être étudié par cryo-microscopie électronique (cryo-EM). Pour obtenir de tels complexes pour les études structurales, il est important d’extraire des microtubules contenant ou dépourvus de modifications post-traductionnelles spécifiques. Ici, nous décrivons un protocole simplifié pour extraire la tubuline endogène de cellules de mammifères génétiquement modifiées, impliquant la polymérisation des microtubules, suivie d’une sédimentation par ultracentrifugation. La tubuline extraite peut ensuite être utilisée pour préparer des grilles de cryo-microscope électronique avec des microtubules liés à une protéine purifiée de liaison aux microtubules d’intérêt. À titre d’exemple, nous démontrons l’extraction de microtubules entièrement tyrosinés à partir de lignées cellulaires conçues pour ne pas avoir les trois enzymes détyrosinantes connues de la tubuline. Ces microtubules sont ensuite utilisés pour fabriquer un complexe protéique avec la tubuline détyrosinase associée à la microtubule enzymatiquement inactive sur des grilles cryo-EM.
Introduction
Les microtubules sont une partie cruciale du cytosquelette; Ils sont impliqués dans différentes fonctions telles que la migration et la division cellulaires mais contribuent également à l’organisation intracellulaire. Pour s’adapter à différents destins fonctionnels, les microtubules interagissent avec une variété de protéines associées aux microtubules (MAP), d’enzymes et d’autres protéines, que nous appellerons collectivement « protéines interagissant avec les microtubules ». La liaison microtubule de ces protéines peut être guidée par différentes modifications de la tubuline, communément appelées « code de la tubuline »1. Des exemples de cette préférence sont la kinésine mitotique associée au centromère (MCAK)2 et le domaine dynéine-dynactine CAP-Gly de p1503, qui s’associent de préférence à la tubuline tyrosinée, tandis que les moteurs kinésiens de la protéine E associée au centromère (CENP-E)4 et kinésine-25 préfèrent la tubuline dépourvue de tyrosine C-terminale.
Bien qu’une variété de méthodes puissent être utilisées pour étudier les interactions microtubule-protéine, la cryo-microscopie électronique (cryo-EM) est souvent utilisée pour étudier ces interactions à une résolution quasi atomique 6,7. Ces dernières années, les structures cryo-EM ont révélé comment les grandes protéines motrices telles que la dynéine 8,9,10 et la kinésine 11, les protéines +TIP telles que EB312,13 et MCAK 14, d’autres protéines telles que Tau15,16, et même de petites molécules telles que le paclitaxel, le péloroside et le zampanolide 17 interagir avec les microtubules. Pour étudier les interactions microtubule-protéine, les microtubules sont généralement extraits du cerveau porcin18. Par la suite, la plupart des études in vitro, y compris les structures de microtubules cryo-EM, sont réalisées à l’aide de tubuline cérébrale porcine. Les résultats de ces études masquent donc l’importance de la nature hétérogène des modifications de la tubuline19 entre les tissus et les types cellulaires. Cela crée un problème particulier lors de l’étude d’une protéine qui nécessite ou préfère une modification spécifique pour se lier aux microtubules. Cela peut être illustré avec la tubuline tyrosinée, le substrat de la microtubule détyrosinase MATCAP.
La détyrosination est une modification de la tubuline dans laquelle l’acide aminé C-terminal tyrosine de la α-tubuline fait défaut, ce qui est associé à la fonction mitotique, cardiaque et neuronale20. Bien que les microtubules entièrement tyrosinés soient le substrat idéal pour MATCAP, cela est largement absent dans les microtubules disponibles dans le commerce du cerveau porcin en raison de la fonction des vasohibines 21,22 et des MATCAP 23 détyrosinases dans ce tissu 22,23,24,25,26. Bien que la tubuline HeLa disponible dans le commerce contienne principalement des microtubules tyrosinés, une détyrosination pourrait se produire, et cette source de tubuline est donc moins appropriée pour créer un échantillon uniforme pour l’analyse cryo-EM.
Pour stimuler la liaison de MATCAP aux microtubules et créer un échantillon homogène pour l’analyse structurelle, nous avons cherché une source de microtubules entièrement tyrosinée. À cette fin, une lignée cellulaire déficiente en MATCAP et en vasohibin a été créée, qui a été utilisée pour extraire des microtubules entièrement tyrosinés. La procédure d’extraction était basée sur des protocoles bien établis qui utilisent des cycles répétés de polymérisation et de dépolymérisation des microtubules pour extraire la tubuline du tissu cérébral ou des cellules 18,27,28,29,30, avec une seule étape de polymérisation et de centrifugation sur un coussin de glycérol. En utilisant MATCAP comme exemple, nous démontrons ensuite comment ces microtubules peuvent être utilisés pour les études cryo-EM. Pour préparer des grilles cryo-EM, un protocole d’application en deux étapes à une faible concentration en sel est décrit. Les méthodes décrites dans cet article décrivent l’extraction de microtubules personnalisables en quantités et puretés suffisantes pour effectuer une analyse cryo-EM et fournissent un protocole détaillé sur la façon d’utiliser ces microtubules pour créer des complexes protéine-microtubule sur des grilles cryo-EM.
Protocole
REMARQUE : Voir le tableau des matériaux pour plus de détails sur tous les matériaux et équipements utilisés dans ce protocole.
1. Culture cellulaire
REMARQUE: Toute culture cellulaire doit être effectuée dans une hotte à flux laminaire stérile.
- Pour suivre ce protocole, décongelez d’abord un flacon de cellules congelées dans un bain-marie à 37 °C. Ici, nous utilisons une lignée cellulaire HCT116 génétiquement modifiée qui n’a pas les trois enzymes détyrosinantes connues, VASH1, VASH2 et MATCAP, pour créer de la tubuline tyrosinée.
- Préparer une plaque de Ø 10 cm contenant 10 mL du milieu de culture cellulaire approprié.
REMARQUE : Dans ce protocole, le DMEM (milieu Eagle modifié de Dulbecco) complété par 10 % de FCS (sérum de veau fœtal) et d’antibiotique pénicilline/streptomycine (milieu de culture) a été utilisé pour la lignée cellulaire HCT116 génétiquement modifiée. - Compter les cellules et semer ~2,5 × 106 cellules viables (~20% de confluence) dans la plaque préparée de 10 cm. Secouez doucement la plaque pour répartir uniformément les cellules. Incuber la capsule dans un incubateur de culture cellulaire à 37 °C gazé avec 5% (v/v) de CO2 jusqu’à ce que les cellules atteignent 80%-90% de confluence.
REMARQUE: En règle générale, cela prend 3 jours pour les cellules HCT116, mais le temps peut dépendre de la densité d’ensemencement spécifique et de la lignée cellulaire utilisée. - Jeter le milieu de culture cellulaire à l’aide d’une pipette ou d’un aspirateur à vide et laver la capsule 2 x 5 ml de PBS.
REMARQUE: Veillez à ne pas distribuer le PBS avec trop de force sur la monocouche de cellule, car cela pourrait détacher les cellules de la plaque. - Ajouter 1-2 mL de trypsine, et incuber les cellules dans l’incubateur pendant 2-5 min pour détacher les cellules.
- Ajouter 2 ml du milieu de culture dans la plaque pour tremper la trypsine.
- Diviser la suspension cellulaire en trois à cinq parties égales et les réensemencer pour étendre les cellules dans le milieu de culture jusqu’à l’obtention de 6 à 12 plaques confluentes de 15 cm.
2. Récolte
- Lavez doucement les cellules avec 10 ml de PBS (1x) pour éliminer tout milieu de culture cellulaire.
- Détacher les cellules des plaques en les incubant pendant 5 minutes à température ambiante avec 3 mL de PBS glacé complété par 5 mM d’EDTA (stérile/filtré) et, par la suite, à l’aide d’un grattoir cellulaire.
- Recueillir les cellules dans un tube de 50 ml sur de la glace et tourner vers le bas (10 min, 250 × g).
- Notez le volume des cellules récoltées avec l’échelle volumétrique sur le tube de 50 mL.
REMARQUE: Le volume attendu peut être compris entre ~0,5 mL et 4 mL. ÉTAPE DE PAUSE : Congeler la pastille de cellule dans LN2 et conserver à −20 °C jusqu’à utilisation. Notez que la pastille de cellule ne peut être stockée que pendant quelques semaines ou quelques mois. Si la pastille est conservée plus longtemps, cela pourrait entraîner une diminution du rendement ou l’absence de microtubules du tout.
- Notez le volume des cellules récoltées avec l’échelle volumétrique sur le tube de 50 mL.
3. Extraction de microtubules
REMARQUE : Conservez tout ce qui concerne les étapes 3.1 à 3.5 sur la glace; tout à partir de l’étape 3.6 doit être maintenu au chaud (30-37 °C).
- Préparer 10 mL de tampon de lyse glacée contenant 100 mM de tuyaux/koh (pH 6,9), 2 mM D’EGTA/KOH, 1 mM de MgCl2, 1 mM de PMSF et un comprimé d’inhibiteur de protéase (mini).
- Remettez en suspension la pastille de cellules récoltées dans un tampon de lyse 1:1 v/v (en cas de doute sur le volume exact, prenez moins de tampon de lyse plutôt que plus).
- Lyse les cellules par sonication: 15 s allumé, 45 s éteint, amplificateur 30, quatre cycles (déterminer les conditions expérimentalement, et changer en fonction du sonicateur).
- Après sonication, prélever un échantillon pour l’analyse SDS-PAGE : 2 μL de lysat + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
REMARQUE: Vérifiez sous un microscope optique standard si les cellules ont effectivement été complètement lysées.
- Après sonication, prélever un échantillon pour l’analyse SDS-PAGE : 2 μL de lysat + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
- Pipeter les cellules lysées dans un tube centrifuge. Faire tourner pendant 1 h à 100 000 × g à 4 °C dans un rotor ultracentrifuge pour dégager le lysat.
REMARQUE: Assurez-vous que toutes les poches du rotor sont sèches et propres pour assurer l’équilibrage correct de la centrifugeuse. - Utilisez une seringue pour retirer le lysat effacé. Veillez à ne pas déranger le granulé ainsi que la couche flottante sur le dessus.
- Prélever un échantillon du lysat éliminé : 2 μL de lysat + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
- Rincez soigneusement la pastille et ramassez un peu de la pastille en faisant tourbillonner une pointe de pipette P10 à travers la pastille; ajouter 200 μL d’eau et 50 μL de tampon SDS.
- Compléter le surnageant de l’étape précédente avec 1 mM GTP et 20 μM de paclitaxel pour polymériser les microtubules ; pour un volume de 1 mL, ajouter 10 μL de paclitaxel 2 mM et 10 μL de 100 mM GTP.
ATTENTION : Le paclitaxel peut causer une irritation de la peau, des lésions oculaires graves, une irritation respiratoire, des anomalies génétiques, des dommages à l’enfant à naître et des dommages aux organes. Une exposition prolongée ou répétée cause des dommages aux organes. Ne pas respirer, vaporiser ou épousseter la substance de quelque façon que ce soit. Portez des gants en caoutchouc nitrile pour éviter tout contact avec la peau. - Incuber le surnageant supplémenté en GTP/paclitaxel pendant 30 min à 37 °C pour permettre aux microtubules de s’assembler.
- Pendant cette étape d’incubation, laissez le rotor et l’ultracentrifugeuse se réchauffer jusqu’à 30 °C.
- Préparer le tampon coussin : Ajouter 0,6 mL de glycérol à 0,4 mL de tampon de lyse et compléter le mélange avec 20 μM de paclitaxel. Préchauffez le tampon du coussin à 37 °C.
- Ajouter 800 μL de tampon coussin à un tube à ultracentrifugation. Pipeter soigneusement le lysat supplémenté en GTP/paclitaxel sur le tampon du coussin.
NOTE: Empêcher le mélange du tampon coussin et du lysat en pipetant très doucement. - Faire tourner pendant 30 min à 100 000 × g à 30 °C dans un rotor à ultracentrifugeuse. Marquez le bord orienté vers l’extérieur du tube de centrifugation pour reconnaître facilement où la pastille de microtubule doit se former.
- Retirez soigneusement le tampon coussin à l’aide d’une pipette, en prenant soin de ne pas déranger la pastille de microtubule.
- Prélever un échantillon du tampon coussin : 2 μL + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
- Lavez soigneusement la pastille 3x avec un tampon de lyse tiède pour éliminer le glycérol. Distribuez doucement le tampon chaud à côté de la pastille (sans rincer le liquide directement sur la pastille), tournez le tube plusieurs fois pour éliminer autant de glycérol que possible de la pastille et des parois du tube, puis aspirez et répétez.
REMARQUE: Si le glycérol n’est pas lavé correctement, la grille fondra très rapidement sous l’éclairage électronique. Cela pourrait être mis en évidence par un mouvement élevé des particules, créant des images floues. - Préparer le tampon de remise en suspension avec les ingrédients suivants : 100 mM DE TUYAUX/KOH (pH 6,9), 2 mM EGTA/KOH et 1 mM MgCl2, et chauffer le tampon à 37 °C.
- Remettez doucement en suspension la pastille lavée avec un embout coupé dans ~50 μL de tampon de remise en suspension préchauffé et maintenez le tube à 37 °C.
- Prélever un échantillon de la fraction de pastilles en suspension : 2 μL + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
ASTUCE: L’embout coupé empêche la rupture des microtubules. Préparez un bloc chauffant métallique à 37 °C et conservez-le dans une boîte en polystyrène afin que les tubes d’échantillon puissent être transportés facilement sans les refroidir à température ambiante.
- Prélever un échantillon de la fraction de pastilles en suspension : 2 μL + 18 μL d’eau + 5 μL de 5x tampon d’échantillon SDS.
4. Préparation de la grille cryo-EM
- Préparez le dispositif de congélation en installant le papier buvard. Réchauffez le congélateur plongeur jusqu’à 30 °C et réglez l’humidification à 100 %. Laisser agir ~30 min pour équilibrer la température et l’humidité.
- Préparez les réglages du congélateur à deux applications et exécutez l’ensemble du programme une fois pour vous assurer que les paramètres sont correctement réglés. Assurez-vous que la première application a une force de 10, 2 s de temps de transfert et 0 s de temps d’attente et que la deuxième application a une force de 10, 6,5 s de temps de transfert et 10 s de temps d’attente.
- Décharge luminescente des grilles cryo-EM à 30 mA pendant 60 s.
- Refroidissez le récipient en polystyrène avec du LN2 et préparez l’éthane liquide dans une tasse métallique en condensant l’éthane gazeux dans une tasse métallique froide.
- Préparer un tampon de dilution avec les composants suivants: tuyaux de 100 mM/Koh (pH 6,9), 2 mM EGTA/KH et 1 mM MgCl2, et le chauffer à 37 °C.
- Diluer la protéine interagissant avec les microtubules 1:1 v/v avec un tampon de dilution juste avant de l’appliquer sur les grilles pour s’assurer que la concentration en sel est abaissée (nous avons utilisé une concentration finale de sel de 50 mM NaCl). Maintenir le mélange à 37 °C.
- Prenez une grille à décharge luminescente avec une pince à épiler et cliquez-les dans le congélateur.
- Placez le récipient en polystyrène avec de l’éthane liquide dans le congélateur et passez en revue le programme préparé: appliquez d’abord 3,5 μL de solution de microtubules sur la grille, laissez le congélateur tacher la grille, puis appliquez immédiatement 3,5 μL de protéines fraîchement diluées, et enfin, laissez le piston éponger et congelez la grille dans de l’éthane liquide.
- Transférez les grilles dans une boîte de stockage de grille et stockez-les dans un dewar LN2 jusqu’à l’imagerie.
Résultats
Nous avons étudié la tubuline détyrosinase MATCAP liée aux microtubules tyrosinés par cryo-EM. Pour ce faire, nous avons extrait des microtubules entièrement tyrosinés d’une lignée cellulaire HCT116 génétiquement modifiée dépourvue des trois enzymes détyrosinantes connues, VASH1/2 et MATCAP. Nous avons utilisé 6 à 12 boîtes confluentes de 15 cm pour extraire les microtubules d’environ 0,5 à 4 ml de pastille cellulaire (Figure 1). Après la deuxième étape de centrifugation (étape 3.11), on obtient une pastille visible mais petite et transparente (figure 1I). Le rendement en microtubules est généralement de ~75 μg. Si la pastille n’est pas visible, cela peut indiquer un problème dans l’une des étapes précédentes, comme une température de polymérisation incorrecte des microtubules, des problèmes de qualité du GTP ou du paclitaxel utilisé, ou l’ajout d’un tampon de lyse trop important, entraînant une concentration de tubuline trop faible pour la polymérisation. Pour évaluer la qualité et la concentration des microtubules extraits, nous avons analysé des échantillons sur un gel SDS coloré à Coomassie (Figure 2A). Ces analyses ont indiqué que les microtubules extraits étaient relativement purs. La concentration interpolée de microtubules dérivée de la quantification de BSA était de ~1,4 mg/mL. Cela concorde bien avec le nombre mesuré avec un spectrophotomètre (Figure 2B,C).
Les microtubules fraîchement extraits peuvent être directement utilisés pour fabriquer des échantillons pour cryo-EM. Les microtubules doivent sembler intacts et abondants sur les micrographies. Pour une analyse cryo-EM plus approfondie, il est essentiel d’avoir une faible densité de microtubules par micrographie afin d’éviter que les microtubules ne se croisent (Figure 3A). Les microtubules brisés ou ceux qui ne sont pas visibles peuvent indiquer que les microtubules se sont dépolymérisés (p. ex. en raison d’une basse température ou d’une hydrolyse GTP) ou que les paramètres de transfert et de congélation par plongeon n’ont pas été réglés correctement. Le fond autour des microtubules est dense, probablement avec de la tubuline non polymérisée.
Le poids moléculaire de MATCAP est de 53 kDa, et il a un domaine catalytique globulaire juste en dessous de la taille d’un monomère de tubuline. La décoration de MATCAP sur le microtubule a donc pu être détectée visuellement. Les microtubules qui ne se lient pas à MATCAP présentent des bords « lisses », tandis que les microtubules qui se lient à MATCAP ont des bords « rugueux », caractérisés par des points denses en électrons sur la surface des microtubules (figure 3B). Les microtubules liés à MATCAP et non liés à MATCAP ont également pu être distingués dans les classes 2D calculées, bien qu’en raison de leur forme et de leur taille, cela puisse différer pour d’autres protéines interagissant avec les microtubules (Figure 3C). Pour confirmer que la densité appartient bien à la protéine d’intérêt, on peut tirer parti des structures déterminées ou prédites expérimentalement. Nous suggérons également de créer une grille de contrôle contenant des microtubules uniquement à des fins de comparaison. Cela indique si les microtubules ont été polymérisés et extraits intacts à une concentration suffisamment élevée et si le processus de congélation a été exécuté correctement. Nous avons remarqué que l’abondance des microtubules diminuait dans les grilles avec une deuxième application MATCAP.
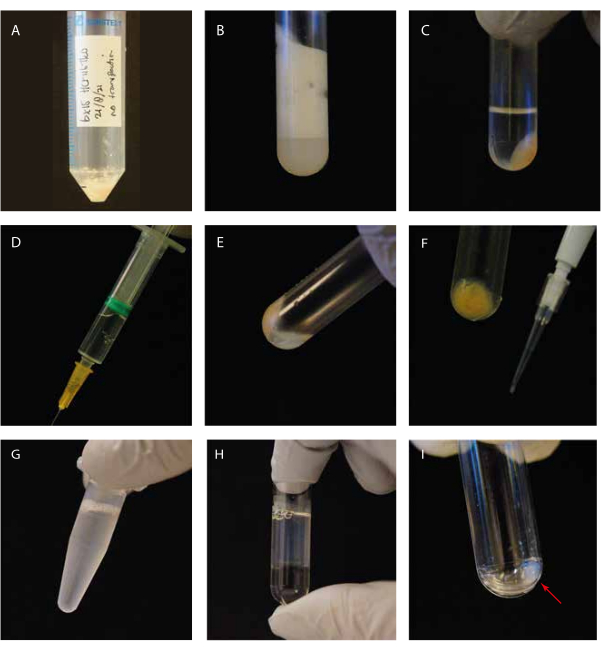
Figure 1 : Guidage visuel des étapes expérimentales. (A) Pastille cellulaire avant lyse; (B) cellules soniquées dans un tube à ultracentrifugation avant centrifugation; (C) cellules soniquées dans un tube à ultracentrifugation après centrifugation; D) seringue avec le surnageant autorisé; E) granulés résiduels après enlèvement du surnageant, y compris une « couche flottante blanche »; F) pointe P10 avec une pastille de débris cellulaires pour le gel SDS Coomassie; G) surnageant supplémenté en GTP/paclitaxel avant incubation; H) surnageant incubé au GTP/paclitaxel sur un coussin de glycérol dans un tube à ultracentrifugation; (I) Nettoyer la pastille de microtubule après la deuxième étape de centrifugation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
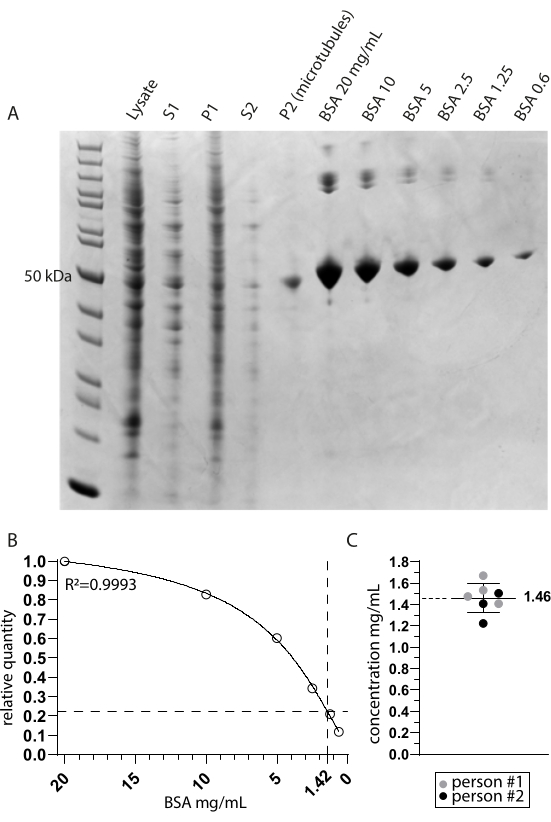
Figure 2 : Détermination de la pureté et de la concentration des microtubules. (A) Gel de page FDS coloré à Coomassie montrant les échantillons prélevés pendant le protocole d’extraction et une comparaison des concentrations de BSA. S1 et P1 correspondent respectivement au surnageant et à la pastille après la première étape de centrifugation. S2 et P2 correspondent de la même manière à la deuxième étape de centrifugation. (B) Une droite de régression non linéaire des quantités relatives de BSA dérivées de A. L’interpolation de la bande des microtubules autour de 50 kDa dans la voie P2 (microtubules) indique une concentration finale de 1,42 mg/mL. (C) L’analyse spectrophotométrique des microtubules en suspension (P2) mesurée par deux personnes et corrigée du coefficient d’extinction combiné de TUBA1A et TUBB3 (0,971) indique une concentration moyenne et un écart-type de 1,46 mg/mL ± 0,14 mg/mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Exemples de micrographies. (A) Exemples de micrographies présentant des microtubules liés à MATCAP. Les microtubules indiqués par une boîte verte sont intacts, décorés et peuvent être utilisés pour l’analyse cryo-EM. Le microtubule indiqué par la boîte orange est un microtubule intact et décoré mais est positionné près des microtubules à gauche de celui-ci ; par conséquent, il est moins approprié de l’inclure dans l’analyse cryo-EM. Les microtubules dans la boîte rouge se croisent et se brisent. Ceux-ci doivent être exclus de l’analyse cryo-EM. (B) Vue agrandie du microtubule entouré de vert du panneau de gauche. Les pointes de flèches rouges indiquent les points noirs qui n’apparaissaient que sur les microtubules dans les micrographies qui avaient une application de MATCAP et, par conséquent, correspondent probablement à MATCAP lié au microtubule. (C) Exemple de classes 2D de particules de microtubules choisies dans A qui montraient une décoration haute et basse et une classe 2D d’un jeu de données différent pour lequel nous n’avons observé aucune décoration par MATCAP (panneau le plus à droite). Barres d’échelle = (A) 50 nm, (B) 25 nm, (C) 10 nm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse immunoblot de microtubules dérivés de cellules HCT116 déficientes en MATCAP et en VASH1/2-deficient triple knockout (TKO), de cerveau porcin commercial et de tubuline HeLa. Abréviations : TKO = triple knockout; mAb = anticorps monoclonal; pAb = anticorps polyclonal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette méthode décrit comment extraire rapidement la tubuline endogène des lignées cellulaires et ensuite décorer ces microtubules sur des grilles cryo-EM. Les microtubules sont sensibles à la température. Ils se dépolymérisent dans un environnement froid et polymérisent dans un environnement chaud31. Il est donc essentiel d’exécuter la rotation de sonication et de clairance (étapes 1.1-1.5) à 4 °C pour solubiliser la tubuline. Si des facteurs stabilisaient si bien les microtubules qu’ils ne se dépolymériseraient pas à cette étape, ces microtubules et les facteurs de stabilisation seraient éliminés dans la pastille après le spin de clairance initial. Après (ré)polymérisation des microtubules, il est important de garder la solution contenant les microtubules polymérisés au chaud en tout temps. Nous avons extrait les microtubules des cellules HCT116, qui sont déficientes en protéines VASH1, VASH2 et MATCAP. D’autres lignées cellulaires, ainsi que des tissus, peuvent être utilisés pour extraire des microtubules29, bien que les contaminants, les isotypes de tubuline et le rendement puissent être très différents de ce qui est décrit ici. Les plasmides surexprimant qui contiennent des enzymes modificatrices peuvent également être utilisés pour introduire des modifications spécifiques de la tubuline.
D’autres protocoles 18,27,28,29,30 utilisent plusieurs cycles de polymérisation et de dépolymérisation des microtubules pour obtenir des microtubules dépourvus d’autres protéines en interaction. Ici, nous avons simplifié ces protocoles et ne polymérisons les microtubules qu’une seule fois. Il est possible qu’en raison de cette polymérisation unique, ces microtubules puissent co-sédimenter avec d’autres protéines interagissant avec les microtubules. Cependant, nous avons constaté que ce protocole donne des microtubules suffisamment purs pour les cryo-EM. Si un échantillon plus pur est nécessaire pour des essais spécifiques, des cycles supplémentaires de polymérisation et de dépolymérisation pourraient produire un échantillon plus pur, bien que cela puisse se faire au détriment du rendement en microtubules. Dans ce protocole, nous avons utilisé le paclitaxel pour polymériser les microtubules. Cependant, le paclitaxel pourrait biaiser le réseau des microtubules vers une certaine torsion et augmentation, ce qui pourrait interférer avec l’affinité microtubule de la protéine d’intérêt. D’autres réactifs stabilisateurs des microtubules pourraient être utilisés si le paclitaxel ne convient pas; des exemples de ces réactifs sont des molécules non taxanes telles que le peloruside ou des variantes GTP non hydrolysables telles que GMPCPP 17,32.
Pour étudier structurellement les protéines qui se lient aux microtubules sur des grilles cryo-EM, il faut lier une quantité suffisante de la protéine d’intérêt pour les microtubules. Un problème courant est que les complexes protéiques qui sont stables en solution se désagrègent sur la grille. Pour former le complexe protéique sur la grille, il était crucial de superposer d’abord les microtubules, puis d’appliquer la protéine de liaison aux microtubules avec une faible concentration de sel sur la grille recouverte de microtubules, assemblant ainsi le complexe protéique directement sur la grille. D’autres ont également signalé un protocole à faible teneur en sel 33,34 et un protocole d’application en deux étapes34,35,36 pour une décoration réussie des microtubules. Il est probable qu’une concentration de sel plus faible oriente le complexe protéique vers une interaction plus stable en raison de la diminution des charges électrostatiques. Cependant, en raison de la faible concentration en sel, la protéine d’intérêt risque de précipiter. Par conséquent, il est fortement recommandé de maintenir la protéine à ou autour des concentrations de sel physiologiquement pertinentes jusqu’à peu de temps avant de vitrifier les grilles. Ce protocole d’application en deux étapes empêche probablement le complexe protéique de se désagréger pendant les étapes de transfert ou de congélation. Dans ce protocole, nous avons utilisé le Vitrobot. Cependant, des méthodes de vitrification plus rapides (VitroJet) ou l’utilisation de grilles sans taches (Puffalot) ou de dispositifs ayant les deux propriétés (caméléon) pourraient potentiellement surmonter l’application en deux étapes, mais ceux-ci ne sont actuellement pas largement disponibles pour les tests.
La résolution finale de la densité cryo-EM reconstruite peut être affectée par un certain nombre de facteurs, y compris le mouvement de la protéine de liaison aux microtubules par rapport au microtubule et le niveau de décoration qui peut être atteint. Une décoration plus élevée des microtubules est probablement bénéfique pour la résolution finale obtenue dans la reconstruction de densité 3D. Cela peut être limité par quelques facteurs, tels que la concentration protéique la plus élevée obtenue lors de la purification de la protéine de liaison aux microtubules, la concentration de sel la plus faible que la protéine interagissant avec les microtubules peut supporter sans agrégation et le mode de liaison de la protéine interagissant avec les microtubules (par exemple, la protéine pourrait couvrir plus d’un dimère de tubuline, entravant ainsi un rapport de liaison de 1:1). Bien que la résolution de la reconstruction cryo-EM puisse être compromise par des microtubules peu décorés, l’analyse informatique peut contourner de nombreux problèmes, comme en témoigne une structure complexe microtubule-protéine récemment rapportée qui était extrêmement peu décorée8.
Le protocole que nous décrivons ici présente une méthode rapide et peu coûteuse pour obtenir des microtubules adaptés à des fins cryo-EM. Contrairement à la tubuline cérébrale porcine disponible dans le commerce, les microtubules dérivés de cellules HCT116 déficientes en MATCAP et en vasohibin sont entièrement tyrosinés (Figure 4). La tubuline HeLa commerciale, un réactif coûteux, est en principe relativement uniformément tyrosinée et contient peu d’autresmodifications4 telles que la glutamylation, mais les lots peuvent varier et la modification ne peut être réalisée que in vitro. Un avantage de l’extraction de microtubules à partir de lignées cellulaires sur mesure est la flexibilité dont on dispose pour surexprimer ou supprimer les enzymes modifiant la tubuline, telles que les tubulines détyrosinases, pour créer un pool plus homogène de microtubules. Cela peut améliorer la décoration et l’uniformité de l’échantillon cryo-EM et, en fin de compte, la facilité et la qualité des cartes de densité cryo-EM et des structures moléculaires dérivées de cet échantillon.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions tous les membres des groupes Sixma, Brummelkamp et Perrakis pour leurs discussions scientifiques fructueuses et pour avoir fourni un environnement de travail agréable, et plus particulièrement, nous remercions Jan Sakoltchik (« personne 2 ») d’avoir aidé à déterminer la concentration de protéines représentée à la figure 3C. Nous tenons également à remercier l’installation cryo-EM NKI et le Centre néerlandais de nanoscopie électronique (NeCEN) de l’Université de Leiden pour leur soutien. Ce travail a été soutenu par la subvention NWO Vici 016.Vici.170.033 accordée à T.R.B.. A.P. et T.R.B. sont des enquêteurs Oncode et reçoivent un financement de NWO ENW (OCENW. M20.324). L.L. a reçu un financement du Fonds autrichien pour la science (FWF JB4448-B). Cette recherche a été financée par une subvention institutionnelle de la Société néerlandaise du cancer et du ministère néerlandais de la Santé, du Bien-être et des Sports.
matériels
| Name | Company | Catalog Number | Comments |
| Material | |||
| 0.05% trypsin-EDTA | Gibco | 25300-054 | Cell culture |
| 10 cm plate | Falcon | 353003 | Cell culture |
| 15 cm plate | Thermo FisherScientific | 168381 | Cell culture |
| 50 mL tubes | Sarstedt | 62.547255 | Cell culture |
| 300 mesh quantifoil holey carbon copper grid R1.2/1.3 | Quantifoil Micro Tools | N1-C14nCu30-01 | Cryo-EM grid preparation |
| Cell scrapers | Falcon | 353085 | Cell culture |
| DMEM | Gibco | 41966-029 | Cell culture |
| EDTA | Merck | 108418 | Cell culture |
| EGTA | Sigma Aldrich | E3899 | Microtubule extraction |
| Ethane gas | Cryo-EM grid preparation | ||
| FCS | Serana | s-FBS-EU-015 | Cell culture |
| Glycerol | VWR | 24.397.296 | Microtubule extraction |
| GTP | Fisher Scientific | G8877-1G | Microtubule extraction |
| HCT116 VASH1 VASH2 MATCAP KO cells | self made | Wild type HCT116 cells RRID: CVCL_0291 | Cell culture |
| KOH | Merck | 1.05033 | Microtubule extraction |
| MgCl2 | Merck | 105833 | Microtubule extraction |
| Microtubule binding protein | self made | Cryo-EM grid preparation | |
| Needle | BD microlance | 300600 | Microtubule extraction |
| Paclitaxel | Santa Cruz Biotechnology | sc-212517 | caution toxic, microtubule extraction |
| PBS | Fisher Scientific | BP399 | Cell culture |
| Penicillin and streptomycin | Sigma Aldrich | P0781-100mL | Cell culture |
| PIPES | Merck | P8203 | Microtubule extraction |
| PMSF (in EtOH) | Roche | 16837091001 | Microtubule extraction |
| SDS sample buffer | self made | Quality assessment | |
| Syringe | BD plastipak | 309658 | Microtubule extraction |
| Ultra protease tables mini | Fisher Scientific | NC0975224 | Microtubule extraction |
| Whatman blotting paper | Whatman | 47000-100 | Cryo-EM grid preparation |
| Equipment | |||
| Flow hood | cell culture | ||
| GloQube | Quorum | Cryo-EM grid preparation | |
| Grid storage box | SWISSCI | 41018 | Cryo-EM grid storage |
| Heating block, electric or metal | to warm the buffers | ||
| Incubator, cell culture | NUAIR | cell culture | |
| LN2 dewar | Cryo-EM grid storage | ||
| Plunge-tweezers | Electron Microscopy Sciences | 0508-L5-PS | Cryo-EM grid preparation, hole drilled in top to fit the vitrobot |
| Polystyrene box | to keep the buffers warm | ||
| Sonicator | Qsonica | Q700 | Microtubule extraction |
| Standard light microscope | Olympus | CKX 41 | Quality assessment |
| TLA 100.3 rotor | Beckman Coulter | Microtubule extraction | |
| TLA 120.2 rotor | Beckman Coulter | Microtubule extraction | |
| Tubes for TLA 100.3 rotor | Beckman Coulter | 326819 | Microtubule extraction |
| Tubes for TLA 120.2 rotor | Beckman Coulter | 347356 | Microtubule extraction |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | Microtubule extraction |
| Vitrobot | FEI, ThermoFischer Scientific | mark IV | Cryo-EM grid preparation |
| Vitrobot polystyrene container assembly with metal ethane cup | ThermoFisher Scientific | 200703 | Cryo-EM grid preparation |
| Water bath | cell culture |
Références
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Peris, L., et al. Motor-dependent microtubule disassembly driven by tubulin tyrosination. Journal of Cell Biology. 185 (7), 1159-1166 (2009).
- McKenney, R. J., Huynh, W., Tanenbaum, M. E., Bhabha, G., Vale, R. D. Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes. Science. 345 (6194), 337-341 (2014).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Sirajuddin, M., Rice, L. M., Vale, R. D. Regulation of microtubule motors by tubulin isotypes and post-translational modifications. Nature Cell Biology. 16 (4), 335-344 (2014).
- Nogales, E., Kellogg, E. H. Challenges and opportunities in the high-resolution cryo-EM visualization of microtubules and their binding partners. Current Opinion in Structural Biology. 46, 65-70 (2017).
- Manka, S. W., Moores, C. A. Microtubule structure by cryo-EM: Snapshots of dynamic instability. Essays in Biochemistry. 62 (6), 737-751 (2018).
- Chaaban, S., Carter, A. P. Structure of dynein-dynactin on microtubules shows tandem adaptor binding. Nature. 610 (7930), 212-216 (2022).
- Lacey, S. E., He, S., Scheres, S. H., Carter, A. P. Cryo-EM of dynein microtubule-binding domains shows how an axonemal dynein distorts the microtubule. eLife. 8, 47145 (2019).
- Walton, T., Wu, H., Brown, A. Structure of a microtubule-bound axonemal dynein. Nature Communications. 12, 477 (2021).
- Sindelar, C. V., Downing, K. H. An atomic-level mechanism for activation of the kinesin molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 107 (9), 4111-4116 (2010).
- Zhang, R., Alushin, G. M., Brown, A., Nogales, E. Mechanistic origin of microtubule dynamic instability and its modulation by EB proteins. Cell. 162 (4), 849-859 (2015).
- Maurer, S. P., Fourniol, F. J., Bohner, G., Moores, C. A., Surrey, T. EBs Recognize a nucleotide-dependent structural cap at growing microtubule ends. Cell. 149 (2), 371-382 (2012).
- Benoit, M. P. M. H., Asenjo, A. B., Sosa, H. Cryo-EM reveals the structural basis of microtubule depolymerization by kinesin-13s. Nature Communications. 9, 1662 (2018).
- Kellogg, E. H., et al. Near-atomic model of microtubule-tau interactions. Science. 360 (6394), 1242-1246 (2018).
- Brotzakis, Z. F., et al. A structural ensemble of a Tau-microtubule complex reveals regulatory Tau phosphorylation and acetylation mechanisms. ACS Central Science. 7 (12), 1986-1995 (2021).
- Kellogg, E. H., et al. Insights into the distinct mechanisms of action of taxane and non-taxane microtubule stabilizers from cryo-EM structures. Journal of Molecular Biology. 429 (5), 633-646 (2017).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Wloga, D., Joachimiak, E., Louka, P., Gaertig, J. Posttranslational modifications of tubulin and cilia. Cold Spring Harbor Perspectives in Biology. 9 (6), 028159 (2017).
- Nieuwenhuis, J., Brummelkamp, T. R. The tubulin detyrosination cycle: Function and enzymes. Trends in Cell Biology. 29 (1), 80-92 (2019).
- Nieuwenhuis, J., et al. Vasohibins encode tubulin detyrosinating activity. Science. 358 (6369), 1453-1456 (2017).
- Aillaud, C., et al. Vasohibins/SVBP are tubulin carboxypeptidases (TCPs) that regulate neuron differentiation. Science. 358 (6369), 1448-1453 (2017).
- Landskron, L., et al. Posttranslational modification of microtubules by the MATCAP detyrosinase. Science. 376 (6595), (2022).
- Erck, C., et al. A vital role of tubulin-tyrosine-ligase for neuronal organization. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7853-7858 (2005).
- Pagnamenta, A. T., et al. Defective tubulin detyrosination causes structural brain abnormalities with cognitive deficiency in humans and mice. Human Molecular Genetics. 28 (20), 3391-3405 (2019).
- Peris, L., et al. Tubulin tyrosination regulates synaptic function and is disrupted in Alzheimer's disease. Brain. 145 (7), 2486-2506 (2022).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14 (5), 1634-1660 (2019).
- Gell, C., et al. Purification of tubulin from porcine brain. Methods in Molecular Biology. 777, 15-28 (2011).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled posttranslational modifications and isotypes from limited sources by polymerization-depolymerization cycles. Journal of Visualized Experiments. (165), e61826 (2020).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue. GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Sindelar, C. V., Downing, K. H. The beginning of kinesin's force-generating cycle visualized at 9-Å resolution. Journal of Cell Biology. 177 (3), 377-385 (2007).
- Kellogg, E. H., et al. Near-atomic cryo-EM structure of PRC1 bound to the microtubule. Proceedings of the National Academy of Sciences of the United States of America. 113 (34), 9430-9439 (2016).
- Maurer, S. P., Bieling, P., Cope, J., Hoenger, A., Surrey, T. GTPγS microtubules mimic the growing microtubule end structure recognized by end-binding proteins (EBs). Proceedings of the National Academy of Sciences of the United States of America. 108 (10), 3988-3993 (2011).
- Manka, S. W., Moores, C. A. Pseudo-repeats in doublecortin make distinct mechanistic contributions to microtubule regulation. EMBO Reports. 21 (12), 51534 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon