Method Article
초저온 전자 현미경으로 미세소관-단백질 복합체를 연구하기 위해 포유류 세포에서 변형된 미세소관 추출
요약
여기에서 우리는 특정 미세소관 변형 효소가 부족하거나 포함할 수 있는 포유류 세포에서 내인성 튜불린을 추출하여 특정 변형을 위해 풍부한 미세소관을 얻는 프로토콜을 설명합니다. 그런 다음 추출된 미세소관을 정제된 미세소관 결합 단백질로 장식하여 초저온 전자 현미경을 위한 그리드를 준비하는 방법을 설명합니다.
초록
미세소관은 세포골격의 중요한 부분이며 세포 내 조직, 세포 분열 및 이동에 관여합니다. 번역 후 변형에 따라 미세소관은 다양한 상호 작용 단백질과 복합체를 형성할 수 있습니다. 이러한 미세소관-단백질 복합체는 종종 인간 질병과 관련이 있습니다. 이러한 복합체의 구조를 이해하는 것은 작용 메커니즘을 설명하는 데 유용하며 초저온 전자 현미경(Cryo-EM)으로 연구할 수 있습니다. 구조 연구를 위해 이러한 복합체를 얻으려면 특정 번역 후 변형을 포함하거나 포함하지 않는 미세소관을 추출하는 것이 중요합니다. 여기에서 우리는 미세소관 중합을 포함하는 유전자 변형 포유류 세포에서 내인성 튜불린을 추출한 다음 초원심분리를 사용한 침전을 포함하는 단순화된 프로토콜을 설명합니다. 추출된 튜불린은 관심 있는 정제된 미세소관 결합 단백질에 결합된 미세소관이 있는 초저온 전자 현미경 그리드를 준비하는 데 사용할 수 있습니다. 예를 들어, 우리는 세 가지 알려진 튜불린-탈티로신 효소가 부족하도록 조작된 세포주에서 완전히 티로신화된 미세소관을 추출하는 것을 보여줍니다. 그런 다음 이러한 미세소관을 사용하여 Cryo-EM 그리드에서 효소적으로 비활성 미세소관 관련 튜불린 디티로시나아제와 단백질 복합체를 만듭니다.
서문
미세소관은 세포골격의 중요한 부분입니다. 그들은 세포 이동 및 분열과 같은 다양한 기능에 관여하지만 세포 내 조직에도 기여합니다. 다양한 기능적 운명에 적응하기 위해 미세소관은 다양한 미세소관 관련 단백질(MAP), 효소 및 기타 단백질과 상호 작용하며, 이를 총칭하여 "미세소관 상호 작용 단백질"이라고 합니다. 이러한 단백질의 미세소관 결합은 일반적으로 "튜불린 코드"라고 하는 다양한 튜불린 변형에 의해 유도될 수 있습니다.1. 이러한 선호의 예로는 유사분열 중심체 관련 키네신(MCAK)2 및 p1503의 dynein-dynactin CAP-Gly 도메인이 있으며, 이는 바람직하게는 티로신화 튜불린과 결합하는 반면, 키네신 모터 중심체 관련 단백질 E(CENP-E)4 및 키네신-25 는 C-말단 티로신이 결여된 튜불린을 선호합니다.
미세소관-단백질 상호작용을 연구하기 위해 다양한 방법을 사용할 수 있지만, 초저온 전자 현미경(cryo-EM)은 종종 원자에 가까운 분해능에서 이러한 상호작용을 연구하는 데 사용됩니다 6,7. 최근 몇 년 동안 Cryo-EM 구조는 dynein 8,9,10 및 kinesin11과 같은 운동 단백질, EB312,13 및 MCAK 14와 같은 +TIP 단백질, Tau 15,16과 같은 기타 단백질, 심지어 paclitaxel, peloruside 및 zampanolide 17과 같은 작은 분자까지 밝혀냈습니다 미세 소관과 상호 작용합니다. 미세소관-단백질 상호작용을 연구하기 위해, 미세소관은 전형적으로 돼지의 뇌에서 추출된다18. 그 후, Cryo-EM 미세소관 구조를 포함한 대부분의 in vitro 연구는 돼지 뇌 튜불린을 사용하여 수행됩니다. 그러므로, 이러한 연구의 결과는, 조직과 세포 유형 사이의 튜불린 변형19의 이질적인 성질의 중요성을 모호하게 한다. 이것은 미세소관에 결합하기 위해 특정 변형을 필요로 하거나 선호하는 단백질을 조사할 때 특별한 문제를 야기합니다. 이것은 미세소관 디티로시나제 MATCAP의 기질인 티로신화 튜불린으로 설명할 수 있습니다.
디티로신화(Detyrosination)는 α-튜불린의 C-말단 아미노산 티로신이 결핍된 튜불린 변형으로, 유사분열, 심장 및 신경 기능과 관련이 있다20. 완전히 티로신 화 된 미세 소관은 MATCAP의 이상적인 기질이지만,이 조직22,23,24,25,26에서 바소 히빈 21,22 및 MATCAP 23 데티로시나제의 기능으로 인해 돼지 뇌에서 상업적으로 이용 가능한 미세 소관에는 거의 없습니다 . 시판되는 HeLa 튜불린은 대부분 티로신 처리된 미세소관을 함유하고 있지만, 탈티로신이 발생할 수 있으며, 따라서 이 튜불린 공급원은 Cryo-EM 분석을 위한 균일한 시료를 만드는 데 적합하지 않습니다.
미세소관에 대한 MATCAP의 결합을 자극하고 구조 분석을 위한 균질한 샘플을 만들기 위해 우리는 완전히 티로신화된 미세소관의 공급원을 찾았습니다. 이를 위해 MATCAP 및 바소히빈 결핍 세포주를 만들어 완전히 티로신 처리된 미세소관을 추출하는 데 사용했습니다. 추출 절차는 미세소관의 중합 및 해중합의 반복 주기를 사용하여 뇌 조직 또는 세포(18,27,28,29,30)에서 튜불린을 추출하는 잘 확립된 프로토콜을 기반으로 했으며, 단일 중합 단계와 글리세롤 쿠션을 통한 원심분리만 있었습니다. 그런 다음 MATCAP을 예로 들어 이러한 미세소관을 Cryo-EM 연구에 사용하는 방법을 보여줍니다. Cryo-EM 그리드를 준비하기 위해 낮은 염 농도의 2단계 응용 프로토콜에 대해 설명합니다. 이 백서의 방법은 Cryo-EM 분석을 수행하기에 충분한 양과 순도로 맞춤형 미세소관을 추출하는 방법을 설명하고, 이러한 미세소관을 사용하여 Cryo-EM 그리드에서 단백질-미세소관 복합체를 생성하는 방법에 대한 자세한 프로토콜을 제공합니다.
프로토콜
알림: 이 프로토콜에 사용된 모든 재료 및 장비와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 세포 배양
참고: 모든 세포 배양은 멸균 층류 후드에서 이루어져야 합니다.
- 이 프로토콜을 따르기 위해, 먼저 냉동 세포의 바이알을 37°C 수조에서 해동한다. 여기에서 우리는 세 가지 알려진 탈티로신 효소인 VASH1, VASH2 및 MATCAP가 없는 유전자 변형 HCT116 세포주를 사용하여 티로신화 튜불린을 생성합니다.
- 적절한 세포 배양 배지 10mL가 들어 있는 Ø 10cm 플레이트를 준비합니다.
참고: 이 프로토콜에서는 10% v/v FCS(태아 송아지 혈청) 및 페니실린/스트렙토마이신 항생제(배양 배지)가 보충된 DMEM(Dulbecco's modified Eagle medium)을 유전자 변형 HCT116 세포주에 사용했습니다. - 세포를 세고 준비된 10cm 플레이트에 ~2.5 ×10 6 개의 생존 세포(~20% 합류)를 시드합니다. 세포가 고르게 분포되도록 플레이트를 부드럽게 흔듭니다. 세포가 80%-90% 합류에 도달할 때까지 5%(v/v) CO2 로 가스가 공급된 37°C 세포 배양 배양기에서 접시를 배양합니다.
참고: 일반적으로 HCT116 세포의 경우 3일이 소요되지만 시간은 사용된 특정 파종 밀도 및 세포주에 따라 달라질 수 있습니다. - 피펫 또는 진공 흡기를 사용하여 세포 배양 배지를 버리고 PBS 2 x 5 mL 접시를 세척합니다.
알림: PBS를 세포 단층에 너무 세게 분주하면 플레이트에서 세포가 분리될 수 있으므로 주의하십시오. - 트립신 1-2mL를 넣고 인큐베이터에서 2-5분 동안 세포를 배양하여 세포를 분리합니다.
- 플레이트에 배양액 2mL를 넣어 트립신을 켄칭합니다.
- 세포 현탁액을 3-5등분으로 분할하고 6-12개의 합류 15cm 플레이트가 얻어질 때까지 배양 배지에서 세포를 확장하기 위해 다시 시드합니다.
2. 수확
- 세포를 10mL의 PBS(1x)로 부드럽게 세척하여 세포 배양 배지를 제거합니다.
- 5mM EDTA(멸균/여과)가 보충된 3mL의 얼음처럼 차가운 PBS로 실온에서 5분 동안 세포를 배양한 후 세포 스크레이퍼를 사용하여 플레이트에서 세포를 분리합니다.
- 얼음 위의 50mL 튜브에 세포를 모으고 회전시킵니다(10분, 250× g).
- 50mL 튜브에서 부피 척도로 수확된 세포의 부피를 확인합니다.
참고: 예상 용량은 ~0.5mL에서 4mL 사이일 수 있습니다. 일시 중지 단계: LN2에서 세포 펠릿을 급속 동결하고 사용할 때까지 -20°C에서 보관합니다. 세포 펠릿은 몇 주 또는 몇 달 동안만 보관할 수 있습니다. 펠릿을 더 오래 보관하면 수율이 감소하거나 미세소관이 전혀 없을 수 있습니다.
- 50mL 튜브에서 부피 척도로 수확된 세포의 부피를 확인합니다.
3. 미세소관 추출
알림: 3.1-3.5단계의 모든 것을 얼음 위에 보관하십시오. 3.6단계부터는 모든 것을 따뜻하게 유지해야 합니다(30-37 °C).
- 10mM PIPES/KOH(pH 100), 2mM EGTA/KOH, 2mMMgCl2, 1mM PMSF 및 1개의 프로테아제 억제제 정제(미니)를 포함하는 얼음처럼 차가운 용해 완충액 1mL를 준비합니다.
- 수확된 세포 펠릿을 1:1 v/v 용해 완충액에 재현탁합니다(정확한 부피가 확실하지 않은 경우 용해 완충액을 더 많이 섭취하지 않고 적게 섭취하십시오).
- 초음파 처리로 세포를 용해하십시오 : 15 초 켜짐, 45 초 꺼짐, 암페어 30, 4 사이클 (조건을 실험적으로 결정하고 초음파 처리기에 따라 변경).
- 초음파 처리 후 SDS-PAGE 분석을 위한 샘플을 수집합니다: 2 μL의 용해물 + 18 μL의 물 + 5 μL의 5x SDS 샘플 버퍼.
참고: 표준 광학 현미경으로 세포가 실제로 완전히 용해되었는지 확인하십시오.
- 초음파 처리 후 SDS-PAGE 분석을 위한 샘플을 수집합니다: 2 μL의 용해물 + 18 μL의 물 + 5 μL의 5x SDS 샘플 버퍼.
- 용해된 세포를 원심 튜브에 피펫팅합니다. 초원심분리기 로터에서 4°C에서 100,000× g 에서 1시간 동안 회전시켜 용해물을 제거합니다.
알림: 원심분리기의 올바른 균형을 위해 로터의 모든 주머니가 건조하고 깨끗한지 확인하십시오. - 주사기를 사용하여 제거된 용해물을 꺼냅니다. 펠릿과 상단의 부유층을 방해하지 않도록 주의하십시오.
- 투명화된 용해물의 샘플을 수집합니다: 용해물 2μL + 물 18μL + 5x SDS 샘플 버퍼 5μL.
- 펠릿을 조심스럽게 헹구고 펠릿을 통해 P10 피펫 팁을 소용돌이 치면서 펠릿을 약간 퍼냅니다. 200 μL의 물과 50 μL의 SDS 완충액을 첨가한다.
- 이전 단계의 상청액을 1 mM GTP 및 20 μM 파클리탁셀로 보충하여 미세소관을 중합하고; 부피 1mL의 경우 2mM 파클리탁셀 10μL와 100mM GTP 10μL를 추가합니다.
주의: 파클리탁셀은 피부 자극, 심각한 눈 손상, 호흡기 자극, 유전적 결함, 태아 손상 및 장기 손상을 유발할 수 있습니다. 장기간 또는 반복적인 노출은 장기에 손상을 줄 수 있습니다. 어떤 식으로든 물질을 흡입하거나 분무하거나 먼지를 뿌리지 마십시오. 피부 접촉을 방지하기 위해 고무 니트릴 장갑을 착용하십시오. - GTP/파클리탁셀이 보충된 상청액을 37°C에서 30분 동안 배양하여 미세소관이 조립되도록 합니다.
- 이 배양 단계에서 로터와 초원심분리기를 30°C까지 예열합니다.
- 쿠션 완충액 준비: 0.4mL의 용해 완충액에 0.6mL의 글리세롤을 첨가하고 혼합물에 20μM 파클리탁셀을 보충합니다. 쿠션 버퍼를 37°C로 예열합니다.
- 800 μL의 쿠션 버퍼를 초원심분리기 튜브에 추가합니다. GTP/파클리탁셀이 보충된 용해물을 쿠션 버퍼 위에 조심스럽게 피펫팅합니다.
알림: 매우 부드럽게 피펫팅하여 쿠션 완충액과 용해물이 혼합되는 것을 방지하십시오. - 초원심분리기 로터에서 30°C에서 100,000× g 으로 30분 동안 회전합니다. 미세소관 펠릿이 형성되어야 하는 위치를 쉽게 인식할 수 있도록 원심분리 튜브의 바깥쪽을 향한 가장자리를 표시하십시오.
- 미세소관 펠릿을 방해하지 않도록 주의하면서 피펫을 사용하여 쿠션 버퍼를 조심스럽게 제거합니다.
- 쿠션 버퍼 샘플 수집: 2 μL + 물 18 μL + 5x SDS 샘플 버퍼 5 μL.
- 펠릿을 따뜻한 용해 완충액으로 조심스럽게 3배 세척하여 글리세롤을 제거합니다. 펠릿 옆에 따뜻한 완충액을 부드럽게 분배하고(펠릿 위에 액체를 직접 플러시하지 않음) 튜브를 몇 번 돌려 펠릿과 튜브 벽에서 가능한 한 많은 글리세롤을 제거한 다음 흡인하고 반복합니다.
알림: 글리세롤이 제대로 씻겨 나가지 않으면 전자 조명 아래에서 그리드가 매우 빠르게 녹습니다. 이것은 높은 입자 움직임으로 입증되어 흐릿한 이미지를 만들 수 있습니다. - 다음 성분으로 재현탁 완충액을 준비하십시오: 100mM PIPES/KOH(pH 6.9), 2mM EGTA/KOH 및 1mMMgCl2, 완충액을 37°C로 가온합니다.
- 세척된 펠릿을 ~50μL의 예열된 재현탁 완충액에 절단된 팁으로 부드럽게 재현탁하고 튜브를 37°C로 유지합니다.
- 재현탁 펠릿 분획의 샘플 수집: 2μL + 물 18μL + 5x SDS 샘플 버퍼 5μL.
팁 : 절단 팁은 미세 소관의 파손을 방지합니다. 금속 가열 블록을 37°C로 준비하고 이를 폴리스티렌 상자에 보관하여 시료 튜브를 실온으로 냉각하지 않고 쉽게 운반할 수 있도록 합니다.
- 재현탁 펠릿 분획의 샘플 수집: 2μL + 물 18μL + 5x SDS 샘플 버퍼 5μL.
4. Cryo-EM 그리드 준비
- 압지를 설치하여 플런지 냉동 장치를 준비합니다. 플런지 냉동고를 최대 30°C까지 예열하고 가습을 100%로 설정합니다. 온도와 습도가 평형을 이루도록 ~30분 정도 기다립니다.
- 플런지 냉동고의 설정을 두 가지 응용 프로그램으로 준비하고 전체 프로그램을 한 번 실행하여 설정이 올바르게 설정되었는지 확인합니다. 첫 번째 애플리케이션의 힘은 10초, 2초의 블롯 시간 및 0초의 대기 시간을 가지며 두 번째 애플리케이션의 힘은 10초, 6.5초의 블롯 시간 및 10초의 대기 시간을 갖는지 확인합니다.
- 30mA에서 60초 동안 Cryo-EM 그리드를 글로우 방전합니다.
- 폴리스티렌 용기 어셈블리를 LN2로 냉각하고 에탄 가스를 차가운 금속 컵에 응축하여 금속 컵에 액체 에탄을 준비합니다.
- 100 mM PIPES/KOH (pH 6.9), 2 mM EGTA/KOH 및 1 mMMgCl2 성분으로 희석 완충액을 준비하고, 37°C로 가온한다.
- 미세소관 상호작용 단백질을 그리드에 적용하기 직전에 희석 완충액으로 1:1 v/v로 희석하여 염 농도가 낮아지도록 합니다(최종 염 농도 50mM NaCl 사용). 혼합물을 37°C에서 유지한다.
- 플런지 핀셋으로 글로우 방전 그리드를 잡고 플런지 냉동고에 딸깍 소리를 냅니다.
- 플런지 냉동고에 액체 에탄이 있는 폴리스티렌 용기를 배치하고 준비된 프로그램을 통해 실행합니다: 먼저 3.5 μL의 미세소관 용액을 그리드에 적용하고, 플런지 냉동고가 그리드를 블럿한 다음 즉시 3.5 μL의 갓 희석된 단백질을 적용하고, 마지막으로, 플런저가 액체 에탄에서 그리드를 블럽하고 플런지 동결시킵니다.
- 그리드를 그리드 보관 상자로 옮기고 이미징할 때까지 LN2 듀어에 보관합니다.
결과
우리는 Cryo-EM에 의해 티로신화된 미세소관에 결합된 튜불린 데티로시나제 MATCAP를 조사했습니다. 이를 위해 우리는 세 가지 알려진 탈티로신 효소인 VASH1/2 및 MATCAP가 모두 결여된 유전자 변형 HCT116 세포주에서 완전히 티로신화된 미세소관을 추출했습니다. 우리는 약 0.5-4mL의 세포 펠릿에서 미세소관을 추출하기 위해 6-12개의 합류 15cm 접시를 사용했습니다(그림 1). 두 번째 원심분리 단계(단계 3.11) 후, 가시적이지만 작고 투명한 펠릿이 생성됩니다(그림 1I). 미세소관 수율은 일반적으로 ~75μg입니다. 펠릿이 보이지 않는 경우, 이는 잘못된 미세소관 중합 온도, 사용된 GTP 또는 파클리탁셀의 품질 문제 또는 너무 많은 용해 완충액의 첨가와 같은 이전 단계 중 하나의 문제를 나타낼 수 있으며, 그 결과 중합에 너무 낮은 튜불린 농도가 발생합니다. 추출된 미세소관의 품질과 농도를 평가하기 위해 Coomassie로 염색된 SDS 젤에서 샘플을 분석했습니다(그림 2A). 이러한 분석은 추출된 미세소관이 비교적 순수하다는 것을 나타냅니다. BSA 정량화에서 파생된 보간된 미세소관 농도는 ~1.4mg/mL였습니다. 이것은 분광 광도계로 측정한 수치와 잘 일치합니다(그림 2B, C).
갓 추출한 미세소관은 Cryo-EM용 시료를 만드는 데 직접 사용할 수 있습니다. 미세소관은 현미경 사진에서 손상되지 않고 풍부하게 보여야 합니다. 추가 Cryo-EM 분석의 경우, 미세소관이 서로 교차하는 것을 방지하기 위해 현미경 사진당 미세소관 밀도를 낮추는 것이 중요합니다(그림 3A). 깨진 미세소관 또는 보이지 않는 미세소관은 미세소관이 해중합되거나(예: 저온 또는 GTP 가수분해로 인해) 블로팅 및 플런지 동결 매개변수가 올바르게 설정되지 않았음을 나타낼 수 있습니다. 미세소관 주변의 배경은 밀도가 높으며 아마도 중합되지 않은 튜불린으로 추정됩니다.
MATCAP의 분자량은 53kDa이며 튜불린 단량체의 크기 바로 아래에 구형 촉매 도메인이 있습니다. 따라서 미세소관의 MATCAP 장식은 시각적으로 감지할 수 있습니다. MATCAP에 결합하지 않은 미세소관은 "매끄러운" 가장자리를 보인 반면, MATCAP에 결합한 미세소관은 미세소관 표면에 전자 밀도가 높은 점이 특징인 "거친" 가장자리를 가졌습니다(그림 3B). MATCAP 결합 및 MATCAP 결합되지 않은 미세소관도 계산된 2D 클래스에서 구별할 수 있지만 모양과 크기로 인해 다른 미세소관 상호 작용 단백질에 따라 다를 수 있습니다(그림 3C). 밀도가 실제로 관심 단백질에 속하는지 확인하기 위해 실험적으로 결정되거나 예측된 구조를 활용할 수 있습니다. 또한 비교를 위해서만 미세소관을 포함하는 제어 그리드를 만드는 것이 좋습니다. 이는 미세소관이 중합되어 충분히 높은 농도로 온전하게 추출되었는지, 플런지 동결 공정이 올바르게 실행되었는지 여부를 나타냅니다. 우리는 두 번째 MATCAP 적용으로 그리드에서 미세소관 풍부도가 감소한다는 것을 알아차렸습니다.
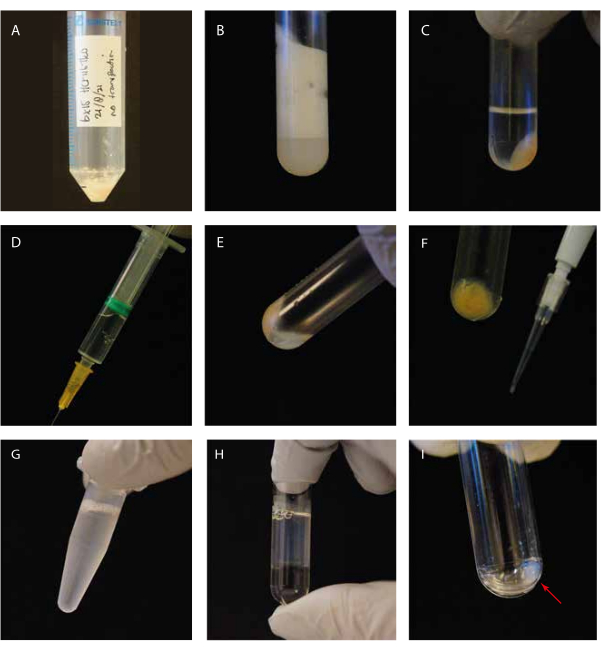
그림 1: 실험 단계의 시각적 안내. (a) 용해 전의 세포 펠렛; (b) 원심분리 전에 초원심분리 튜브에서 세포를 초음파 처리하는 단계; (c) 원심분리 후 초원심분리 튜브에서 세포를 초음파 처리하는 단계; (d) 투명화된 상층액이 있는 주사기; (e) 상등액 제거 후의 잔류 펠릿-"백색 부유층"; (f) P10 팁과 SDS 쿠마시 겔용 세포 파편 펠렛; (G) 배양 전 GTP/파클리탁셀 보충 상청액; (H) 초원심분리기 튜브의 글리세롤 쿠션 위에 GTP/파클리탁셀 배양 상청액; (i) 제2 원심분리 단계 후 미세소관 펠렛을 세척한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
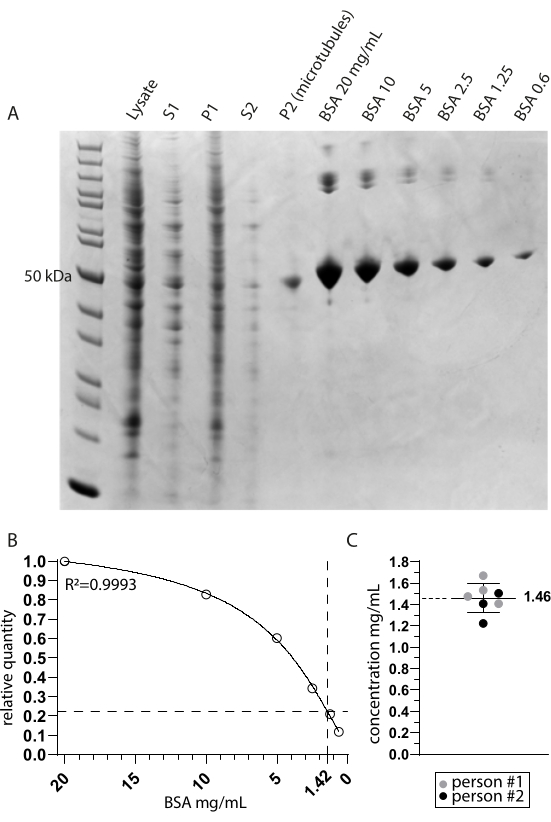
그림 2: 미세소관 순도 및 농도 측정 . (A) 추출 프로토콜 동안 채취한 샘플과 BSA 농도 비교를 보여주는 Coomassie-stained SDS 페이지 겔. S1 및 P1은 각각 제1 원심분리 단계 후의 상청액 및 펠렛에 상응한다. S2 및 P2는 유사하게 제2 원심분리 단계에 대응한다. (B) A로부터 도출된 상대적 BSA 수량의 비선형 회귀선. P2(미세소관) 레인에서 약 50kDa의 미세소관 대역의 보간은 1.42mg/mL의 최종 농도를 나타냅니다. (C) 두 사람이 측정하고 TUBA1A와 TUBB3의 결합 흡광 계수(0.971)에 대해 보정한 재현탁 미세소관(P2)의 분광 광도계 분석은 1.46mg/mL ± 0.14mg/mL의 평균 및 표준 편차 농도를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 현미경 사진의 예. (A) MATCP에 결합된 미세소관을 보여주는 현미경 사진의 예. 녹색 상자로 표시된 미세소관은 손상되지 않고 장식되어 있으며 Cryo-EM 분석에 사용할 수 있습니다. 주황색 상자로 표시된 미세소관은 손상되지 않고 장식된 미세소관이지만 왼쪽 미세소관 가까이에 위치합니다. 따라서, Cryo-EM 분석에 포함시키는 것은 적합하지 않다. 빨간 상자의 미세소관이 교차하여 부서지고 있습니다. 이러한 것들은 Cryo-EM 분석에서 제외되어야 합니다. (B) 왼쪽 패널의 녹색으로 둘러싸인 미세소관의 확대도. 빨간색 화살촉은 MATCAP을 적용한 현미경 사진의 미세소관에만 나타나는 검은색 점을 나타내므로 미세소관에 결합된 MATCP에 해당할 가능성이 높습니다. (C) A에서 고가와 저장식을 보여준 미세소관 입자의 2D 클래스와 MATCAP(가장 오른쪽 패널)에 의해 데코레이션이 관찰되지 않은 다른 데이터 세트의 2D 클래스의 예. 스케일 바 = (A) 50 nm, (B) 25 nm, (C) 10 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: MATCAP 결핍 및 VASH1/2 결핍 삼중 녹아웃(TKO) HCT116 세포, 상업용 돼지 뇌 및 HeLa 튜불린에서 유래한 미세소관의 면역블롯 분석. 약어: TKO = 트리플 녹아웃; mAb = 단클론 항체; pAb = 다클론 항체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 방법은 세포주에서 내인성 튜불린을 신속하게 추출한 후 Cryo-EM 그리드에 미세소관을 장식하는 방법을 설명합니다. 미세소관은 온도에 민감합니다. 그들은 추운 환경에서 해중합하고 따뜻한 환경에서 중합합니다31. 따라서 튜불린을 가용화하기 위해 4 °C에서 초음파 처리 및 클리어런스 스핀 (1.1-1.5 단계)을 실행하는 것이 중요합니다. 어떤 요인이 미세소관을 너무 잘 안정화시켜 이 단계에서 해중합되지 않는다면, 이러한 미세소관과 안정화 인자는 초기 클리어런스 스핀 후에 펠릿에서 폐기될 것입니다. 미세소관을 (재)중합한 후에는 중합된 미세소관을 포함하는 용액을 항상 따뜻하게 유지하는 것이 중요합니다. 우리는 VASH1, VASH2 및 MATCAP 단백질이 결핍된 HCT116 세포에서 미세소관을 추출했습니다. 조직뿐만 아니라 다른 세포주를 사용하여 미세소관(microtubules)29을 추출할 수 있지만, 오염 물질, 튜불린 이소타입 및 수율은 여기에 설명된 것과 매우 다를 수 있다. 변형 효소를 함유하는 과발현 플라스미드는 또한 특정 튜불린 변형을 도입하는 데 사용될 수 있습니다.
다른 프로토콜(18,27,28,29,30)은 다른 상호작용 단백질이 없는 미세소관을 얻기 위해 미세소관의 중합 및 해중합의 다중 사이클을 사용한다. 여기에서 우리는 이러한 프로토콜을 단순화하고 미세소관을 한 번만 중합합니다. 이 단일 중합으로 인해 이러한 미세소관은 다른 미세소관 상호 작용 단백질과 함께 침전될 수 있습니다. 그러나 우리는 이 프로토콜이 Cryo-EM 목적을 위해 충분히 순수한 미세소관을 제공한다는 것을 발견했습니다. 특정 분석을 위해 더 순수한 샘플이 필요한 경우, 중합 및 해중합의 추가 주기는 더 순수한 샘플을 생성할 수 있지만, 이는 미세소관 수율을 희생시킬 수 있습니다. 이 프로토콜에서 우리는 파클리탁셀을 사용하여 미세소관을 중합했습니다. 그러나 파클리탁셀은 미세소관 격자를 특정 비틀림 및 상승으로 편향시킬 수 있으며, 이는 관심 단백질의 미세소관 친화도를 방해할 수 있습니다. 파클리탁셀이 부적합한 경우 다른 미세소관 안정화 시약을 사용할 수 있습니다. 이러한 시약의 예로는 비-탁산 분자, 예컨대 펠로루사이드 또는 비-가수분해성 GTP 변이체, 예컨대 GMPCPP17,32가 있다.
Cryo-EM 그리드의 미세소관에 결합하는 단백질을 구조적으로 조사하려면 충분한 양의 관심 단백질을 미세소관에 결합해야 합니다. 일반적으로 발생하는 문제는 용액에서 안정적인 단백질 복합체가 그리드에서 분리된다는 것입니다. 그리드 상에 단백질 복합체를 형성하기 위해서는 먼저 미세소관을 적층한 다음 염 농도가 낮은 미세소관 결합 단백질을 미세소관 코팅 그리드에 적용하여 단백질 복합체를 그리드에 직접 조립하는 것이 중요했습니다. 다른 연구자들은 성공적인 미세소관 장식을 위한 저염 33,34 프로토콜과 2단계 적용34,35,36 프로토콜을 유사하게 보고했습니다. 염 농도가 낮을수록 정전기 전하가 감소하여 단백질 복합체가 보다 안정적인 상호 작용으로 편향될 가능성이 있습니다. 그러나 염 농도가 낮기 때문에 관심 단백질이 침전될 위험이 있습니다. 따라서 그리드를 유리화하기 직전까지 단백질을 생리학적으로 관련된 염 농도 또는 그 부근으로 유지하는 것이 좋습니다. 이 2단계 적용 프로토콜은 블로팅 또는 플런지 동결 단계에서 단백질 복합체가 분리되는 것을 방지할 수 있습니다. 이 프로토콜에서는 Vitrobot을 사용했습니다. 그러나 더 빠른 유리화 방법(VitroJet) 또는 무점 그리드(Puffalot) 또는 두 가지 특성을 모두 가진 장치(카멜레온)의 사용은 잠재적으로 2단계 적용을 극복할 수 있지만 현재 테스트에 널리 사용되지 않습니다.
재구성된 Cryo-EM 밀도의 최종 분해능은 미세소관에 대한 미세소관 결합 단백질의 움직임 및 달성할 수 있는 장식 수준을 비롯한 여러 요인의 영향을 받을 수 있습니다. 더 높은 미세소관 장식은 3D 밀도 재구성에서 얻은 최종 해상도에 도움이 될 수 있습니다. 이는 미세소관 결합 단백질의 정제 중에 얻어지는 가장 높은 단백질 농도, 미세소관 상호작용 단백질이 응집되지 않고 견딜 수 있는 가장 낮은 염 농도 및 미세소관 상호작용 단백질의 결합 모드(예: 단백질이 둘 이상의 튜불린 이량체에 걸쳐 있을 수 있으므로 1:1 결합 비율을 방해함)와 같은 몇 가지 요인에 의해 제한될 수 있습니다. Cryo-EM 재구성의 분리능은 드물게 장식된 미세소관에 의해 손상될 수 있지만, 최근에 보고된 매우 드물게 장식된 미세소관-단백질 복합체 구조에서 볼 수 있듯이 전산 분석은 많은 문제를 피할 수 있습니다8.
여기서 설명하는 프로토콜은 Cryo-EM 목적에 적합한 미세소관을 얻을 수 있는 빠르고 저렴한 방법을 제시합니다. 상업적으로 이용 가능한 돼지 뇌 튜불린과 달리 MATCAP 결핍 및 바소히빈 결핍 HCT116 세포에서 파생된 미세소관은 완전히 티로신화되어 있습니다(그림 4). 고가의 시약인 상업적인 헬라 튜불린은 원칙적으로 비교적 균일하게 티로신화되어 있고, 글루타밀화와 같은 다른 변형4을 거의 포함하지 않지만, 배치는 다양할 수 있으며, 변형은 시험관 내에서만 이루어질 수 있다. 맞춤형 세포주에서 미세소관을 추출하는 것의 장점은 튜불린 디티로시나제와 같은 튜불린 변형 효소를 과발현하거나 삭제하여 보다 균일한 미세소관 풀을 생성할 수 있는 유연성입니다. 이는 Cryo-EM 시료의 데코레이션 및 균일성에 도움이 될 수 있으며, 궁극적으로 이 시료에서 파생된 Cryo-EM 밀도 맵과 분자 구조의 용이성과 품질에도 도움이 됩니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
유익한 과학적 토론과 쾌적한 작업 환경을 제공한 Sixma, Brummelkamp 및 Perrakis 그룹의 모든 구성원에게 감사드리며, 특히 그림 3C에 묘사된 단백질 농도를 결정하는 데 도움을 준 Jan Sakoltchik("사람 2")에게 감사드립니다. 또한 NKI Cryo-EM 시설과 라이덴 대학교의 네덜란드 전자 나노스코피 센터(NeCEN)의 지원에도 감사드립니다. 이 작업은 TRB에 수여된 NWO Vici 보조금 016.Vici.170.033의 지원을 받았습니다. A.P.와 T.R.B.는 Oncode 조사관이며 NWO ENW(OCENW. M20.324)입니다. L.L.은 오스트리아 과학 기금 (FWF JB4448-B)으로부터 자금을 지원 받았다. 이 연구는 네덜란드 암 학회와 네덜란드 보건 복지 체육부의 기관 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Material | |||
| 0.05% trypsin-EDTA | Gibco | 25300-054 | Cell culture |
| 10 cm plate | Falcon | 353003 | Cell culture |
| 15 cm plate | Thermo FisherScientific | 168381 | Cell culture |
| 50 mL tubes | Sarstedt | 62.547255 | Cell culture |
| 300 mesh quantifoil holey carbon copper grid R1.2/1.3 | Quantifoil Micro Tools | N1-C14nCu30-01 | Cryo-EM grid preparation |
| Cell scrapers | Falcon | 353085 | Cell culture |
| DMEM | Gibco | 41966-029 | Cell culture |
| EDTA | Merck | 108418 | Cell culture |
| EGTA | Sigma Aldrich | E3899 | Microtubule extraction |
| Ethane gas | Cryo-EM grid preparation | ||
| FCS | Serana | s-FBS-EU-015 | Cell culture |
| Glycerol | VWR | 24.397.296 | Microtubule extraction |
| GTP | Fisher Scientific | G8877-1G | Microtubule extraction |
| HCT116 VASH1 VASH2 MATCAP KO cells | self made | Wild type HCT116 cells RRID: CVCL_0291 | Cell culture |
| KOH | Merck | 1.05033 | Microtubule extraction |
| MgCl2 | Merck | 105833 | Microtubule extraction |
| Microtubule binding protein | self made | Cryo-EM grid preparation | |
| Needle | BD microlance | 300600 | Microtubule extraction |
| Paclitaxel | Santa Cruz Biotechnology | sc-212517 | caution toxic, microtubule extraction |
| PBS | Fisher Scientific | BP399 | Cell culture |
| Penicillin and streptomycin | Sigma Aldrich | P0781-100mL | Cell culture |
| PIPES | Merck | P8203 | Microtubule extraction |
| PMSF (in EtOH) | Roche | 16837091001 | Microtubule extraction |
| SDS sample buffer | self made | Quality assessment | |
| Syringe | BD plastipak | 309658 | Microtubule extraction |
| Ultra protease tables mini | Fisher Scientific | NC0975224 | Microtubule extraction |
| Whatman blotting paper | Whatman | 47000-100 | Cryo-EM grid preparation |
| Equipment | |||
| Flow hood | cell culture | ||
| GloQube | Quorum | Cryo-EM grid preparation | |
| Grid storage box | SWISSCI | 41018 | Cryo-EM grid storage |
| Heating block, electric or metal | to warm the buffers | ||
| Incubator, cell culture | NUAIR | cell culture | |
| LN2 dewar | Cryo-EM grid storage | ||
| Plunge-tweezers | Electron Microscopy Sciences | 0508-L5-PS | Cryo-EM grid preparation, hole drilled in top to fit the vitrobot |
| Polystyrene box | to keep the buffers warm | ||
| Sonicator | Qsonica | Q700 | Microtubule extraction |
| Standard light microscope | Olympus | CKX 41 | Quality assessment |
| TLA 100.3 rotor | Beckman Coulter | Microtubule extraction | |
| TLA 120.2 rotor | Beckman Coulter | Microtubule extraction | |
| Tubes for TLA 100.3 rotor | Beckman Coulter | 326819 | Microtubule extraction |
| Tubes for TLA 120.2 rotor | Beckman Coulter | 347356 | Microtubule extraction |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | Microtubule extraction |
| Vitrobot | FEI, ThermoFischer Scientific | mark IV | Cryo-EM grid preparation |
| Vitrobot polystyrene container assembly with metal ethane cup | ThermoFisher Scientific | 200703 | Cryo-EM grid preparation |
| Water bath | cell culture |
참고문헌
- Janke, C., Magiera, M. M. The tubulin code and its role in controlling microtubule properties and functions. Nature Reviews Molecular Cell Biology. 21 (6), 307-326 (2020).
- Peris, L., et al. Motor-dependent microtubule disassembly driven by tubulin tyrosination. Journal of Cell Biology. 185 (7), 1159-1166 (2009).
- McKenney, R. J., Huynh, W., Tanenbaum, M. E., Bhabha, G., Vale, R. D. Activation of cytoplasmic dynein motility by dynactin-cargo adapter complexes. Science. 345 (6194), 337-341 (2014).
- Barisic, M., et al. Microtubule detyrosination guides chromosomes during mitosis. Science. 348 (6236), 799-803 (2015).
- Sirajuddin, M., Rice, L. M., Vale, R. D. Regulation of microtubule motors by tubulin isotypes and post-translational modifications. Nature Cell Biology. 16 (4), 335-344 (2014).
- Nogales, E., Kellogg, E. H. Challenges and opportunities in the high-resolution cryo-EM visualization of microtubules and their binding partners. Current Opinion in Structural Biology. 46, 65-70 (2017).
- Manka, S. W., Moores, C. A. Microtubule structure by cryo-EM: Snapshots of dynamic instability. Essays in Biochemistry. 62 (6), 737-751 (2018).
- Chaaban, S., Carter, A. P. Structure of dynein-dynactin on microtubules shows tandem adaptor binding. Nature. 610 (7930), 212-216 (2022).
- Lacey, S. E., He, S., Scheres, S. H., Carter, A. P. Cryo-EM of dynein microtubule-binding domains shows how an axonemal dynein distorts the microtubule. eLife. 8, 47145 (2019).
- Walton, T., Wu, H., Brown, A. Structure of a microtubule-bound axonemal dynein. Nature Communications. 12, 477 (2021).
- Sindelar, C. V., Downing, K. H. An atomic-level mechanism for activation of the kinesin molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 107 (9), 4111-4116 (2010).
- Zhang, R., Alushin, G. M., Brown, A., Nogales, E. Mechanistic origin of microtubule dynamic instability and its modulation by EB proteins. Cell. 162 (4), 849-859 (2015).
- Maurer, S. P., Fourniol, F. J., Bohner, G., Moores, C. A., Surrey, T. EBs Recognize a nucleotide-dependent structural cap at growing microtubule ends. Cell. 149 (2), 371-382 (2012).
- Benoit, M. P. M. H., Asenjo, A. B., Sosa, H. Cryo-EM reveals the structural basis of microtubule depolymerization by kinesin-13s. Nature Communications. 9, 1662 (2018).
- Kellogg, E. H., et al. Near-atomic model of microtubule-tau interactions. Science. 360 (6394), 1242-1246 (2018).
- Brotzakis, Z. F., et al. A structural ensemble of a Tau-microtubule complex reveals regulatory Tau phosphorylation and acetylation mechanisms. ACS Central Science. 7 (12), 1986-1995 (2021).
- Kellogg, E. H., et al. Insights into the distinct mechanisms of action of taxane and non-taxane microtubule stabilizers from cryo-EM structures. Journal of Molecular Biology. 429 (5), 633-646 (2017).
- Vallee, R. B. Reversible assembly purification of microtubules without assembly-promoting agents and further purification of tubulin, microtubule-associated proteins, and MAP fragments. Methods in Enzymology. 134, 89-104 (1986).
- Wloga, D., Joachimiak, E., Louka, P., Gaertig, J. Posttranslational modifications of tubulin and cilia. Cold Spring Harbor Perspectives in Biology. 9 (6), 028159 (2017).
- Nieuwenhuis, J., Brummelkamp, T. R. The tubulin detyrosination cycle: Function and enzymes. Trends in Cell Biology. 29 (1), 80-92 (2019).
- Nieuwenhuis, J., et al. Vasohibins encode tubulin detyrosinating activity. Science. 358 (6369), 1453-1456 (2017).
- Aillaud, C., et al. Vasohibins/SVBP are tubulin carboxypeptidases (TCPs) that regulate neuron differentiation. Science. 358 (6369), 1448-1453 (2017).
- Landskron, L., et al. Posttranslational modification of microtubules by the MATCAP detyrosinase. Science. 376 (6595), (2022).
- Erck, C., et al. A vital role of tubulin-tyrosine-ligase for neuronal organization. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7853-7858 (2005).
- Pagnamenta, A. T., et al. Defective tubulin detyrosination causes structural brain abnormalities with cognitive deficiency in humans and mice. Human Molecular Genetics. 28 (20), 3391-3405 (2019).
- Peris, L., et al. Tubulin tyrosination regulates synaptic function and is disrupted in Alzheimer's disease. Brain. 145 (7), 2486-2506 (2022).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nature Protocols. 14 (5), 1634-1660 (2019).
- Gell, C., et al. Purification of tubulin from porcine brain. Methods in Molecular Biology. 777, 15-28 (2011).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled posttranslational modifications and isotypes from limited sources by polymerization-depolymerization cycles. Journal of Visualized Experiments. (165), e61826 (2020).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein Expression and Purification. 32 (1), 83-88 (2003).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue. GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Sindelar, C. V., Downing, K. H. The beginning of kinesin's force-generating cycle visualized at 9-Å resolution. Journal of Cell Biology. 177 (3), 377-385 (2007).
- Kellogg, E. H., et al. Near-atomic cryo-EM structure of PRC1 bound to the microtubule. Proceedings of the National Academy of Sciences of the United States of America. 113 (34), 9430-9439 (2016).
- Maurer, S. P., Bieling, P., Cope, J., Hoenger, A., Surrey, T. GTPγS microtubules mimic the growing microtubule end structure recognized by end-binding proteins (EBs). Proceedings of the National Academy of Sciences of the United States of America. 108 (10), 3988-3993 (2011).
- Manka, S. W., Moores, C. A. Pseudo-repeats in doublecortin make distinct mechanistic contributions to microtubule regulation. EMBO Reports. 21 (12), 51534 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유