5.10 : الغازات الحقيقية- الانحراف عن قانون الغاز المثالي
حتى الآن، تم تطبيق قانون الغاز المثالي، PV = nRT ، على مجموعة متنوعة من المشكلات المختلفة، بدءاً من قياس العناصر المتفاعلة ومشكلات الصيغة التجريبية والجزيئية إلى تحديد الكثافة والكتلة المولية للغاز. ومع ذلك، غالباً ما يكون سلوك الغاز غير مثالي، مما يعني أن العلاقات المرصودة بين ضغطه وحجمه ودرجة حرارته لم يتم وصفها بدقة بواسطة قوانين الغاز
وفقاً للنظرية الجزيئية الحركية، لا تُظهر جزيئات الغاز المثالي قوى جذب أو تنافر مع بعضها البعض. من المفترض أن يكون حجمها ضئيلاً مقارنةً بحجم الوعاء الحاوي. في درجة حرارة الغرفة و1 atm أو أقل، تتبع الغازات السلوك المثالي، كما هو موضح في معادلة الغاز المثالية.
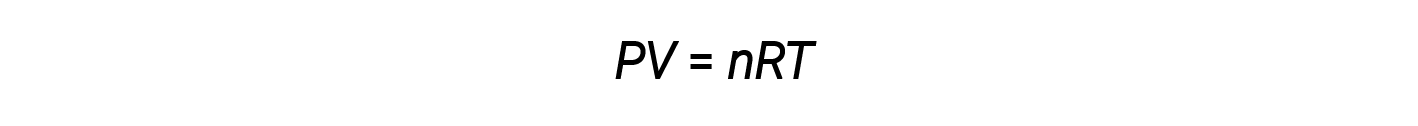
ومع ذلك، عند الضغط العالي أو درجات الحرارة المنخفضة، تحدث انحرافات عن قانون الغاز المثالي، مما يعني أن العلاقات الملحوظة بين الضغط والحجم ودرجة الحرارة لا يتم اتباعها بدقة.
تؤدي إعادة ترتيب معادلة الغاز المثالية لحل قيمة n إلى ما يلي:
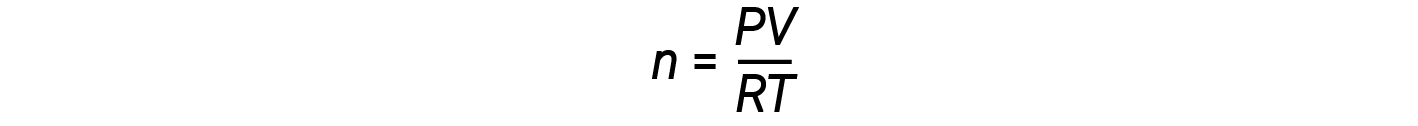
بالنسبة إلى مول واحد من الغاز المثالي ، النسبةPV/RT = 1، بغض النظر عن الضغط. أي انحراف لهذه النسبة عن واحد هو مؤشر على السلوك غير المثالي.
لا يصف قانون الغاز المثالي سلوك الغاز جيداً عند الضغوط العالية نسبياً. بمعنى أن النسبة تساوي 1 فقط عند الضغط المنخفض. ولكن مع ارتفاع الضغط ، يبدأ PV/RT في الانحراف عن 1، وتكون الانحرافات غير موحدة. عند الضغط العالي، يكون الانحراف عن السلوك المثالي كبيراً ومختلفاً لكل غاز. بمعنى آخر، لا تتصرف الغازات الحقيقية بشكل مثالي عند الضغط العالي. عند الضغط المنخفض (عادةً أقل من 10 atm) ، يكون الانحراف عن السلوك المثالي صغيراً، ويمكننا استخدام معادلة الغاز المثالي.
لا تحتوي جزيئات الغاز المثالي الافتراضي على حجم كبير ولا تتجاذب أو تتنافر. بشكل عام، تقترب الغازات الحقيقية من هذا السلوك عند ضغوط منخفضة نسبياً ودرجات حرارة عالية. ومع ذلك، عند الضغط العالي، تتزاحم جزيئات الغاز بالقرب من بعضها البعض، وتقل مساحة الفراغ بين الجزيئات. عند هذه الضغوط العالية، يصبح حجم جزيئات الغاز نفسها ملموساً بالنسبة للحجم الكلي الذي يشغله الغاز. لذلك ، يصبح الغاز أقل انضغاطاً عند هذه الضغوط العالية، وعلى الرغم من استمرار حجمه في الانخفاض مع زيادة الضغط، فإن هذا الانخفاض لا يتناسب كما توقع قانون بويل’s law.
في ضغوط منخفضة نسبياً، لا تمتلك جزيئات الغاز عملياً أي جاذبية لبعضها البعض لأنها (في المتوسط) متباعدة جداً ، وتتصرف تقريباً مثل جزيئات الغاز المثالي. ومع ذلك، فإن قوة الجاذبية لم تعد مهملة أيضاً عند الضغوط العالية. تسحب هذه القوة الجزيئات أقرب قليلاً من بعضها، مما يقل الضغط قليلاً (إذا كان الحجم ثابتاً) أو يقل الحجم (عند ضغط ثابت). يكون هذا التغيير أكثر وضوحاً في درجات الحرارة المنخفضة لأن الجزيئات لديها KE أقل مقارنة بالقوى الجاذبة، وبالتالي فهي أقل فعالية في التغلب على عوامل الجذب هذه بعد الاصطدام مع بعضها البعض.
هناك عدة معادلات مختلفة تقرب سلوك الغاز بشكل تقريبي أفضل من قانون الغاز المثالي. تم تطوير أولها وأبسطها من قبل العالم الهولندي يوهانس فان دير فالس في عام 1879. تطوّرت معادلة فان دير فال قانون الغاز المثالي بإضافة مصطلحين: أحدهما لحساب حجم جزيئات الغاز والآخر لحساب القوى الجاذبة بينهما.
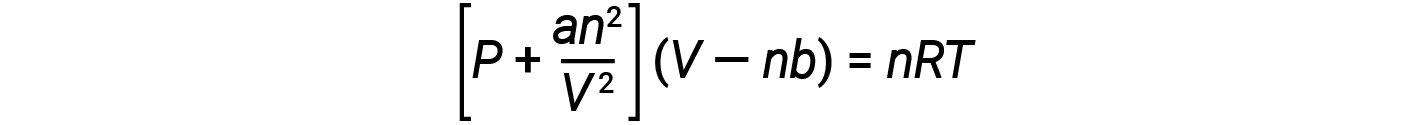
يتوافق الثابت a مع قوة التجاذب بين جزيئات غاز معين، ويقابل الثابت b حجم جزيئات غاز معين.“التصحيح” بالنسبة لمصطلح الضغط في قانون الغاز المثالي هو an2/V2، و “التصحيح” بالنسبة لمصطلح الحجم هو nb. لاحظ أنه عندما يكون V كبيراً نسبياً و n صغيراً نسبياً، يصبح كلا مصطلحي التصحيح هذين مهملين، وتختزل معادلة فان دير فال إلى قانون الغاز المثالي، PV= nRT. تتوافق مثل هذه الحالة مع غاز يشغل فيه عدد قليل نسبياً من الجزيئات حجماً كبيراً نسبياً، أي غاز عند ضغط منخفض نسبياً.
عند الضغط المنخفض، يكون التصحيح الخاص بالتجاذب بين الجزيئات، a ، أكثر أهمية من التصحيح الخاص بالحجم الجزيئي، b. في ضغوط عالية وأحجام صغيرة، يكون تصحيح حجم الجزيئات أمراً مهماً لأن الجزيئات نفسها غير قابلة للضغط وتشكل جزءاً لا بأس به من الحجم الكلّي. عند بعض الضغط المتوسط، يكون للتصحيحين تأثيرات متعارضة، ويبدو أن الغاز يتبع العلاقة التي تقدمها PV = nRT عبر نطاق صغير من الضغوط.
وبالمعنى الدقيق للكلمة، فإن معادلة الغاز المثالية تعمل بشكل جيد عندما تكون عوامل الجذب بين جزيئات الغاز ضئيلة للغاية، وجزيئات الغاز ذاتها لا تشغل جزءاً ملموساً من الحجم الكلي. يتم استيفاء هذه المعايير في ظل ظروف الضغط المنخفض ودرجة الحرارة المرتفعة. وفي ظل هذه الظروف، يُقال إن الغاز يتصرف على نحو مثالي، وإن الانحرافات عن قوانين الغاز ضئيلة إلى الحد الذي قد يسمح بتجاهلها ــ ولكن هذه ليست الحال في كثير من الأحيان.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 9.2: Non-ideal Gas Behavior.
From Chapter 5:

Now Playing
5.10 : الغازات الحقيقية- الانحراف عن قانون الغاز المثالي
Gases
34.2K Views

5.1 : الضغط وقياس الضغط
Gases
35.5K Views

5.2 : قوانين الغازات
Gases
65.3K Views

5.3 : تطبيقات قانون الغاز المثالي: الكتلة المولية والكثافة والحجم
Gases
56.1K Views

5.4 : خليط الغازات- قانون دالتون
Gases
38.8K Views

5.5 : الحسابات الكيميائية للعناصر المتفاعلة والغازات
Gases
24.4K Views

5.6 : النظرية الجزيئية الحركية: المسلّمات الأساسية
Gases
33.3K Views

5.7 : النظرية الجزيئية الحركية وقوانين الغاز
Gases
32.2K Views

5.8 : السرعات الجزيئية والطاقة الحركية
Gases
27.1K Views

5.9 : الانصباب والانتشار
Gases
28.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved