5.10 : 真实气体-偏离理想气体定律
到目前为止,理想气体定律 PV = nRT 已应用于各种不同类型的问题,从反应化学计量学,经验和分子式问题到确定密度和摩尔比气体质量。但是,气体的行为通常是不理想的,这意味着气体定律无法准确描述所观察到的其压力,体积和温度之间的关系。
根据动力学分子理论,理想气体的粒子彼此之间不表现出吸引力或排斥力。假定它们的体积与容器的体积相比可以忽略不计。如理想气体方程式所暗示,在室温和1个大气压或更低的温度下,气体遵循理想行为。
然而,在较高的压力或较低的温度下,会发生偏离理想气体定律的现象,这意味着未准确遵循所观察到的其压力,体积和温度之间的关系。
重新排列理想气体方程式来求解 n 可得出:
对于1摩尔的理想气体,无论压力如何,比率 PV / RT = 1。该比率与1的任何偏差都表示不理想的行为。
理想的气体定律不能很好地描述相对较高压力下的气体行为。这意味着该比率仅在低压下等于1。但是随着压力的升高, PV / RT 开始偏离1,偏差也不均匀。在高压下,每种气体与理想行为的偏差都很大且各不相同。换句话说,实际气体在高压下的行为并不理想。但是,在较低压力(通常低于10个大气压)下,与理想行为的偏差很小,我们可以使用理想气体方程式。
假设的理想气体的粒子没有明显的体积,并且不会相互吸引或排斥。通常,在相对较低的压力和高温下,实际气体近似于这种行为。然而,在高压下,气体分子更紧密地拥挤在一起,并且分子之间的空白空间减少了。在这些较高的压力下,气体分子本身的体积相对于气体所占的总体积变得可观。因此,气体在这些高压下变得不可压缩,尽管其体积随着压力的增加而持续减小,但这种减小与波义耳定律所预测的不成比例。
在相对较低的压力下,气体分子彼此之间几乎没有吸引力,因为它们(平均)相距很远,并且它们的行为几乎类似于理想气体的粒子。但是,在较高压力下,吸引力也不再是微不足道的。该力将分子拉得更近一些,从而稍微降低压力(如果体积恒定)或减小体积(在恒定压力下)。这种变化在低温下更为明显,因为相对于吸引力,这些分子的KE较低,因此在相互碰撞后克服这些吸引力的效果较差。
有几个不同的方程比理想气体定律能更好地近似气体行为。其中的第一个也是最简单的,是荷兰科学家约翰内斯·范德瓦耳斯(Johannes van der Waals)在1879年开发的。范德瓦耳斯方程通过增加两个术语来改进理想气体定律:一个用于解释气体分子的体积,另一个用于解释气体分子的体积。它们之间的吸引力。
常数 a 对应于特定气体分子之间的吸引力强度,常数 b 对应于特定气体分子的大小。 "更正"理想气体定律中的压力项的值是 an 2 / V 2 ,并且"校正"为的音量为 nb 。请注意,当 V 相对较大而 n 相对较小时,这两个校正项都可以忽略不计,并且范德华方程简化为理想气体定律 PV = nRT 。这种条件对应于其中分子数量相对较少的气体占据相对较大的气体,即压力相对较低的气体。
在低压下,分子间吸引力 a 的校正比对分子体积 b 的校正更重要。 在高压和小体积下,分子体积的校正变得很重要,因为分子本身是不可压缩的,并且构成总体积的相当一部分。 在某些中间压力下,这两种校正具有相反的影响,并且在很小的压力范围内,气体似乎遵循 PV = nRT 给出的关系。
严格来说,当气体分子之间的分子间引力可忽略不计且气体分子本身不占整个体积的可观部分时,理想的气体方程会很好地起作用。这些标准在低压和高温条件下得到满足。在这种条件下,据说气体的行为理想,与气体定律的偏差足够小,可以忽略不计。但是,通常情况并非如此。
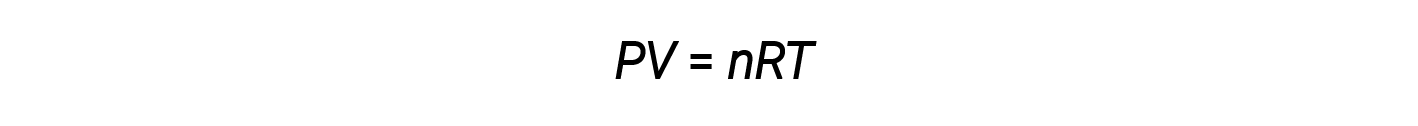
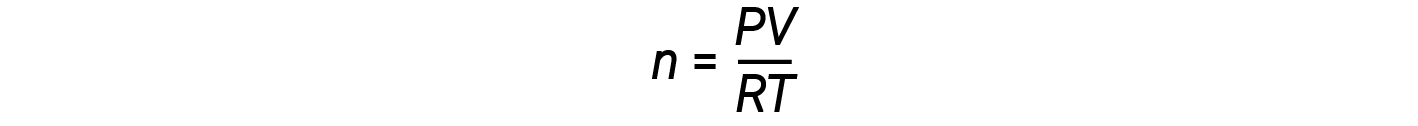
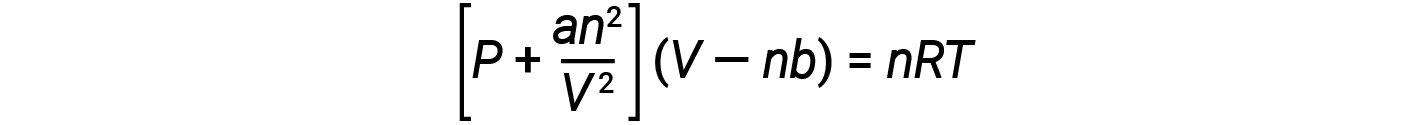
来自章节 5:

Now Playing
5.10 : 真实气体-偏离理想气体定律
热化学
34.2K Views

5.1 : 压力和测量压力
热化学
35.5K Views

5.2 : 气体定律
热化学
65.4K Views

5.3 : 理想气体定律的应用:摩尔质量、密度和体积
热化学
56.1K Views

5.4 : 气体混合物-道尔顿分压定律
热化学
38.8K Views

5.5 : 化学计量学和气体
热化学
24.4K Views

5.6 : 动力学分子理论:基本假设
热化学
33.3K Views

5.7 : 动力学分子理论与气体定律
热化学
32.2K Views

5.8 : 分子速度和动能
热化学
27.1K Views

5.9 : 渗出和扩散
热化学
28.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。