15.2 : قوى الحمض/القاعدة وثوابت التفكّك
القوة النسبية لحمض أو قاعدة هي مدى تأينه عند إذابته في الماء. إذا اكتمل تفاعل التأين بشكل أساسي، يُطلق على الحمض أو القاعدة اسم قوي؛ في حالة حدوث تأين قليل نسبيًا، يكون الحمض أو القاعدة ضعيفًا. هناك الكثير من الأحماض والقواعد الضعيفة أكثر من الأحماض والقواعد القوية. أكثر الأحماض والقواعد القوية شيوعًا مذكورة أدناه:
| أحماض قوية | أحماض ضعيفة |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | Ca(OH)2 |
| HNO3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
يمكن قياس القوة النسبية للأحماض عن طريق قياس ثوابت التوازن في المحاليل المائية. في المحاليل التي لها نفس التركيز، تتأين الأحماض الأقوى إلى حد أكبر وبالتالي تنتج تركيزات أعلى من أيونات الهيدرونيوم مقارنة بالأحماض الأضعف. يسمى ثابت التوازن للحمض ثابت التأين الحمضي، Ka. لتفاعل حمضHA:

تتم كتابة ثابت التأين الحمضي بالشكل
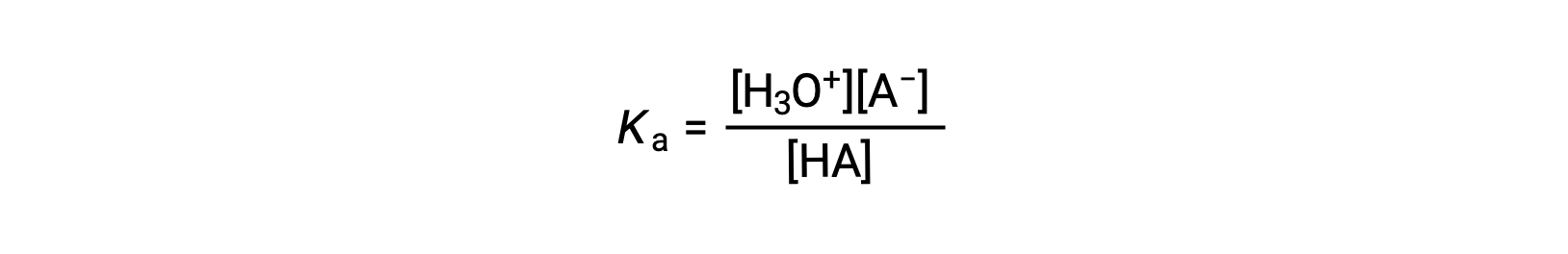
حيث تكون التركيزات في حالة توازن. على الرغم من أن الماء مادة متفاعلة في التفاعل، إلا أنه مذيبة أيضاً، لذلك لا نقوم بتضمين [H2O] في المعادلة. كلما زادت قيمة Ka للحمض، زاد تركيز H3O+ و A− نسبةً إلى تركيز الحمض غير المؤين، HA، في خليط التوازن، كلما كان الحمض أقوى. يصنف الحمض على أنه “قوي” عندما يخضع للتأين الكامل، وفي هذه الحالة يكون تركيز HA صفراً ويكون ثابت التأين الحمضي كبيراً بما لا يقاس (Ka ≈ ∞). تسمى الأحماض المتأينة جزئياً “ضعيفة,” وثوابت التأين الحمضي الخاصة بهم يمكن قياسها تجريبياً.
لتوضيح هذه الفكرة، يتم عرض ثلاث معادلات للتأين الحمضي و قيم Ka مذكورة أدناه. تزداد ثوابت التأين من الأول إلى الأخير من المعادلات المدرجة، مما يشير إلى زيادة قوة الحمض النسبية بالترتيب CH3CO2H < HNO2 < HSO4−.
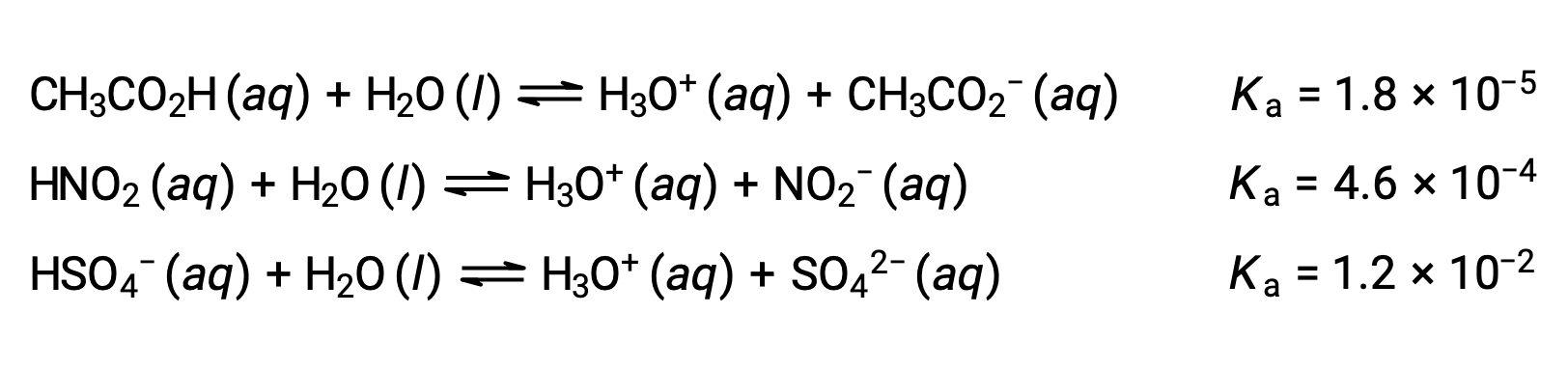
مقياس آخر لقوة الحمض هو نسبة التأين. يتم تحديد نسبة التأين في الحمض الضعيف من حيث تكوين خليط التوازن:
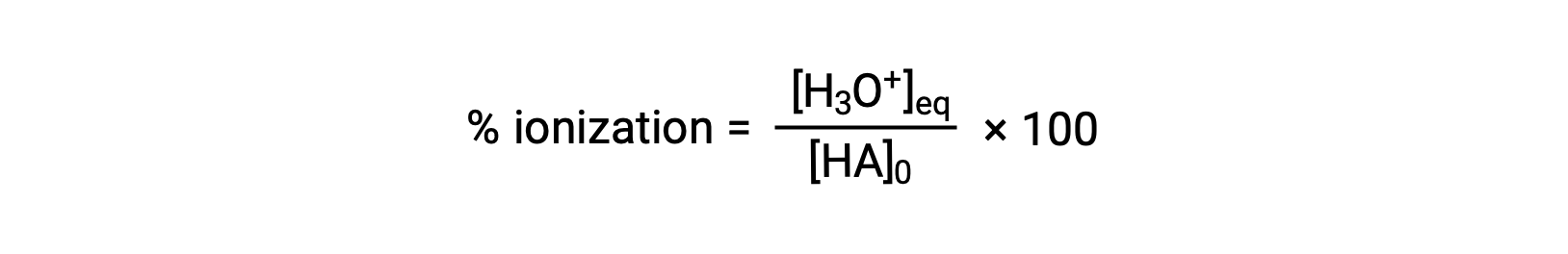
حيث تكون قيمة البسط مكافئة لتركيز القاعدة المترافقة للحمض (لكل قياس كيميائي للعناصر المتفاعلة، [A−] = [H3O+]). على عكس قيمة Ka، فإن النسبة المئوية لتأين الحمض الضعيف تختلف باختلاف التركيز الأولي للحمض، وعادة ما تنخفض مع زيادة التركيز.
كما هو الحال بالنسبة للأحماض، تنعكس القوة النسبية للقاعدة في مقدار ثابت التأين الأساسي (Kb) في المحاليل المائية. في المحاليل من نفس التركيز، تتأين القواعد الأقوى إلى حد أكبر، وبالتالي تنتج تركيزات أعلى من أيونات الهيدروكسيد مقارنة بالقواعد الأضعف. القاعدة الأقوى لها ثابت تأين أكبر من القاعدة الأضعف. لتفاعل القاعدة، B:
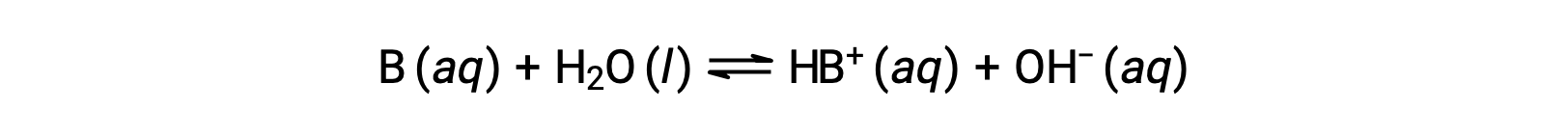
تتم كتابة ثابت التأين بالشكل
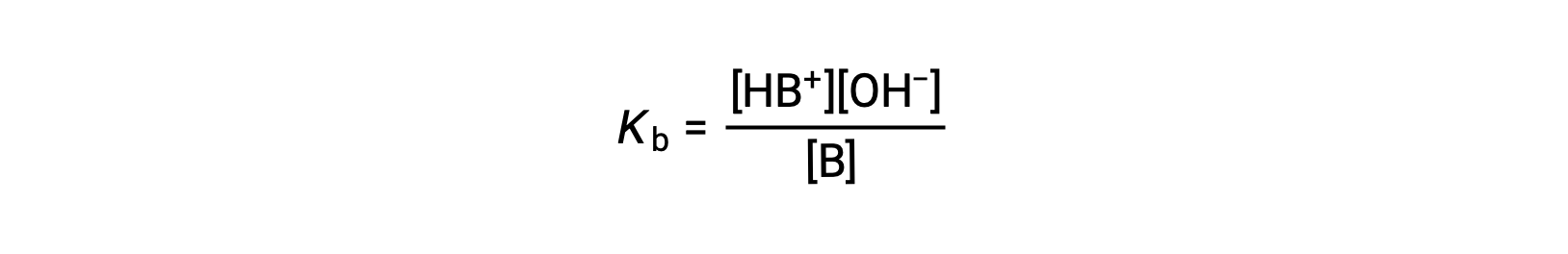
يوضح فحص البيانات لثلاث قواعد ضعيفة الموضحة أدناه زيادة قوة القاعدة بالترتيب NO2− < CH2 CO2− < NH3.
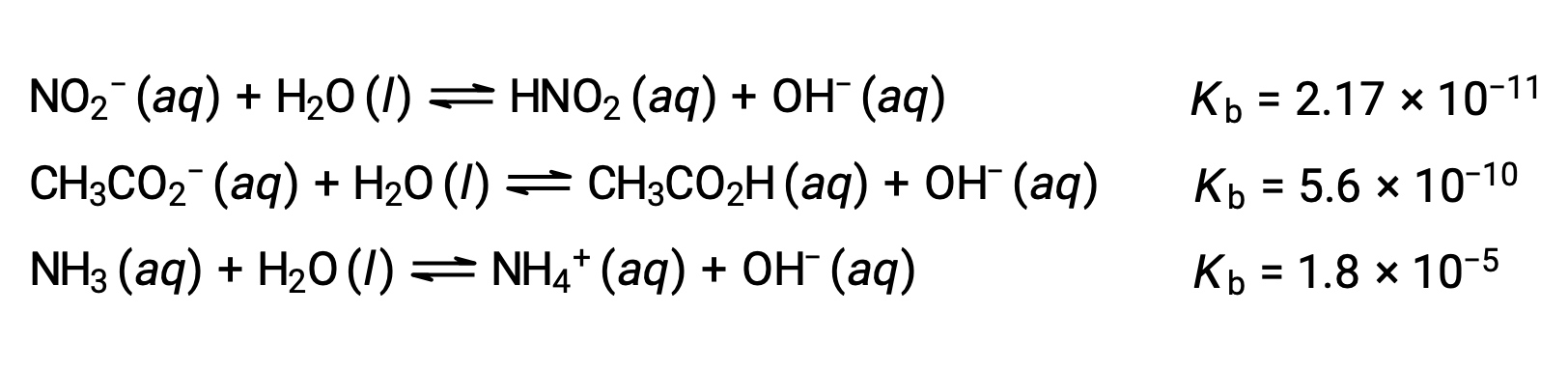
بالنسبة للأحماض، تنعكس القوة النسبية للقاعدة أيضًا في نسبة التأين المئوية، والتي يتم حسابها على أنها
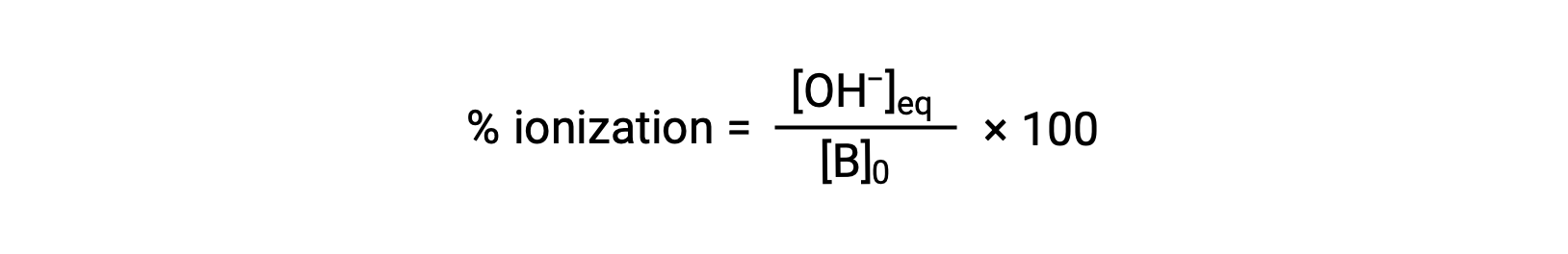
ولكنها ستختلف اعتماداً على ثابت التأين الأساسي والتركيز الأولي للمحلول.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
From Chapter 15:

Now Playing
15.2 : قوى الحمض/القاعدة وثوابت التفكّك
Acids and Bases
59.6K Views

15.1 : أحماض وقواعد برونستيد-لوري
Acids and Bases
89.8K Views

15.3 : الماء: حمض وقاعدة برونستيد-لوري
Acids and Bases
49.2K Views

15.4 : مقياس درجة الحموضة
Acids and Bases
67.5K Views

15.5 : القوى النسبية لأزواج حمض-قاعدة المترافقة
Acids and Bases
44.8K Views

15.6 : حمض قوي ومحاليل أساسية
Acids and Bases
30.9K Views

15.7 : المحاليل الحامضية الضعيفة
Acids and Bases
37.2K Views

15.8 : المحاليل القاعدية الضعيفة
Acids and Bases
22.1K Views

15.9 : مخاليط الأحماض
Acids and Bases
19.4K Views

15.10 : الأيونات كأحماض وقواعد
Acids and Bases
23.0K Views

15.11 : تحديد الرقم الهيدروجيني (pH) لمحاليل الملح
Acids and Bases
43.1K Views

15.12 : أحماض بوليبروتيك
Acids and Bases
28.5K Views

15.13 : قوة الحمض والبنية الجزيئية
Acids and Bases
30.4K Views

15.14 : أحماض وقواعد لويس
Acids and Bases
42.9K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved