15.2 : Forças de Ácidos/Bases e Constantes de Dissociação
A força relativa de um ácido ou base é a extensão em que se ionizam quando dissolvidos em água. Se a reação de ionização for essencialmente completa, o ácido ou a base é denominado forte; se relativamente pouca ionização ocorrer, o ácido ou a base é fraco. Há muito mais ácidos e bases fracos do que fortes. Os ácidos e bases fortes mais comuns estão listados abaixo:
| Ácidos Fortes | Bases Fortes |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | Ca(OH)2 |
| HNO3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
As forças relativas dos ácidos podem ser quantificadas medindo as suas constantes de equilíbrio em soluções aquosas. Em soluções com a mesma concentração, ácidos mais fortes ionizam-se em maior medida e, por isso, produzem concentrações mais elevadas de iões hidrónio do que ácidos mais fracos. A constante de equilíbrio para um ácido é chamada a constante de ionização do ácido, Ka. Para a reação de um ácido HA:

a constante de ionização do ácido é escrita como
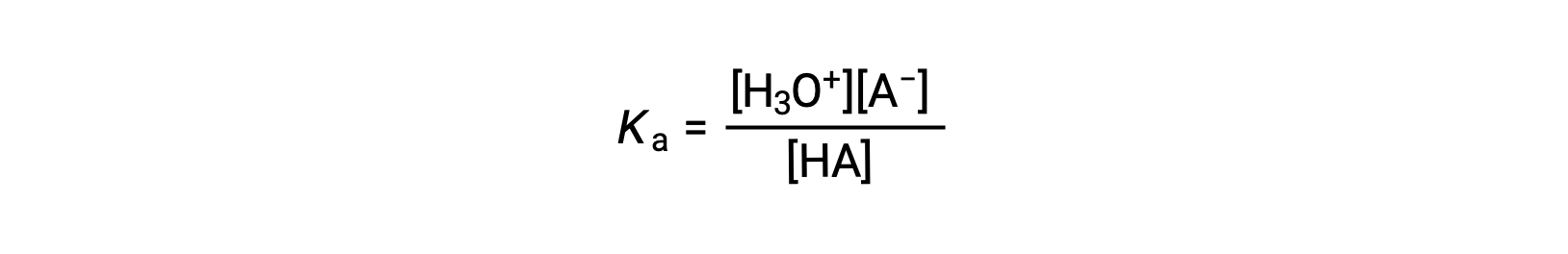
onde as concentrações são aquelas em equilíbrio. Embora a água seja um reagente na reação, é também o solvente, então não incluímos [H2O] na equação. Quanto maior a Ka de um ácido, maior a concentração de H3O+ e A− em relação à concentração do ácido não ionizado, HA, em uma mistura de equilíbrio, e mais forte o ácido. Um ácido é classificado como “forte” quando é submetido a ionização completa, caso em que a concentração de HA é zero e a constante de ionização do ácido é imensamente grande (Ka ≈ ∞). Os ácidos que são parcialmente ionizados são chamados de “fracos”, e as suas constantes de ionização de ácido podem ser medidas experimentalmente.
Para ilustrar esta idéia, três equações de ionização de ácido e valores de Ka são mostrados abaixo. As constantes de ionização aumentam da primeira para a última das equações listadas, indicando que a força relativa do ácido aumenta na ordem CH3CO2H < HNO2 < HSO4−.
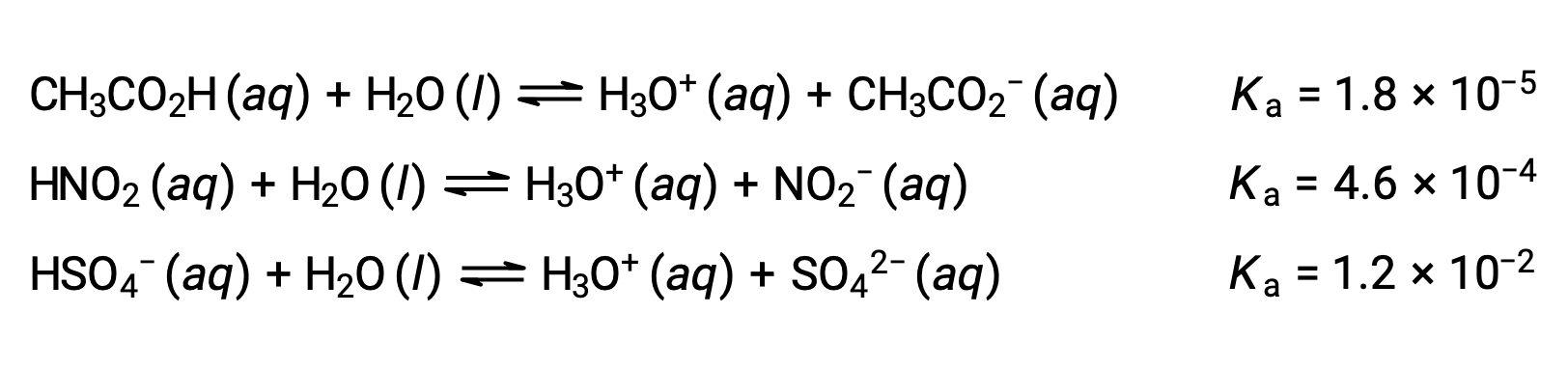
Outra medida da força de um ácido é a sua ionização percentual. A ionização percentual de um ácido fraco é definida em termos da composição de uma mistura de equilíbrio:
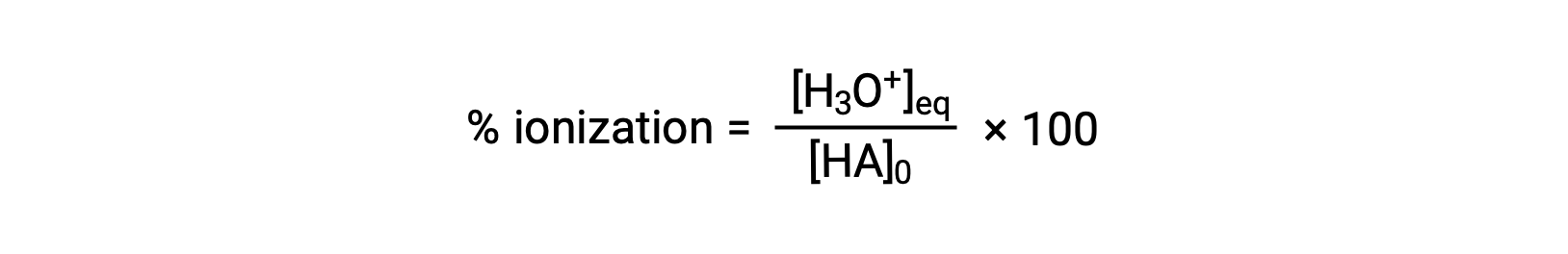
onde o numerador é equivalente à concentração da base conjugada do ácido (por estequiometria, [A−] = [H3O+]). Ao contrário do valor de Ka, a ionização percentual de um ácido fraco varia com a concentração inicial de ácido, diminuindo normalmente à medida que a concentração aumenta.
Tal como para ácidos, a força relativa de uma base reflete-se na magnitude da sua constante de ionização de base (Kb) em soluções aquosas. Em soluções com a mesma concentração, as bases mais fortes ionizam-se em maior medida e, por conseguinte, produzem concentrações de iões hidróxido mais elevadas do que as bases mais fracas. Uma base mais forte tem uma constante de ionização maior do que uma base mais fraca. Para a reação de uma base, B:
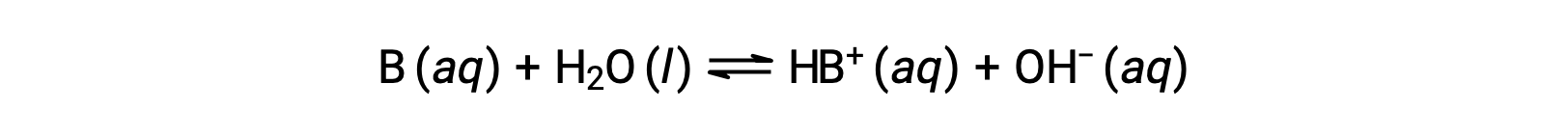
a constante de ionização é escrita como
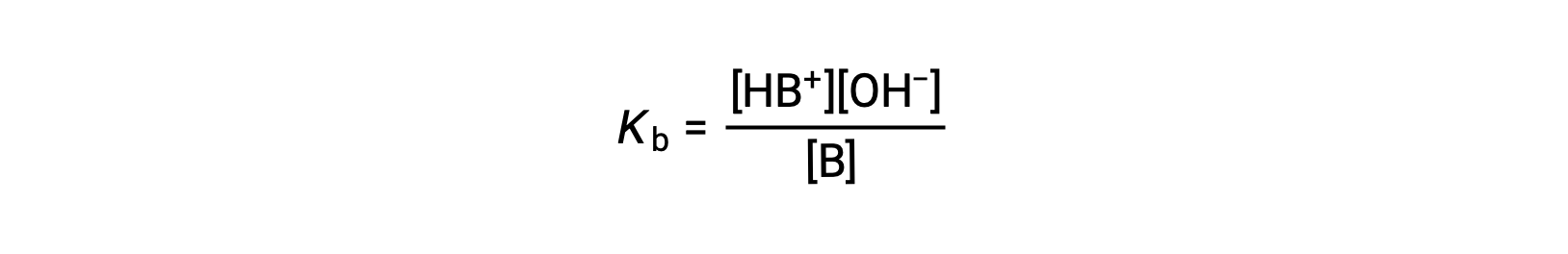
A inspeção dos dados para três bases fracas apresentadas abaixo mostra que a força da base aumenta na ordem NO2− < CH2 CO2− < NH3.
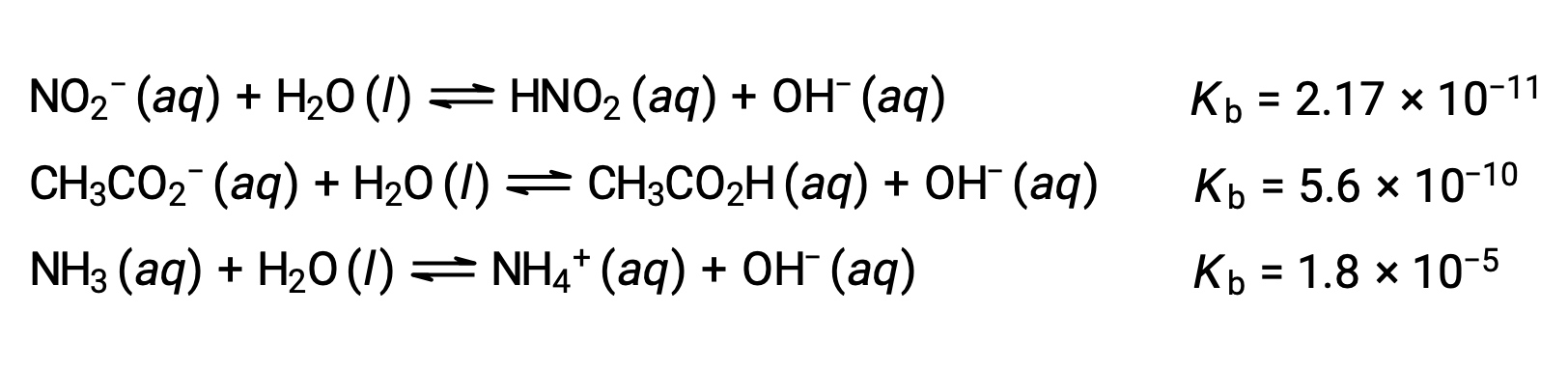
Como para os ácidos, a força relativa de uma base também é refletida na sua ionização percentual, computada como
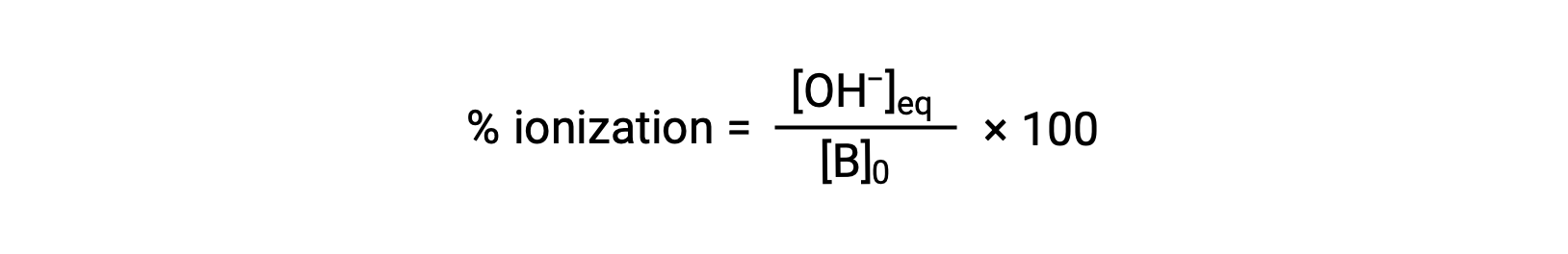
mas irá variar dependendo da constante de ionização da base e da concentração inicial da solução.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
Do Capítulo 15:

Now Playing
15.2 : Forças de Ácidos/Bases e Constantes de Dissociação
Ácidos e Bases
60.1K Visualizações

15.1 : Ácidos e Bases de Bronsted-Lowry
Ácidos e Bases
90.7K Visualizações

15.3 : Água: Um Ácido e Base de Bronsted-Lowry
Ácidos e Bases
49.9K Visualizações

15.4 : Escala de pH
Ácidos e Bases
68.2K Visualizações

15.5 : Forças Relativas de Pares Ácido-Base Conjugados
Ácidos e Bases
45.2K Visualizações

15.6 : Soluções de Ácidos e Bases Fortes
Ácidos e Bases
31.3K Visualizações

15.7 : Soluções de Ácidos Fracos
Ácidos e Bases
37.5K Visualizações

15.8 : Soluções de Bases Fracas
Ácidos e Bases
22.4K Visualizações

15.9 : Misturas de Ácidos
Ácidos e Bases
19.5K Visualizações

15.10 : Íons como Ácidos e Bases
Ácidos e Bases
23.4K Visualizações

15.11 : Determinação do pH de Soluções Salinas
Ácidos e Bases
43.3K Visualizações

15.12 : Ácidos Polipróticos
Ácidos e Bases
28.9K Visualizações

15.13 : Força e Estrutura Molecular de Ácidos
Ácidos e Bases
30.7K Visualizações

15.14 : Ácidos e Bases de Lewis
Ácidos e Bases
43.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados