16.10 : توازنات الذوبان
يتم إنشاء توازن الذوبان عندما يحدث انحلال وترسيب الأنواع المذابة بمعدلات متساوية. تكمن هذه التوازن في العديد من العمليات الطبيعية والتكنولوجية، بدءاً من تسوس الأسنان إلى تنقية المياه. وبالتالي، فإن فهم العوامل التي تؤثر على قابلية الذوبان المركب ، ضروري للإدارة الفعالة لهذه العمليات. يطبق هذا القسم مفاهيم وأدوات التوازن التي تم تقديمها سابقاً على الأنظمة التي تتضمن الذوبان والترسيب.
منتج الذوبان
تذكر أن قابلية ذوبان المادة يمكن أن تختلف من صفر أساساً (غير قابل للذوبان أو قليل الذوبان) إلى ما لا نهاية (الامتزاج). يمكن أن ينتج المذاب ذو الذوبان المحدود محلول مشبع عند إضافته إلى مذيب بكمية تزيد عن قابليته للذوبان، مما ينتج عنه خليط غير متجانس من المحلول المشبع والكمّية الزائدة غير المذابة من المذاب. على سبيل المثال، المحلول المشبع من كلوريد الفضة هو المحلول الذي تم فيه تحقيق التوازن الموضح أدناه.
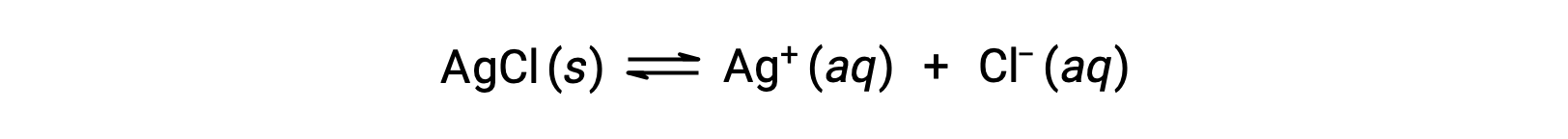
في هذا المحلول، يذوب الفائض من AgCl الصلب ويتفكك لإنتاج أيونات مائية Ag+ و Cl– بنفس المعدل الذي تتحد فيه هذه الأيونات المائية وترسب لتشكيل AgCl الصلبة. نظرًا لأن كلوريد الفضة هو ملح قليل الذوبان، فإن تركيز الأيونات الذائبة في المحلول يكون منخفضًا نسبيًا.
يسمى ثابت التوازن لتوازن الذوبان مثل هذا ثابت منتج الذوبان ، Ksp، في هذه الحالة
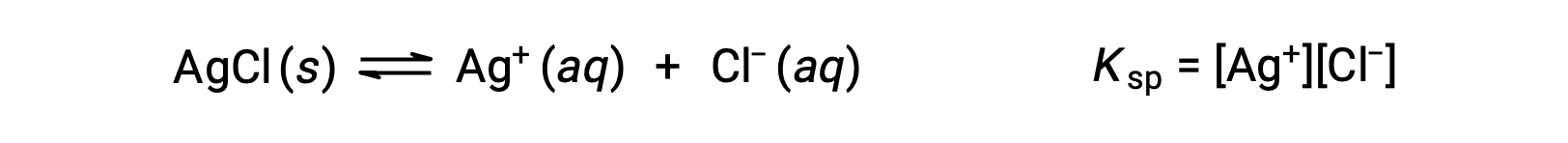
تذكر أنه يتم تمثيل الغازات والمذابات فقط في التعبيرات الثابتة للتوازن، لذلك لا يتضمن Ksp مصطلحًا لـ AgCl غير المحلول.
< Ksp والذوبان
قد يرتبط Ksp لمركب أيوني قليل الذوبان ببساطة بقابلية الذوبان المقاسة بشرط أن تتضمن عملية الذوبان فقط التفكك والذوبان ، على سبيل المثال:
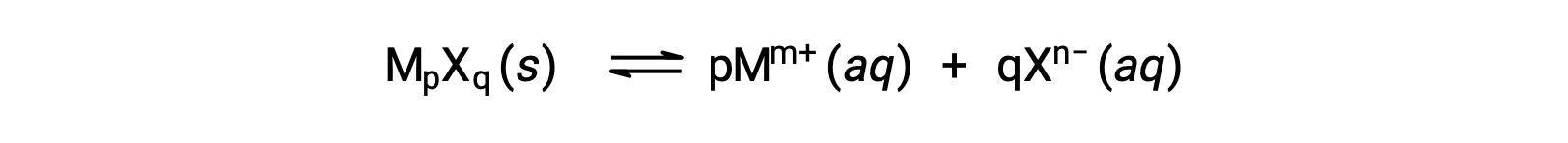
في مثل هذه الحالات، قد يشتق المرء قيم Ksp من قابلية الذوبان المتوفرة، أو العكس. يتم إجراء الحسابات من هذا النوع بشكل أكثر ملاءمة باستخدام قابلية الذوبان المولارية للمركب’، والتي يتم قياسها على أنها مولات المذاب المنحلّة لكل لتر من المحلول المشبع.
توقع هطول الأمطار
المعادلة التي تصف التوازن بين كربونات الكالسيوم الصلبة وأيوناتها المنحلة هي:
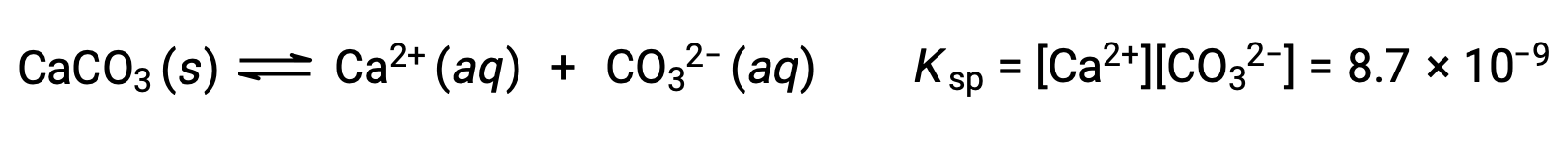
من المهم أن ندرك أن هذا التوازن يتم إنشاؤه في أي محلول مائي يحتوي على أيونات Ca2+ و CO32–، ليس فقط في محلول يتكون من تشبع الماء بكربونات الكالسيوم. ضع في اعتبارك، على سبيل المثال، خلط المحاليل المائية للمركبات القابلة للذوبان كربونات الصوديوم ونترات الكالسيوم. إذا كانت تركيزات أيونات الكالسيوم والكربونات في الخليط لا تنتج حاصل تفاعل، Q، الذي يتجاوز منتج الذوبان، Ksp، فإنه لن يحدث ترسيب. إذا أسفرت تركيزات الأيونات عن ناتج تفاعل أكبر من منتج قابلية الذوبان، فسيحدث الترسيب، مما يؤدي إلى خفض تلك التركيزات حتى يتحقق التوازن (Q = Ksp). تعد مقارنة Q بـ Ksp للتنبؤ بالترسيب مثالاً على النهج العام لتوقع اتجاه التفاعل الذي تم تقديمه لأول مرة في الدروس على التوازن. بالنسبة للحالة المحددة لتوازن الذوبان:
س & # 60 ؛ K sp : يستمر التفاعل في الاتجاه الأمامي (المحلول ليس مشبعًا ، ولم يلاحظ هطول)
Q < Ksp: يستمر التفاعل في الاتجاه العكسي (المحلول مفرط التشبع؛ سيحدث الترسيب)
هذا النص مقتبس من Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
From Chapter 16:

Now Playing
16.10 : توازنات الذوبان
Acid-base and Solubility Equilibria
52.0K Views

16.1 : تأثير الأيون الشائع
Acid-base and Solubility Equilibria
40.9K Views

16.2 : المحاليل المنظِّمة
Acid-base and Solubility Equilibria
163.4K Views

16.3 : معادلة هندرسون هاسلبالخ
Acid-base and Solubility Equilibria
68.1K Views

16.4 : حساب تغيرات الرقم الهيدروجيني (pH) في محلول منظِّم
Acid-base and Solubility Equilibria
52.6K Views

16.5 : فعالية المحلول المنظِّم
Acid-base and Solubility Equilibria
48.4K Views

16.6 : حسابات المعايرة: حمض قوي-قاعدة قوية
Acid-base and Solubility Equilibria
29.0K Views

16.7 : حسابات المعايرة: حمض ضعيف-قاعدة ضعيفة
Acid-base and Solubility Equilibria
43.8K Views

16.8 : المؤشّرات
Acid-base and Solubility Equilibria
47.8K Views

16.9 : معايرة حمض بوليبروتيك
Acid-base and Solubility Equilibria
95.7K Views

16.11 : العوامل المؤثّرة على الذويان
Acid-base and Solubility Equilibria
33.0K Views

16.12 : تكوين الأيونات المعقّدة
Acid-base and Solubility Equilibria
23.2K Views

16.13 : ترسيب الأيونات
Acid-base and Solubility Equilibria
27.5K Views

16.14 : التحليل النوعي
Acid-base and Solubility Equilibria
21.5K Views

16.15 : منحنيات معايرة القاعدة الحمضية
Acid-base and Solubility Equilibria
126.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved