16.10 : Équilibre de solubilité
Les équilibres de solubilité sont établis lorsque la dissolution et la précipitation d'une espèce de soluté se produisent à des vitesses égales. Ces équilibres sous-tendent de nombreux processus naturels et technologiques, allant de la carie dentaire à la purification de l'eau. Il est donc essentiel de comprendre les facteurs qui influent sur la solubilité des composés pour une gestion efficace de ces processus. Cette section applique les concepts et les outils d'équilibre précédemment introduits aux systèmes de dissolution et de précipitation.
Le produit de solubilité
Rappelons que la solubilité d'une substance peut varier de zéro (insoluble ou peu soluble) à l'infini (miscible). Un soluté ayant une solubilité finie peut donner une solution saturée lorsqu'il est ajouté à un solvant dans une quantité dépassant sa solubilité, ce qui conduit à un mélange hétérogène de la solution saturée et de l'excès de soluté non dissous. Par exemple, une solution saturée de chlorure d'argent est une solution dans laquelle l'équilibre indiqué ci-dessous a été établi.
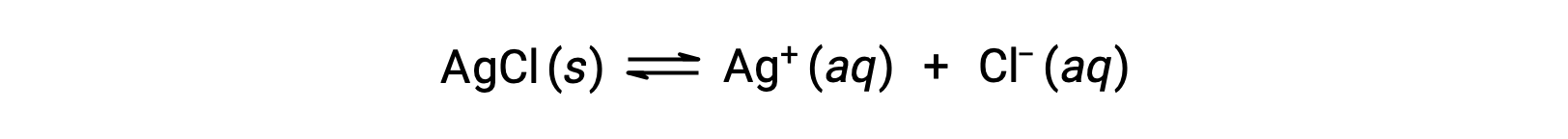
Dans cette solution, un excès d'AgCl solide se dissout et se dissocie pour produire des ions Ag+ et Cl– aqueux à la même vitesse que ces ions aqueux se combinent et précipitent pour former de l'AgCl solide. Comme le chlorure d'argent est un sel peu soluble, la concentration à l'équilibre de ses ions dissous dans la solution est relativement faible.
La constante d'équilibre pour les équilibres de solubilité comme celui-ci est appelée la constante du produit de solubilité, Kps, dans ce cas
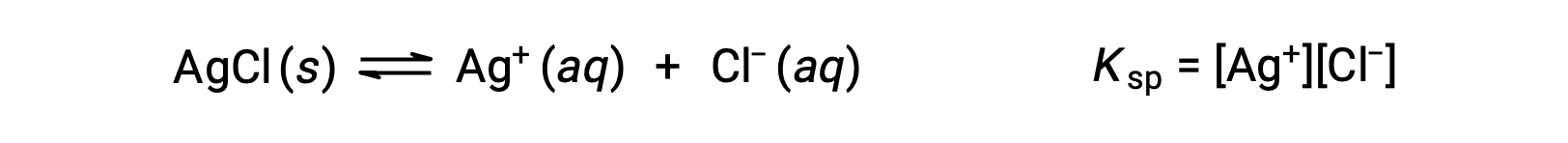
Rappelons que seuls les gaz et les solutés sont représentés dans des expressions de constante d'équilibre, de sorte que le Kps n'inclut pas de terme pour l'AgCl non dissous.
Kps et solubilité
Le Kps d'un composé ionique légèrement soluble peut être simplement lié à sa solubilité mesurée à condition que le processus de dissolution n'implique qu'une dissociation et solvatation, par exemple :
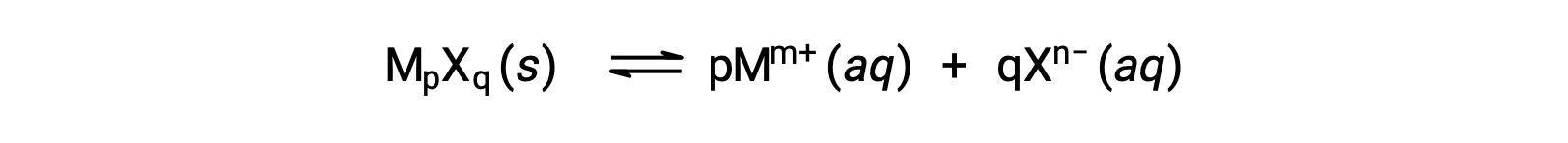
Dans de tels cas, on peut déduire les valeurs de Kps à partir des solubilités fournies, ou vice-versa. Les calculs de ce type sont plus pratiques en utilisant la solubilité molaire d’un composé, mesurée en moles de soluté dissous par litre de solution saturée.
Prévision de la précipitation
L'équation qui décrit l'équilibre entre le carbonate de calcium solide et ses ions solvatés est la suivante :
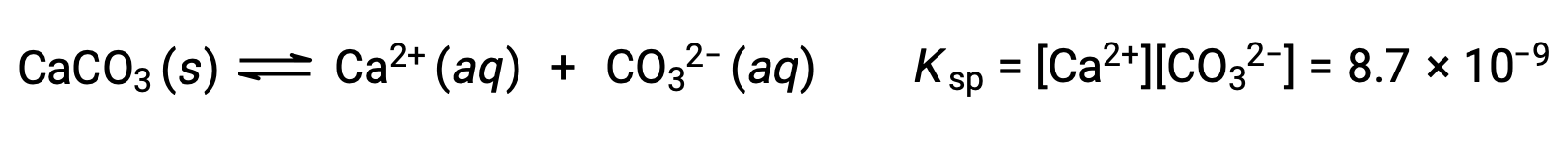
Il est important de se rendre compte que cet équilibre est établi dans toute solution aqueuse contenant des ions Ca2+ et CO32–, et pas seulement dans une solution formée par la saturation de l'eau avec du carbonate de calcium. Prenons, par exemple, le mélange de solutions aqueuses des composés solubles carbonate de sodium et nitrate de calcium. Si les concentrations d'ions calcium et carbonate dans le mélange ne donnent pas un quotient réactionnel, Q, qui dépasse le produit de solubilité,Kps, alors aucune précipitation ne se produira. Si les concentrations ioniques produisent un quotient réactionnel supérieur au produit de solubilité, une précipitation se produira, ce qui va abaisser ces concentrations jusqu'à que l'équilibre soit établi (Q = Kps). La comparaison entre Q et Kps pour prédire la précipitation est un exemple de l'approche générale pour prédire le sens d'une réaction, qui a été introduite dans les leçons sur l'équilibre. Dans le cas précis des équilibres de solubilité :
Q < Kps : la réaction se poursuit dans le sens direct (la solution n'est pas saturée ; aucune précipitation n'est observée)
Q > Kps : la réaction se poursuit dans le sens inverse (la solution est sursaturée ; une précipitation se produit)
Ce texte est adapté de Openstax, Chimie 2e, Section 15.1 : Précipitation et dissolution.
Du chapitre 16:

Now Playing
16.10 : Équilibre de solubilité
Réactions acido-basiques et produit de solubilité
52.0K Vues

16.1 : Effet d'ion commun
Réactions acido-basiques et produit de solubilité
40.9K Vues

16.2 : Solutions tampons
Réactions acido-basiques et produit de solubilité
163.4K Vues

16.3 : Équation de Henderson-Hasselbalch
Réactions acido-basiques et produit de solubilité
68.1K Vues

16.4 : Calcul des changements de pH dans une solution tampon
Réactions acido-basiques et produit de solubilité
52.6K Vues

16.5 : Efficacité d'un tampon
Réactions acido-basiques et produit de solubilité
48.4K Vues

16.6 : Calculs de titrage : acide fort - base forte
Réactions acido-basiques et produit de solubilité
29.0K Vues

16.7 : Calculs de titrage : acide faible - base forte
Réactions acido-basiques et produit de solubilité
43.8K Vues

16.8 : Indicateurs de pH
Réactions acido-basiques et produit de solubilité
47.8K Vues

16.9 : Titrage d'un polyacide
Réactions acido-basiques et produit de solubilité
95.7K Vues

16.11 : Facteurs affectant la solubilité
Réactions acido-basiques et produit de solubilité
33.0K Vues

16.12 : Formation d'ions complexes
Réactions acido-basiques et produit de solubilité
23.2K Vues

16.13 : Précipitation d'ions
Réactions acido-basiques et produit de solubilité
27.5K Vues

16.14 : Analyse qualitative inorganique
Réactions acido-basiques et produit de solubilité
21.5K Vues

16.15 : Courbes de titrage acide-base
Réactions acido-basiques et produit de solubilité
126.4K Vues