16.10 : 溶解度平衡
溶解度平衡是在溶质物种的溶解和沉淀以相同的速率出现时建立的。 这些平衡是许多自然和技术过程的基础,从蛀牙到净水。 因此,了解影响化合物溶解度的因素对于有效管理这些过程至关重要。 本节将以前引入的平衡概念和工具应用于涉及溶解和沉淀的系统。
溶度积
请注意,物质的溶解度从本质上为零 (不溶解或微溶) 到无穷大 (可混溶的) 不等。 当饱和溶液在超过其溶解度的数量中添加到溶剂时,具有有限溶解度的溶质可以产率饱和非均相混合物,从而生成饱和溶液的溶质和过量的未溶解。 例如,一种饱和氯化银溶液就是一种建立了以下平衡的产品。
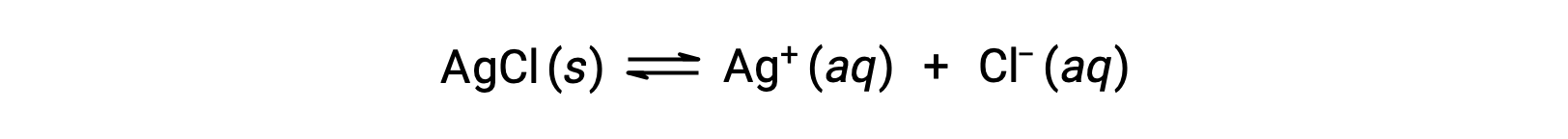
在该溶液中,过量的固体琼脂溶解和解离以在这些水离子组合并沉淀以形成固体琼脂的相同率值下产生水基 A+和 CL- 离子。 由于氯化银是一种微溶盐,其在溶液中的溶解离子的平衡浓度相对较低。
在这种情况下,溶解度平衡的平衡常量称为溶度积常量Ksp
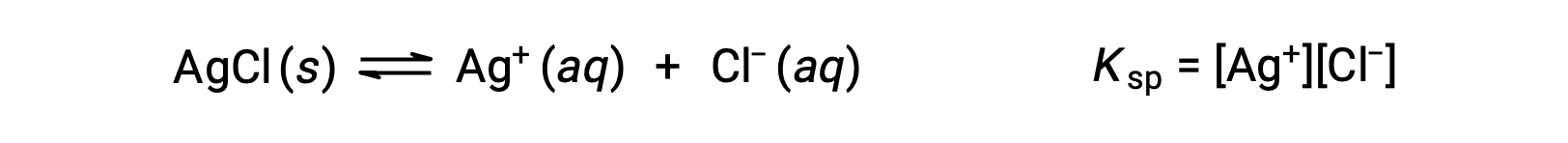
请注意,只有气体和溶质以平衡常量表达式表示,因此Ksp 不包括未溶解的琼脂。
Ksp 和溶解性
微溶性离子化合物的Ksp可能只是与其测量的溶解度相关,前提是溶解过程仅涉及离解和溶化,例如:
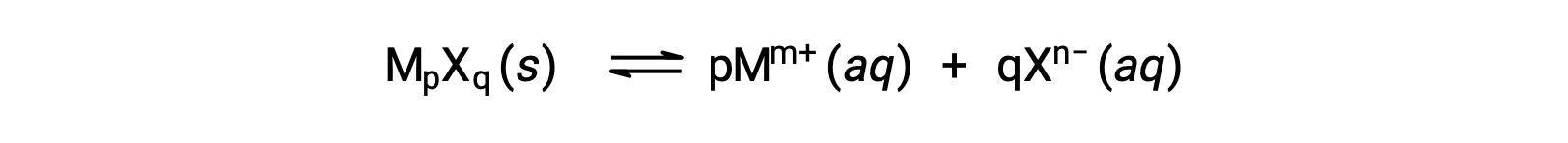
在这类情况下,可以从提供的溶解性中得出Ksp值,反之亦然。 这类计算最方便地使用化合物的摩尔溶解度进行,测量单位为每升饱和溶液的溶解溶质摩尔。
预测沉淀
描述固体碳酸钙及其溶剂化离子之间平衡的方程是:
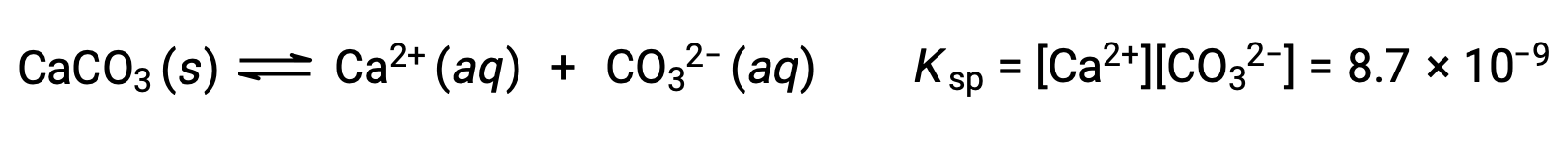
重要的是要认识到,这种平衡是在任何含有 Ca2+ 和 CO32– 离子的水溶液中建立的,而不仅仅是在用碳酸钙饱和水形成的溶液中。 例如,考虑混合碳酸钠和硝酸钙的可溶化合物水溶液。 如果混合物中的钙离子和碳酸盐离子浓度未生成反应商, Q ,超过溶度积,Ksp ,则不会发生沉淀。 如果离子浓度生成反应商大于溶度积 (离子浓度值为 A) ,则将发生沉淀,降低这些浓度直到建立平衡 (Q =Ksp)。 将Q 与Ksp进行比较以预测沉淀是预测平衡经验教训中最初引入的反应方向的一般方法的一个示例。 对于溶解度平衡的特定情况:
Q < Ksp :反应沿正向进行 (溶液未饱和;未观察到沉淀)
Q > Ksp :反向反应 (溶液已过饱和;将发生沉淀)
来自章节 16:

Now Playing
16.10 : 溶解度平衡
酸碱和溶解度平衡
52.0K Views

16.1 : 同离子效应
酸碱和溶解度平衡
40.9K Views

16.2 : 缓冲液
酸碱和溶解度平衡
163.4K Views

16.3 : 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
酸碱和溶解度平衡
68.1K Views

16.4 : 计算缓冲溶液中的 pH 值变化
酸碱和溶解度平衡
52.6K Views

16.5 : 缓冲液效力
酸碱和溶解度平衡
48.4K Views

16.6 : 滴定计算:强酸 - 强碱
酸碱和溶解度平衡
29.0K Views

16.7 : 滴定计算:弱酸 - 弱碱
酸碱和溶解度平衡
43.8K Views

16.8 : 指标
酸碱和溶解度平衡
47.8K Views

16.9 : 多质子酸的滴定
酸碱和溶解度平衡
95.7K Views

16.11 : 影响溶解度的因素
酸碱和溶解度平衡
33.0K Views

16.12 : 错合离子的形成
酸碱和溶解度平衡
23.2K Views

16.13 : 离子沉淀
酸碱和溶解度平衡
27.5K Views

16.14 : 定性分析
酸碱和溶解度平衡
21.5K Views

16.15 : 酸-碱 滴定曲线
酸碱和溶解度平衡
126.4K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。