5.3 : الأحماض والقواعد: Ka، pKa، والقوة النسبية
يتعمق هذا الدرس في جانب مهم من جوانب القوة النسبية للأحماض والقواعد. يتم تقييم قوة الحمض من خلال تفكك الحمض إلى قاعدته المترافقة وأيون الهيدرونيوم في الماء. يتم تأكيد التفكك الكامل للحمض القوي بتركيز عالٍ جدًا من أيونات الهيدرونيوم. ونتيجة لذلك، فإن عملية التفكك غير الكاملة تؤكد وجود حمض ضعيف. ولذلك فإن التوازن يكون في الاتجاه الأمامي للأحماض القوية والعكس بالنسبة للأحماض الضعيفة في هذه التفاعلات.
وبناء على ذلك، يتم تحديد قوة الحمض من خلال تركيز جزيئات الحمض غير المنفصلة وأيونات الهيدرونيوم. في حين يمكن تقدير الحمض الضعيف عن طريق ثابت التوازن (Keq)، فهو ثابت بالنسبة للمحلول المخفف، والتغير في تركيز الماء لا يكاد يذكر. تؤدي هذه الملاحظة إلى تعديل ثابت التوازن المعروف باسم ثابت الحموضة أو ثابت التفكك Ka. لتحديد ثابت الحموضة الذي يمثل مقياسًا للحموضة، ضع في اعتبارك التفاعل الحمضي القاعدي العام:
الشكل 1: تفكك حمض عام في الماء
هنا، يشير HA إلى الحمض العام، ويشير A– إلى قاعدته المترافقة. يمثل التعبير التالي ثابت الحموضة لهذا التفاعل.
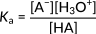
الشكل 2: ثابت الحموضة لتفكك حمض عام
تركز هذه العلاقة على تركيز أيونات الهيدرونيوم في البسط. وبناء على ذلك فإن زيادة هذه الأيونات تؤدي إلى زيادة ثابت الحموضة وحمض أقوى. في الأحماض العضوية، عادةً، ينتشر حجم Ka عبر عدة أوامر. وبالتالي، يتم التعبير عن قوة الأحماض المختلفة من حيث قيم pKa، والتي يتم حسابها على أنها اللوغاريتم السلبي لـ Ka:
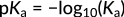
الشكل 3: التعبير عن pKa
هنا، تشير الإشارة السالبة إلى العلاقة العكسية بين قيمة pKa والحموضة. كما هو موضح مع حمض البنزويك مقابل حمض الهيدروبروميك، فإن قيمة pKa الأعلى تساوي قيمة Ka أقل، مما يشير إلى حمض أضعف.
وبتوسيع المبدأ المذكور أعلاه، يمكن لقيم pKa أيضًا تحديد قوة القاعدة. نظرًا لأن تفكك القاعدة يشكل حمضًا مرافقًا، فإن الحمض المرافق الأقوى يتوافق مع قاعدة أضعف. على سبيل المثال، النظر في الميثانول مقابل الإيثيل أمين. يكون حمض الميثانول المترافق بقيمة pKa بقيمة −3.8 أكثر حمضية من حمض الإيثيل أمين المترافق بقيمة pKa البالغة 10.6. وبالتالي، الميثانول هو قاعدة أضعف من الإيثيل أمين.
From Chapter 5:

Now Playing
5.3 : الأحماض والقواعد: Ka، pKa، والقوة النسبية
Acids and Bases
26.2K Views

5.1 : أحماض وقواعد برونستد لوري
Acids and Bases
18.8K Views

5.2 : أحماض لويس وأسسها
Acids and Bases
13.8K Views

5.4 : موضع التوازن في التفاعلات الحمضية القاعدية
Acids and Bases
12.0K Views

5.5 : التركيب الجزيئي والحموضة
Acids and Bases
16.9K Views

5.6 : تأثير التسوية والمحاليل الحمضية القاعدية غير المائية
Acids and Bases
8.0K Views

5.7 : تأثيرات الذوبان
Acids and Bases
7.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved