5.3 : Кислоты и основания: Ka, pKa и относительные силы
Этот урок углубляется в важнейший аспект относительной силы кислот и оснований. Силу кислоты оценивают по диссоциации кислоты на сопряженное основание и ион гидроксония в воде. Полная диссоциация сильной кислоты подтверждается очень высокой концентрацией ионов гидроксония. В результате неполный процесс диссоциации утверждает слабую кислоту. Следовательно, в этих реакциях равновесие находится в прямом направлении для сильных кислот и в обратном направлении для слабых кислот.
Соответственно, сила кислоты определяется концентрацией недиссоциированных молекул кислоты и ионов гидроксония. Хотя слабую кислоту можно оценить с помощью константы равновесия (Keq), она постоянна для разбавленного раствора, а изменение концентрации воды незначительно. Это наблюдение приводит к модифицированной константе равновесия, известной как константа кислотности или константа диссоциации Ka. Чтобы определить константу кислотности, которая представляет собой шкалу кислотности, рассмотрим общую кислотно-основную реакцию:
Рисунок 1: Диссоциация обычной кислоты в воде.
Здесь HA обозначает некую кислоту, а A− обозначает сопряженное с ней основание. Следующее выражение представляет константу кислотности для этой реакции.
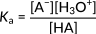
Рисунок 2: Константа кислотности для диссоциации обычной кислоты.
В этом соотношении основное внимание уделяется концентрации ионов гидроксония в числителе. Соответственно, увеличение числа этих ионов приводит к увеличению константы кислотности и более сильной кислоте. В органических кислотах величина Ka обычно разбросана на несколько порядков. Следовательно, сила различных кислот выражается через значения pKa, рассчитываемые как отрицательный логарифм Ka:
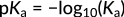
Рисунок 3: Экспрессия pKa
Здесь знак минус указывает на обратную зависимость между значением pKa и кислотностью. Как выяснилось на примере бензойной кислоты по сравнению с бромистоводородной кислотой, более высокое значение pKa соответствует более низкому значению Ka, что указывает на более слабую кислоту.
В рамках вышеизложенного принципа значения pKa также могут определять силу основания. Поскольку при диссоциации основания образуется сопряженная кислота, более сильная сопряженная кислота соответствует более слабому основанию. Например, рассмотрим сравнение метанола с этиламином. Сопряженная кислота метанола со значением pKa -3,8 более кислая, чем сопряженная кислота этиламина со значением pKa 10,6. Следовательно, метанол является более слабым основанием, чем этиламин.
Из главы 5:

Now Playing
5.3 : Кислоты и основания: Ka, pKa и относительные силы
Acids and Bases
26.1K Просмотры

5.1 : Кислоты и основания Брёнстеда-Лоури
Acids and Bases
18.8K Просмотры

5.2 : Кислоты и основания Льюиса
Acids and Bases
13.8K Просмотры

5.4 : Положение равновесия в кислотно-основных реакциях
Acids and Bases
12.0K Просмотры

5.5 : Молекулярная структура и кислотность
Acids and Bases
16.9K Просмотры

5.6 : Выравнивающий эффект и неводные кислотно-щелочные растворы
Acids and Bases
8.0K Просмотры

5.7 : Солватирующие эффекты
Acids and Bases
7.3K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены