5.3 : Asit ve Bazlar: Ka, pKa ve Göreceli Büyüklükler
Bu ders asitlerin ve bazların göreceli büyüklüklerin kritik bir yönünü ele almaktadır. Bir asidin gücü, asidin konjuge bazına ve sudaki hidronyum iyonuna ayrışmasıyla değerlendirilir. Güçlü bir asidin tamamen ayrışması, çok yüksek konsantrasyonda hidronyum iyonları ile doğrulanır. Sonuç olarak, eksik bir ayrışma süreci zayıf bir asit olduğunu doğrular. Dolayısıyla bu reaksiyonlarda denge kuvvetli asitler için ileri, zayıf asitler için ise geri yöndedir.
Buna göre asit kuvveti, ayrışmamış asit moleküllerinin ve hidronyum iyonlarının konsantrasyonu ile tanımlanır. Zayıf asit, denge sabiti (Keq) aracılığıyla tahmin edilebilse de, seyreltik bir çözelti için sabittir ve su konsantrasyonundaki değişiklik ihmal edilebilir düzeydedir. Bu gözlem, asitlik sabiti veya ayrışma sabiti Ka olarak bilinen değiştirilmiş bir denge sabitine yol açar. Bir asitlik ölçeği olan asitlik sabitini tanımlamak için genel asit-baz reaksiyonunu göz önünde bulundurun:
Figure 1: Genel bir asidin su içinde ayrışması
Burada HA jenerik asidi, A^− ise onun konjuge bazını belirtir. Aşağıdaki ifade bu reaksiyonun asitlik sabitini temsil etmektedir.
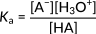
Figure 2: Genel bir asit ayrışması için asitlik sabiti
Bu ilişki paydaki hidronyum iyonlarının konsantrasyonuna odaklanır. Buna göre, bu iyonların artması asitlik sabitinin artmasına ve daha güçlü bir asit oluşmasına yol açar. Organik asitlerde Ka'nın büyüklüğü tipik olarak birkaç mertebeye yayılır. Dolayısıyla farklı asitlerin kuvveti, Ka'nın negatif logaritması olarak hesaplanan pKa değerleri cinsinden ifade edilir:
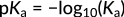
Figure 3: pKa'nın ifadesi
Burada eksi işareti pKa değeri ile asitlik arasındaki ters ilişkiyi göstermektedir. Benzoik asit ve hidrobromik asit ile açıklandığı gibi, daha yüksek bir pKa değeri daha düşük bir Ka değerine eşittir, bu da daha zayıf bir asit anlamına gelir.
Yukarıdaki prensibin genişletilmesiyle pKa değerleri aynı zamanda bir bazın gücünü de belirleyebilir. Bir bazın ayrışması bir konjuge asit oluşturduğundan, daha güçlü bir konjuge asit, daha zayıf bir baza karşılık gelir. Örneğin metanol ile etilamini ele alalım. Metanolün pKa değeri -3,8 olan konjuge asidi, pKa değeri 10,6 olan etilaminin konjuge asidinden daha asidiktir. Bu nedenle metanol, etilaminden daha zayıf bir bazdır.
Bölümden 5:

Now Playing
5.3 : Asit ve Bazlar: Ka, pKa ve Göreceli Büyüklükler
Asitler ve Bazlar
26.2K Görüntüleme Sayısı

5.1 : Brønsted-Lowry Asitleri ve Bazları
Asitler ve Bazlar
18.8K Görüntüleme Sayısı

5.2 : Lewis Asitleri ve Bazları
Asitler ve Bazlar
13.8K Görüntüleme Sayısı

5.4 : Asit-baz reaksiyonlarında denge konumu
Asitler ve Bazlar
12.0K Görüntüleme Sayısı

5.5 : Moleküler Yapı ve Asitlik
Asitler ve Bazlar
16.9K Görüntüleme Sayısı

5.6 : Tesviye Etkisi ve Susuz Asit-Baz Çözeltileri
Asitler ve Bazlar
8.0K Görüntüleme Sayısı

5.7 : Efektleri Çözme
Asitler ve Bazlar
7.3K Görüntüleme Sayısı
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır