Method Article
التنميط وغيره من Methyltransferases S - adenosyl - L - الهموسيستين ملزم البروتينات المركبة من قبل التقاط الطيف الكتلي (CCMS)
In This Article
Summary
التقاط المركبات هي عبارة عن جزيئات صغيرة trifunctional للحد من تعقيد بروتيوم الوظيفية التي عكسها التفاعل جزيء بروتين صغير يليه يشابك - الصور وتنقيتها. نستخدم هنا لقطة مع مجمع S - adenosyl - L - الهموسيستين ملزم وظيفة انتقائية لعزل من methyltransferases القولونية خلية كاملة lysate والتعرف عليهم بواسطة MS.
Abstract
هناك مجموعة متنوعة من النهج للحد من تعقيد بروتيوم على أساس وظيفي التفاعلات جزيء صغير من البروتين مثل اللوني تقارب 1 أو التنميط نشاط البروتين واستنادا 2. التقاط المركبات Trifunctional (CCS ، الشكل 1A) 3 هي أساس لنهج عام ، والتي يحركها التوازن الأولي بين تحقيق التفاعل جزيء صغير (وظيفة انتقائية ، وهنا S - adenosyl - L - الهموسيستين ، SAH ، الشكل 1A) ويتم إصلاح البروتينات الهدف بشكل لا رجعة فيه على الصورة ، يشابك بين وظيفة مستقلة التفاعل الصور activable (هنا phenylazide) من القانون الجنائي والسطح من البروتينات الهدف. وظيفة الفرز (هنا البيوتين) يعمل على عزل CC -- تقارن البروتين من الخلائط البيولوجية المعقدة مع مساعدة من المرحلة الصلبة (هنا الخرز streptavidin المغناطيسي). طرازين من التجارب ممكنة : "بعيدا عن حبة" (4) أو وصف في الوقت الحاضر "على حبة" التكوين (الشكل 1B). قد تكون انتقائية وظيفة تقريبا أي جزيء صغير من الفائدة (ركائز ، ومثبطات ، جزيئات المخدرات).
S - Adenosyl - L - ميثيونين (SAM ، الشكل 1A) هو على الارجح ، والثانية للبطولة ، والعامل المساعد الأكثر استخداما على نطاق واسع في الطبيعة 5 ، 6. فهو يستخدم بوصفه المانح الميثيل المجموعات الرئيسية في جميع الكائنات الحية مع كونها المحفز التفاعل الكيميائي بواسطة SAM - تعتمد methyltransferases (MTases) ، الذي ميثيلات DNA 7 ، 8 الحمض النووي الريبي والبروتينات 9 أو 10 جزيئات صغيرة. نظرا للدور الحاسم من ردود الفعل الفيزيولوجية مثيلة في سيناريوهات متنوعة (الجينات التنظيم ، علم التخلق ، والتمثيل الغذائي) ، ويمكن أن يتوقع من التنميط للMTases لتصبح ذات أهمية مماثلة في البروتيوميات الوظيفية مثل التنميط من الكينازات. الأدوات التحليلية لالتنميط بهم ، ومع ذلك ، لم تكن متوفرة. قدمنا مؤخرا مع CC SAH كمجموعة الانتقائية لملء هذه الفجوة التكنولوجية (الشكل 1A).
SAH ، نتاج SAM بعد نقل الميثيل ، وهو منتج معروف MTase العامة المانع 11. لهذا السبب ، وأنه يتم استخدام العامل المساعد الطبيعية SAM بواسطة انزيمات نقل مزيد من أجزاء أخرى من العامل المساعد أو الشروع في ردود الفعل المتطرفة وكذلك بسبب عدم الاستقرار الكيميائي 12 ، SAH الانتقائية هي وظيفة مثالية لCC لاستهداف MTases. هنا ، نحن تقرير فائدة SAH - CC والتي CCMS MTases التنميط وغيرها من البروتينات SAH ملزم من DH5α سلالة من القولونية (اي كولي) ، واحدة من أفضل تتميز بدائيات النوى ، والتي كانت بمثابة النموذج المفضل الكائن في عدد لا يحصى من الدراسات البيوكيميائية والبيولوجية والبيوتكنولوجية. الصورة تنشيط يشابك تزيد الغلة وحساسية هذه التجربة ، ويمكن بسهولة خصوصية اختبار للمنافسة في التجارب باستخدام فائض من SAH الحرة.
Protocol
1) إعداد E. Lysate القولونية خلية DH5α
- تطعيم ثقافة 2mL (LB سائل الإعلام في أنبوب اختبار) مع هاء القولونية DH5α سلالة مباشرة من الجلسرين واحتضان الأسهم عند 37 درجة مئوية و 250 دورة في الدقيقة لمدة 8 ساعة. استخدام وسائل الإعلام LB تعقيمها (10 غرام / لتر Bacto - تريبتون ، 5 خلاصة الخميرة ز / لتر ، و 10 غرام / لتر كلوريد الصوديوم ، ودرجة الحموضة 7.5).
- تطعيم 250 مل الإعلام LB في قارورة 1 لتر مع شاكر يحير مع الثقافة 2 مل واحتضان أكثر من ليلة عند 37 درجة مئوية و 166 دورة في الدقيقة في حاضنة مع شاكر المداري.
- تلقيح four 5 لترات قوارير شاكر مع يحير كل منها يحتوي على 2.5 لتر مع وسائل الاعلام LB الثقافة 250 مل (50 مل لكل قارورة) واحتضان الثقافات في 37 درجة مئوية ويتم التوصل إلى 166 دورة في الدقيقة حتى يتم OD 600 من 0.8.
- حصاد الخلايا بواسطة الطرد المركزي في 4 درجات مئوية ز 3000x ، لمدة 20 دقيقة. إجراء مزيد من المعالجة في 0-4 درجة مئوية أو على الجليد.
- اعادة تعليق المادة الخلية التي تحصد في الملة - Q الماء ، والجمع بين أجهزة الطرد المركزي في دلو واحد والطرد المركزي عن 30 دقيقة أخرى في 6000x ز و 4 درجات مئوية.
- تخزين الخلايا الناتجة ز 20 مادة في ° -20 درجة مئوية -78 درجة مئوية أو
- اعادة تعليق الخلايا في 100 مل من الجليد الباردة خلية فتح العازلة (6.7 ملي زارة التربية والعلم ، 6.7 ملي NaOAc ، 6.7 HEPES ملم ، 1 ملم EDTA ، 10 ملي β - المركابتويثانول ، 200 ملي مول كلوريد الصوديوم ، ودرجة الحموضة 7.5 ، 10 ٪ (W / V) الجلسرين ؛ PMSF 0.2 ملم) ويصوتن ثلاث مرات لمدة 1 دقيقة في أربعة أجزاء 25 مل على الجليد باستخدام sonifier (مثل SONOPULS HD 2070 من BANDELIN الالكترونية GMBH & CO ، السعة القصوى ، خرج مستمر).
- أجهزة الطرد المركزي في أكثر من ليلة في lysate ز 2370x و 2 درجة مئوية.
- تركيز طاف إلى 14 مليلتر من قبل الفائق (على سبيل المثال باستخدام المكثفات ICON ، 7 mL/9K من بيرس) في 2370x ز و 2 درجة مئوية.
- المستنفدة لزجة من تركيز الجزيئات الصغيرة مثل SAM SAH أو عن طريق الترشيح في هلام 2 درجة مئوية (على سبيل المثال سبين Desalt زيبا أعمدة ، 10 مل ، من بيرس ، وأربعة أعمدة ؛ العازلة التخزين في إزالة ز 1000x لمدة 2 دقيقة ، وأربعة أضعاف موازنة مع 5 مل الجليد فتح زنزانة باردة العازلة والفاصلة في إزالة ز 1000x لمدة 2 دقيقة على التوالي ، تركز على تطبيق 3.5 مل كل عمود و 45 دقيقة في الطرد المركزي ز 24X ، ثم مرتين في 2 دقيقة ز 1000x)
- تكملة الناتجة lysate 13 مل و 13 مل من الجليد الباردة والجلسرين روش مثبط البروتياز كوكتيل أقراص صغيرة ، EDTA الحرة. مزيج وحل أقراص.
- تخزين lysate في -20 درجة مئوية
- تحديد تركيز البروتين الكلي من مقايسة برادفورد (21 ملغم / لتر في هذه الحالة). برادفورد الكاشف : 100 ملغ Coomassie بريليانت الأزرق G - 250 في 50 مل من الايثانول 95 ٪ ، إضافة 100 مل حمض الفوسفوريك 85 ٪ (W / V) ، لتمييع 1 لتر عند الصبغة قد حلت تماما ، وتصفية من خلال ورقة Whatman # 1 فقط قبل الاستخدام.
2) الفحص التقاط (A) ، ومراقبة المنافسة (C) ، المنسدلة (PD) ، ومراقبة المنافسة في المنسدلة (CPD) ، والجمع بين الفحص بالاضافة الى التقاط المنسدلة (A + PD)
- لالتقاط التجارب ، تم استخدام caproKit SAH (caprotec bioanalytics شركة محدودة) ، والذي يتضمن SAH - CC ، حرر SAH كما منافس ، streptavidin المغلفة الخرز المغناطيسي بقطر ميكرومتر (1 Dynabeads MyOne Streptavidin C1 ، Invitrogen Dynal) ، 5X العازلة التقاط (CB 5X ، تحتوي على HEPES 100 ملم ، 250 ملم اسيتات البوتاسيوم ، المغنيسيوم خلات 50 ملم والجلسرين 50 ٪) ، وغسل العازلة 5X (WB 5X ، تحتوي على حمض الهيدروكلوريك تريس 250 ملم ، ودرجة الحموضة 7.5 ، 5 ملم EDTA ، 5 م كلوريد الصوديوم ، 42.5 ميكرومتر الأوكتيل - β - D - glucopyranoside).
- موازية للتجارب عدة فمن المستحسن أن يعد مزيج الرئيسي للمياه ، والتقاط العازلة وهاء lysate القولونية وأداء مختلف التفاعلات داخل أنابيب واحد 200 شريط أنبوب ميكرولتر - PCR (مستحسن 0.2 مل قطاع الحرارية ، الحرارية العلمية ، AB - 1114). هنا ، يتم إعطاء كميات رد فعل لأنبوب واحد. وستعرض النتائج لمدة خمس تجارب مختلفة ، وهي مقايسة التقاط (A) ، ومراقبة المنافسة (C) ، المنسدلة (PD) ، ومراقبة المنافسة في المنسدلة (CPD) ، والجمع بين مقايسة التقاط زائد المنسدلة (A + PD).
- لكل رد فعل ، وإعداد 1.5 مل 1X البنك الدولي البنك الدولي من خلال إضافة 0.3 إلى 1.2 مل 5X مل من الملة - Q المياه.
- إعداد SAH - CC تحميل streptavidin المغلفة الخرز المغناطيسي (caproBeads) في 200 ميليلتر شرائط أنبوب PCR. ولذلك ، مزيج من 25 ميكرولتر من 100 ميكرومتر SAH - CC مع 50 ميكرولتر من 10 حبات streptavidin المغلفة ملغ / مل المغناطيسي لكل قسامة ، هزة بقوة المعلقات الناتجة في درجة حرارة الغرفة لمدة 2 دقيقة للسماح الملزم للشاردة من البيوتين - SAH CC إلى streptavidin على سطح حبة المغناطيسي ، وجمع حبات باستخدام مغناطيس قوي (على سبيل المثال في مباراة دولية للشرائط أنبوب PCR باستخدام جهاز caproMagTM المغناطيسي ، caprotec bioanalytics محدودة). تجاهل supernatants ، وإعادة تعليق caproBeads الناتج في 200 ميكرولتر البنك الدولي ، وجمع مغناطيسيا في caproBeads (في مباراة دولية للشرائط أنبوب PCR) ، ورفض البنك الدولي supernating. أنابيب وثيق لتجنب جفاف الخرز.
- إعداد aliquots كله من DH5α القولونيةlysate الخلايا في أنابيب جديدة في PCR 0-4 درجة مئوية باستخدام مزيج الرئيسي (انظر 2.2). رد فعل واحد ، وبلغ حجم التداول تكملة الملة - Q المياه لحجم رد الفعل النهائي مزيج من 100 ميكرولتر مع CB 20 ميكرولتر 5X. المزيج ، إضافة 0.26 ملغ E. lysate القولونية ، ومزيج بلطف بواسطة انقلاب. فقط لجيم وثيقة البرنامج القطري ، إضافة 20 ميكرولتر 10 منافس SAH حل ملم والمزيج بلطف انعكاس (إضافة الملة - Q المياه بدلا من حل SAH إلى A PD ، و A + PD). رسم نموذج 1 ميكرولتر من ألف لمزيد من التحليل (أنظر أدناه).
- تعليق caproBeads في lysate منها واحتضان لمدة 3 ساعات في 4 درجات مئوية في الحفاظ على حبات تعليق بالتناوب للسماح للبروتينات ملزمة عكسها SAH ملزمة للدالة من الانتقائية SAH SAH - CC.
- وضع تعليق A ، C ، و A + PD في caproBoxTM (جهاز لتشعيع العينات الكيميائية الحيوية للأشعة فوق البنفسجية والتبريد في نفس الوقت ، caprotec bioanalytics محدودة) ، وأشرق لفترة ما مجموعه 30 دقيقة في أنابيب مغلقة بين 0-4 درجة مئوية لتشكيل تشعبي التساهمية بين وظيفة التفاعل من SAH - CC للبروتينات الربط SAH. ولذلك ، إزالة الإيقاف بعد فترات تشعيع 2.5 دقيقة ، على التوالي ، من caproBoxTM ، بارد في المياه الجليدية ليالي 15 ~ (خاصة الأغطية) ، مزيج عدة مرات من قبل انقلاب ، في وقت قريب جدا (~ 2 ثانية) الطرد المركزي لإزالة تعليق المتبقية في الأغطية ، والمكان مرة أخرى في الفترة الفاصلة عن caproBoxTM تشعيع المقبل.
- إضافة 20 ميكرولتر 10 ملم إلى حل SAH ألف ، أو 20 ملي ميكرولتر المياه إلى C - Q ، PD ، CPD ، و A + PD واحتضان تعليق لمدة 10 دقيقة على 4 درجات مئوية لتهجير ، وألف ، والبروتينات SAH ملزم لا crosslinked إلى SAH - CC. الحفاظ على حبات في التعليق من التناوب أو إعادة الخط المتقطع بسبب الايقاف.
- جمع caproBeads من الايقاف باستخدام مغناطيس قوي (مثل caproMagTM) ، تجاهل supernatants ، وتغسل حبات ست مرات -- عن طريق اعادة تعليق وجمع -- البنك الدولي مع 200 ميكرولتر 1X ومرة واحدة مع 200 ميكرولتر المياه الملة - Q.
- ويمكن تخزين حبات في الملة - Q المياه لعدة أسابيع في 4 درجة مئوية. بروتوكولات بديلة موجودة لمزيد من المعالجة من البروتينات والتعرف عليهم القبض (انظر المناقشة).
- تغسل حبات ثلاث مرات مع 200 ميكرولتر أسيتونتريل 60 ٪ (ACN) والافراج عن البروتينات استولت عليها من الخرز التي الحضانة 10 دقيقة في درجة حرارة الغرفة تهتز تحت قوية مع 200 ميكرولتر حمض 60 ٪ trifluoroacetic ACN/0.2 ٪ (TFA) (إعداد طازجة) . استخدام LC - MS - الصف الكواشف والمياه.
- جمع حبات مغناطيسيا ، وتتبخر في فصل طاف للجفاف باستخدام المبخر الطرد المركزي (مثل الحمض النووي المكثف MiVac من GeneVac المحدودة ، المملكة المتحدة). تجاهل الخرز.
3) SDS - PAGE من البروتينات الملتقطة
- لSDS - PAGE ، ويحل البروتينات القبض التي صدرت من الخرز المغناطيسي (ACN تبخرت / TFA الحلول من الخطوة 2.12) في 20 ميكرولتر العازلة عينة SDS (50 ملي تريس حمض الهيدروكلوريك ، 320 مم β - المركابتويثانول ، SDS 2.5 ٪ ، 0.05 ٪ زرقة البروموفينول و 10 ٪ الجلسرين ، ودرجة الحموضة 6.8). مزيج العينة المسحوبة من 1 ميكرولتر A (راجع الخطوة 2.5) مع 19 ميكرولتر العازلة عينة SDS ؛ 5 ميكرولتر من استخدام هذا الحل لتحليل SDS - PAGE (0.25 ٪ من مقايسة). تسخين العينات في 10 دقيقة SDS عينة العازلة إلى 95 درجة مئوية والسماح السماح لتبرد إلى درجة حرارة الغرفة.
- تحليل بواسطة SDS - PAGE (الإعداد عامة : عملية شريان الحياة ® ProPage 40-20 ٪ تريس / جليكاين مسبقة الصنع المواد الهلامية ؛ شريان الحياة هلام مصغرة omniPAGE النظام الكهربائي ؛ SDS العازلة بتشغيل : 25 مم قاعدة تريس ، 200 ملي جليكاين ، 0.1 ٪ SDS ، ودرجة الحموضة 8.3 ؛ وقت التشغيل 90 دقيقة في الجهد المستمر من 180 V التبريد تحت الجليد في المنطقة العازلة تشغيل SDS).
- الفضة وصمة عار الجل باستخدام أسلوب متوافق MS الفضة وصمة عار (على سبيل المثال مجموعة من فضة ProteoSilver اللطخة سيغما). ويرد نتيجة ممثل في الشكل 2.
4) وفي جل دايجست زيتية من البروتينات والببتيد استخراج جل من البولنجر
- اغسل الجل الملون الفضية ثلاث مرات على الأقل مع 100 ملي ماء - Q مل لمدة 10 دقيقة بعد إزالة حل الفضة وقف وصمة عار.
- قطع العصابات هلام (على سبيل المثال باستخدام مشرط نظيف ونقل في أنبوب 0.5 مل إيبندورف) وتخزينها في -20 درجة مئوية أو عملية مباشرة. عصابات غسل هلام لمدة 15 دقيقة ، على التوالي ، مع 100 ميكرولتر المياه ، و 100 ميكرولتر الايثانول 50 ٪ ، 100 ميكرولتر المياه ، و 100 ميكرولتر الايثانول 50 ٪ ، و لمدة 5 دقائق مع الإيثانول النقي. كرر هذا الإجراء الغسيل مرة أخرى.
- إعادة هيدرات الفرقة هلام مع 10 ميكرولتر في جل حل الهضم (12.5 نانوغرام / ميكرولتر التربسين تسلسل الرتب في 50 ملي بيكربونات الأمونيوم ، وإعداد بإضافة 7.5 ميكرولتر 0.5 ميكروغرام / ميكرولتر حل التربسين في حمض الهيدروكلوريك ملي 1-292،5 ميكرولتر 50 ملي بيكربونات الأمونيوم ) لمدة 45 دقيقة على 4 درجة مئوية. إزالة طاف واستبدالها بنسبة 20 ميكرولتر 50 ملي بيكربونات الأمونيوم (بدون التربسين) ، يليه الحضانة عند 37 درجة مئوية خلال الليل بينما تهتز.
- جمع طاف. لاستخراج الببتيد ، احتضان الفرقة هلام مع 20 ميكرولتر حمض الفورميك بنسبة 5 ٪ (FA) لمدة 15 دقيقة في حين تهتز ، إضافةACN 20 ميكرولتر والمحتضنة لمدة 15 دقيقة في حين تهتز. الجمع بين طاف طاف مع السابقة وكرر الإجراء استخراج الببتيد مرة أخرى.
- تتبخر ودمجوا ثلاثة supernatants إلى جفاف وتذوب في الاتحاد ميكرولتر 10 5 ٪ في حين تهتز وتطبيق الموجات فوق الصوتية (حمام بالموجات فوق الصوتية ، على سبيل المثال من Sonorex Bandelin ، ألمانيا) ، والمضي قدما في إزالة الملوحة (5،2 خطوة وأخرى).
5) دايجست تريبسيني الملتقطة من البروتينات ، وإعداد لهضميدات LC-MS/MS
- حل البروتينات القبض التي صدرت من الخرز المغناطيسي (ACN تبخرت / TFA الحلول من الخطوة 2.12) في 10 ميكرولتر 50 ملي بيكربونات الأمونيوم باستخدام الموجات فوق الصوتية وحمام vortexing ، إضافة 1 ميكرولتر 0.5 ميكروغرام / التربسين ميكرولتر حمض الهيدروكلوريك في 1 مم والحل في احتضان 37 درجة مئوية خلال الليل.
- Desalt الحل الذي يحتوي على الببتيدات زيتية من البروتينات التقاطها باستخدام المواد C18 (مثلا 20-10 StageTips ميكرولتر ، 20 ميكرولتر غيض ، Proxeon النظم البيولوجية A / S ، أودنسي ، الدانمرك ، وإجراء الصانع : الشرط المسبق مع 10 الميثانول 50 ٪ ميكرولتر / 5 FA ٪ ، تتوازن مع الاتحاد ميكرولتر 10 5 ٪ ، مع تحميل الببتيدات من البروتينات القبض عليه ، يغسل مع الاتحاد ميكرولتر 10 5 ٪ ، أزل مرتين مع الميثانول ميكرولتر 10 50 ٪ / FA 5 ٪).
- تتبخر والببتيدات المحلاة في الميثانول 50 ٪ / FA 5 ٪ إلى جفاف وتذوب في الاتحاد ميكرولتر 5.5 0.1 ٪ في حين تهتز وتطبيق الموجات فوق الصوتية (الموجات فوق الصوتية الحمام) وتحليل عينة من nanoLC-MS/MS.
6) تحليل NanoLC-MS/MS
- نقل العينة إلى لوحة العينة والمكان في لوحة اللوني السائل تدفق نانو (nanoLC) نظام (مثل اللوني السائل سهلة NLC النظام ؛ Proxeon النظم البيولوجية A / S ، الدانمارك).
- استخدام كرة القدم في الماء 0.1 ٪ كمرحلة النقالة و 0.1 ٪ في الاتحاد ACN كما النقالة المرحلة باء فقط استخدام المذيبات الصف LC - MS.
- تحميل 5 ميكرولتر من الحل الببتيد مباشرة على عمود قبل (المحيط الحيوي nanoflow مثل C18 ، 5 ميكرون ، 120 ، 20 × 0.1 ملم ؛ NanoSeparations ، هولندا) بالإضافة إلى عمود التحليلية (مثل المحيط الحيوي nanoflow C18 ، 5 ميكرون ، 120 A ، 100 × 0.075 مم ؛ NanoSeparations ، هولندا) باستخدام 5 ٪ FA ACN/0.1 ٪.
- خلال الببتيدات ، LC أزل خلال التدرج الخطي 80 دقيقة من 5 ٪ FA ACN/0.1 ٪ إلى 40 ٪ FA ACN/0.1 ٪ يليها 2 دقيقة إضافية إلى 100 ٪ ACN/0.1 ٪ المتبقية الاتحاد وبنسبة 100 ٪ ACN/0.1 ٪ كرة القدم لمدة دقيقة و 8 مع معدل التدفق للرقابة من 400 NL / دقيقة.
- أداء الكتلة الطيفي (MS) تحليل الببتيد eluted على دقة عالية للدولة من بين الفن مطياف الكتلة (على سبيل المثال LTQ Orbitrap مطياف الكتلة XL ؛ FisherScientific الحرارية ، وألمانيا ، مجهزة nanoelectrospray مصدر ايون لelectrospray التأين (ESI) ؛ Proxeon النظم البيولوجية A / S ، الدانمارك).
- إجراء تحليل الطيفي الشامل في وضع البيانات التي تعتمد على التبديل تلقائيا بين MS - orbitrap (التعريف واسطة) وLTQ-MS/MS (وضع النقطه الوسطى) الاستحواذ.
- السيطرة على واجب دورة مطياف الكتلة من خلال تحديد الوقت كسب السيطرة الحقن التلقائي.
- الحصول على مسح كامل للمسح MS الأطياف (من ض / 300 م إلى عام 2000) في orbitrap مع قرار ص = 60000 في ض / م 400 (بعد تراكم على القيمة المستهدفة من 500000 التهم في فخ ايون الخطي).
- تعيين أداة لعزل بالتسلسل الأيونات على أشده (تصل إلى خمس سنوات ، اعتمادا على شدة إشارة) للتجزئة في فخ ايون الخطية باستخدام الاصطدام الناجم عن تفكك (CID) بقيمة 10000 هدف الاتهامات. وتسجل الأيونات الناتجة في جزء LTQ.
- قياسات دقيقة للكتلة في وضع MS ، استخدم اتهم منفردة polydimethylcyclosiloxane الخلفية ايون (سي (CH 3) 2 O) 6 H + (م / ض 445.120025) المتولدة أثناء عملية electrospray من الهواء المحيط وقفل للكتلة الوقت الحقيقي الداخلية إعادة تقويم.
- استبعاد حيوي أيونات الهدف بالفعل الشامل التي اختيرت لإدارة البحث الجنائي لمدة 60 ثانية.
- مجموعة رسوم فحص الدولة والرفض من الأيونات مع المسؤول عن إدارة البحث الجنائي غير معين.
- مزيد من الإعدادات الطيفي الشامل هي على النحو التالي : تعيين رذاذ الجهد ليصل إلى 1.6 كيلو فولت ، ودرجة حرارة ثابتة للنقل ساخنة الشعرية إلى 200 درجة مئوية ، وتطبيع للطاقة التصادم هو 35 ٪ للMS 2. إشارة الحد الأدنى المطلوب لمرض التصلب العصبي المتعدد هو 500 2 التهم. تطبيق التنشيط ف = 0.25 والساعة 30 مللي تفعيل لعمليات استحواذ 2 MS.
- لتنظيف النظام LC ، نفذ أحد تشغيل فارغة بين اثنين من القياسات CCMS متتالية.
7) تحديد بروتين الببتيد وتسلسل الآلي عبر البحث في قاعدة البيانات
- استخدام خوارزمية تحديد البروتين لتحليل البيانات MS / MS (في هذه الحالة المخزنة في الملفات الخام) ، على سبيل المثال نفذت في SEQUEST BioworksBrowser 3.3.1 SP1 (FisherScientific الحرارية ، ألمانيا) ، وجنبا الى جنب X! (المنظمة العالمية لآلة بروتيوم ؛ إصدار 2007.01.01.1) التي تنفذ في برأسية3 affold البرمجيات (الإصدار Scaffold_3_00_03 ، بروتيوم برمجيات شركة ، الولايات المتحدة).
- تنفيذ قاعدة بيانات آلية تفتيش ضد UniProtKB الأخيرة / السويسري بروت www.expasy.org إطلاق قاعدة بيانات للكائن التحقيق (قاعدة البيانات المستخدمة لهذه الدراسة : كولاي أو سلالة K12 ، وإطلاق سراح 57-11).
- استخدام الإعدادات التالية للحصول على قاعدة بيانات آلية البحث داخل SEQUEST : 5 التسامح السلائف جزء في المليون ، 1 ايون جزء التسامح الاتحاد المغاربي ، وخصوصية كاملة التربسين السماح ليصل الى اثنين من الانشقاقات لم يرد عليها. كما تسمح التعديلات الفسفرة متغير في السيرين ، ثريونين ، والتيروزين ؛ أكسدة methionines ؛ نزع الأميد في asparagines والجلوتامين ؛ أستلة في ليسين وسيرين ؛ formylation في ليسين ، ومثيلة في أرجينين ، ليسين ، السيرين ، ثريونين ، والأسباراجين. لا تستخدم التعديلات ثابت في البحث في قاعدة بيانات.
- تحميل SRF أو DTA والخروج الملفات التي تم إنشاؤها بواسطة SEQUEST في سقالة 3 ، الذي يؤدي تقييم احتمال تعيينات الببتيد وتحديد الهوية من خلال الجمع بين البروتينات وتفتيش SEQUEST X! قاعدة البيانات جنبا الى جنب. سقالة مفيد لمقارنة بسهولة وتصور قوائم عدة عينات من البروتين (في هذه الحالة A ، C ، PD ، CPD ، و A + PD).
- تعيين المعلمات في داخل البرنامج 3 سقالة للنظر الببتيدات فقط مع احتمال ≥ 95 ٪ كما هو محدد من قبل خوارزمية النبي الببتيد (ref.13). تعيين الاحتمالات تحديد بروتين للقيام بمهام متعددة لالببتيد ≥ 95 ٪ وفقا للبروتين الخوارزمية النبي 13. التعرف على واحد من البروتين الببتيد ، على نحو تعسفي احتمال البروتين ل≥ 50 ٪ وتفتيشها يدويا المقابلة الببتيد MS / MS الأطياف. يتم تجميع البروتينات التي تشكل الببتيدات المتشابهة والمتباينة لا يمكن أن يكون على أساس MS / MS تحليل وحده من قبل البرنامج لتلبية مبادئ البخل. ويمكن تحديد يقدر معدل اكتشاف هويات كاذبة من الببتيد باستخدام قاعدة بيانات البروتين عكس النهج وينبغي أن يكون <1 ٪.
- وتعطى نتائج التجارب ممثل CCMS في الجدولين 1 و 2 و S1 الجدول التكميلي (العقل أن قاعدة البيانات البروتين لا يصل إلى موعد لبعض البروتينات ، مثل PrmB (الملقب YfcB) أو RsmH (الملقب MraW)) ، وكذلك كما في الشكل 3.
8) الممثل النتائج
الجدول رقم 1 :
| بروتين | ORF | MW / كيلو دالتون | وصف | الركيزة | A | C | PD | CPD | A + PD |
| DCM | b1961 | 53.5 | الحمض النووي السيتوزين MTase | الحمض النووي (M5C) | 1 | 0 | 0 | 0 | 1 |
| RlmI | b0967 | 44.4 | 23S الرنا الريباسي m5C1962 MTase | الرنا الريباسي (M5C) | 17 | 0 | 17 | 0 | 20 |
| RlmL | b0948 | 78.9 | 23S الرنا الريباسي m2G2445 MTase | الرنا الريباسي (m2G) | 12 | 0 | 0 | 0 | 10 |
| TrmB | b2960 | 27.3 | الحمض الريبي النووي النقال (جوانين - N (7) --) - MTase | الحمض الريبي النووي النقال (m7G) | 11 | 0 | 0 | 0 | 13 |
| CmoA | b1870 | 27.8 | الحمض الريبي النووي النقال (cmo5U34) - MTase | الحمض الريبي النووي النقال (mcmo5U) | 7 | 0 | 0 | 0 | 4 |
| RsmG | b3740 | 23.4 | 16S الرنا الريباسي m7G MTase | الرنا الريباسي (m7G) | 6 | 0 | 1 | 0 | 5 |
| RsmH | b0082 | 34.9 | 16S الرنا الريباسي m4C1402 MTase | الرنا الريباسي (m4C) | 5 | 0 | 0 | 0 | 7 |
| RsmD | b3465 | 21.7 | 16S الرنا الريباسي m2G966 MTase | الرنا الريباسي (m2G) | 2 | 0 | 0 | 0 | 2 |
| RsmB | b3289 | 48.3 | 16S الرنا الريباسي m5C967 MTase | الرنا الريباسي (M5C) | 1 | 0 | 0 | 0 | 0 |
| MnmC | b2324 | 74.4 | بروتين Bifunctional يتضمن الحمض الريبي النووي النقال (MNM (5) ق (2) U34) - MTase | الحمض الريبي النووي النقال (mnm5s2U) | 1 | 0 | 0 | 0 | 0 |
| PrmB | b2330 | 35.0 | 50S الريباسي البروتين L3 Gln150 MTase | البروتين (GLN) | 13 | 0 | 0 | 0 | 15 |
| شير | b1884 | 32.8 | الكيميائي البروتين MTase | البروتين (حمض الغلوتاميك) | 0 | 0 | 0 | 0 | 1 |
| CFA | b1661 | 44.9 | سكلوبروبان الدهنية ، أسيل ، فسفوليبيد سينسيز | جزيء صغير | 15 | 0 | 0 | 0 | 14 |
| تام | b1519 | 29.0 | عبر aconitate 2 - MTase | جزيء صغير | 2 | 0 | 0 | 0 | 3 |
| CysG | b3368 | 50.0 | Siroheme سينسيز يشمل يوروفيرينوجين - III - C MTase | جزيء صغير | 1 | 0 | 0 | 0 | 2 |
| SMTA | b0921 | 29.8 | بروتين SMTA | (؟ أ) | 7 | 1 | 0 | 0 | 8 |
| MtnN | b0159 | 24.4 | 5' - Methylthioadenosine / SAH nucleosidase | جزيء صغير ب | 36 | 0 | 0 | 0 | 39 |
| GlnA | b3870 | 51.9 | مخلقة الجلوتامين | جزيء صغير ج | 90 | 0 | 0 | 0 | 97 |
| RplK | b3983 | 14.9 | 50S الريباسي البروتين L11 | د من البروتين PrmA MTase | 2 | 0 | 0 | 0 | 2 |
(أ) لا (تماما) تميزت
ب لا مثيلة لكن الانقسام السند غليكوزيدية من SAH
ج لا مثيلة لكن الملزمة SAH في موقع الربط ATP كما يتضح من التجارب CCMS مع ATP كما منافس (لا تظهر البيانات)
د الركيزة لل50S الريباسي PrmA البروتين MTase L11 ، وتحديد محددة استنساخه من قبل CCMS (لا تظهر البيانات)
الجدول رقم 1 : MTases البروتينات وغيرها من التجارب المختارة التي حددتها CCMS. الأرقام المعطاة للدلالة على عدد غير المرجح الببتيد الطيفية في البروتين. نماذج مكررة لتلك التي حللتها SDS-PAGE/silver صمة عار في الشكل 2. ويتم تحديد MTases أكثر من ذلك بكثير وغيرها من البروتينات ملزمة SAH في مقايسة CCMS (A) مقابل المنسدلة (PD) ، ويظهر SAH خصوصية بسبب غياب شبه كامل لهذه البروتينات في مراقبة المنافسة (C).
الجدول 2 :
| A | C | PD | CPD | A + PD | |
| A | 111 (64) | ||||
| C | 65 (41) | 107 (46) | |||
| PD | 25 (15) | 23 (13) | 61 (17) | ||
| CPD | 23 (13) | 22 (12) | 20 (14) | 47 (14) | |
| A + PD | 87 (61) | 64 (41) | 23 (14) | 22 (12) | 124 (67) |
الجدول 2 : عدد من البروتينات التي تم تحديدها في يدير CCMS البروتين والتداخل بين تشغيله. ونظرا لعدد من البروتينات التي تم تحديدها مع ما لا يقل عن 2 الببتيدات بين قوسين. ويمكن الاستدلال على استنساخ عالية من التداخل أسلوب من نسبة عالية من البروتين (البروتينات غير محددة أساسا) للمقارنة بين التجارب (A مقابل جيم وخصوصا مقابل A + PD PD ولكن أيضا مقابل CPD) خصوصا مع البروتينات التي تم تحديدها مع بقوة على الأقل 2 الببتيدات. انظر الشكل 3 أيضا عن مخططات فين وS1 الجدول التكميلي للحصول على قائمة جميع البروتينات التي تم تحديدها.
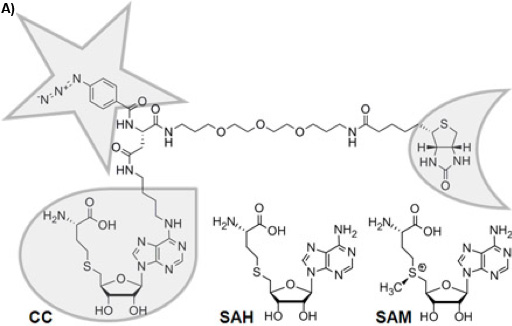
الشكل 1A : التركيب الكيميائي للمجمع التقاط trifunctional (CC). غير مؤطرة وظيفة انتقائية مع قطيرة ، وظيفة التفاعل مع نجم ، والدالة الفرز مع نصف القمر. المستقرة كيميائيا S - adenosyl - L - الحمض الاميني (SAH) هو نتاج العامل المساعد للميثيونين - S - adenosyl - L (SAM) بعد نقل مجموعة الميثيل بحلول SAM - تعتمد MTases ، التي SAH بمثابة مثبط المنتج.
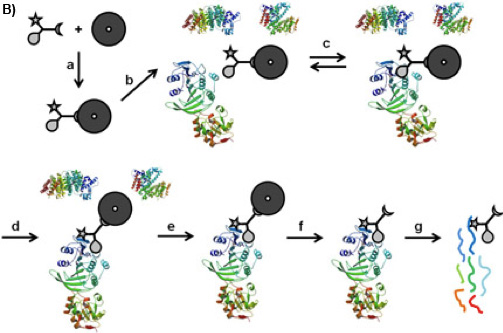
1B الرقم : CCMS "علىحبة "سير العمل. منضما CC على حبات المغناطيسي الفرز حسب الوظيفة والخمسين (أ) ، ويتم تحضين caproBeads شكلت حتى مع خليط من البروتين المعقدة (ب) ، حيث تم تأسيس توازن عكسها ملزمة (ج) بين وظيفة انتقائية لجنة التنسيق والبروتينات الهدف. عند اشعة فوق البنفسجية (د) ، وظيفة التفاعل يشكل تشعبي التساهمية ، وبعد غسل حبات مغناطيسية تحمل بروتينات القبض (ه) ، تشطر المجمعات CC - البروتين crosslinked من الخرز المغناطيسي (و) وتريبسيني هضم (ز) ، يمكن التعرف على البروتينات التي احتلتها تحليل MS من الببتيدات زيتية.
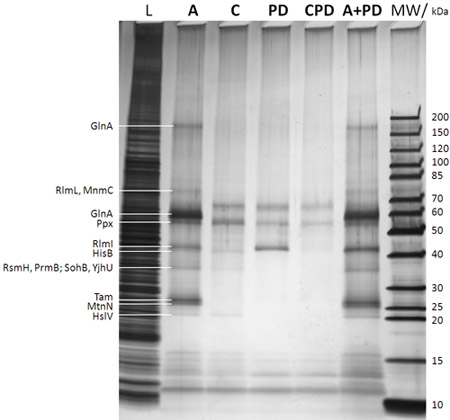
الشكل 2 : وصمة عار SDS-PAGE/silver تحليل البروتينات القبض (و بعد خطوة في الشكل 1B). ويرد وصف حارة على رأس هلام (MW : الوزن الجزيئي علامة مع الأوزان الجزيئية المقابلة من العصابات نظرا إلى اليمين علامة للغاية ؛ L : 0.25 ٪ عينة المسحوبة من lysate القولونية E. DH5a خلية كاملة قبل إضافة caproBeads في خطوة ب في الشكل 1B ؛ ج : مقايسة مع اضافة وجود فائض من الأشعة فوق البنفسجية SAH حرة بعد التشعيع د خطوة في الشكل 1B ، C : السيطرة على مقايسة بما في ذلك وجود فائض من SAH الحرة باعتبارها المنافس خلال الخطوات وج د في الشكل 1B (الأساسية لتحديد أي من البروتينات غير استولت على وجه التحديد) ؛ PD : معنى المنسدلة أي خطوة للاشعة فوق البنفسجية د في الشكل وليس 1B إضافة SAH الحرة ؛ CPD : السيطرة على المنسدلة باستخدام SAH كما منافس ؛ PD A + : مقايسة مجتمعة لا معنى زائد المنسدلة بالإضافة من SAH الحرة خلال سير العمل). تعطى البروتينات التي حددها MS من وقف خارج نطاقات هلام بروتين بعد في جل هضم تريبسيني إلى leftt جدا. ومن الواضح ان الصور يشابك تزيد الغلة وحساسية هذه التجربة ، ويمكن بسهولة خصوصية اختبار للمنافسة في التجارب باستخدام فائض من SAH الحرة. انظر الجدول رقم 1 لMTases البروتينات وغيرها من التجارب المختارة التي حددتها CCMS عينات مكررة من تلك التي تظهر في الشكل الحالي.

الشكل 3 : المخططات فين explaning تداخل البروتينات المحددة في مقايسة CCMS (A) ، ومراقبة المنافسة (C) ، والمنسدلة (PD). اليسار : عدد MTases وSAH nucleosidase ، فقط ، في اشارة الى الجدول رقم 1. الحق : عدد جميع البروتينات التي تم تحديدها في اشارة الى الجدول 2 والجدول S1 التكميلية. ونظرا لعدد من البروتينات التي تم تحديدها مع ما لا يقل عن 2 الببتيدات بين قوسين.
Discussion
قد الاحتياطات التالية والتعليقات تكون مفيدة عند بعد بروتوكول وصف : أ) والميزة الرئيسية لبطاقات الإئتمان يكمن في تشكيل الرابطة التساهمية بين CC وMTase ، حسب هذا يسمح لاحقة الشروط غسل صرامة. يتحقق تشعبي التساهمية بواسطة نجم عن تفاعل ضوئي ضوء الأشعة فوق البنفسجية (310 نانومتر كحد أقصى). ضوء النفقات العامة العادية يحتوي فقط على جزء صغير من الأشعة فوق البنفسجية ، ولكن ، وحماية SAH - CC أطول من التعرض لأشعة الشمس أو الحمل حتى يصل إلى تشعيع للرقابة وتبريده في caproBox. ب) من العينات البيولوجية التي MTases أن تكون معزولة قد تحتوي على البروتينات عرضة لتمسخ ، وبالتالي فمن الإلزامي للحفاظ على عينات باردة وتجنب مزبد في جميع الأوقات. ج) caproBox يبرد العينات الى 0-4 درجة مئوية ، والمصابيح التي ينبعث منها ضوء الأشعة فوق البنفسجية ، ولكن ، كما تنبعث منها الحرارة. لذا فمن الضروري أن أجهزة الطرد المركزي لفترة وجيزة قبل ان القنينات التشعيع ، لذلك البروتينات التمسك القبعات أو جدران لا يمكن شكل قارورة بذور هطول الأمطار. د) وإذا أعيد تعليق الخرز المغناطيسية (على سبيل المثال في الحلول يغسل) غير ممكن من جهة ، وتطبيق فترة وجيزة فوق الصوتية عن طريق وضع العينات في حمام بالموجات فوق الصوتية. ه) إعداد فرشلي 0.2 ٪ في حل ACN TFA/60 ٪. وجدنا أن ذلك قد لا يكون القبض على البروتينات المشقوق من الخرز. و) ويتم التحليل النهائي للبروتينات استولت بها LC-MS/MS. الطيف الكتلي هو طريقة حساسة للغاية. فمن الضروري استخدام الكواشف حصرا LC - MS الصف في الخطوات النهائية (2،11 خطوة وأخرى). تجنب التلوث من التجارب من مصادر البروتين الخارجية ، على سبيل المثال الكيراتين منشؤها من الغبار أو من المجرب. ولا سيما خلال خطوات عملية الهضم النهائي ، فمن المستحسن أن تدفع الانتباه إلى مساحة عمل نظيفة ، وارتداء قفازات ومعطف المختبر ، وربما الشعر الصافي أو أداء مثالي الخطوات النهائية تحت مقعد نظيفة. إعداد الأمونيوم 50 مم بيكربونات العازلة المستخدمة لهضم زيتية في مياه MS LC الصف ، من خلال تصفية 0.22 ميكرون التصفية ، تخزين ، قسامة في -20 درجة مئوية ، واستخدام كل قسامة مرة واحدة فقط لتجنب التلوث. ويمكن تخزين الحل التربسين (تسلسل الرتب ، روش ، وإعداد ميكروغرام 0.5 / ميكرولتر حل عن طريق إضافة حمض الهيدروكلوريك إلى 1 ملم التربسين مجفف بالتجميد) في 4 درجات مئوية لعدة أسابيع. ز) يمكن الاعتماد عليها للحصول على الأطياف الشامل فمن الضروري أن يكون هناك رذاذ مستقرة في تحليل ESI-MS/MS. ح) بالنسبة للأنظمة الأخرى LC-MS/MS من تلك التي استخدمت في هذه الدراسة ، لا بد من تعديل معلمات القياس وتحديد خوارزميات الببتيد فردي.
التعديلات التالية ممكنة فيما يتعلق بروتوكول وصف : أ) بدلا من ذلك الى الافراج عن البروتينات من الخرز التي TFA 60 ٪ ACN/0.2 ٪ (الخطوة 2.11) ، يمكن هضم البروتينات مباشرة داخل tryptically تعليق خرزة (نفس حجم كما في الخطوة 5.1) ، أو لSDS - PAGE ، يمكن الافراج عن البروتينات والتدفئة من خلال تعليق الخرز جمعها بعد الخطوة 2،9-95 درجة مئوية لمدة 10 دقيقة في المخزن عينة SDS (على حد سواء ، وتعليق كامل أو فقط يمكن تحميل طاف في جيب هلام). وجدنا أن حبات الافراج ببطء كميات صغيرة من البوليمر في المحلول المائي خلال هضم زيتية على هضم حبة زيتية حتى بعد عدة خطوات غسل مائي. تلوث البوليمر يتداخل مع تحديد MS الببتيد ، ويمكن غسله باستخدام حبات ACN 80 ٪ (على الأقل ثلاث مرات). بعد الخطوات غسل ACN 80 ٪ ، يجب غسلها بالماء حبات مرة واحدة قبل على هضم حبة زيتية. يمكن ب) أيضا البقع الغربية باستخدام streptavidin - horseraddish البيروكسيداز والركيزة ECL يمكن استخدامها لتصور يشابك الناجح للنسخة التي تحتوي على البيوتين إلى البروتينات. لذا ، إما يمكن الجل الحصول عليها بعد خطوة أو 3.2 نشف ، لأن الحساسية حوالي 10 أضعاف أعلى من تلطيخ فضية المواد الهلامية ، يمكن أيضا عينات 10 ميكرولتر بعد الخطوة التي يتم تحليلها 2.7 لطخة غربية. الاعتبار أنه في الحالة الأخيرة كما البروتينات biotinylated endogeneously يتم الكشف عن جانب البروتينات biotinylated اصطناعيا بواسطة SAH - CC. ج) وجدنا ان هذا الامر يعتمد على نظام خاص (lysate ، تناول البروتينات المستهدفة والانتقائية وظيفة تفاعلية انه CC) ، سواء كان "خارج حبة" التكوين ، حيث رد الفعل يشابك يحدث بين CC الحرة والبروتين في حل 4 أو وصف في الوقت الحاضر "على حبة" التكوين (1B الشكل) أداء أفضل.
بصفة عامة ، ينبغي أن يكون الأسلوب متوافق أيضا مع أي دولة من البروتين الفن النظائر مستقرة أو ببتيد تكنولوجيا التوسيم ، أو تقييم العينة استيلاء هلام إستشراد 2D. في التكوين "خارج حبة" ، فمن الممكن أيضا لالتقاط البروتينات داخل الخلايا بأكمله (نتائج غير منشورة). وعلاوة على ذلك ، يمكن أن أوجز المخدرات أو موقع العامل المساعد ملزمة من البروتين من خلال تحديد موقف يشابك عن قرب من قبل للجنة المركزية ضمن تسلسل تسلسل البروتين الببتيد MS. يمكن استكشاف وضع الملزم للجزيء صغير للبروتين باستخدام مختلف جمواقف مرفق hemical الدالة على الانتقائية وأطوال مختلفة رابط. تناول البروتين أيضا شركاء ملزم للبروتينات كما هو مبين في الدراسة الحالية ، من خلال وظيفة الانتقائية (RplK وركيزة من PrmA) أو البروتين جزيء صغير معروف التفاعلات (SAH لGlnA) يمكن تحديدها. تلخيص ، ميزة إضافية من قانون الأحوال المدنية ، والتفاعل الصور يشابك ، ويسمح للعزلة وتحديد البروتينات وفيرة من البروتين أو الأسر المنخفضة وظيفية من خليط معقد من البروتين مع حساسية عالية ، ويقدم العلماء مع أداة إضافية لدراسة جزيء صغير -- تفاعلات البروتين .
Disclosures
Acknowledgements
وأيد هذا العمل من قبل منظمة الحدودي الإنسان برنامج العلوم (HFSP جائزة عام 2007 ، RGP0058/2007-C). نشكر الأستاذ ريتشارد روبرتس لبدء المشروع وإجراء مناقشات مثمرة.
Materials
| Name | Company | Catalog Number | Comments |
| SAH caproKit™ | caprotec bioanalytics GmbH | 1-1010-050 (50 reactions) 1-1010-010 (10 reactions) | Includes the SAH-CC, SAH competitor, streptavidin coated magnetic beads, capture buffer, and wash buffer |
| caproBox™ | caprotec bioanalytics GmbH | 1-5010-003 (110 V) 1-5010-004 (230 V) | For reproducible photo-activation while cooling the samples |
| caproMag™ | caprotec bioanalytics GmbH | 1-5100-001 | For easy handling of magnetic particles without pipetting |
References
- Katayama, H., Oda, Y. Chemical proteomics for drug discovery based on compound-immobilized affinity chromatography. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 855, 21-27 (2007).
- Barglow, K. T., Cravatt, B. F. Activity-based protein profiling for the functional annotation of enzymes. Nat. Methods. 4, 822-827 (2007).
- Koster, H., Little, D. P., Luan, P., Muller, R., Siddiqi, S. M., Marappan, S., Yip, P. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev. Technol. 5, 381-390 (2007).
- Dalhoff, C., Hueben, M., Lenz, T., Poot, P., Nordhoff, E., Koster, H., Weinhold, E. Synthesis of S-Adenosyl-L-homocysteine Capture Compounds for Selective Photoinduced Isolation of Methyltransferases. ChemBioChem. 11, 256-265 (2010).
- Lu, S. C. S-Adenosylmethionine. Int. J. Biochem. Cell. Biol. 32, 391-3952 (2000).
- Cantoni, G. L. Biological methylation: selected aspects. Annu. Rev. Biochem. 44, 435-451 (1975).
- Jeltsch, A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. ChemBioChem. 3, 274-293 (2002).
- Chow, C. S., Lamichhane, T. N., Mahto, S. K. Expanding the nucleotide repertoire of the ribosome with post-transcriptional modifications. ACS Chem. Biol. 2, 610-619 (2007).
- Grillo, M. A., Colombatto, S. S-Adenosylmethionine and protein methylation. Amino Acids. 28, 357-362 (2005).
- Fujioka, M. Mammalian small molecule methyltransferases: their structural and functional features. Int. J. Biochem. 24, 1917-1924 (1992).
- Borchardt, R. T., Salvatore, F., Borek, E., Zappia, V., Williams-Ashman, H. G., Schlenk, F. . The Biochemistry of S-Adenosylmethionine. , 151-171 (1977).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S-adenosyl-l-methionine. Biochemistry. 25, 4444-4449 (1986).
- Keller, A., Nesvizhskii, A. I., Kolker, E., Aebersold, R. Empirical statistical model to estimate the accuracy of peptide identifications made by MS/MS and database search. Anal. Chem. 74, 5383-5392 (2002).
- Nesvizhskii, A. I., Keller, A., Kolker, E., Aebersold, R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 75, 4646-4658 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved