Method Article
Профилирование метилтрансферазы и других S-Аденозил- L-Гомоцистеин-связывающих белков Захват соединения масс-спектрометрия (CCMS)
В этой статье
Резюме
Захват Соединения трифункциональных малых молекул уменьшить сложность протеома функциональным обратимым маленькая молекула-белковых взаимодействий следуют фото-сшивания и очистки. Здесь мы используем Захват соединения с S-Аденозил- L-Гомоцистеин-обязательный характер, как избирательность функцию, чтобы изолировать от метилтрансферазы Кишечной палочки Целой клетки лизат и определить их государствами-членами.
Аннотация
There is a variety of approaches to reduce the complexity of the proteome on the basis of functional small molecule-protein interactions such as affinity chromatography 1 or Activity Based Protein Profiling 2. Trifunctional Capture Compounds (CCs, Figure 1A) 3 are the basis for a generic approach, in which the initial equilibrium-driven interaction between a small molecule probe (the selectivity function, here S-adenosyl-L-homocysteine, SAH, Figure 1A) and target proteins is irreversibly fixed upon photo-crosslinking between an independent photo-activable reactivity function (here a phenylazide) of the CC and the surface of the target proteins. The sorting function (here biotin) serves to isolate the CC - protein conjugates from complex biological mixtures with the help of a solid phase (here streptavidin magnetic beads). Two configurations of the experiments are possible: "off-bead" 4 or the presently described "on-bead" configuration (Figure 1B). The selectivity function may be virtually any small molecule of interest (substrates, inhibitors, drug molecules).
S-Adenosyl-L-methionine (SAM, Figure 1A) is probably, second to ATP, the most widely used cofactor in nature 5, 6. It is used as the major methyl group donor in all living organisms with the chemical reaction being catalyzed by SAM-dependent methyltransferases (MTases), which methylate DNA 7, RNA 8, proteins 9, or small molecules 10. Given the crucial role of methylation reactions in diverse physiological scenarios (gene regulation, epigenetics, metabolism), the profiling of MTases can be expected to become of similar importance in functional proteomics as the profiling of kinases. Analytical tools for their profiling, however, have not been available. We recently introduced a CC with SAH as selectivity group to fill this technological gap (Figure 1A).
SAH, the product of SAM after methyl transfer, is a known general MTase product inhibitor 11. For this reason and because the natural cofactor SAM is used by further enzymes transferring other parts of the cofactor or initiating radical reactions as well as because of its chemical instability 12, SAH is an ideal selectivity function for a CC to target MTases. Here, we report the utility of the SAH-CC and CCMS by profiling MTases and other SAH-binding proteins from the strain DH5α of Escherichia coli (E. coli), one of the best-characterized prokaryotes, which has served as the preferred model organism in countless biochemical, biological, and biotechnological studies. Photo-activated crosslinking enhances yield and sensitivity of the experiment, and the specificity can be readily tested for in competition experiments using an excess of free SAH.
протокол
1) Подготовка Е. кишечной DH5α лизат сотовый
- Привить 2 мл культуры (LB СМИ в пробирке) с Е. кишечной DH5α напряжение непосредственно с фондового глицерина и инкубировать при температуре 37 ° C и 250 оборотов в минуту в течение 8 ч. Использование автоклавного СМИ LB (10 г / л Бакто-триптон, 5 г / л дрожжевого экстракта, 10 г / л NaCl, рН 7,5).
- Привить 250 мл среды LB в 1 л шейкер колбу с перегородками с 2 мл культуры и инкубировать в течение ночи при температуре 37 ° C и 166 оборотов в минуту в инкубатор с орбитальный шейкер.
- Привить четыре 5 L шейкер колбах с перегородками каждый из которых содержит 2,5 медиа L LB с 250 мл культуры (50 мл для каждой колбы) и инкубировать культур при 37 ° С и 166 оборотов в минуту до OD 600 в 0,8 будет достигнута.
- Урожай клетки центрифугированием при 4 ° С, 3000X г в течение 20 мин. Выполните дальнейшей обработки при 0-4 ° С или на льду.
- Повторное приостановить собран клеточного материала в Milli-Q вода, соединить в одно ведро центрифуги и центрифуги для еще 30 мин при 6000x г и 4 ° C.
- Магазин в результате 20 г клеточного материала при температуре -20 ° С или -78 ° C.
- Повторное приостановить клетки в 100 мл ледяной буфера открытия ячейки (6,7 мМ MES, 6,7 мм NaOAc, 6,7 мМ HEPES, 1 мМ EDTA, 10 мМ β-меркаптоэтанол, 200 мМ NaCl, рН 7,5, 10% (м / о) глицерина, 0,2 мМ PMSF) и разрушать ультразвуком три раза в течение 1 мин в четырех 25 мл порциями по льду использованием sonifier (например Sonopuls HD 2070 от BANDELIN электронных GmbH & KG, максимальная амплитуда, непрерывный выход).
- Центрифуга лизата в течение ночи при 2370x г и 2 ° C.
- Концентрат супернатанта до 14 мл путем ультрафильтрации (например, при помощи значка Концентраторы, 7 mL/9K, от Pierce) на 2370x г и 2 ° C.
- Разрушающим вязкого концентрата из малых молекул, как SAM или SAH помощью гель-фильтрации на 2 ° С (например, Zeba опреснения Спиновые Столбцы, 10 мл, от Пирса, четыре колонны; хранения буфера удаляется на 1000x г в течение 2 мин, четыре раза уравновешивания с 5 мл ледяной буфера открытия клетки и удалить в буфер 1000x г в течение 2 мин, соответственно, 3,5 мл концентрата применяется к каждой колонке; 45 мин центрифугирования при 24x г, затем два раза по 2 мин при 1000x г)
- Дополнение в результате 13 мл лизат с 13 мл ледяной глицерина и Роше мини протеазы таблетки ингибитор коктейль, ЭДТА бесплатно. Смешать и растворить таблетки.
- Магазин лизат при температуре -20 ° C
- Определение общей концентрации белка анализа Брэдфорда (21 мг / мл в данном случае). Брэдфорд реагентов: 100 мг Кумасси бриллиантовый синий G-250 в 50 мл 95% этилового спирта, добавьте 100 мл 85% (м / о) фосфорной кислоты, развести водой до 1 л, когда краска полностью растворяется, и фильтр Ватман № 1 бумага просто перед использованием.
2) Захват анализ (А), конкурс Control (C), Pulldown (PD), конкурс Контроль Pulldown (ДСП), и комбинированные Пробирной Захват плюс Pulldown (+ PD)
- Для захвата экспериментов, САК caproKit (caprotec биоаналитики GmbH) была использована, которая включает SAH-CC, бесплатное САК как конкурента, покрытых стрептавидином магнитных шариков с 1 мкм в диаметре (Dynabeads MyOne Стрептавидином C1, Invitrogen Dynal), 5X буфера захвата (5X ЦБ, содержащего 100 мМ HEPES, 250 мМ ацетата калия, 50 мМ ацетат магния и 50% глицерин), и 5 раз промывочным буфером (5X ВБ, содержащий 250 мМ Трис-HCl, рН 7,5, 5 мМ ЭДТА, 5 М NaCl, 42,5 мкМ октил-β-D-глюкопиранозида).
- В течение нескольких параллельных экспериментов рекомендуется подготовить мастер смесь воды, буфер записи и Е. лизат палочка и для выполнения реакций в различных трубах одного 200 мкл ПЦР-трубки полосы (рекомендуется 0,2 мл Термо-Газа, Thermo Scientific, AB-1114). Здесь количество для одной реакционной трубы заданы. Результаты для пяти различных экспериментов будут представлены, которые захвата анализа (), конкуренция контроля (С), выпадающего (PD), конкуренция контроль пулдауна (ДСП), и комбинированный анализ захвата плюс пулдауна (+ PD).
- Для каждой реакции, подготовить 1,5 мл 1X ВБ, добавляя 0,3 мл 5 раз ВБ до 1,2 мл Milli-Q воды.
- Подготовка SAH-CC загружены покрытых стрептавидином магнитных шариков (caproBeads) в 200 мкл трубки полос ПЦР. Таким образом, смесь 25 мкл 100 мкМ SAH-CC с 50 мкл 10 мг / мл покрытых стрептавидином магнитных шариков для каждого аликвоту, энергично встряхнуть в результате суспензии при комнатной температуре в течение 2 мин, чтобы связывание биотина фрагмент из САК- ЦК стрептавидин на магнитную поверхность шва, и собирать бисер использованием сильный магнит (например, в шапках ПЦР-пробирку полосы использованием caproMagTM магнитное устройство, caprotec биоаналитики GmbH). Отменить супернатантах, вновь приостановить результате caproBeads в 200 мкл ВБ, магнитно собирать caproBeads (в шапках полос ПЦР трубки), а также отказаться от supernating ВБ. Закройте трубы, чтобы избежать высыхания бусин.
- Подготовка аликвоты целом E.coli DH5αКлеточный лизат в новой ПЦР пробирок при 0-4 ° С, используя мастер смеси (см. п. 2.2). С одной реакции, дополнять объема Milli-Q воды для конечного объема смеси реакция с 100 мкл 20 мкл 5X ЦБ. Перемешать, добавить 0,26 мг Е. кишечной лизат, и осторожно перемешайте инверсии. Только для С и ДСП, добавить 20 мкл 10 мМ SAH конкурирующим решением и осторожно перемешайте инверсии (добавить Milli-Q воду вместо SAH решение, ПД, и + PD). Ничья в 1 мкл образца из дальнейшего анализа (см. ниже).
- Приостановить caproBeads в соответствующих лизат и инкубировать в течение 3 ч при температуре 4 ° C хранение бисера в виде суспензии по очереди, чтобы обратимым связыванием SAH связывающих белков с функцией SAH селективность SAH-CC.
- Место суспензий, С и А + PD в caproBoxTM (устройство для облучения биохимических образцов УФ светом и одновременно охлаждение, caprotec биоаналитики GmbH) и облучать на общее время 30 мин в закрытой трубы между 0-4 ° С формировать ковалентные сшивки между реакционной функции SAH-CC с САК связывающих белков. Таким образом, удаление суспензии после облучения интервалом 2,5 мин, соответственно, с caproBoxTM, прохладно в ледяной воде в течение ~ 15 с (в частности, крышки), перемешать несколько раз обращением, в самое ближайшее время (~ 2 сек) центрифуги для удаления оставшихся подвески в век, и место обратно в caproBoxTM для следующего интервала облучения.
- Добавьте 20 мкл 10 мМ SAH решения, или 20 мкл Milli-Q воды C, PD, КПИ, и + PD и инкубировать подвески в течение 10 мин при 4 ° С для вытеснения, в, САК связывающие белки не сшитый для SAH-CC. Держите бисера в виде суспензии вращением или прерывистого ручной ресуспендирования.
- Сбор caproBeads с использованием суспензий сильный магнит (например, caproMagTM), отказаться от супернатантов и умой бусин шесть раз - путем повторного приостановления и коллекции - 200 мкл 1X ВБ и один раз с 200 мкл Milli-Q воды.
- Бусины могут быть сохранены в Milli-Q воды в течение нескольких недель при температуре 4 ° C. Альтернативные протоколы существуют для дальнейшей обработки захваченных белков и их идентификации (см. обсуждение).
- Вымойте бисером три раза с 200 мкл 60% ацетонитрил (ACN) и отпустить захваченных белков из бисера на 10 мин инкубации при комнатной температуре в энергичного встряхивания 200 мкл 60% ACN/0.2% трифторуксусной кислоты (ТФК) (подготовить свежий) . Использование LC-MS-класса реагентов и воды.
- Магнитное собирать бусы, отдельные и испаряются супернатант досуха использованием центробежного испарителя (например MiVac ДНК концентратор от GeneVac, Inc, Великобритания). Отменить бисером.
3) SDS-PAGE захваченных Белки
- Для SDS-PAGE, растворить захватили белков освобождается от магнитных шариков (испаряется АКС / TFA решений, начиная с шага 2.12) в 20 мкл образца SDS буфера (50 мМ Трис-HCl, 320 мМ β-меркаптоэтанол, 2,5% SDS, 0,05% бромфенола синий , 10% глицерина, рН 6,8). Смешайте 1 мкл пробы, взятой из (см. шаг 2.5) с 19 мкл буфера образец SDS; использовать 5 мкл этого раствора для SDS-PAGE анализа (0,25% от анализа). Тепло образцов в SDS образец буфера 10 мин до 95 ° С и пусть дать остыть до комнатной температуры.
- Анализ на SDS-PAGE (общие установки: МНК ® ProPage 4-20% Tris / глицин сборных гели; МНК OmniPage мини-гель-электрофореза системы; SDS работает буфер: 25 мМ трис базы, 200 мМ глицин, 0,1% SDS, рН 8,3 ; время выполнения 90 минут при постоянном напряжении 180 В при охлаждении льдом из буфера работает SDS).
- Серебряное пятно геля использованием MS совместимы серебра пятно метод (например ProteoSilver Серебряный пятно Kit от Sigma). Представитель Результат показан на рисунке 2.
4) В-гель Триптический дайджест белков и пептидов Извлечение из геля Группы
- Мойте серебро гель окрашивали по крайней мере три раза с 100 мл Milli-Q воде в течение 10 мин после серебра пятно решение остановка была удалена.
- Вырежьте гель полос (например, с помощью скальпеля и чистой передачи в 0,5 мл трубку Eppendorf) и хранят при температуре -20 ° С или непосредственно процесса. Вымойте геля полосы в течение 15 мин, соответственно, с 100 мкл воды, 100 мкл 50% этанола, 100 мкл воды, 100 мкл 50% этанола, и в течение 5 мин с чистого этанола. Повторите эту процедуру промывки еще раз.
- Re-гидрата гель группы по 10 мкл в-гель решение пищеварения (12,5 нг / мкл последовательности класса трипсина в 50 мМ бикарбоната аммония, готовят путем добавления 7,5 мкл 0,5 мкг / мкл раствора трипсина в 1 мМ HCl до 292,5 мкл 50 мМ бикарбоната аммония ) в течение 45 мин при 4 ° C. Удалить супернатант и заменить на 20 мкл 50 мМ бикарбоната аммония (без трипсина) с последующей инкубации при температуре 37 ° C в течение ночи при встряхивании.
- Сбор супернатант. Для извлечения пептид, инкубировать гель полосы с 20 мкл 5%-ной муравьиной кислотой (ФА) в течение 15 мин при встряхивании, добавляют20 мкл АКС и инкубировали еще 15 мин при встряхивании. Комбинат супернатант с предыдущим супернатант и повторите процедуру извлечения пептид еще раз.
- Evaporate объединил три супернатанты досуха, растворяют в 10 мкл 5% ФА при встряхивании и применения ультразвука (ультразвуковая ванна, например Sonorex от Bandelin, Германия) и приступить к обессоливания (шаг 5,2 и далее).
5) Триптический Дайджест захваченных Белки и пептиды Подготовка для LC-MS/MS
- Растворите захватили белков освобождается от магнитных шариков (испаряется АКС / TFA решений, начиная с шага 2.12) в 10 мкл 50 мМ бикарбоната аммония использованием ультразвука и ванны вортексе, добавить 1 мкл 0,5 мкг / мкл трипсина в 1 мМ HCl и инкубировать решение в 37 ° C в течение ночи.
- Опреснения раствор, содержащий пептиды триптического захваченных белков, используя C18 материала (например, 2-10 мкл StageTips, 20 мкл наконечник, Proxeon Biosystems / S, Оденсе, Дания, методикой производителя: предварительным условием по 10 мкл 50% метанола / 5 % FA, равновесие по 10 мкл 5% FA, нагрузка с пептидами захваченных белки, мыть по 10 мкл 5% FA, элюируются в два раза по 10 мкл 50% метанол / 5% ФА).
- Evaporate обессоленной пептидов в 50% метанол / 5% FA досуха, растворяют в 5,5 мкл 0,1% ФА при встряхивании и применения ультразвука (ультразвуковая ванна) и анализировать пробы nanoLC-MS/MS.
6) Анализ NanoLC-MS/MS
- Передача образца на образец стекла и поместить пластину в нано-поток жидкостной хроматографии (nanoLC) системы (например, Easy-НЖК жидкостной хроматографии системы; Proxeon Biosystems / S, Дания).
- Используйте 0,1% ФА в воде в качестве подвижной фазы и 0,1% ФА в Сети в качестве подвижной фазы B. Только использование LC-MS растворителей класса.
- Нагрузка 5 мкл пептида решение непосредственно на предварительно колонку (например, биосферный nanoflow С18, 5 мкм, 120 А, 20 х 0,1 мм; NanoSeparations, Нидерланды) в сочетании с аналитической колонки (например, биосферный nanoflow С18, 5 мкм, 120 А , 100 х 0,075 мм; NanoSeparations, Нидерланды), используя 5% ACN/0.1% ФА.
- Во время LC, элюировать пептидов в течение 80 мин линейным градиентом от 5% ACN/0.1% FA до 40% ACN/0.1% FA следуют дополнительные 2 мин до 100% ACN/0.1% FA, оставаясь на 100% ACN/0.1% FA еще на 8 мин с контролируемой скоростью потока 400 Нл / мин.
- Выполните масс-спектрометрического (MS) анализ элюировали пептидов на высокую точность состоянии современных масс-спектрометр (например LTQ Орбитрэп XL масс-спектрометра; Thermo FisherScientific, Германии, оснащенный источником nanoelectrospray иона электрораспылением ионизации (ESI); Proxeon Biosystems / S, Дания).
- Выполните масс-спектрометрического анализа данных зависит от режима автоматического переключения между Орбитрэп-MS (профиль режиме) и LTQ-MS/MS (центроида режим) приобретения.
- Управление долгом масс-спектрометр цикла, установив время впрыска автоматическая регулировка усиления.
- Приобретать обзор полного сканирования MS спектров (от т / г 300 до 2000) в Орбитрэп с разрешением R = 60000 на т / г 400 (после накопления на целевое значение 500000 зарядов в линейной ионной ловушки).
- Установите инструмент для последовательного выделения наиболее интенсивных ионов (до пяти, в зависимости от интенсивности сигнала) для фрагментации в линейной ионной ловушки использованием индуцированных столкновениями диссоциации (CID) на целевое значение 10 000 зарядов. В результате осколочные ионы регистрируются в LTQ.
- Для точного измерения массы в режиме MS, использование однозарядных polydimethylcyclosiloxane фоне ионов (Si (CH 3) 2 O) 6 H + (т / г 445,120025), образующихся при электрораспылением процесса из окружающего воздуха, как блокировка массы для реального времени внутренние калибровки.
- Динамически исключить целевые ионы уже массовый, отобранных для CID на протяжении 60 с
- Установить плату скрининга государства и отказ от ионов для CID с неназначенным заряда.
- Далее масс-спектрометрического настройки следующим образом: набор спрей напряжения до 1,6 кВ, установка температуры в отапливаемом передачи капиллярной до 200 ° С, и нормированная энергия столкновения равна 35% для MS 2. Минимальный сигнал, необходимых для MS 2 составляет 500 пунктам. Применить активации д = 0,25 и времени активации от 30 мс для MS 2 приобретений.
- Для очистки системы LC, выполните одно холостой ход между двумя последовательными измерениями СКК.
7) пептидов и белков Идентификация по автоматизированного поиска базы данных последовательностей
- Использование алгоритма идентификации белков для анализа MS / MS данных (в данном случае хранятся в исходных файлов), например, SEQUEST реализованы в BioworksBrowser 3.3.1 SP1 (Thermo FisherScientific, Германия) и X! Тандем (Глобальный Протеом Организация машины, версия 2007.01.01.1), реализованных в Scaffold 3 (версия Scaffold_3_00_03, Протеом Software Inc, США).
- Выполните автоматизированной базы данных поиска против последних UniProtKB / швейцарский-Prot Database Release www.expasy.org организма изучены (база данных, используемая для настоящего исследования: кишечная палочка, штамм К12, выпуск 57-11).
- Используйте следующие параметры для автоматизированного поиска в базе данных SEQUEST: 5 промилле предшественником терпимости, 1 а.е.м. фрагмент ионно терпимость и полное специфичность трипсина позволяет на срок до двух пропущенных расколы. Разрешить как переменные фосфорилирования модификаций на серин, треонин, и тирозина; окисление methionines; дезамидирования на аспарагин и глутамин; ацетилирования на лизин и серин; формилирования на лизин и метилирования в аргинин, лизин, серин, треонин и аспарагин. Не используйте фиксированные изменения в базе данных поиска.
- Нагрузка РВСН или ДТА и из файлов, создаваемых в SEQUEST лесов 3, который выполняет оценку вероятности пептидных задания и идентификации белков, объединяя SEQUEST и X! поиски Тандем базе данных. Леса полезно для легкого сравнения и визуализации белка списки из нескольких образцов (в данном случае, C, PD, КПИ, и + PD).
- Установите параметры, в пределах лесов 3 программное обеспечение, чтобы рассматривать только пептиды с ≥ 95% вероятностью, как указано пептида алгоритм Пророк (ref.13). Установить вероятности идентификации белков для нескольких заданий пептид ≥ 95% в соответствии с алгоритмом белка Пророк 13. Для идентификации белков одного пептида, произвольно установить белка вероятность ≥ 50% и вручную проверять соответствующие пептидные MS / MS спектров. Белки, составляющие аналогичных пептидов и не могут быть дифференцированы на основе MS / MS анализ сами по себе, сгруппированных по программное обеспечение для удовлетворения принципов бережливости. Оценкам ложных открытий пептида идентификации можно определить, используя обратный подход белка базы данных и должно быть <1%.
- Представитель результаты CCMS экспериментов приведены в таблицах 1, 2 и дополнительные таблицы S1 (виду, что белок база данных не последнюю дату для некоторых белков, например, PrmB (ака YfcB) или RsmH (ака MraW)), а также как показано на рисунке 3.
8) представитель Результаты
Таблица 1:
| Белок | ORF | MW / кДа | Описание | Подложка | C | PD | ДСП | + PD | |
| DCM | b1961 | 53,5 | ДНК-цитозин MTase | ДНК (5mC) | 1 | 0 | 0 | 0 | 1 |
| RlmI | b0967 | 44,4 | 23S рРНК m5C1962 MTase | рРНК (5mC) | 17 | 0 | 17 | 0 | 20 |
| RlmL | b0948 | 78,9 | 23S рРНК m2G2445 MTase | рРНК (m2G) | 12 | 0 | 0 | 0 | 10 |
| TrmB | b2960 | 27,3 | тРНК (гуанин-N (7) -)-MTase | тРНК (m7G) | 11 | 0 | 0 | 0 | 13 |
| CmoA | b1870 | 27,8 | тРНК (cmo5U34)-MTase | тРНК (mcmo5U) | 7 | 0 | 0 | 0 | 4 |
| RsmG | b3740 | 23,4 | 16S рРНК m7G MTase | рРНК (m7G) | 6 | 0 | 1 | 0 | 5 |
| RsmH | b0082 | 34,9 | 16S рРНК m4C1402 MTase | рРНК (M4C) | 5 | 0 | 0 | 0 | 7 |
| RsmD | b3465 | 21,7 | 16S рРНК m2G966 MTase | рРНК (m2G) | 2 | 0 | 0 | 0 | 2 |
| RSMB | b3289 | 48,3 | 16S рРНК m5C967 MTase | рРНК (5mC) | 1 | 0 | 0 | 0 | 0 |
| MnmC | b2324 | 74,4 | Бифункциональные белка включает тРНК (МНМ (5) S (2) U34)-MTase | тРНК (mnm5s2U) | 1 | 0 | 0 | 0 | 0 |
| PrmB | b2330 | 35,0 | 50S рибосомных белков L3 Gln150 MTase | белка (Gln) | 13 | 0 | 0 | 0 | 15 |
| Шер | b1884 | 32,8 | Хемотаксис белка MTase | белка (Glu) | 0 | 0 | 0 | 0 | 1 |
| Cfa | b1661 | 44,9 | Циклопропан-жирные-ацил-фосфолипидных синтазы | маленькая молекула | 15 | 0 | 0 | 0 | 14 |
| Tam | b1519 | 29,0 | Транс-aconitate 2-MTase | маленькая молекула | 2 | 0 | 0 | 0 | 3 |
| CysG | b3368 | 50,0 | Siroheme синтазы включает uroporphyrinogen-III C-MTase | маленькая молекула | 1 | 0 | 0 | 0 | 2 |
| ССПМ | b0921 | 29,8 | Белки ССПМ | (?) | 7 | 1 | 0 | 0 | 8 |
| MtnN | b0159 | 24,4 | 5'-Methylthioadenosine / САК nucleosidase | малый б молекулы | 36 | 0 | 0 | 0 | 39 |
| GlnA | b3870 | 51,9 | Глутаминсинтетазы | небольшие молекулы с | 90 | 0 | 0 | 0 | 97 |
| RplK | b3983 | 14,9 | 50S рибосомных белков L11 | белка MTase PrmA г | 2 | 0 | 0 | 0 | 2 |
Не (полностью) характеризуется
б Нет метилирования но расщепление гликозидной связью SAH
с Нет метилирования, но связывание САК в АТФ сайт связывания как показали эксперименты с CCMS СПС в качестве конкурента (данные не представлены)
г подложка из 50S рибосомных белков L11 MTase PrmA; воспроизводимых конкретной идентификации CCMS (данные не представлены)
Таблица 1: MTases и ряда других белков, определенные CCMS экспериментов. Заданные числа обозначают невзвешенное пептид спектральный подсчета на белок. Образцы дубликаты тех проанализированы SDS-PAGE/silver пятно на рисунке 2. Гораздо более MTases и других SAH связывающие белки выявлены в анализе СКК () по сравнению с пулдауна (PD) и САК специфики показывает почти полное отсутствие этих белков в конкурсе контроля (С).
Таблица 2:
| C | PD | ДСП | + PD | ||
| 111 (64) | |||||
| C | 65 (41) | 107 (46) | |||
| PD | 25 (15) | 23 (13) | 61 (17) | ||
| ДСП | 23 (13) | 22 (12) | 20 (14) | 47 (14) | |
| + PD | 87 (61) | 64 (41) | 23 (14) | 22 (12) | 124 (67) |
Таблица 2: Общее число выявленных белков в CCMS работает и белка перекрытия трасс. Количество белков отождествляется с по крайней мере 2 пептидов приведены в скобках. Высокая воспроизводимость метода может быть выведено из высоких перекрытия белков (в основном неспецифические белки) между сопоставимыми экспериментов (по сравнению с С и особенно против + PD, но и PD против CPD), особенно с белками энергично отождествляется с по крайней мере 2 пептидов. См. также рисунке 3 диаграммы Венна и S1 дополнительную таблицу, чтобы получить список всех идентифицированных белков.
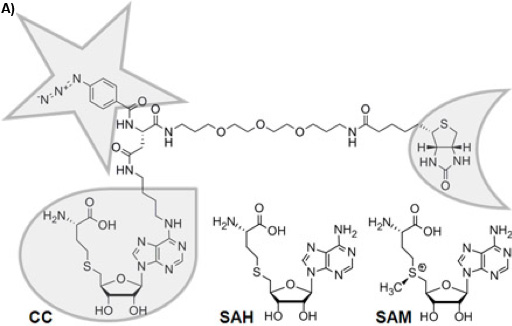
Рисунок 1А: Химическая структура трифункциональных соединения Capture (ГК). Селективность функции обрамлена капли, реакционная функции с звездой, и функция сортировки с полумесяцем. Химически стабильны S-аденозил-L-гомоцистеина (САК) является кофактором продукт S-аденозил-L-метионина (SAM) после метильной группы передаче SAM-зависимых MTases, для которых SAH действует как ингибитор продукта.
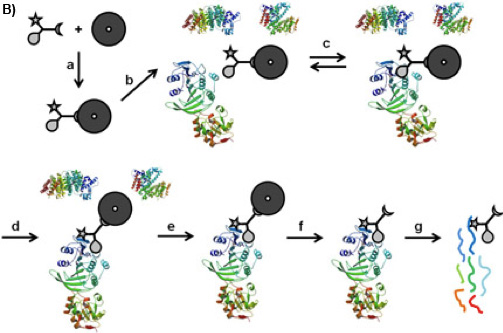
Рис 1B: CCMS "по-бусинка "рабочий процесс. УК обязана на магнитных шариков его функция сортировки (а), так формируется caproBeads инкубируют с сложную смесь белков (б), где обратимое связывание равновесия (с) устанавливается между селективностью функции CC и белков-мишеней. При УФ-облучении (г), реакционная функции формы ковалентной сшивки. После мытья магнитных шариков подшипников захватили белков (е), расщепление сшитый CC-белковые комплексы из магнитных шариков (е) и триптического дайджест (г), захваченные белки могут быть идентифицированы по MS анализ триптического пептидов.
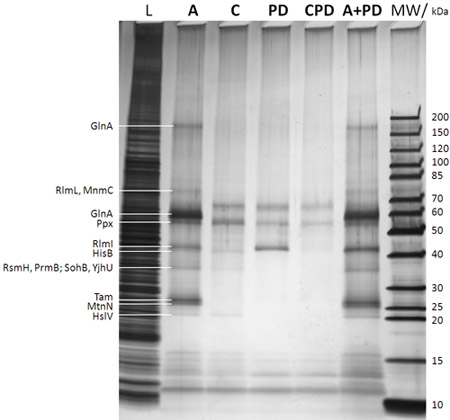
Рисунок 2: SDS-PAGE/silver пятно анализа захваченных белки (после шага F на рисунке 1В). Переулок описание приведено в верхней части геля (МВт: маркер молекулярного веса с соответствующим молекулярным весом маркера полосы уделяется очень правильный, L: 0,25% пробы, взятой из кишечной палочки DH5a целом лизат клетка, прежде чем добавлять caproBeads на стадии б на рисунке 1В;: анализ с добавлением избыточных свободных САК после УФ-облучения г шагом на рисунке 1В; C: управление анализа в том числе избыток свободного САК как конкурента во время шаги в, г на рис 1B (эфирные определить какие-либо неспецифически захватили белков); PD: выпадающее означает отсутствие УФ-й шаг облучения на Рисунке 1B и без добавления свободного SAH; CPD: контроль за использованием выпадающего САК как конкурента; + PD: комбинированный анализ плюс выпадающего то есть не того свободных SAH во время рабочего процесса). Белки, определенные MS от выреза белковых полос гель после в-гель триптического переварить даются очень leftt. Очевидно, что фото-сшивающие повышает урожайность и чувствительность эксперимента, и специфичность может быть легко проверены на конкурсе в экспериментах с использованием избыточных свободных САК. В Таблице 1 MTases и ряда других белков, определенные CCMS опыты дубликаты проб из показанных в данном рисунке.

Рисунок 3: диаграммы Венна explaning перекрытия идентифицированных белков в анализе СКК (), конкуренция контроля (С), и выпадающее (PD). Слева: Количество MTases и САК nucleosidase, только со ссылкой на таблице 1. Справа: Количество всех идентифицированных белков ссылкой на таблицу 2 и S1 Дополнительный таблице. Количество белков отождествляется с по крайней мере 2 пептидов приведены в скобках.
Обсуждение
Следующие меры предосторожности и замечания могут быть полезны, когда после описанного протокола:) Главное преимущество СК заключается в образовании ковалентной связи между ЦК и MTase, так как это позволяет последующие жесткие условия стирки. Ковалентные сшивки достигается фотореакции вызваны ультрафиолетовым светом (310 нм максимум). Нормальный свет над головой содержит лишь небольшую часть УФ, однако, защитить SAH-CC с больше контакта с головой или даже солнечный свет до контролируемого облучения и охлаждается в caproBox. б) биологические образцы, из которых MTases должны быть изолированы может содержать белки склонны к денатурации, следовательно, необходимо в обязательном порядке сохранить образцы прохладно и, чтобы избежать вспенивания во все времена. в) caproBox охлаждения образцов до 0-4 ° С, излучающих ламп ультрафиолетового излучения, однако, также излучают тепло. Поэтому необходимо кратко центрифуги флаконов до облучения, так белков придерживаясь шапки или флакон стены не могут образовывать осадков семян. г) Если повторное приостановление магнитных шариков (например, в решениях мыть) невозможно вручную, вскоре применить ультразвук, помещая образцы в ультразвуковой ванне. д) Только что подготовить 0,2% TFA/60% АКС решение. Мы обнаружили, что в противном случае захваченных белков не может быть расщеплен из бисера. е) Окончательный анализ захваченных белков осуществляется LC-MS/MS. Масс-спектрометрия является высокочувствительным методом. Надо использовать исключительно LC-MS класса реагентов в заключительных шагов (шаг 2.11 и далее). Избегайте загрязнения экспериментов за счет внешних источников протеина, например, кератин, происходящих от пыли и от экспериментатора. Особенно на последнем шаге пищеварение, рекомендуется обратить внимание на чистое место работы, носить перчатки и халат и, возможно, сетку для волос или, в идеале выполняет заключительные шаги по чистой поверхности. Подготовка 50 мМ бикарбоната аммония буфер, используемый для триптического переварить в ЖК MS класса воды, процедить через фильтр 0,22 мкм, Алиготе, хранить при -20 ° С, и использовать каждую аликвоту только один раз, чтобы избежать загрязнения. Решение трипсина (секвенирование класса, Roche, подготовить 0,5 мкг / мкл раствора добавлением 1 мМ раствора для лиофилизированных трипсина) могут храниться при температуре 4 ° С в течение нескольких недель. г) Для получения надежных масс-спектры очень важно иметь стабильный спрей в анализе ESI-MS/MS. з) Для других систем LC-MS/MS, чем той, которая используется в настоящем исследовании, измерение параметров и алгоритмов идентификации пептида должны быть скорректированы в индивидуальном порядке.
Следующие изменения возможны по отношению к описанным протоколом:) В качестве альтернативы к выпуску белков из бисера на 60% ACN/0.2% TFA (шаг 2,11), белков может быть непосредственно tryptically переваривается в бисер подвеска (тех же объемах, как в пункте 5.1) или, для SDS-PAGE, белки могут быть высвобождены путем приостановления и отопления бусин собраны за шагом от 2,9 до 95 ° С в течение 10 мин в буфере образца SDS (как, вся подвеска или только супернатанта может быть загружена в гель карман). Мы обнаружили, что бусины медленно выделяют небольшое количество полимера в водном триптического решение переварить ходе проверок на борт триптического переварить даже после нескольких водных шаги стирки. Загрязнение полимера препятствует идентификации MS пептида и могут быть смыты бисера с использованием 80% ACN (по крайней мере три раза). После 80% шагов АКС мыть, бисер следует мыть один раз водой до на-бусинка триптического переварить. б) западные пятна использованием стрептавидином horseraddish пероксидазы и ECL подложки также можно использовать для визуализации успешных сшивание биотин содержащие ЦК белков. Поэтому или геля, полученного после шага 3,2 могут быть уничтожены или, так как чувствительность примерно в 10 раз выше, чем серебро окрашивание гелей, 10 мкл образцов после шагом 2,7 также может быть проанализирована иммуноблоттинга. Помните, что в последнем случае endogeneously биотинилированного белков также будут обнаружены, кроме белков искусственно биотинилированного от SAH-CC. в) Мы обнаружили, что это зависит от специальной системы (лизат, адресованное белков-мишеней, избирательность и реакционная функции он CC), будь то "вне шарик" конфигурации, где сшивание происходит реакция между свободными CC и белков в растворе 4 или в настоящее время описано "на борт" конфигурации (рис. 1В) работает лучше.
В общем, метод также должна быть совместима с любым государством-оф-арт стабильный изотоп белка или пептида технологии маркировки, или оценки захвата образца 2D гель-электрофореза. В "вне шарик" конфигурации, возможно также захватить белки в течение целых клеток (неопубликованные результаты). Кроме того, препарат или кофактора сайт связывания белка можно выделить путем определения двух шагах от сшивания позиции ЦК в белковой последовательности, с помощью секвенирования MS пептида. Режим привязки небольшой молекулы белка могут быть изучены с использованием различных сhemical позиции вложений в функции селективности и различными компоновщик длины. Как показано в настоящем исследовании, также связывается с белками партнеров белки рассмотрены селективность функции (RplK как субстрат PrmA) или неизвестных маленькой молекулы белковых взаимодействий (САК для GlnA) могут быть идентифицированы. Обобщенная, дополнительная особенность СК, фото-сшивающие реактивности, дает возможность выделения и идентификации белков низкой обильные или функциональных белковых семейств из сложных смесей белков с высокой чувствительностью и обеспечивает ученых дополнительным инструментом для изучения малых молекул - белковых взаимодействий .
Раскрытие информации
Благодарности
Эта работа была поддержана Советом по правам пограничной науки Программа организации (HFSP Award 2007, RGP0058/2007-C). Мы благодарим профессор Ричард Робертс за инициирование проекта и за полезные обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| SAH caproKit™ | caprotec bioanalytics GmbH | 1-1010-050 (50 reactions) 1-1010-010 (10 reactions) | Includes the SAH-CC, SAH competitor, streptavidin coated magnetic beads, capture buffer, and wash buffer |
| caproBox™ | caprotec bioanalytics GmbH | 1-5010-003 (110 V) 1-5010-004 (230 V) | For reproducible photo-activation while cooling the samples |
| caproMag™ | caprotec bioanalytics GmbH | 1-5100-001 | For easy handling of magnetic particles without pipetting |
Ссылки
- Katayama, H., Oda, Y. Chemical proteomics for drug discovery based on compound-immobilized affinity chromatography. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 855, 21-27 (2007).
- Barglow, K. T., Cravatt, B. F. Activity-based protein profiling for the functional annotation of enzymes. Nat. Methods. 4, 822-827 (2007).
- Koster, H., Little, D. P., Luan, P., Muller, R., Siddiqi, S. M., Marappan, S., Yip, P. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev. Technol. 5, 381-390 (2007).
- Dalhoff, C., Hueben, M., Lenz, T., Poot, P., Nordhoff, E., Koster, H., Weinhold, E. Synthesis of S-Adenosyl-L-homocysteine Capture Compounds for Selective Photoinduced Isolation of Methyltransferases. ChemBioChem. 11, 256-265 (2010).
- Lu, S. C. S-Adenosylmethionine. Int. J. Biochem. Cell. Biol. 32, 391-3952 (2000).
- Cantoni, G. L. Biological methylation: selected aspects. Annu. Rev. Biochem. 44, 435-451 (1975).
- Jeltsch, A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. ChemBioChem. 3, 274-293 (2002).
- Chow, C. S., Lamichhane, T. N., Mahto, S. K. Expanding the nucleotide repertoire of the ribosome with post-transcriptional modifications. ACS Chem. Biol. 2, 610-619 (2007).
- Grillo, M. A., Colombatto, S. S-Adenosylmethionine and protein methylation. Amino Acids. 28, 357-362 (2005).
- Fujioka, M. Mammalian small molecule methyltransferases: their structural and functional features. Int. J. Biochem. 24, 1917-1924 (1992).
- Borchardt, R. T., Salvatore, F., Borek, E., Zappia, V., Williams-Ashman, H. G., Schlenk, F. . The Biochemistry of S-Adenosylmethionine. , 151-171 (1977).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S-adenosyl-l-methionine. Biochemistry. 25, 4444-4449 (1986).
- Keller, A., Nesvizhskii, A. I., Kolker, E., Aebersold, R. Empirical statistical model to estimate the accuracy of peptide identifications made by MS/MS and database search. Anal. Chem. 74, 5383-5392 (2002).
- Nesvizhskii, A. I., Keller, A., Kolker, E., Aebersold, R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 75, 4646-4658 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены