Method Article
メチルトランスフェラーゼのプロファイリングおよびその他の S -アデノシル- L -ホモシステイン結合タンパク質
要約
キャプチャ化合物は、光架橋および精製に続いて機能的な可逆小分子 - タンパク質相互作用により、プロテオームの複雑さを軽減するために三官能性低分子化合物です。ここでは、使用してキャプチャーコンパウンドを使用 S -アデノシル- L -ホモシステイン結合選択性の関数としてのメチルトランスフェラーゼを分離する大腸菌全細胞は、溶解液とMSでそれらを識別する。
要約
アフィニティークロマトグラフィーなど1または活動ベースのタンパク質プロファイリング2のような機能性小分子とタンパク質の相互作用に基づいてプロテオームの複雑さを軽減するためのさまざまなアプローチがあります。三官能キャプチャ化合物(CCS、図1A)3は 、一般的なアプローチの基礎とされている初期の平衡駆動型の低分子プローブ(ここで選択性の機能、S -アデノシル- L -ホモシステイン、SAH、図1A)との間の相互作用と標的タンパク質は、不可逆的にCCの独立した光活性化反応の機能(ここでphenylazide)と標的蛋白質の表面との間の光架橋により固定されています。固相(ここでストレプトアビジン磁気ビーズ)の助けを借りて、複雑な生物学的な混合物からタンパク質複合体 - ソート関数(ここでビオチン)は、CCを分離するのに役立つ。実験の二つの構成が可能です:"オフビーズ"4または現在説明"上のビーズ"の構成(図1B)。選択性の機能は、関心のあるほぼすべての小分子(基質、阻害剤、薬物分子)があります。
(SAM、図1A)S -アデノシル- L -メチオニンは、おそらくATP、自然5、6で最も広く使用されている因子に2番目です。それはDNA 7メチル化SAM依存メチルトランスフェラーゼ(MTases)、、RNA 8、蛋白質9、または小分子10で触媒される化学反応を持つすべての生物の主要なメチル基供与体として使用されます。多様な生理学的なシナリオでのメチル化反応の重要な役割(遺伝子制御、エピジェネティクス、代謝)を考えると、MTasesのプロファイリングは、キナーゼのプロファイリングなど、機能的プロテオミクスにおける同様の重要性になることを期待することができます。彼らのプロファイリングのための分析ツールは、しかし、利用されていない。我々は最近、この技術格差(図1A)を埋めるために選択性のグループとしてSAHとCCを導入しました。
SAH、メチル転移後のSAMの製品は、既知の一般的なMTase製品の阻害剤11です。このような理由から、天然補酵素SAMが原因で、その化学的不安定性の12因子の他の部分を転送するかだけでなく、ラジカル反応を開始、さらに酵素で使用されているため、SAHは、ターゲットMTasesへのCCの理想的な選択性の関数です。ここで、我々は、 大腸菌の株DH5α( 大腸菌 )からMTasesと他のSAH結合タンパク質をプロファイリングすることによって好ましいモデルを務めている最高の特徴と原核生物、のいずれかをSAH - CCとCCMSのユーティリティを報告する数え切れないほどの、生化学、生物学、およびバイオテクノロジーの研究で生物。写真活性化架橋は、実験の収量と感度を向上させ、特異性は容易に自由SAHの過剰を使用して競合実験のためにテストすることができます。
プロトコル
E. 1)準備大腸菌 DH5α細胞可溶化物
- E.と2mLの培養(試験管内のLB培地)を接種する8時間大腸菌 37直接グリセロールストックとインキュベートからDH5α株℃、250 rpmでオートクレーブしたLB培地(10g / lのバクト - トリプトン、5g / L酵母エキス、10g / Lの塩化ナトリウム、pH 7.5)を使用してください。
- 37℃と軌道シェーカーとインキュベーター内で166回転を一晩2mLの培養液とインキュベートするとバッフルで1L振とうフラスコに250mLのLB培地に接種する。
- それぞれを含む2.5 LのLB培地は250 mlの培養液(各フラスコに50 mL)でバッフルを4個の5 Lシェーカーフラスコに接種し、37の文化をインキュベート· 0.8のOD 600まではCと166回転に達している。
- 20分間4℃、3000X gで遠心分離して細胞を収集する。 0〜4℃℃または氷上でさらに処理を行います。
- Milli - Q水で収穫細胞の材料に再サスペンド、6000x g及び4℃で更に30分間℃まで毎に遠心バケットと遠心機で組み合わせる
- -20℃または-78℃での結果20gの細胞材料を保管してください
- 100mlの氷冷細胞の開口部のバッファー(6.7 mMのMES、6.7 mMのNaOAc、6.7 mMのHEPES、1mMのEDTA、10mMのβ-メルカプトエタノール、200mMのNaClを、pH7.5の、10%(w / v)の中に細胞を再懸グリセロール、0.2mMのPMSF)と超音波処理(BANDELIN電子社&Co KG、最大振幅から例えばSONOPULS HD 2070、連続出力)を使用して氷の上の4つの25mLの部分で1分間を3回超音波処理。
- 2370x gおよび2℃で一晩ライセートを遠心
- 2370x gおよび2℃で限外濾過(例えば、PierceからICONコンセントレータ、7 mL/9Kを、使用して)で14 mLに上清を濃縮
- つの列; 2分間、1000X gで削除されたストレージバッファー、5 mLで4倍の平衡ピアースから° C(例えばZeba脱塩スピンカラム、10mLの、2でゲル濾過により、SAMまたはSAHのような小分子から粘性の濃縮物を枯渇させる氷冷細胞の開口部のバッファーとバッファはそれぞれ、2分間1000X gで削除、3.5 mLを各列に適用鉱、24倍速のgで45分間の遠心分離、1000X gでその後2回2分)
- 13mlの氷冷グリセロールとロシュミニプロテアーゼインヒビターカクテル錠、EDTAフリーで結果を13mlの溶解液を補う。錠剤を混合し、溶解する。
- -20℃でライセートを保存する
- ブラッドフォードアッセイ(本例の21 mg / ml)を別の総タンパク質濃度を決定する。ブラッドフォード試薬:100mgをクマシーブリリアントブルーはmLの95%エタノール50のG - 250、ワットマン#1ろ紙で100mLの85%(w / v)のリン酸、染料が完全に溶解した1 Lに希釈し、フィルターを追加するだけ使用前に。
2)捕捉アッセイ()、競争のコントロール(C)、プルダウン(PD)、プルダウン(CPD)の競争の制御、およびCombined捕捉アッセイプラスプルダウン(+ PD)
- 捕獲実験のために、SAH caproKit(caprotec bioanalytics GmbHは)SAH - CC、競争相手としてフリーSAH、1μmの直径(ダイナMyOneストレプトアビジンC1、インビトロジェンDYNAL)、5Xキャプチャバッファとストレプトアビジン被覆磁気ビーズを含む、使用されていました(5X CB、100mMのHEPES、250mMの酢酸カリウム、50mMの酢酸マグネシウムおよび50%グリセロールを含む)、及び5 ×洗浄バッファー(5X WB、250 mMトリス塩酸、pH 7.5、5mMのEDTA、5 M NaClを、42.5を含むμMオクチル-β- D -グルコピラノシド)。
- それは水のマスターミックスを調製することが推奨され、いくつかの並列実験のために、バッファおよびE.をキャプチャ大腸菌のライセート一200μL- PCRチューブストリップの異なるチューブ内で反応を実施する(推奨0.2mLのサーモストリップ、サーモサイエンティフィック、AB - 1114)。ここで、一つの反応チューブの数量が与えられている。つの異なる実験の結果は、捕捉アッセイ()、競争の制御(C)、プルダウン(PD)、プルダウン(CPD)の競争の制御、および複合捕捉アッセイプラスプルダウン(+ PD)である、表示されます。
- 各反応について、Milli - Q水1.2 mLに0.3 mLの5倍のWBを追加して1.5 mLの1X WBを準備。
- 200μLのPCRチューブストリップにSAH - CCロードされたストレプトアビジン被覆磁気ビーズ(caproBeads)を準備する。したがって、各アリコートに対して10 mg / mlのストレプトアビジン被覆磁気ビーズを50μLと100μMSAH - CCの25μLを混合し、精力のビオチン部分の結合を許可する2分間、室温で生じる懸濁液を振るSAH -磁気ビーズ表面上にストレプトアビジンへのCC、および強力な磁石(caproMagTM磁気デバイスを使用してPCRチューブストリップのキャップで、例えば、caprotec bioanalytics GmbH)を用いてビーズを収集する。上清を破棄し、再度サスペンド200μLのWBの結果caproBeadsは、磁気(PCRチューブストリップのキャップで)caproBeadsを収集し、supernating WBを捨てる。ビーズの乾燥を防ぐためにチューブを閉じます。
- 大腸菌DH5αの全体のアリコートを準備0から4で新しいPCRチューブに細胞ライセート° Cマスターミックスを用いて(2.2参照)。一つの反応の場合は、20μLの5X CBと100μLの最終的な反応ミックスのボリュームのMilli - Q水の量を補う。ミックス、0.26 mgのE.を追加する大腸菌ライセート 、穏やかに転倒混和します。唯一のCとCPDのために、20μLの10mMのSAHの競合他社のソリューションを加え、穏やかに(、PD、および+ PDにMilli - Q水ではなく、SAHのソリューションを追加する)に転倒混和します。さらなる分析のため(下記参照)から1μLのサンプルを描く。
- 4℃で3時間、それぞれのライセートとインキュベートでcaproBeadsをサスペンド° C SAH - CCのSAHの選択性関数へのSAH結合タンパク質の可逆的な結合を可能にする回転によって懸濁液中のビーズを保つ。
- 0から4の間の閉じたチューブで30分° Cの合計時間のために懸濁、C、および+ caproBoxTMのPD(紫外光と同時に冷却して生化学的試料を照射する装置、caprotec bioanalytics社)と照射を配置SAH結合タンパク質へのSAH - CCの反応関数の間の共有結合架橋を形成する。したがって、(〜2秒)は非常にまもなく、残りの懸濁物を除去する遠心分離機を、〜15秒(特にふた)のために氷水で、caproBoxTMから、それぞれ、2.5分の照射の間隔の後にクールを懸濁液を取り除くに転倒を数回混ぜる蓋で、と次の照射の間隔にcaproBoxTMに戻って置きます。
- C、PD、CPD、及び+ PDに、または20μLMilli - Q水に20μLの10mM SAHのソリューションを追加し、4℃で10分間懸濁液をインキュベート° Cで、で、架橋さSAH結合タンパク質を置換するSAH - CCへ。回転したり、断続的な手動の再懸濁により懸濁液中でビーズをしてください。
- 強力な磁石を(caproMagTMなど)を使用して懸濁液からcaproBeadsを収集し、上清を捨てて、そしてビーズを6回洗浄 - 再懸濁およびコレクションから - 200μL1X WBと一回200μLのMilli - Q水で。
- ビーズは4℃で数週間のためにMilli - Q水で保存することができます代替プロトコルは、(議論を参照)捕捉されたタンパク質とそれらの同定のさらなる処理のために存在します。
- 200μLの60%アセトニトリル(ACN)でビーズを3回洗浄し、200μLの60パーセントACN/0.2%トリフルオロ酢酸(TFA)(新鮮な準備)で激しく振盪下、室温で10分間のインキュベーションによりビーズから捕捉されたタンパク質を放出する。 LC - MSグレードの試薬と水を使用してください。
- 磁気別、ビーズを回収し、遠心エバポレーター(GeneVac、(株)から例えばMiVacのDNAコンセントレータ、英国)を用いて乾燥するまで上清を蒸発させる。ビーズを捨てます。
3)捕獲されたタンパク質のSDS - PAGEは、
- SDS - PAGEの場合、20μLのSDSサンプルバッファー(50mMトリスHCl、320 mMのβ-メルカプトエタノール、2.5%SDS、0.05%ブロモフェノールブルーの磁気ビーズ(ステップ2.12からACN / TFAソリューションを蒸発)から放出される捕獲されたタンパク質を溶かす、10%グリセロール、pH6.8)を。 (ステップ2.5参照)、19μLのSDSサンプルバッファーから引き出された1μLのサンプルを混ぜて、(アッセイの0.25%)SDS - PAGE解析のためにこの溶液5μLを使用してください。 95 ° CにSDSサンプルバッファー10分でサンプルを加熱し、室温に冷ましてみましょう。
- 25mMのトリス塩基、200 mMグリシン、0.1%SDS、pH8.3中:; OLS OmniPageのミニゲル電気泳動システムSDSランニングバッファーOLS ® ProPage 4-20%トリス/グリシンプレキャストゲル:SDS - PAGE(汎用的な設定で分析する;)SDSランニングバッファーの氷冷下180 Vの定電圧で時間90分を実行します。
- シルバーは、MS互換性のある銀染色法(シグマから例えばProteoSilver銀染色キット)を用いてゲルを染色。代表的な結果を図2に示されています。
ゲルのバンドからのタンパク質やペプチドの抽出4)ゲル内トリプシン消化物
- 銀染色停止液を除去した後、10分を100 mLのMilli - Q水で銀染色ゲルの少なくとも3回洗浄する。
- ゲルのバンド(例えば、0.5mlのエッペンドルフチューブに清潔なメスと転送を使用して)、-20℃で保存または直接プロセスを切り取ります。 100μLの水、100μLの50%エタノール、100μLの水、100μLの50%エタノール、および純粋なエタノールで5分間で、それぞれ、15分間ゲルのバンドを洗います。もう一度この洗浄操作を繰り返します。
- 消化液、ゲル、10μLで再水和ゲルのバンド(12.5 ng /μLの50 mM重炭酸アンモニウムでグレードトリプシンをシーケンシング、292.5μLの50 mM重炭酸アンモニウムを1mM塩酸に7.5μLの0.5μg/μLトリプシン溶液を添加して準備)4℃で45分間上清を除去し、℃で一晩振とうしながら37℃でインキュベーションに続いて20μLの50 mM重炭酸アンモニウム(トリプシンなし)で置き換えます。
- 上清を集める。振とうしながらペプチド抽出するために、追加、15分間20μL、5%ギ酸(FA)でゲルのバンドをインキュベート20μLACNと、振盪しながらさらに15分間インキュベートした。前回の上清で上清を組み合わせて、もう一度ペプチド抽出手順を繰り返します。
- 乾燥するまで統合された3つの上清を蒸発させ、超音波を振って、適用しているときに10μLの5%FAで溶解(超音波風呂、Bandelinから例えばSonorex、ドイツ)と(ステップ5.2およびそれ以上)脱塩に進みます。
5)捕獲されたタンパク質及びLC-MS/MS用ペプチドの調製のトリプシン消化物は、
- 超音波風呂とボルテックスを用いて10μLの50 mM重炭酸アンモニウムで磁気ビーズ(ステップ2.12から蒸発ACN / TFAソリューション)から放出された捕捉されたタンパク質を溶解、1mMのHClで1μLの0.5μg/μLトリプシンを追加し、で解決策をインキュベート37 ° Cで一晩。
- C18材料を使用して捕捉されたタンパク質のトリプシンペプチドを含む溶液を脱塩(例えば20から10μLStageTips、20μLの先端、Proxeonアプライドバイオシステムズ/ S、オーデンセ、デンマーク、製造者の手続き:事前条件10μL、50%メタノール/ 5付%のFAは、捕捉されたタンパク質のペプチドで、10μLの5%FAで負荷を平衡化10μLの5%FAで洗浄し、10μLの50%メタノール/ 5%FA)で2回溶出する。
- 50%メタノール/乾燥に5%FAで脱塩されたペプチドを蒸発させ、超音波(超音波風呂)を振って、適用しているときに5.5μLの0.1%FAで溶解し、nanoLC-MS/MSでサンプルを分析する。
6)NanoLC-MS/MS分析
- ナノ流量液体クロマトグラフィー(ナノLC)システム(; Proxeonアプライドバイオシステムズ/ S、デンマークなどの簡単NLC液体クロマトグラフィーシステム)にサンプルプレートと場所のプレートにサンプルを移す。
- ACNで、0.1%FAはBのみLC - MSグレードの溶媒を使用する移動相として移動相として水で0.1%FAを使用してください。
- 分析カラム(C18などナノフロー生物圏、5ミクロン、120Åの結合、直接(NanoSeparations、オランダなどナノフロー生物圏C18、5μm以下、120 Å、20 × 0.1mm)をプレカラムにペプチド溶液5μLをロードする、100 × 0.075ミリメートル、NanoSeparations、オランダ)5%ACN/0.1%のFAを使用。
- LCの間に、5%ACN/0.1%のFAから40%へ80分直線勾配中に溶出するペプチドACN/0.1%の追加の2分間に続いてFA 100パーセントACN/0.1%のFAへと100%でACN/0.1%を残りの400 NL / minの流量制御で別の8分間FA。
- サーモFisherScientific、ドイツ、エレクトロスプレーイオン化(ESI)のためのナノエレクトロスプレーイオン源を搭載した; Proxeon高精度、最先端の質量分析計(例:LTQ Orbitrap XL質量分析計で溶出されたペプチドの質量分析(MS)解析を実行アプライドバイオシステムズ社A / S、デンマーク)。
- 自動的にorbitrap - MS(プロファイルモード)とLTQ-MS/MS(重心モード)の買収を切り替えるにはデータ依存モードでの質量分析を行います。
- 注入時間自動利得制御を設定することにより、質量分析計のデューティサイクルを制御します。
- のm / z 400(リニアイオントラップで50万電荷の目標値まで蓄積した後)で、分解能R = 60,000とorbitrapで調査のフルスキャンMSスペクトルを比(m / z 300から2000年まで)取得する。
- 順次万電荷の目標値に衝突誘起解離(CID)を使用して、線形イオントラップにおける断片化のための最も強烈なイオンを(最大5、信号強度に応じて)分離する機器を設定します。結果として得られるフラグメントイオンは、LTQに記録されます。
- MSモードでの精密質量測定では、内部のリアルタイム用ロックの質量などの周囲の空気からエレクトロプロセス中に生成された1価polydimethylcyclosiloxane背景イオン(Siの(CH 3)2 O)6 H +を (m / zの 445.120025)を使用してください再校正。
- 動的にすでに60秒の間、CIDのために大量に選択したターゲットのイオンを除外する
- 未割り当ての電荷を持つCIDのためのイオンの荷電状態のスクリーニングと拒絶反応を設定します。
- さらに質量分析の設定は次の通りです:1.6 kVのセットのスプレー電圧、200〜キャピラリー加熱転送の設定温度は、° C、および正規化された衝突エネルギーは、MS 2の35%を占めている。 MS 2に必要な最小限の信号は500カウントです。活性化Q = 0.25およびMS 2買収のための30ミリ秒のアクティベーション時間を適用します。
- LCシステムをクリーンアップするには、二つの連続したCCMSの測定値間に1つのブランクランを実行します。
自動化された配列データベースの検索を介して7)ペプチドとタンパク質同定
- MS / MSデータ(RAWファイルに保存されている今回の場合)、BioworksBrowser 3.3.1 SP1(FisherScientificサーモ、ドイツ)とX!タンデム(グローバルプロテオームの機械機構の実装例SEQUESTを分析するタンパク質同定アルゴリズムを使用して、バージョンScのに実装さ2007.01.01.1)affold 3ソフトウェア(バージョンScaffold_3_00_03、プロテオームSoftware社、米国)。
- (: 大腸菌 、K12株、リリース57から11本研究に使用されるデータベース)調査、生物の最も最近のUniProtKB /スイス- Protデータベースのリリースのwww.expasy.orgに対して検索を自動化されたデータベースを実行します。
- 5ppmの前駆体の許容値は、1原子質量単位のフラグメントイオンの許容値、および最大2つのミス開裂までを可能にする完全なトリプシンの特異性:SEQUEST内での検索が自動化されたデータベースの設定を使用します。メチオニンの酸化;アスパラギンとグルタミンで脱アミド化、リジンやセリンでのアセチル化リジンでホルミル化、およびアルギニン、リジン、セリン、スレオニンのメチル化、およびアスパラギン変数の変更のセリン、スレオニン、そしてチロシンのリン酸化のように許可する。データベースの検索に固定変更を使用しないでください。
- SRFまたはDTAとSEQUESTとX!タンデムデータベースの検索を組み合わせることにより、ペプチドの割り当ておよびタンパク質の同定の確率の評価を行うスキャフォールド3にSEQUESTによって生成された出力ファイルをロードします。足場は簡単にいくつかのサンプルからのタンパク質のリストを比較し、視覚化するのに便利です(存在する場合は、C、PD、CPD、及び+ PD)。
- ペプチド預言者のアルゴリズム(ref.13)によって指定された≥95%の確率でしかペプチドを考慮するスキャフォールド3ソフトウェア内でパラメータを設定します。 ≥50%に、単一のペプチド蛋白質の同定のため。タンパク質の預言者のアルゴリズム13に記載の≥95%まで任意に設定したタンパク質の確率を、複数のペプチドの割り当てのためのタンパク質同定の確率を設定し、手動で対応するペプチドのMS / MSスペクトルを調べてください。類似のペプチドを構成し、単独でMS / MS分析に基づいて区別することができなかったタンパク質は、節約の原則を満たすためにソフトウェアによってグループ化されます。ペプチドの同定の推定偽発見率は逆にタンパク質のデータベースのアプローチを使用し、<1%でなければならない決定することができます。
- CCMSの実験の代表的な結果は表1、表2に示され、されている補足表S1(タンパク質のデータベースはいくつかのタンパク質のための最新ではないことを覚えて、たとえばPrmB(別名YfcB)またはRsmH(別名MraW))だけでなく、図3のように。
8)代表の結果
表1:
| タンパク | ORF | MW / kDaの | 説明 | 基材 | A | C | PD | CPD | + PD |
| DCM | b1961 | 53.5 | DNA -シトシンMTase | DNA(m5C) | 1 | 0 | 0 | 0 | 1 |
| RlmI | b0967 | 44.4 | 23S rRNAのm5C1962 MTase | リボソームRNA(m5C) | 17 | 0 | 17 | 0 | 20 |
| RlmL | b0948 | 78.9 | 23S rRNAのm2G2445 MTase | リボソームRNA(m2G) | 12 | 0 | 0 | 0 | 10 |
| TrmB | b2960 | 27.3 | tRNAは(グアニン- N(7) - )- MTase | tRNAは(m7G) | 11 | 0 | 0 | 0 | 13 |
| CmoA | b1870 | 27.8 | tRNAは(cmo5U34)- MTase | tRNAは(mcmo5U) | 7 | 0 | 0 | 0 | 4 |
| RsmG | b3740 | 23.4 | 16S rRNAのm7G MTase | リボソームRNA(m7G) | 6 | 0 | 1 | 0 | 5 |
| RsmH | b0082 | 34.9 | 16S rRNAのm4C1402 MTase | リボソームRNA(m4C) | 5 | 0 | 0 | 0 | 7 |
| RsmD | b3465 | 21.7 | 16S rRNAのm2G966 MTase | リボソームRNA(m2G) | 2 | 0 | 0 | 0 | 2 |
| RsmB | b3289 | 48.3 | 16S rRNAのm5C967 MTase | リボソームRNA(m5C) | 1 | 0 | 0 | 0 | 0 |
| MnmC | b2324 | 74.4 | 二官能性タンパク質は、tRNA(MNM(5)S(2)U34) - MTaseが含まれています | tRNAは(mnm5s2U) | 1 | 0 | 0 | 0 | 0 |
| PrmB | b2330 | 35.0 | 50Sリボソームタンパク質L3 Gln150 MTase | タンパク質(Gln)を | 13 | 0 | 0 | 0 | 15 |
| シェール | b1884 | 32.8 | 走化性タンパク質MTase | タンパク質(GLU) | 0 | 0 | 0 | 0 | 1 |
| CFA | b1661 | 44.9 | シクロプロパン脂肪酸-アシル-リン脂質合成酵素 | 小分子 | 15 | 0 | 0 | 0 | 14 |
| タム | b1519 | 29.0 | トランスaconitate 2 - MTase | 小分子 | 2 | 0 | 0 | 0 | 3 |
| CysG | b3368 | 50.0 | Siroheme合成酵素は、ウロポルフィリノーゲン- III C - MTase含まれています | 小分子 | 1 | 0 | 0 | 0 | 2 |
| SMTA | b0921 | 29.8 | タンパク質SMTA | (?A) | 7 | 1 | 0 | 0 | 8 |
| MtnN | b0159 | 24.4 | SAH / 5' -メチルチオヌクレオシダーゼ | 小分子のB | 36 | 0 | 0 | 0 | 39 |
| GlnA | b3870 | 51.9 | グルタミン合成酵素 | 小分子のC | 90 | 0 | 0 | 0 | 97 |
| RplK | b3983 | 14.9 | 50Sリボソームタンパク質L11 | タンパク質MTase PRMA dの | 2 | 0 | 0 | 0 | 2 |
(完全に)特徴がない
B SAHのグリコシド結合のないメチル化が開裂
Cなしメチル化が競争相手としてATPとCCMSの実験(データは示さず)によって示されるようにATP結合部位へのSAHの結合
50Sリボソームタンパク質L11 MTase PRMAのD基板、CCMSによって再現可能な特定の識別(データは示さず)
表1:MTasesとCCMS実験によって識別される他の選択されたタンパク質。与えられた数字は、タンパク質あたりの重みなしのペプチドのスペクトル数を表す。サンプルはSDS-PAGE/silverは図2の染色によって分析したものと重複している。はるかMTasesと他のSAH結合タンパク質は、プルダウン(PD)とSAHの特異性と比較してCCMSアッセイ()で識別される競争の制御(C)におけるこれらのタンパク質のほぼ完全な欠如によって示されています。
表2:
| A | C | PD | CPD | + PD | |
| A | 111(64) | ||||
| C | 65(41) | 107(46) | |||
| PD | 25(15) | 23(13) | 61(17) | ||
| CPD | 23(13) | 22(12) | 20(14) | 47(14) | |
| + PD | 87(61) | 64(41) | 23(14) | 22(12) | 124(67) |
表2:実行の間CCMSを実行し、タンパク質のオーバーラップで同定されたタンパク質の合計数。少なくとも2つのペプチドと同定されたタンパク質の数は括弧内に与えられている。方法の高い再現性が特に確実に同定されたタンパク質と同等の実験間で高いタンパク質のオーバーラップ(主に非特異的タンパク質の)(AとCと特に対A + PDだけでなく、PD対CPD)から推測することができます。少なくとも2つのペプチド。また、すべての同定されたタンパク質のリストについては、ベン図と補足表のS1は、 図3を参照してください。
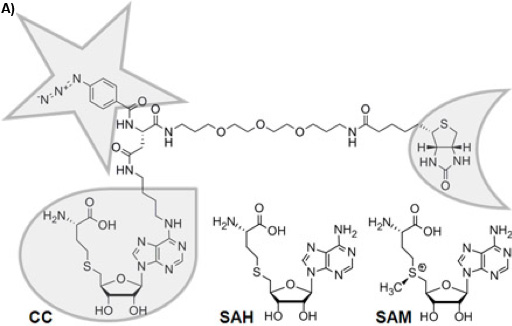
図1A:官能キャプチャ化合物(CC)の化学構造。選択性の機能は、液滴、スターとの反応性の機能、および半月でソート関数で囲まれている。化学的に安定したS -アデノシル- L -ホモシステイン(SAH)はSAHは、製品の阻害剤として機能するためにSAM依存MTasesによるメチル基転移後(SAM)、S -アデノシル- L -メチオニンの補因子の製品です。
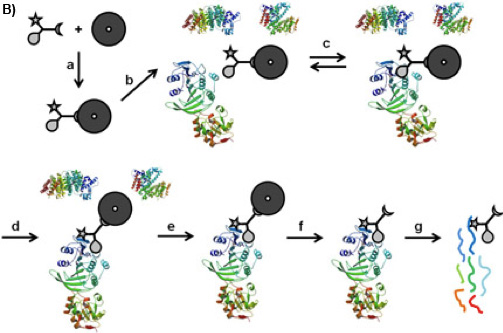
図1B:CCMS"オンビーズ"ワークフロー。CCは、そのソート関数()で磁気ビーズに結合しているが、そのように形成されたcaproBeadsは可逆結合平衡(cは)の選択性の機能との間に確立される複雑なタンパク質混合物(B)、とインキュベートされていますCCと標的タンパク質は、UV照射(d)にすると、反応性の機能は、共有結合架橋を形成している。捕捉されたタンパク質(e)を担持する磁性ビーズを洗浄した後、磁気ビーズから架橋CC -タンパク質複合体(f)の開裂、及びトリプシン消化物(G)、捕捉されたタンパク質はトリプシンペプチドのMS分析によって同定することができます。
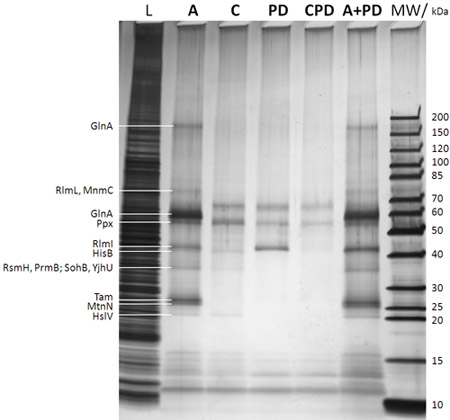
図2:SDS-PAGE/silver捕捉されたタンパク質の染色分析(図1Bの手順fの後)。 0.25%のサンプルcaproBeadsを追加する前に、 大腸菌 DH5a全細胞溶解液から引き出さ:; L非常に右側に与えられたマーカーのバンドの対応する分子量と分子量マーカー:レーンの説明は、ゲルの上部(MWで与えられる。図1BにおけるUV照射工程dの後にフリーSAHの過剰添加したアッセイ、C::ステップcとdの間に競争相手としてフリーSAHの過剰を含むアッセイの制御図1Bの(本質的な、図1Bの工程bあらゆる非特異的に捕捉されたタンパク質を決定する)、PD:プルダウンの意味図1BのないUV照射工程dと無料のSAHの無添加、CPD:競争相手としてSAHを使用してプルダウンの制御; + PD:なし加算を意味しない組み合わせたアッセイに加えてプルダウンフリーSAHのワークフローの間)。カットアウトタンパク質ゲルのバンドから、ゲル内トリプシン消化した後、MSによって同定されたタンパク質は、非常にlefttに与えられている。それは、光架橋が実験の収量と感度を強化し、特異性が容易に自由なSAHの過剰を使用して競合実験のためにテストすることができることは明らかである。 MTasesと現在の図に示すように、それらの重複サンプルのCCMS実験によって識別される他の選択されたタンパク質については、表1を参照してください。

図3:識別CCMSアッセイにおけるタンパク質()、競争の制御(C)、およびプルダウン(PD)のオーバーラップをexplaningベン図。左:MTasesとSAHのヌクレオシダーゼ、だけの数、表1を参照する。右:すべての同定されたタンパク質の数を表2および補助表のS1を参照する。少なくとも2つのペプチドと同定されたタンパク質の数は括弧内に与えられている。
ディスカッション
記述されたプロトコルを以下のときは、次の注意事項とコメントは役に立つかもしれません:これは、その後の厳しい洗浄条件を許可するようにCCの)主要な利点は、CCとMTase間の共有結合の形成にある。共有結合架橋は、UV光(310 nmの最大)によって引き起こされる光反応によって達成される。通常のオーバーヘッドの光は紫外線のごく一部が含まれている、しかし、上caproBoxの制御と冷却照射のオーバーヘッド、あるいは太陽の光に長く曝露によるSAH - CCを保護する。 B)MTasesが分離される元となる生体試料が変性を起こしやすいタンパク質を含む可能性がある、従ってそれは、試料を低温に保つため、常に泡を避けるために必須です。 C)caproBoxが0〜4にサンプルを冷却° C、UV光を発するランプは、しかし、また熱を発する。したがって、それは一時的に照射する前にバイアルを遠心分離する必要があるので、キャップやバイアルの壁に付着したタンパク質は、降水量の種子を形成することはできません。 D)磁性ビーズの再懸濁が(洗浄溶液などにおいて)手で不可能な場合は、すぐに超音波浴中に試料を配置することにより、超音波を適用する。 e)の新鮮な0.2パーセントTFA/60%のACN溶液を調製。我々は、そうでなければ捕捉されたタンパク質がビーズから切断されていない可能性がありますことを発見。 f)に捕捉されたタンパク質の最終的な分析は、LC-MS/MSにより実施される。質量分析法は高感度な方法です。それは最後のステップ(ステップ2.11とさらに)で排他的にLC - MSグレード試薬を使用する必要があります。外部のタンパク質源、ほこりからまたは実験者からの発信などのケラチンでの実験のコンタミネーションを避ける。特に最終的な消化のステップの間に、それは、清潔な作業スペースに注意を払うために手袋を着用すると白衣と多分ヘアネットまたは理想的にはクリーンベンチの下に最終的な手順を実行することをお勧めします。フィルタ、分注し、-20℃で保存し、汚染を避けるために一度だけ各アリコートを使用して0.22μmのフィルター、LC MSグレードの水の中でトリプシン消化物に使用する50mMの重炭酸アンモニウムバッファを準備します。トリプシン溶液(クエンシンググレード、ロシュ、凍結乾燥したトリプシンに1mMのHClを添加、0.5μg/μLの溶液を調製)を、4℃で数週間保存することができます。 g)を信頼性の高いマススペクトルを得るためには、ESI-MS/MS分析で安定したスプレーを持つことが不可欠です。 H)本研究で使用したもの以外のLC-MS/MSシステムでは、測定パラメータとペプチド同定アルゴリズムを個別に調整する必要があります。
次の変更を説明するプロトコルに関して可能です:60%ACN/0.2%TFA(ステップ2.11)でビーズからタンパク質を放出する代わりに)、タンパク質は直接trypticallyビーズ懸濁液(同じボリュームなどの内で消化することができます。ステップ5.1)でまたは、SDS - PAGEのために、タンパク質を95ステップ2.9の後に収集されたビーズを懸濁し、加熱することによって解除することができます℃のSDSサンプルバッファーで10分(両方とも、全体の停止または上清のみをロードすることができるためゲルのポケットに)。我々は、ビーズがゆっくりであっても、いくつかの水系洗浄ステップの後で、ビーズトリプシン消化物中に水性のトリプシン消化物の溶液中にポリマーの少量を解放することを発見。ポリマーの汚染は、MSペプチドの同定と干渉し、80%ACNを(少なくとも3回)を使用してビーズから洗浄することができます。 80%ACNの洗浄ステップの後、ビーズを前に、オンビーズトリプシン消化物に水で1回洗浄してください。 B)ストレプトアビジン- horseraddishペルオキシダーゼおよびECL基質を用いたウェスタンブロットはまた、タンパク質にビオチンを含むCCの成功架橋を可視化するために使用することができます。したがって、ステップ3.2の後に得られるいずれのゲルをブロットすることができるまたは、感度が10倍程度であるため、ステップ2.7の後に10μlのサンプルを、ゲルの銀染色よりも高いにもウェスタンブロットで分析することができます。後者の場合にendogeneouslyビオチン化タンパク質はまた、人為的にSAH - CCによるビオチン化タンパク質のほかに検出されることに留意。 c)我々は、架橋反応が溶液4で自由CCとタンパク質の間で行われる"オフビード"の構成、どうか、(ライセート、標的タンパク質、選択性と彼CCの反応性の機能を対処)それは特殊なシステムに依存することを見出したまたは現在説明"上のビーズ"の構成(図1B)は、パフォーマンスが向上します。
一般的には、この方法はまた、あらゆる最先端の安定同位体の蛋白質またはペプチドの標識技術、または2次元ゲル電気泳動によるキャプチャのサンプルの評価と互換性があります。 "オフ - ビーズ"構成では、全細胞(未発表結果)内のタンパク質をキャプチャすることも可能です。さらに、薬剤またはタンパク質の補因子結合部位は、MSペプチド配列決定によりタンパク質配列内にCCのすぐ近くの架橋の位置を決定することにより説明することができます。蛋白質への小分子の結合様式は異なるC言語を使用して調べることができます選択性の機能と異なるリンカー長でhemical取り付け位置。として選択する機能によってアドレスのタンパク質のタンパク質結合パートナー(PRMAの基質としてRplK)また、本研究で示されているか、または未知の小分子のタンパク質の相互作用(GlnAにSAH)を識別することができます。要約、CCの追加機能、光架橋反応は、高感度で、複雑なタンパク質混合物から低濃度タンパク質や機能性タンパク質のファミリーの分離と同定を可能にし、低分子化合物を研究するための追加のツールを科学者を提供 - タンパク質相互作用。
開示事項
謝辞
この作品は、ヒューマンフロンティアサイエンスプログラム推進機構(HFSPアワード2007、RGP0058/2007-C)によってサポートされていました。我々はプロジェクトを開始するためと有意義な議論のための教授リチャードロバーツに感謝。
資料
| Name | Company | Catalog Number | Comments |
| SAH caproKit™ | caprotec bioanalytics GmbH | 1-1010-050 (50 reactions) 1-1010-010 (10 reactions) | Includes the SAH-CC, SAH competitor, streptavidin coated magnetic beads, capture buffer, and wash buffer |
| caproBox™ | caprotec bioanalytics GmbH | 1-5010-003 (110 V) 1-5010-004 (230 V) | For reproducible photo-activation while cooling the samples |
| caproMag™ | caprotec bioanalytics GmbH | 1-5100-001 | For easy handling of magnetic particles without pipetting |
参考文献
- Katayama, H., Oda, Y. Chemical proteomics for drug discovery based on compound-immobilized affinity chromatography. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 855, 21-27 (2007).
- Barglow, K. T., Cravatt, B. F. Activity-based protein profiling for the functional annotation of enzymes. Nat. Methods. 4, 822-827 (2007).
- Koster, H., Little, D. P., Luan, P., Muller, R., Siddiqi, S. M., Marappan, S., Yip, P. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev. Technol. 5, 381-390 (2007).
- Dalhoff, C., Hueben, M., Lenz, T., Poot, P., Nordhoff, E., Koster, H., Weinhold, E. Synthesis of S-Adenosyl-L-homocysteine Capture Compounds for Selective Photoinduced Isolation of Methyltransferases. ChemBioChem. 11, 256-265 (2010).
- Lu, S. C. S-Adenosylmethionine. Int. J. Biochem. Cell. Biol. 32, 391-3952 (2000).
- Cantoni, G. L. Biological methylation: selected aspects. Annu. Rev. Biochem. 44, 435-451 (1975).
- Jeltsch, A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. ChemBioChem. 3, 274-293 (2002).
- Chow, C. S., Lamichhane, T. N., Mahto, S. K. Expanding the nucleotide repertoire of the ribosome with post-transcriptional modifications. ACS Chem. Biol. 2, 610-619 (2007).
- Grillo, M. A., Colombatto, S. S-Adenosylmethionine and protein methylation. Amino Acids. 28, 357-362 (2005).
- Fujioka, M. Mammalian small molecule methyltransferases: their structural and functional features. Int. J. Biochem. 24, 1917-1924 (1992).
- Borchardt, R. T., Salvatore, F., Borek, E., Zappia, V., Williams-Ashman, H. G., Schlenk, F. . The Biochemistry of S-Adenosylmethionine. , 151-171 (1977).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S-adenosyl-l-methionine. Biochemistry. 25, 4444-4449 (1986).
- Keller, A., Nesvizhskii, A. I., Kolker, E., Aebersold, R. Empirical statistical model to estimate the accuracy of peptide identifications made by MS/MS and database search. Anal. Chem. 74, 5383-5392 (2002).
- Nesvizhskii, A. I., Keller, A., Kolker, E., Aebersold, R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 75, 4646-4658 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved