Method Article
العضلة المشمرة ماوس التحضير لتصوير Intravital للدوران الأوعية الدقيقة
In This Article
Summary
ووصف إعداد التصور والأنسجة لمعالجة التجريبية للدوران الأوعية الدقيقة الحية. في الفئران الذكور تخدير ، يتم إعداد رقيقة ، والعضلات المشمرة أوعية دموية للغاية لintravital المجهري لدراسة شبكات الاوعية الدموية الدقيقة بما في ذلك الشرايين والشعيرات الدموية والأوردة. ويتم تكييف بسهولة التحضير لهذه الجرذان والفئران البيضاء.
Abstract
في جميع أنحاء الجسم ، والحفاظ على التوازن يتطلب امدادات ثابتة من الأوكسجين والمواد المغذية يصاحب ذلك مع إزالة الأيضية والمنتجات. ويتحقق هذا التوازن عن طريق حركة الدم من خلال دوران الأوعية الدقيقة ، والذي يشمل فروع أصغر من إمدادات الأوعية الدموية في جميع الأنسجة والأعضاء. الشرينات فرع من الشرايين على شكل شبكات للتحكم في توزيع وحجم الدم المؤكسج تصب في العديد من الشعيرات الدموية المرتبطة ارتباطا وثيقا مع خلايا متنية. الشعيرات الدموية توفر مساحة كبيرة لتبادل diffusional بين خلايا الأنسجة والدم. الوريدات جمع النفايات السائلة الشعرية وتتلاقى مع عودتهم امؤكسج الدم نحو القلب. لمراقبة هذه العمليات في الوقت الحقيقي يتطلب نهجا تجريبيا لتصور والتلاعب دوران الأوعية الدقيقة الحية.
وقد استخدم لأول مرة في عضلة المشمرة الجرذان كنموذج لدراسة التهاب الأنسجة باستخدام المجهر والإلكترون 1،2 آخر بعد الوفاة. التحقيق الأول في تقرير المجراة من الفئران المعرضة سليمة العضلات المشمرة ردود الاوعية الدموية الدقيقة على الأدوية فعال في الأوعية باستخدام الضوء ينعكس 3. مهما كانت محدودة انحناء في العضلات وعدم وجود إنارة ركزت على فائدة من هذا الإعداد. واستتبع فتح فتحا كبيرا في العضلات ، وفصلها من الخصية وانتشاره شعاعيا كورقة للشقة تضوء تحت المجهر المركب 4. في حين أظهرت أن يكون إعداد قيمة لدراسة علم وظائف الأعضاء للدوران الأوعية الدقيقة في الجرذان والفئران البيضاء 5 6 ، وقد ثبت في العضلة المشمرة الفئران 7 مفيدة بشكل خاص في تشريح مسارات الخلوية تشارك في تنظيم وظيفة الاوعية الدموية الدقيقة 11/08 في الوقت الحقيقي والتصوير من بين الخلايا إشارات 12.
مشتق من العضلة المشمرة عضلات البطن الداخلية المائل والعرضي والخصيتين ينزل من خلال القناة الإربية 13. إنه يساعد على دعم (باليونانية : المشمرة = رباط الجورب) والحفاظ على درجة حرارة الخصيتين. كما هو موضح هنا ، هو إعداد ورقة والعضلات المشمرة شقة رقيقة لقرار الضوئية المعلقة. مع الحفاظ على الماوس في درجة حرارة الجسم ثابتة وطائرة من التخدير ، وإعداد الجراحية ينطوي على تحرير العضلات من الأنسجة المحيطة بها ، والخصيتين ، ونشر ذلك على قاعدة التمثال من المطاط silastic شفافة وتأمين الحواف مع دبابيس الحشرات بينما لري بشكل مستمر مع محلول ملحي الفسيولوجية . ويستخدم هذا البروتوكول الفئران المعدلة وراثيا في التعبير عن GCaMP2 الخلايا البطانية تصلب. GCaMP2 المرمزة وراثيا هو مؤشر الكالسيوم الفلورسنت 12 الجزيء. Widefield التصوير والكاميرا كثف الجهاز المسؤول إلى جانب تمكين في الدراسة المجراة من إشارات الكالسيوم في بطانة تصلب.
Protocol
1. الماوس متنها ، رمى العضلات ، إسفين الجسم وحل superfusion
- "يرصد (سميكة لاحتواءه على المرحلة من المجهر وألف زجاجي شفاف مستطيلة المجلس 6" واسعة X 8 "X الطويلة 3 / 16)" لوحة الماوس "هو المكان الذي يتم تأمين الماوس تخدير أثناء التحضير الجراحي لل: مجلس الماوس المشمرة والعضلات.
- رمى العضلات : ويتم إعداد شفافة رمى من المطاط silastic Sylgard 184 ، يختلط فيها وفقا لتعليمات الصانع ° ق. قالب مناسب هو 15 مم X قطرها بقطر 50 ملم المتاح طبق بتري. هو خفض كتلة Sylgard على الشكل المطلوب مع شفرة حلاقة (انظر الشكل 1C). وتستخدم طبقة رقيقة من السيليكون واضحة لاصقة مقاومة للماء لتأمين كتلة Sylgard إلى لوحة الماوس. نصائح مفيدة : بعد صب Sylgard في صحن بيتري ، التفريغ في فراغ الغرفة لمدة ساعة إزالة فقاعات الهواء ويحسن من الوضوح. بعد التفريغ ، علاج هو اختصار الوقت لSylgard عن طريق وضع الطبق في فرن في المختبر 50 درجة مئوية لعدة ساعات.
- إسفين الجسم ومنصة للتدفئة : اسفين (2 "X 4" X 15 درجة) وضعه تحت الماوس وضد رمى يميل الجسم إلى الأمام مما يسهل تمديد العضلات المشمرة على قاعدة التمثال من مصدره. تتضمن منصة الألمنيوم على سطح يوفر موصل للحرارة. يسخن بواسطة منصة المقاومات موصلة بمصدر التيار المستمر (الشكل 1A). معايرة درجة حرارة منصة ل~ 40 درجة مئوية درجة الحرارة يحافظ على المريء ~ 37 درجة مئوية. خلاف ذلك ، يتم استخدام الحرارة الناتجة عن مصباح.
- الدبابيس. لتأمين العضلة المشمرة على قاعدة التمثال ، وتعد من دبابيس دبابيس 0.15 ملم الحشرات التي كانت مصممة في شكل "L".
- الفسيولوجية محلول الملح (PSS). وsuperfused التحضيرات (المروية) باستمرار مع بيكربونات - مخزنة في جهاز الأمن الوقائي أعد عالى النقاء (18.2 MΩ) H 2 O. وتعد حلول المخزون في التركيز النهائي 20X العمل وتعقيمها من خلال مرشح ميكرومتر 0.2. حلول الأسهم لا تزال جيدة لعدة أسابيع عند تخزينها في 4 درجات مئوية. إعداد الأملاح بشكل منفصل من بيكربونات ومزجها مع التخفيف في يوم من التجربة يمنع هطول الأمطار من بيكربونات الكالسيوم. ويتألف المخزون من محلول الملح (في ملمول / لتر) : 2638 كلوريد الصوديوم ، و 94 بوكل ، 40 MgS0 4 و 23.4 CaCl 2. بيكربونات الأسهم هو 360 NaHCO 3. في يوم من التجربة ، والتوصل إلى حلول لكل منها إلى وحدة تخزين النهائي (عادة 2 لتر بالنسبة للتجربة معينة) في دورق حجمي وتوضع في حمام مائي في ~ 37 درجة مئوية. Equilibrating جهاز الأمن الوقائي مع 5 ٪ CO 2 / 95 ٪ N 2 دقائق 15 ~ باستخدام الغاز المفرق بتعديل الرقم الهيدروجيني إلى 7.4 ~ ويمنع التساقط. وانفجر جهاز الأمن الوقائي باستمرار مع 5 ٪ CO 2 / 95 ٪ N 2 في جميع أنحاء التجارب. الحل النهائي تكوين العمل (في ملمول / لتر) هي : 132 كلوريد الصوديوم ، 4.7 بوكل ، 1.2 MgS0 4 ، 2 CaCl 2 و 18 NaHCO 3.
2. التخدير والتحضير لعملية جراحية
- بعد الحصول على موافقة من رعاية الحيوان واللجنة المؤسسية استعمال وتستخدم الفئران الذكور لا يقل عن 12 أسابيع من العمر. الفأر هو تخدير بنتوباربيتال مع الصوديوم (60 ملغ / كلغ) عن طريق الحقن (IP) داخل الصفاق. أنبوب الزجرية يثبت مفيدة لتأمين الماوس أثناء الحقن الأولي. في جميع أنحاء العمليات الجراحية التجريبية والبروتوكولات ، يتم الاحتفاظ التخدير بواسطة ملاحق (10-20 ٪ من الحقن الأولى ، IP) حسب الحاجة (كل دقيقة 30-60 ، وأشار ، ردا الانسحاب إلى أخمص القدمين أو قرصة الذيل). نصيحة : تمييع بنتوباربيتال 10 ملغ / مل في ملحي معقم قبل الحقن يقلل من احتمال جرعة زائدة.
- التخدير التنازلات تنظيم درجة الحرارة لذلك يجب أن تبقى دافئة الماوس مباشرة بعد الحقن الأولى. وضع الماوس في الناقل المعدنية (التهوية سلة الألومنيوم) في أعلى لوحة التدفئة (معايرتها إلى ~ 37 درجة مئوية) يعمل بشكل جيد. بدلا من ذلك ، يمكن استخدام مصباح الحرارة مع الحرص على وضعه على مسافة مناسبة من الماوس. وينبغي رصد الماوس كل 5-10 دقائق حتى يتم تحقيق مستوى مناسب من التخدير (عدم الانسحاب إلى أخمص القدمين أو قرصة الذيل). قد تكون هناك حاجة لجرعة تكميلية بعد 15-20 دقيقة. فمن الأفضل أن نتحلى بالصبر والمضي قدما بحذر لتفادي جرعة زائدة ، لا سيما مع الحيوانات أو الذين تتراوح أعمارهم بين البدناء.
- إزالة الشعر من أسفل البطن ، أسفل الظهر ، والساقين من قبل كيس الصفن بعناية حلق المناطق المعنية. وينبغي اتخاذ اهتمام خاص لتجنب الصدمة إلى كيس الصفن والخصيتين ، والتي سوف تصيب إلا المشمرة العضلات. إزالة الشعر فضفاض مع مسحة الكحول النقي.
- إذا كانت المثانة ممتلئة فإنه يشعر وكأنه العنب الصغيرة من خلال جدار البطن. إفراغ المثانة عن طريق استخدام الضغط لطيف لمنع الفأرة من التبول على إعداد المشمرة خلال التجارب. A Kimwipe هو الاسفنج تأثير على التحصيلر البول.
- موقف الماوس على ظهرها ، والكذب على وتد مع سيقانه على جانبي التمثال. A خياطة الحرير (4-0 أو 5-0) ترتبط كل قدم ويقدم حبل لتأمين الفأر مع المنشعب ضد قاعدة التمثال. قطعة من الشريط وضعت فضفاضة عبر الصدر والمضمون إلى إسفين يحافظ عموما موقف الجسم. وتجرى العمليات الجراحية أثناء عرض خلال stereomicroscope باستخدام مقص وملقط microdissection الزاوية.
3. الجراحية إعداد العضلات المشمرة فتح
- يتم وضع دبوس من خلال قمة الكيس الصفن (سواء في الجانب الأيمن أو الأيسر) ، والمضمون في قاعدة التمثال إلى مكان التوتر على الجلد. يبدأ Superfusion مع جهاز الأمن الوقائي (34-35 درجة مئوية) على مدى الجراحي الميداني والحفاظ عليها في جميع أنحاء تشريح للحفاظ على النسيج يتعرض دافئة ورطبة. فتيلة (مصنوعة من Kimwipe) المتمركزة مع نهاية واحدة بجانب كيس الصفن وغيرها المقبل إلى خط فراغ يزيل PSS النفايات السائلة. ألف حبة من تسرب السيليكون انضمت إلى مجلس زجاجي ويطوق تماما اسفين ورمى بمثابة "الخندق" لجمع أي PSS الذي لا يستنشق ، الذي يتولى منصب وقائي فعال لمنع تسرب PSS على المجهر.
- يتم إجراء شق على طول السطح البطني للكيس الصفن. إذا كان قد تم سحب الخصية بواسطة العضلات المشمرة في تجويف البطن ، وضغط لطيف على أسفل البطن يوجه الخصية في كيس. وينبغي تحديد سطح العضلة المشمرة المغطي الخصية في هذا الوقت. تتم إزالة النسيج الضام بعناية بين الجلد والعضلات صفني المشمرة لتحرير العضلة المشمرة من الأنسجة المحيطة.
- وتراجع بلطف الجلد صفني خلف الحافة القريبة من التمثال والمضمون على كل جانب مع دبوس. ثم يتم مسح السطح الخارجي للسطح العضلة المشمرة من النسيج الضام. superfusion هيدرات المستمر خلال تشريح النسيج الضام ، وتسهيل الرؤية وإزالتها.
- ويتم استخدام دبوس خلال قمة عضلة المشمرة وضعه تحت التوتر الطولية. يتم إجراء شق طولي من خلال السطح البطني للعضلة بقدر كبير من العناية التي اتخذت للحد من انقطاع إمدادات الأوعية الدموية. يتم تغيير ديناميكية تدفق الدم بالقرب من محيط هذا النسيج من خلال إعداد 14 الضرر. لذلك ، للحد من هذه يؤثر على جمع البيانات ، والأوعية الدموية بالقرب من مركز إعداد وتستخدم للتصوير والدراسات الفسيولوجية.
- توصيل العضلات المشمرة رقيقة من الرباط إلى البربخ تحت الخصية. يعكس الخصية إلى جانب واحد يعرض هذا الرباط ، والذي يفصل بعناية من البربخ. بالقرب من قمة عضلة المشمرة هو الشريان والوريد الصغيرة التي توصيله إلى البربخ. غالقة هذه السفن بين ملقط وسحب بينهما يقلل النزيف. و تربط الخصية ، البربخ والخصية الشريان والوريد قريب (4-0 أو 5-0 خياطة الحرير) ، وقطعت وتجاهل (orchiectomy) جنبا إلى جنب مع لوحة الدهون الأربية المرتبطة بها. بدلا من ذلك ، يمكن دفع الخصية بلطف مرة أخرى إلى تجويف البطن واحتفظ بقطعة من القطن أو Kimwipe. ويخدم orchiectomy لتجنب الصدمات المحتملة على أنسجة الخصيتين عند الضغط مرة أخرى إلى تجويف البطن. لدينا لم يتم العثور على اختلافات ملحوظة في نوعية إعداد المشمرة دوران الأوعية الدقيقة (انظر القسم 3.8) باستخدام إما الإجراء 7،15.
- يتم مسح السطح الخارجي للعضلة المشمرة من النسيج الضام المتبقية ومن ثم انتشار شعاعيا على سطح الركيزة. يتم تأمين حواف مع دبابيس (انظر القسم 1.4) في الأماكن 5-6 لإنشاء ورقة مسطحة من العضلات المخططة مع دوران الأوعية الدقيقة سليمة.
- ينقل إعداد استكمال لمرحلة مجهر intravital ، superfused باستمرار (3-5 مل / دقيقة ، و 34 درجة مئوية) ومعايرتها لمدة 30 دقيقة.
- يتم تقييم سلامة إعداد المشمرة وفقا لعدة معايير. يشار عفوية نغمة حركي مع الحد الأدنى من الصدمة الجراحية التي التدفق السريع في الشرايين ونقص الكريات البيض ملتصقة في الأوردة. المؤشر الأكثر حساسية لإعداد استجابة هو انقباض الشرايين في رفع محتوى الاكسجين حل superfusion لمدة 5-10 دقائق. يتم ذلك عن طريق equilibrating مع 21 ٪ O 2 (مقابل 5 ٪ O 2 ، وانظر القسم 1.5 ؛ مع كل 5 ٪ CO 2 ، والتوازن N 2). وجود الكريات البيض في الشرايين ، وعدم وجود خلايا الدم الحمراء التي تتدفق من خلال الشعيرات الدموية ، و / أو الكريات البيضاء التي تتراكم في الأوردة والأنسجة المحيطة هي علامات تلف الأنسجة والالتهابات.
4. Intravital التصوير للدوران الأوعية الدقيقة العضلات المشمرة
- يتم تنفيذ Intravital التصوير على المجهر مخصصة تستند منصة MVX10 أوليمبوس تكبير الاستريو. الجسم المجهر MVX10هي التي شنت على الوقوف MVX10 الهجين مزودة تضوء (مصابيح الهالوجين) للتصوير (كولر) brightfield مع البرنامج الموسع للتمنيع ، والإضاءة (الزئبق مصباح) للتصوير مضان. باستخدام برنامج الموسع للتمنيع ، الإضاءة ، هو متحمس GCaMP2 في نانومتر 472/30 مع الانبعاثات التي تم جمعها في نانومتر 520/35. يتم الحصول على الصور من خلال عدسة MV 2XC PLAPO (الفتحة العددية = 0.50 ؛ أوليمبوس) باستخدام XR/Mega-10 تكثيف كاميرا رقمية (ستانفورد الضوئيات ، وشركة ؛ SPI) من خلال التحكم في برامج بايبر (SPI) على جهاز كمبيوتر شخصي. مع هذا النظام ، يمكن أن تختلف من حقل لاحظ طريقة العرض (FOV) من 553 ميكرومتر X 442 ميكرون إلى 22 مم X 18 مم.
- عند الانتهاء من تجارب التصوير intravital ، هو الموت الرحيم الماوس مع جرعة زائدة من مخدر بنتوباربيتال تليها خلع عنق الرحم.
5. ممثل النتائج

مجلس ماوس الرقم 1. التصوير intravital إعداد المشمرة الماوس. أ) وتد مع الهيئة منصة الألومنيوم (معزول بالبلاستيك الصفراء) ينظر إليها من الأسفل. المقاومات التدفئة المضمون على الجانب السفلي من المنصة التي أجريت توفير الحرارة. ب) وتقع على منصة التدفئة اسفين البلاستيك. ج) يتم وضع إسفين الجسم على لوح زجاجي لعملية جراحية ونقل لاحقا إلى مرحلة intravital المجهر. يشار Sylgard رمى مع السهم الأحمر. ألف حبة من السيليكون ماء يحيط إعداد كامل لاحتواء أي حل قد تسرب أثناء إجراء intravital ، ومنعه من يقطر على المجهر.

الرقم مخصص MacroZoom 2. مجهر لتصوير widefield. أ) MVX10 الجسم المجهر (أوليمبوس) مع الكاميرا ICCD XR/Mega-10 (ستانفورد الضوئيات) التي شنت على منفذ trinocular. ب) عن قرب عرض للجسم المجهر. (أ) التكبير السيطرة (0.63 إلى 6.3X) ، (ب) عجلة التصفية ، (ج) مضاعف صورة (NA = 0.50 مع التكبير البصري 25X). C) رف المجهر المكثف للإنارة (كولر) brightfield (NA = 0.55 المكثف ، المسافة العامل = 27 ملم).

اكتمل الشكل 3. المشمرة إعداد الماوس. تخدير الماوس في موقف ضعيف في الحارة منصة الألمنيوم البلاستيكية المغلفة (الصفراء). يتم تأمين موقف الجسم مع الشريط. وينتشر في عضلة المشمرة شعاعيا على قاعدة التمثال المطاط silastic شفافة ويعلق على الحواف. الحل هو عرض Superfusion في نهاية الداني من خلال المنقط البلاستيك (السهم الأبيض). خط فراغ (أبيض رأس السهم) يزيل الحل عبر Kimwipe الفتيل. وترد اثنين micropipettes المتمركزة مع نصائح في الأنسجة. هو المضمون والإلكترود المرجعي (سلك الفضة) في الحافة السفلية للعضلة المشمرة.
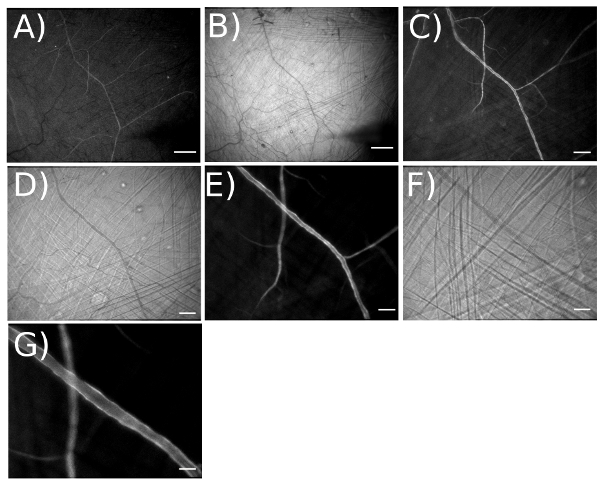
الشكل 4. يوضح مدى التكبير للتعبير عن تصور شبكات شريني GCaMP2 في البطانة. أ) نيون وباء) brightfield صورة اتخذت في التكبير البصري 3.2X التكبير لمجموع = 42X على شاشة فيديو. [مجال الرؤية (FOV) = 4375 X 3470 ميكرومتر]. مقياس بار = 500 ميكرومتر. يعمل في هذا التكبير يسهل وضع micropipettes في الأماكن المطلوبة. C) ونيون D صورة brightfield) المتخذ في التكبير البصري 6.4X التكبير لمجموع = 83X (FOV = 2200 X 1759 ميكرون). مقياس بار = 200 ميكرومتر. E) ونيون صورة brightfield F) الذي اتخذ في التكبير البصري 12.6X التكبير لمجموع = 165X (FOV = 1100 X 885 ميكرون). مقياس بار = 100 ميكرومتر. G) ومضاعف الصورة ، التكبير البصري = 25.2X. مقياس بار = 50 ميكرومتر.
Discussion
نحن هنا وصف العضلة المشمرة فتح في إعداد الماوس لرصد دوران الأوعية الدقيقة في الجسم الحي. وعلى غرار هذا الإجراء بعد "فتح" إعداد المشمرة وصف لأول مرة في الفئران 4. ويمكن أن يكتمل مع الممارسة العملية الجراحية بالكامل في أقل من 1 ساعة. وبراعة هذا الإعداد يسمح لمجموعة متنوعة من المعالجات التجريبية وتكييفها بسهولة للهامستر وكذلك الفئران ، وتمكين مجموعة متنوعة من نماذج تجريبية لدراستها بطريقة مماثلة. ويقتصر إعداد للحيوانات من الذكور ، وينبغي إجراء قياسات نحو وسط النسيج ، وتجنب المناطق المتضررة بالقرب من حواف العضلات 14. وينبغي أيضا أنه يجب الاعتراف بأنه ، في حين يتم تغيير توزيع الضغط والتدفق عندما يتم قطع الأوعية ربط عضلة المشمرة 16 ، microvessels تظل استجابة ومناسبة لجمع البيانات استنساخه. القيد الرئيسي على الرؤية ودوران الأوعية الدقيقة في العضلات المشمرة هو تراكم النسيج الضام مثل الحيوانات الناضجة وزيادة في الحجم ، ولا سيما في الفئران ولكن أيضا في الهامستر. كذلك ، الحيوانات الحصول على الدهون ، فإنه يصبح من الصعب السيطرة عليها بسبب التخدير بنتوباربيتال محبة للدهون ويمكن استيعابها في الأنسجة الدهنية. أفضل طريقة للمضي قدما هو من خلال التحلي بالصبر مع ضمان الحفاظ على درجة حرارة جسم الحيوان ° ~ في 37 درجة مئوية بينما المروية الأنسجة تتعرض باستمرار مع PSS.
Disclosures
تمت الموافقة على كافة الإجراءات والبروتوكولات التي تنطوي على الحيوانات من قبل لجنة رعاية الحيوان ، واستخدم من جامعة ميسوري والتي أجريت في الاتفاق مع المرشد لمعاهد الصحة الوطنية لرعاية واستخدام الحيوانات المختبرية.
وقد رعت الإنتاج من هذه المادة عن طريق الفيديو بواسطة الضوئيات ستانفورد.
Acknowledgements
ويدعم البحوث في المختبر المؤلفين من المعاهد الوطنية للصحة منح R37 - HL041026 ، R01 - R01 HL086483 وHL056786 - (SSS) وHL097463 - F32 و- T32 AR048523 (PB) من خدمة الولايات المتحدة الصحة العامة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم أو جهاز كاشف | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| كلوريد الصوديوم | الصياد | S642 - 212 | |
| كلوريد البوتاسيوم | سيغما | P9541 | |
| سلفات المغنيزيوم | سيغما | M2643 | |
| كلوريد الكالسيوم | سيغما | C1016 | |
| بيكربونات الصوديوم | الصياد | S233 | |
| Nembutal الصوديوم الحل | Lundbeck | NDC 67386-501-55 | كما يشار إلى الصوديوم بنتوباربيتال |
| درجة الحرارة المراقب المالي | نذير الآلات | TC - 344B | البديل : تعديل التيار المستمر 12V العرض |
| سلسلة سخان منصة 20 طقم RH - 2 | نذير الآلات | 64-0274 | يتطلب مبنية خصيصا لوحة الألمنيوم |
| كاميرا 10 ميجا | ستانفورد الضوئيات | XR/Mega-10 | |
| MVX10 | اوليمبوس | ||
| MV PLAPO 2XC العدسة | اوليمبوس | ||
| MVX10 الوقوف الهجين | ليدز | LBX الهجين | |
| مزمر مراقبة البرامج | ستانفورد الضوئيات | برنامج للكاميرا 10 ميجا | |
| مجهر ستيريو | نيكون | SMZ645 | |
| سيليكون مانع التسرب للماء (واضح) | جنرال الكتريك | 47970-72643 - LW5000 | مانعات التسرب سيليكون أخرى واضحة تعمل أيضا |
| 60 × طبق بيتري 15mm | الصياد | 08-757 - 13A | |
| Sylgard | داو كورننغ | 184 | |
| Microdissection مقص | أدوات العلوم غرامة | 15003-08 | |
| دومون الملقط | أدوات العلوم غرامة | # 5 / 45 | |
| GP ميليبور اكسبريس PLUS الغشائية | ميليبور | SCGPT05RE | |
| دبابيس Minutiens الحشرات | أوسترليتز | M حجم 0،15 ملم | |
| المضغوط الحيوانات الأليفة المتقلب | فاهل شركة كليبر | نموذج 9966 | نظيفة بعد كل استعمال |
References
- Majno, G., Palade, G. E. Studies on inflammation. 1. The effect of histamine and serotonin on vascular permeability: an electron microscopic study. J. Biophys. Biochem. Cytol. 11, 571-605 (1961).
- Majno, G., Palade, G. E., Schoefl, G. I. Studies on inflammation. II. The site of action of histamine and serotonin along the vascular tree: a topographic study. J. Biophys. Biochem. Cytol. 11, 607-626 (1961).
- Grant, R. T. Direct Observation of Skeletal Muscle Blood Vessels (Rat Cremaster). J. Physiol. 172, 123-137 (1964).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc. Res. 5, 384-394 (1973).
- Bohlen, H. G., Gore, R. W., Hutchins, P. M. Comparison of microvascular pressures in normal and spontaneously hypertensive rats. Microvasc. Res. 13, 125-130 (1977).
- Klitzman, B., Duling, B. R. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am. J. Physiol. 237, 481-490 (1979).
- Hungerford, J. E., Sessa, W. C., &, S. e. g. a. l., S, S. Vasomotor control in arterioles of the mouse cremaster muscle. FASEB J. 14, 197-207 (2000).
- Figueroa, X. F., Paul, D. L., Simon, A. M., Goodenough, D. A., Day, K. H., Damon, D. N., Duling, B. R. Central role of connexin40 in the propagation of electrically activated vasodilation in mouse cremasteric arterioles in vivo. Circ. Res. 92, 793-800 (2003).
- Wolfle, S. E., Schmidt, V. J., Hoepfl, B., Gebert, A., Alcolea, S., Gros, D., de Wit, C. Connexin45 cannot replace the function of connexin40 in conducting endothelium-dependent dilations along arterioles. Circ. Res. 101, 292-1299 (2007).
- Milkau, M., Kohler, R., de Wit, C. Crucial importance of the endothelial K+ channel SK3 and connexin40 in arteriolar dilations during skeletal muscle contraction. FASEB J. 24, 3572-3579 (2010).
- Bagher, P., Duan, D., Segal, S. S. Evidence for impaired neurovascular transmission in a murine model of Duchenne Muscular Dystrophy. J. Appl. Physiol. 110, 601-610 (2011).
- Tallini, Y. N., Brekke, J. F., Shui, B., Doran, R., Hwang, S. M., Nakai, J., Salama, G., Segal, S. S., Kotlikoff, M. I. Propagated endothelial Ca2+ waves and arteriolar dilation in vivo: measurements in Cx40BAC-GCaMP2 transgenic mice. Circ. Res. 101, 1300-1309 (2007).
- Grant, R. T. The effects of denervation on skeletal muscle blood vessels (rat cremaster). J. Anat. 100, 305-316 (1966).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, H34-H41 (1985).
- Bagher, P., Segal, S. S. Regulation of blood flow in the microcirculation: Role of conducted vasodilation. Acta Physiol. , (2011).
- Hill, M. A., Simpson, B. E., Meininger, G. A. Altered cremaster muscle hemodynamics due to disruption of the deferential feed vessels. Microvasc. Res. 39, 349-363 (1990).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved