Method Article
Die Maus Cremaster Muscle Vorbereitung Intravital Imaging der Mikrozirkulation
In diesem Artikel
Zusammenfassung
Ein Gewebe Vorbereitung ist für die Visualisierung und experimentelle Manipulation des Lebendigen Mikrozirkulation beschrieben. In narkotisierten männlichen Mäusen ist die dünne, stark vaskularisierten M. cremaster für Intravitalmikroskopie zu mikrovaskulären Netzwerken, einschließlich Arteriolen, Kapillaren und Venolen Studie vorbereitet. Die Zubereitung ist leicht für Ratten und Hamstern angepasst.
Zusammenfassung
Während des gesamten Körpers erfordert die Aufrechterhaltung der Homöostase der konstante Versorgung mit Sauerstoff und Nährstoffen gleichzeitig mit der Entfernung der metabolischen Nebenprodukte. Dieses Gleichgewicht wird durch die Bewegung des Blutes durch die Mikrozirkulation, die die kleinsten Verzweigungen der Gefäßversorgung in allen Geweben und Organen umfasst erreicht. Arteriolen Zweig von Arterien Netzwerke zu bilden, dass die Verteilung und Größe der sauerstoffreiches Blut fließt in die Vielzahl von Kapillaren eng mit Parenchymzellen zugeordnete Steuerelement. Kapillaren bieten eine große Oberfläche für die diffusiven Austausch zwischen Gewebezellen und die Blutversorgung. Venolen sammeln Kapillare Abwasser und konvergieren, da sie sauerstoffarmes Blut zum Herzen zurück. Zur Beobachtung dieser Prozesse in Echtzeit erfordert einen experimentellen Ansatz zur Visualisierung und Manipulation der lebenden Mikrozirkulation.
Der M. cremaster von Ratten wurde zunächst als Modell für die Untersuchung Entzündung mit Histologie und Elektronenmikroskopie post mortem 1,2 verwendet. Die erste in vivo Bericht der exponierten intakten Ratte M. cremaster untersuchten mikrovaskulären Reaktionen auf vasoaktive Medikamente mit reflektierte Licht 3. Allerdings Krümmung des Muskels und der Mangel an konzentrierte Ausleuchtung begrenzt die Nützlichkeit dieser Vorbereitung. Der große Durchbruch brachte Eröffnung des Muskels, der Trennung vom Hoden und verbreiten es radial als eine flache Platte für Durchlicht unter einem zusammengesetzten Mikroskop 4. Während gezeigt, dass eine wertvolle Vorbereitung auf die Physiologie der Mikrozirkulation bei Ratten 5 und Hamstern 6 Studie, hat der M. cremaster in Mäusen 7 Bewährte besonders nützlich in Sezieren zelluläre Signalwege bei der Regulierung der mikrovaskulären Funktion 8-11 und Echtzeit-Bildgebung der interzellulären beteiligt Signalisierung 12.
Der M. cremaster ist von der internen schräg und quer abdominis Muskeln abgeleitet, wie die Hoden durch den Leistenkanal Canal 13 steigen. Es dient der Unterstützung (griechisch: cremaster = Hosenträger) und halten Temperatur der Hoden. Wie hier beschrieben, ist der M. cremaster als dünne flache Platte für herausragende optische Auflösung vorbereitet. Mit der Maus auf eine stabile Körpertemperatur und Ebene der Narkose gehalten, umfasst chirurgische Vorbereitung der Befreiung der Muskel umgebende Gewebe und die Hoden, verbreiten sie auf transparenten Sockel Silastic Gummi und die Sicherung der Ränder mit Insektennadeln während Bewässerung es kontinuierlich mit physiologischer Kochsalzlösung . Das vorliegende Protokoll nutzt transgenen Mäusen, die GCaMP2 in Arteriolen Endothelzellen. GCaMP2 ist eine genetisch kodierte fluoreszierende Kalzium-Indikator-Molekül 12. Weitfeld Bildgebung und eine verstärkte charge-coupled device Kamera in-vivo-Studie von Calcium-Signalgebung in den Arteriolen Endothel zu ermöglichen.
Protokoll
1. Maus Bord-, Muskel-Sockel, Körper Keil und Superfusion Lösung
- Maus Bord: Ein transparentes Plexiglas rechteckigen Brett (6 "breit X 8" lang X 3 / 16 "dick) wird auf der Bühne des Mikroskops fit Das." Maus board "ist, wo die narkotisierten Maus während der chirurgischen Vorbereitung gesichert ist M. cremaster.
- Muscle Podest: Eine transparente Silastic Gummi Sockel ist aus Sylgard 184, die nach Angaben des Herstellers ° s Anweisungen vermischt wird vorbereitet. Eine bequeme Form ist ein 15-mm dick x 50-mm Durchmesser Durchmesser Einweg Petrischale. Die Sylgard Block in die gewünschte Form mit einer Rasierklinge (siehe Abbildung 1C.) Geschnitten. Eine dünne Schicht von klaren wasserdichten Silikon-Kleber wird verwendet, um die Sylgard Block mit der Maus Bord zu sichern. Hilfreiche Tipps: Nach dem Gießen des Sylgard in die Petrischale, Entgasung in einer Vakuumkammer für eine Stunde entfernt Luftblasen und verbessert die Übersichtlichkeit. Nach Entgasung, Aushärtezeit für Sylgard, indem das Gericht in einem Labor Ofen bei 50 ° C für mehrere Stunden verkürzt.
- Körper Keil und Heizung-Plattform: Ein Keil (2 "x 4" x 15 °) unterhalb der Maus und gegen den Sockel positioniert kippt den Körper nach vorn, die Verlängerung des M. cremaster über den Sockel von seinem Ursprung erleichtert. Die Einbeziehung einer Aluminium-Plattform auf der Oberfläche bietet Wärmeleitung. Die Plattform wird von Widerständen verbunden mit einem DC-Netzteil (Abbildung 1A) erwärmt. Kalibrieren der Plattform Temperatur auf ~ 40 ° C hält Speiseröhrenkrebs Temperatur bei ~ 37 ° C. Ansonsten ist Strahlungswärme von einer Lampe verwendet.
- Pins. Zur Sicherung des M. cremaster auf dem Sockel sind die Pins von 0,15 mm Insektennadeln, die in ein "L"-Form gebogen wurden vorbereitet.
- Physiologische Kochsalzlösung (PSS). Die Vorbereitungen sind superfundiert (bewässert) kontinuierlich mit Bicarbonat-gepufferte PSS in Reinstwasser (18,2 MOhm) H 2 O. vorbereitet Stammlösungen sind bei 20X Endbearbeitung Konzentration hergestellt und sterilisiert durch einen 0,2 um-Filter. Stammlösungen gut bleiben für mehrere Wochen bei 4 ° C gelagert Herstellung von Salzen getrennt vom Bicarbonat und Vermischung mit Verdünnung am Tag des Experiments verhindert die Ausscheidung von Kalzium-Bicarbonat. Der Bestand Salzlösung setzt sich zusammen aus (in mmol / L): 2638 NaCl, 94 KCl, 40 MgS0 4, 23,4 CaCl 2. Der Bestand Bicarbonat ist 360 NaHCO 3. Am Tag des Experiments werden die jeweiligen Lösungen auf ein Endvolumen (typischerweise 2 L für einen bestimmten Versuch) in einem Meßkolben gebracht und in einem Wasserbad bei ~ 37 ° C. Äquilibrierende die PSS mit 5% CO 2 / 95% N 2 für ~ 15 Minuten mit einem Gas-Dispergierer stellt den pH auf ~ 7,4 und verhindert, dass Niederschlag. Die PSS wird kontinuierlich mit 5% CO 2 / 95% N 2 in Experimenten geleitet. Die letzte funktionierende Lösung Zusammensetzung (in mmol / L) ist: 132 NaCl, 4,7 KCl, 1,2 MgS0 4, 2 CaCl 2, 18 NaHCO 3.
2. Anästhesie und Vorbereitung für die Chirurgie
- Nach der Zustimmung der Institutional Animal Care und Verwenden Committee, sind männliche Mäuse mindestens 12 Wochen alt werden. Die Maus ist mit Pentobarbital-Natrium (60 mg / kg) durch intraperitoneale (ip) Injektion. Ein Verbot Rohr als nützlich erweist für die Sicherung der Maus während der ersten Injektion. Während chirurgischer Eingriffe und experimentelle Protokolle, wird die Narkose durch Nachträge (10-20% der ersten Injektion, ip) bei Bedarf (; gekennzeichnet durch Rückzug als Reaktion auf Zehe oder Schwanz kneifen alle 30-60 Minuten) gehalten. Tipp: Verdünnen der Pentobarbital 10 mg / ml in steriler Kochsalzlösung vor der Injektion reduziert die Möglichkeit einer Überdosierung.
- Anästhesie Kompromisse Temperaturregelung, so dass die Maus müssen warm gehalten werden sofort nach der ersten Injektion. Wenn Sie den Mauszeiger in eine Metall-Träger (belüfteten Aluminium-Korb) auf einer Heizplatte (kalibriert auf ~ 37 ° C) gut funktioniert. Alternativ kann auch eine Wärmelampe eingesetzt darauf achten, dass sie in einem angemessenen Abstand von der Maus zu positionieren. Die Maus sollte alle 5-10 Minuten überwacht werden, bis das richtige Maß an Betäubung erreicht wird (Mangel an Rücktritt bis zu den Zehen oder Schwanz kneifen). Eine ergänzende Dosis kann nach 15-20 Minuten erforderlich sein. Am besten ist es, geduldig zu sein und gehen Sie mit Vorsicht zu Überdosierung zu vermeiden, insbesondere bei übergewichtigen oder älteren Tieren.
- Das Haar ist aus dem Unterbauch, unteren Rücken, Hodensack und Beine durch vorsichtiges Rasieren jeweiligen Regionen entfernt. Besonderes Augenmerk ist darauf zu Verletzungen der Hodensack und Hoden, die sonst verletzen wird der M. cremaster zu vermeiden. Entfernen Sie lose Haare mit einem frischen Alkoholtupfer.
- Wenn die Blase voll ist wird es wie eine kleine Traube durch die Bauchdecke fühlen. Leeren Sie die Blase mit sanftem Druck auf die Maus vom Urinieren auf der cremaster Vorbereitung während der Experimente zu verhindern. Ein Kimwipe ist ein Effekt, Schwamm, um kollektivet des Urins.
- Bewegen Sie die Maus auf dem Rücken liegend auf den Keil mit seinen Beinen rittlings dem Podest. Ein Seidenfaden (4-0 oder 5-0) gebunden an jedem Fuß eine Leine für die Sicherung der Maus mit ihrem Schritt gegen den Sockel. Ein Stück Klebeband lose über der Brust gelegt und mit dem Keil unterhält insgesamt Körperhaltung. Chirurgische Eingriffe werden durchgeführt, während Sie durch ein Stereomikroskop mit Mikrodissektion Schere und Pinzette abgewinkelt.
3. Chirurgische Vorbereitung der offenen M. cremaster
- Ein Stift wird durch die Spitze der Hodensack (entweder die linke oder rechte Seite) gelegt und in den Sockel, um Spannungen auf der Haut statt. Superfusion mit PSS (34-35 ° C) wird über das OP-Feld initiiert und gepflegt durch Dissektion zu halten freiliegende Gewebe warm und feucht. Ein Docht (aus Kimwipe) mit einem Ende neben dem Hodensack und der andere neben einem Vakuum positioniert entfernt das Abwasser PSS. Eine Perle der Silikon-Dichtstoff verklebt auf dem Plexiglas Bord und komplett umschließt den Keil und Sockel dient als "Wassergraben", um alle PSS, die nicht abgesaugt wird zu sammeln, die als eine effektive Vorsorge zur PSS Leckage auf das Mikroskop zu verhindern.
- Ein Schnitt entlang der ventralen Oberfläche der Hodensack gemacht. Wenn die Hoden durch den M. cremaster in die Bauchhöhle zurückgezogen worden, leitet sanften Druck auf den Unterleib der Hoden in den Sack. Die Oberfläche des M. cremaster über dem Hoden sollten zu diesem Zeitpunkt erkannt werden. Bindegewebe zwischen den Skrotalhaut und der M. cremaster wird sorgfältig entfernt, um den M. cremaster vom umgebenden Gewebe frei.
- Die scrotal Haut wird sanft hinter dem proximalen Rand des Sockels eingefahren und gesichert auf jeder Seite mit einem Stift. Die Außenfläche des M. cremaster Oberfläche wird dann von Bindegewebe gelöscht. Kontinuierliche Superfusion beim Präparieren Hydrate des Bindegewebes, die Erleichterung Sichtbarkeit und Entfernung.
- Ein Stift durch die Spitze des M. cremaster wird verwendet, um es unter Längsspannung Platz. Ein Längsschnitt durch die ventrale Oberfläche des Muskels mit großer Sorgfalt vorgegangen, um Störungen der Blutversorgung zu minimieren. Der Blutfluss Dynamik in der Nähe der Peripherie der Vorbereitung sind von dieser Gewebeschäden 14 verändert. Deshalb zur Minimierung dieser Auswirkungen auf die Datenerhebung, die Blutgefäße in der Nähe der Mitte der Vorbereitung sind für die Bildgebung und physiologische Studien verwendet.
- Der M. cremaster ist von einer dünnen Bänder auf den Nebenhoden unter dem Hoden verbunden. Entsprechend der Hoden auf der einen Seite macht diese Band, die sorgfältig aus dem Nebenhoden getrennt ist. In der Nähe der Spitze des M. cremaster ist klein Arterie und Vene, die ihn an den Nebenhoden. Okkludierende diese Schiffe zwischen Zange und zieht sie auseinander minimiert Blutungen. Der Hoden, Nebenhoden, Hoden-Arterie und Vene sind proximal (4-0 oder 5-0 Seidenfaden) ligiert, durchtrennt und verworfen (Orchiektomie) zusammen mit den zugehörigen inguinal Fettpolster. Alternativ können die Hoden sanft zurückgeschoben werden in die Bauchhöhle und behielt mit einem Stück Baumwolle oder Kimwipe. Die Orchiektomie dient dazu, mögliche Verletzung des Gewebes zu vermeiden, wenn Drücken der Hoden wieder in die Bauchhöhle. Wir haben keine auffälligen Unterschiede in der Qualität der cremaster Mikrozirkulation Vorbereitung (siehe Abschnitt 3.8) mit Hilfe der beiden Verfahren 7,15 gefunden.
- Die Außenfläche des M. cremaster ist der verbleibende Bindegewebe gelöscht und breitete sich dann radial auf der Oberfläche des Sockels. Die Kanten sind mit Stiften (siehe Abschnitt 1.4) in 5-6 Plätze gesichert, um eine flache Platte der quergestreiften Muskulatur mit intakter Mikrozirkulation zu schaffen.
- Das fertige Präparat wird zur Bühne eines intravitalen Mikroskop übertragen, superfundiert kontinuierlich (3-5 ml / min, 34 ° C) und äquilibriert für 30 Minuten.
- Die Integrität der cremaster Zubereitung ist nach verschiedenen Kriterien ausgewertet. Spontane Vasomotorentonus mit minimalen chirurgischen Traumas ist durch eine rege fließen in Arteriolen und der Mangel an adhärenten Leukozyten in Venolen angegeben. Die empfindlichste Index einer ansprechenden Vorbereitung ist Verengung der Arteriolen zur Steigerung der Superfusion Lösung Sauerstoffgehalt für 5-10 Minuten. Dies ist durch Äquilibrieren mit 21% O 2 durchgeführt (vs. 5% O 2, siehe Abschnitt 1.5, die alle mit 5% CO 2, Rest N 2). Die Anwesenheit von Leukozyten in Arteriolen, das Fehlen von roten Blutkörperchen fließt durch die Kapillaren sind und / oder Leukozyten, der sich in Venolen und des umgebenden Gewebes Anzeichen von Gewebeschäden und Entzündungen.
4. Intravital Bildgebung des M. cremaster Mikrozirkulation
- Intravital Bildgebung ist auf einem benutzerdefinierten Mikroskop auf einer Olympus MVX10 Stereo Zoom-Plattform durchgeführt. Die MVX10 Mikroskopkörperist es, eine MVX10 Hybrid Stand mit Durchleuchtung (Halogenlampe) für Hellfeld (Köhler) Bildgebung und mit epi-Beleuchtung (Quecksilber) für Fluoreszenz-Bildgebung ausgestattet montiert. Mit Epi-Illumination ist GCaMP2 bei 472/30 nm mit Emission bei 520/35 nm gesammelt aufgeregt. Mit einem XR/Mega-10 intensiviert Digitalkamera (Stanford Photonics, Inc.; SPI) über Piper Control Software (SPI) auf einem Personal Computer; Bilder werden durch eine MV PLAPO 2XC Objektiv (Olympus numerische Apertur = 0,50) erworben. Mit diesem System können die beobachteten Field of View (FOV) von 553 um X 442 pm bis 22 mm X 18 mm variiert werden.
- Nach Abschluss der Intravitalmikroskopie Imaging Experimenten wird die narkotisierten Maus mit Überdosis Pentobarbital durch Genickbruch folgte eingeschläfert.
5. Repräsentative Ergebnisse

Abbildung 1. Maus Bord für intravitale Bildgebung der Maus cremaster Vorbereitung. A) Body Keil mit Aluminium-Plattform (isoliert mit gelben Kunststoff) von unten angesehen. Heizwiderstände befestigt, um die Unterseite der Plattform bieten Wärmeleitung. B) Die Heizung-Plattform beruht auf einer Kunststoff-Keil. C) Der Körper Keil befindet sich auf einem Plexiglas Bord für die Chirurgie und die anschließende Übertragung auf der Bühne des intravitalen Mikroskop gelegt. Sylgard Sockel ist mit rotem Pfeil gekennzeichnet. Eine Perle aus wasserdichtem Silikon umschließt die gesamte Vorbereitung auf jede Lösung, die während der Intravitalmikroskopie Verfahren Leck kann verhindern, dass es tropft auf das Mikroskop enthalten.

Abbildung 2. Benutzerdefinierte MakroZoom Mikroskop für Weitfeld Bildgebung. A) MVX10 Mikroskopkörper (Olympus) mit XR/Mega-10 ICCD Kamera (Stanford Photonics) auf trinokularen Anschluss montiert. B) Nahaufnahme des Mikroskops Körper. (A) Zoom-Steuerung (0,63 bis 6.3x), (b) Filterrad; (c) Bild Verdoppler (NA = 0,50 mit optischem 25fach-Vergrößerung). C)-Kondensor für Hellfeld (Köhler) Beleuchtung (Kondensor NA = 0,55, Arbeitsabstand = 27 mm).

Abbildung 3. Completed Maus cremaster Vorbereitung. Narkotisierten Maus in Rückenlage auf warme Kunststoff-Aluminium-Plattform (gelb). Körperlage ist mit Klebeband befestigt. Der M. cremaster ist radial auf dem transparenten Silastic Gummi Podest zu verbreiten und merken sich an den Rändern. Superfusion Lösung ist am proximalen Ende durch eine Kunststoff-Tropfer (weißer Pfeil) eingeführt. Ein Vakuum-Linie (weiße Pfeilspitze) entfernt die Lösung über eine Kimwipe Docht. Zwei Mikropipetten gezeigt positioniert mit ihren Spitzen in das Gewebe. Eine Referenzelektrode (Silberdraht) ist am unteren Rand des M. cremaster gesichert.
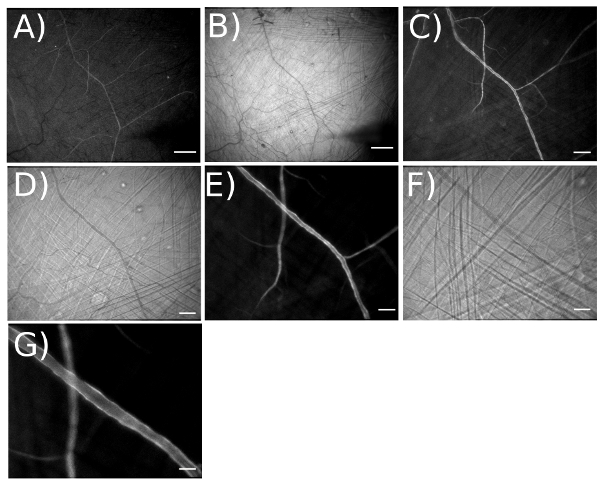
Abbildung 4. Veranschaulichung der Vergrößerungsbereich für die Visualisierung von Netzwerken arteriolären Ausdruck GCaMP2 in Endothel. A) Leuchtstoff-und B) Hellfeld Bild bei einer optischen Vergrößerung von 3,2 x für eine totale Vergrößerung = 42X auf dem Videomonitor genommen. [Field of View (FOV) = 4.375 x 3.470 pm]. Maßstab = 500 um. Arbeiten bei dieser Vergrößerung erleichtert die Platzierung von Mikropipetten an gewünschten Stellen. C) Leuchtstoff-und D) Hellfeld Bild mit optischen Vergrößerung 6.4X für insgesamt Vergrößerung aufgenommen = 83X (FOV = 2.200 x 1.759 um). Maßstab = 200 um. E) Leuchtstoff-und F) Hellfeld Bild mit optischen Vergrößerung 12.6X für insgesamt Vergrößerung aufgenommen = 165X (FOV = 1.100 x 885 um). Maßstab = 100 um. G) Mit Bild Verdoppler, optische Vergrößerung = 25.2X. Balken = 50 um.
Diskussion
Hier beschreiben wir die offene cremaster Muskel-Präparat in der Maus für die Beobachtung der Mikrozirkulation in vivo. Dieses Verfahren ist nach dem "offenen" Cremaster Zubereitung erstmals in der Ratte 4 beschrieben modelliert. Mit etwas Übung das gesamte OP-Verfahren kann in weniger als 1 Stunde abgeschlossen sein. Die Vielseitigkeit dieser Vorbereitung kann für eine Vielzahl von experimentellen Manipulationen und ist leicht zu Hamstern sowie Ratten angepasst, so dass eine Vielzahl von experimentellen Modellen in ähnlicher Weise untersucht werden. Die Zubereitung ist für männliche Tiere beschränkt und Messungen sollten zur Mitte des Gewebes vorgenommen werden, zu vermeiden geschädigten Regionen in der Nähe der Ränder des Muskels 14. Es sollte auch anerkannt, dass, während Druck und Durchfluss-Distributionen verändert werden bei der Verschaltung Gefäße des M. cremaster 16 sind geschnitten, Mikrogefäßen reagieren und eignet sich für reproduzierbare Datenerfassung bleiben. Der primäre Beschränkung auf die Visualisierung der Mikrozirkulation in der M. cremaster ist der Aufbau des Bindegewebes wie Tiere reifen und an Größe zunehmen, besonders bei Ratten, sondern auch bei Hamstern. Ferner ist, wie Tiere Fett zu bekommen, wird es immer schwieriger zu kontrollieren, weil Anästhesie Pentobarbital ist lipophil und kann im Fettgewebe absorbiert werden. Der beste Weg, um fortzufahren ist, indem sie Patienten gleichzeitig sicherzustellen, dass das Tier ° s Körpertemperatur bei ~ 37 ° C gehalten wird, während freiliegende Gewebe kontinuierlich mit PSS bewässert.
Offenlegungen
Alle Verfahren und Protokolle mit Tieren wurden von der Animal Care und Verwenden Ausschuss der University of Missouri genehmigt und durchgeführt in Übereinstimmung mit den National Institutes of Health Guide für die Pflege und Verwendung von Labortieren.
Die Produktion dieses Video-Artikel wurde von Stanford Photonics gefördert.
Danksagungen
Forschung in der Autoren-Labor wird durch die National Institutes of Health gewährt R37-HL041026, R01-HL086483 und R01-HL056786 (SSS) und F32-HL097463 und T32-AR048523 (PB) von der United States Public Health Service unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes oder Gerät | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Kochsalz | Fischer | S642-212 | |
| Kaliumchlorid | Sigma | P9541 | |
| Magnesium-Sulfat | Sigma | M2643 | |
| Kalziumchlorid | Sigma | C1016 | |
| Natriumbikarbonat | Fischer | S233 | |
| Nembutal Natrium-Lösung | Lundbeck | NDC 67386-501-55 | Auch als Natrium-Pentobarbital bezeichnet |
| Temperaturregler | Warner Instruments | TC-344B | Alternate: einstellbar 12V DC Spannungsversorgung |
| Series 20-Plattform Heizung Kit RH-2 | Warner Instruments | 64-0274 | Benötigt custom-built Aluminiumplatte |
| Mega-10 Kamera | Stanford Photonics | XR/Mega-10 | |
| MVX10 | Olymp | ||
| MV PLAPO 2XC Linse | Olymp | ||
| MVX10 Hybrid-Stand | Leeds | LBX-Hybrid | |
| Piper Control Software | Stanford Photonics | Programm für Mega-10-Kamera | |
| Stereo-Mikroskop | Nikon | SMZ645 | |
| Waterproof Silicondichtungsmasse (Clear) | General Electric | 47.970 bis 72.643-LW5000 | Andere klaren Silikon-Dichtstoffe auch Arbeit |
| 60 x 15mm Petrischale | Fischer | 08 bis 757-13A | |
| Sylgard | Dow Corning | 184 | |
| Mikrodissektion Scissors | Feine Science Tools | 15003-08 | |
| Dumont Pinzetten | Feine Science Tools | # 5 / 45 | |
| GP Millipore Express PLUS Membran | Millipore | SCGPT05RE | |
| Minutiens Insect Pins | Austerlitz | Größe M 0,15 mm | |
| Compact Pet Trimmer | Wahl Clipper Corp | Modell 9966 | Reinigen Sie nach jedem Gebrauch |
Referenzen
- Majno, G., Palade, G. E. Studies on inflammation. 1. The effect of histamine and serotonin on vascular permeability: an electron microscopic study. J. Biophys. Biochem. Cytol. 11, 571-605 (1961).
- Majno, G., Palade, G. E., Schoefl, G. I. Studies on inflammation. II. The site of action of histamine and serotonin along the vascular tree: a topographic study. J. Biophys. Biochem. Cytol. 11, 607-626 (1961).
- Grant, R. T. Direct Observation of Skeletal Muscle Blood Vessels (Rat Cremaster). J. Physiol. 172, 123-137 (1964).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc. Res. 5, 384-394 (1973).
- Bohlen, H. G., Gore, R. W., Hutchins, P. M. Comparison of microvascular pressures in normal and spontaneously hypertensive rats. Microvasc. Res. 13, 125-130 (1977).
- Klitzman, B., Duling, B. R. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am. J. Physiol. 237, 481-490 (1979).
- Hungerford, J. E., Sessa, W. C., &, S. e. g. a. l., S, S. Vasomotor control in arterioles of the mouse cremaster muscle. FASEB J. 14, 197-207 (2000).
- Figueroa, X. F., Paul, D. L., Simon, A. M., Goodenough, D. A., Day, K. H., Damon, D. N., Duling, B. R. Central role of connexin40 in the propagation of electrically activated vasodilation in mouse cremasteric arterioles in vivo. Circ. Res. 92, 793-800 (2003).
- Wolfle, S. E., Schmidt, V. J., Hoepfl, B., Gebert, A., Alcolea, S., Gros, D., de Wit, C. Connexin45 cannot replace the function of connexin40 in conducting endothelium-dependent dilations along arterioles. Circ. Res. 101, 292-1299 (2007).
- Milkau, M., Kohler, R., de Wit, C. Crucial importance of the endothelial K+ channel SK3 and connexin40 in arteriolar dilations during skeletal muscle contraction. FASEB J. 24, 3572-3579 (2010).
- Bagher, P., Duan, D., Segal, S. S. Evidence for impaired neurovascular transmission in a murine model of Duchenne Muscular Dystrophy. J. Appl. Physiol. 110, 601-610 (2011).
- Tallini, Y. N., Brekke, J. F., Shui, B., Doran, R., Hwang, S. M., Nakai, J., Salama, G., Segal, S. S., Kotlikoff, M. I. Propagated endothelial Ca2+ waves and arteriolar dilation in vivo: measurements in Cx40BAC-GCaMP2 transgenic mice. Circ. Res. 101, 1300-1309 (2007).
- Grant, R. T. The effects of denervation on skeletal muscle blood vessels (rat cremaster). J. Anat. 100, 305-316 (1966).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, H34-H41 (1985).
- Bagher, P., Segal, S. S. Regulation of blood flow in the microcirculation: Role of conducted vasodilation. Acta Physiol. , (2011).
- Hill, M. A., Simpson, B. E., Meininger, G. A. Altered cremaster muscle hemodynamics due to disruption of the deferential feed vessels. Microvasc. Res. 39, 349-363 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten