Method Article
La preparazione muscolare mouse Cremaster for Imaging intravitale del microcircolo
In questo articolo
Riepilogo
Una preparazione dei tessuti è descritto per la visualizzazione e manipolazione sperimentale del microcircolo viventi. In anestetizzati topi maschi, il sottile, altamente vascolarizzata muscolo cremastere è preparato per la microscopia intravitale per studiare le reti microvascolare tra arteriole, capillari e venule. Questa preparazione è facilmente adattato per ratti e criceti.
Abstract
In tutto il corpo, il mantenimento dell'omeostasi richiede l'apporto costante di ossigeno e sostanze nutritive concomitante con rimozione di sottoprodotti metabolici. Questo equilibrio si ottiene il movimento del sangue attraverso la microcircolazione, che comprende il più piccolo rami della fornitura vascolare in tutti i tessuti e organi. Ramo arteriole dalle arterie a formare reti che controllano la distribuzione e la grandezza di sangue ossigenato scorre nella moltitudine di capillari intimamente associata con le cellule parenchimali. Capillari forniscono un'ampia superficie per lo scambio diffusionale tra le cellule dei tessuti e l'afflusso di sangue. Venule raccogliere effluenti capillare e convergere il loro ritorno deossigenato sangue verso il cuore. Per osservare questi processi in tempo reale richiede un approccio sperimentale per la visualizzazione e la manipolazione del microcircolo vivente.
Il muscolo cremastere di ratti è stato usato come modello per studiare l'infiammazione con istologia e microscopia elettronica a 1,2 post mortem. Il primo in rapporto vivo del muscolo cremastere ratti esposti intatto indagato microvascolari risposte ai farmaci vasoattivi con luce riflessa 3. Tuttavia curvatura del muscolo e la mancanza di illuminazione focalizzata limitato l'utilità di questa preparazione. L'importante passo avanti comportato l'apertura del muscolo, distogliendolo dal testicolo e diffonderla radialmente come una lastra piana per transilluminazione sotto un microscopio composto 4. Mentre dimostrato di essere una preparazione utile per studiare la fisiologia del microcircolo nei ratti criceti 5 e 6, il muscolo cremastere nei topi 7 ha dimostrato particolarmente utile nel sezionare percorsi cellulari coinvolti nella regolazione della funzione microvascolare 8-11 e imaging in tempo reale di intercellulare segnalazione 12.
Il muscolo cremastere è derivata dalla muscoli interni addominale obliquo e trasversale come i testicoli scendono attraverso il canale inguinale 13. Serve a sostenere (in greco: cremastere bretella =) e mantenere la temperatura dei testicoli. Come descritto qui, il muscolo cremastere è preparato come un sottile foglio appartamento in eccellente risoluzione ottica. Con il mouse mantenuti ad una temperatura corporea stabile e piano di anestesia, la preparazione chirurgica comporta liberando il muscolo dal tessuto circostante e testicoli, diffondendolo sul piedistallo trasparente di gomma silastic e garantire i bordi con perni insetti mentre si continua l'irrigazione con soluzione salina fisiologica . Il presente protocollo utilizza topi transgenici che esprimono GCaMP2 arteriolare in cellule endoteliali. GCaMP2 è geneticamente codificato indicatore fluorescente 12 di calcio molecola. Widefield di imaging e di un intensificato ad accoppiamento di carica fotocamera del dispositivo consentono studio in vivo di segnalazione calcio nel endotelio arteriolare.
Protocollo
1. Topo a bordo, piedistallo muscolare, cuneo corpo e soluzione superfusione
- Topo a bordo: una rettangolare in plexiglass trasparente bordo (6 "di larghezza x 8" x lunga 3 / 16 "di spessore) è fatto per stare su palco del microscopio". Bordo mouse "è dove il mouse anestetizzato è assicurata durante la preparazione chirurgica della il muscolo cremastere.
- Piedistallo muscolare: un piedistallo di gomma trasparente silastic è preparato da Sylgard 184, che viene miscelato secondo le istruzioni del · Produttore s. Uno stampo conveniente si trova a 15 mm x 50 mm di diametro diametro monouso piastra di Petri. Il blocco Sylgard viene tagliato nella forma desiderata con una lametta (vedi Figura 1C).. Un sottile strato di silicone trasparente adesivo resistente all'acqua è usato per fissare il blocco Sylgard alla scheda del mouse. Consigli utili: dopo versare il Sylgard nella capsula di Petri, degasaggio in una camera a vuoto per un'ora rimuove le bolle d'aria e migliora la chiarezza. A seguito di degasaggio, curando tempo per Sylgard è ridotto ponendo il piatto in un forno da laboratorio a 50 ° C per diverse ore.
- Cuneo corpo e la piattaforma di riscaldamento: Un cuneo (2 "X 4" X 15 °) posizionata sotto il mouse e contro il piedistallo si inclina il corpo in avanti che facilita l'estensione del muscolo cremastere sopra il piedistallo dalla sua origine. Dotata di un pianale in alluminio sulla superficie fornisce calore conduttivo. La piattaforma è riscaldata da resistenze collegato ad un alimentatore DC (Figura 1A). Calibrazione della temperatura piattaforma a ~ 40 ° C mantiene la temperatura esofagea a ~ 37 ° C. In caso contrario, il calore radiante da una lampada viene utilizzata.
- Pin. Per proteggere il muscolo cremastere sul piedistallo, perni sono preparati da 0,15 millimetri perni insetti che sono state piegate in una forma a "L".
- Sale soluzione fisiologica (PSS). I preparativi sono superfused (irrigati) continuamente con bicarbonato-buffered PSS preparati in ultrapura (18,2 MΩ) H 2 O. Soluzioni madri sono preparate a 20X concentrazione finale di lavoro e sterilizzati attraverso un filtro 0,2 micron. Soluzioni stock rimangono buoni per diverse settimane se conservato a 4 ° C. Preparazione sali separatamente dal bicarbonato e mescolandoli con la diluizione, il giorno dell'esperimento impedisce la precipitazione del bicarbonato di calcio. La soluzione salina magazzino è composta da (in mmol / L): 2638 NaCl, 94 KCl, 40 MgS0 4, 23,4 CaCl 2. Il bicarbonato di magazzino è di 360 NaHCO 3. Il giorno di un esperimento, le soluzioni rispettivi portato ad un volume finale (in genere 2 L per un dato esperimento) in un pallone tarato e collocato in un bagno d'acqua a ~ 37 ° C. Equilibrante il PSS con il 5% di CO 2 / 95% N 2 per ~ 15 minuti utilizzando un dispersore di gas regola il pH a ~ 7,4 e previene precipitazioni. Il PSS è bollito continuamente con il 5% di CO 2 / 95% N 2 in tutta esperimenti. La composizione definitiva soluzione di lavoro (in mmol / L): 132 NaCl, 4.7 KCl, 1.2 MgS0 4, 2 CaCl 2, 18 NaHCO 3.
2. L'anestesia e la preparazione per la chirurgia
- A seguito di approvazione da parte della cura degli animali e del Comitato Istituzionale Usa, topi maschi di almeno 12 settimane di età sono utilizzati. Il mouse è anestetizzato con sodio pentobarbital (60 mg / kg) via intraperitoneale (ip) iniezione. Un tubo di contenimento si rivela utile per il fissaggio del mouse durante l'iniezione iniziale. In tutto gli interventi chirurgici ei protocolli sperimentali, l'anestesia è gestito da supplementi (10-20% di iniezione iniziale, ip), se necessario (ogni 30-60 minuti; indicato dal ritiro di risposta ai piedi, o stringere la coda). Suggerimento: diluendo il pentobarbital 10 mg / ml in soluzione salina sterile prima dell'iniezione riduce la possibilità di sovradosaggio.
- Anestesia compromessi regolazione della temperatura in modo che il mouse deve essere tenuto caldo subito dopo la prima iniezione. Posizionando il mouse in un vettore di metallo (cestello in alluminio ventilato) in cima ad una piastra riscaldante (calibrata a ~ 37 ° C) funziona bene. In alternativa, una lampada di calore può essere utilizzato, avendo cura di posizionarlo a una distanza appropriata dal mouse. Il mouse deve essere controllata ogni 5-10 minuti fino a quando il livello appropriato di anestesia si ottiene (mancanza di recesso ai piedi, o stringere la coda). Una dose supplementare può essere richiesto dopo 15-20 minuti. È meglio avere pazienza e procedere con cautela per evitare overdose, soprattutto con gli animali obesi o anziani.
- Capelli è stato rimosso dal basso addome, parte bassa della schiena, scroto e le gambe con attenzione la rasatura rispettive regioni. Particolare attenzione deve essere adottate per evitare traumi allo scroto e testicoli, che altrimenti danneggiare il muscolo cremastere. Rimuovere i capelli sciolti con un tampone imbevuto di alcool fresca.
- Se la vescica è piena che si sentirà come un chicco d'uva piccolo attraverso la parete addominale. Svuotare la vescica con una leggera pressione per evitare che il mouse di urinare sulla preparazione cremastere durante gli esperimenti. Un Kimwipe è una spugna effetto di raccoltat l'urina.
- Posizionare il mouse sulla sua schiena, sdraiato sul cuneo con le gambe a cavallo tra il piedistallo. Una sutura di seta (4-0 o 5-0) legate ad ogni piede fornisce un cordino per il fissaggio del mouse con il suo inguine contro il piedistallo. Un pezzo di nastro adesivo posizionato liberamente sul petto e fissato per il cuneo mantiene la posizione generale del corpo. Le procedure chirurgiche vengono eseguite durante la visualizzazione attraverso uno stereomicroscopio con le forbici e pinze microdissezione angolato.
3. Preparazione chirurgica del muscolo cremastere aperto
- Un perno viene inserito attraverso l'apice del sacco scrotale (sia il lato destro o sinistro) e fissato nel piedistallo per posizionare la tensione sulla pelle. Superfusione con PSS (34-35 ° C) è iniziata sul campo chirurgico e mantenuto per tutta la dissezione, per mantenere i tessuti esposti caldo e umido. Uno stoppino (a base di Kimwipe) posizionato con una estremità accanto al sacco scrotale e la successiva di altri ad una linea di vuoto rimuove il PSS effluenti. Un cordone di sigillante siliconico aderito alla scheda di plexiglas e completamente circondano il cuneo e piedistallo serve come "fossato" per raccogliere qualsiasi PSS che non è aspirato, che serve come una precauzione efficace per evitare perdite PSS sul microscopio.
- Un'incisione è fatta lungo la superficie ventrale del sacco scrotale. Se il testicolo è stato ritirato dal muscolo cremastere nella cavità addominale, una leggera pressione sul basso addome dirige il testicolo nel sacco. La superficie del muscolo cremastere sovrastante il testicolo devono essere identificati in questo momento. Tessuto connettivo tra la pelle dello scroto e il muscolo cremastere viene accuratamente rimossa per liberare il muscolo cremastere dal tessuto circostante.
- La cute dello scroto è delicatamente retratto dietro il bordo prossimale del piedistallo e fissato su entrambi i lati con uno spillo. La superficie esterna della superficie del muscolo cremastere viene poi eliminato del tessuto connettivo. Superfusione continuo durante la dissezione idrata il tessuto connettivo, favorendo la visibilità e la rimozione.
- Una spilla con l'apice del muscolo cremastere viene usato per metterlo in tensione longitudinale. Una incisione longitudinale viene effettuata attraverso la superficie ventrale del muscolo con grande cura per ridurre al minimo interruzioni nella fornitura vascolare. Dinamica del flusso sanguigno nei pressi della periferia della preparazione sono modificate di questi 14 danni ai tessuti. Pertanto, per minimizzare questi effetti sulla raccolta dei dati, i vasi sanguigni vicino al centro della preparazione sono utilizzati per l'imaging e studi fisiologici.
- Il muscolo cremastere è collegato da un legamento sottile dell'epididimo sotto il testicolo. Riflettendo il testicolo da un lato espone questo legamento, che è accuratamente separati dall'epididimo. Vicino all'apice del muscolo cremastere è piccola arteria e vena che lo collegano alla epididimo. Occlusione questi vasi tra pinza e tirando fuori riduce al minimo il sanguinamento. Il testicolo, epididimo, arteria e vena del testicolo sono legatura prossimale (4-0 o 5-0 sutura seta), tagliato e scartato (orchiectomia) insieme con il cuscinetto di grasso inguinale associati. In alternativa, il testicolo può essere delicatamente spinto indietro nella cavità addominale e conservati con un pezzo di cotone o Kimwipe. L'orchiectomia serve per evitare possibili traumi ai tessuti quando si spinge indietro i testicoli nella cavità addominale. Non abbiamo trovato differenze notevoli nella qualità della preparazione microcircolazione cremastere (vedi Sezione 3.8) utilizzando la procedura di 7,15.
- La superficie esterna del muscolo cremastere viene cancellata del restante tessuto connettivo e poi diffusa radialmente sulla superficie del piedistallo. I bordi sono fissato con perni (vedi Sezione 1.4) a 5-6 posti per creare un foglio piatto di muscoli striati microcircolazione intatto.
- La preparazione è completata trasferiti allo stadio di un microscopio intravitale, superfused continuo (3-5 ml / min, 34 ° C) e equilibrata per 30 minuti.
- L'integrità della preparazione cremastere viene valutata in base a diversi criteri. Spontanea tono vasomotore con il minimo trauma chirurgico è indicato dal flusso vivace nelle arteriole e la mancanza di leucociti aderenti a venule. L'indice più sensibile di un preparato reattivo è costrizione delle arteriole ad innalzare la soluzione superfusione contenuto di ossigeno per 5-10 minuti. Questo è fatto da equilibrare con il 21% O 2 (contro il 5% O 2: si veda Sezione 1.5, tutte con il 5% di CO 2, l'equilibrio N 2). La presenza di leucociti nel arteriole, l'assenza di globuli rossi del sangue che scorre attraverso i capillari, e / o leucociti si accumulano nei tessuti circostanti e venule sono segni di danni ai tessuti e l'infiammazione.
4. L'imaging intravitale della microcircolazione del muscolo cremastere
- Intravitale immagini viene eseguita su un microscopio personalizzato basato su una piattaforma Stereo Zoom Olympus MVX10. Il microscopio MVX10 corpoè montato su un supporto ibrido MVX10 dotato di transilluminazione (lampada alogena) per campo chiaro (Köhler) imaging e con epi-illuminazione (lampada al mercurio) per l'imaging di fluorescenza. Utilizzando epi-illuminazione, GCaMP2 è entusiasta nm 472/30 con emissione raccolti in nm 520/35. Le immagini vengono acquisite attraverso un PLAPO MV 2XC lente (apertura numerica = 0,50; Olympus) utilizzando un XR/Mega-10 intensificato fotocamera digitale (Stanford Photonics, Inc.; SPI) tramite Piper Software di controllo (SPI) su un personal computer. Con questo sistema, il campo osservato di vista (FOV) può essere variata da 553 micron x 442 micron a 22 mm X 18 mm.
- Al termine degli esperimenti di imaging intravitale, il mouse è anestetizzato eutanasia con un'overdose di pentobarbital seguita da dislocazione cervicale.
5. Rappresentante Risultati

Figura 1. Bordo del mouse per l'imaging intravitale della preparazione del mouse cremastere. A) cuneo corpo con piattaforma in alluminio (isolato con materiale plastico giallo) viste dal basso. Resistenze di riscaldamento fissato alla parte inferiore della piattaforma forniscono calore condotto. B) La piattaforma di riscaldamento si basa su un cuneo di plastica. C) Il cuneo del corpo viene posto su una tavola di plexiglas per la chirurgia e il successivo trasferimento alla fase del microscopio intravitale. Piedistallo Sylgard è indicato con la freccia rossa. Una goccia di silicone impermeabile circonda l'intera preparazione per contenere qualsiasi soluzione che potrebbe fuoriuscire durante la procedura intravitale, impedendogli di gocciolamento sul microscopio.

Figura 2. Personalizzati microscopio MacroZoom per widefield imaging. A) MVX10 corpo del microscopio (Olympus) con fotocamera XR/Mega-10 ICCD (Stanford Photonics) montato sulla porta trinoculare. B) Primo piano del corpo microscopio. (A) il controllo dello zoom (da 0,63 a 6.3x), (b) ruota portafiltri, (c) immagine duplicatore (NA = 0,50 con ingrandimento ottico 25X). C) condensatore sotto per campo chiaro (Köhler) illuminazione (Condensatore NA = 0.55, Distanza di lavoro = 27 mm).

Figura 3. Completato la preparazione del mouse cremastere. Topo anestetizzati in posizione supina sul caldo plastificata piattaforma in alluminio (giallo). Posizione del corpo è fissato con del nastro adesivo. Il muscolo cremastere si sviluppa radialmente sul piedistallo di gomma trasparente silastic e appuntato sui bordi. Soluzione superfusione viene introdotto alla fine prossimale attraverso un gocciolatore plastica (freccia bianca). Una linea di vuoto (bianco punta di freccia) rimuove la soluzione attraverso uno stoppino Kimwipe. Due micropipette sono mostrati posizionati con le punte nel tessuto. Un elettrodo di riferimento (filo d'argento) è fissata al bordo inferiore del muscolo cremastere.
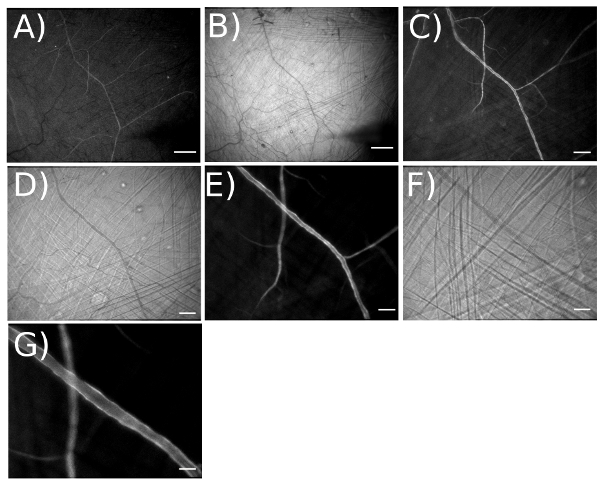
Figura 4. Illustrando la gamma di ingrandimento per la visualizzazione di reti arteriolare esprimere GCaMP2 in endotelio. A) fluorescente e B) immagine brightfield prese a un ingrandimento ottico di 3,2 x per un ingrandimento totale = 42X sul monitor video. [Campo visivo (FOV) = 4.375 x 3.470 mm]. Barra di scala = 500 micron. Lavorare in questo ingrandimento facilita il posizionamento di micropipette nelle posizioni desiderate. C) fluorescente e D) brightfield immagine presa con ingrandimento ottico 6.4X per ingrandimento totale 83x = (FOV = 2.200 x 1.759 micron). Barra di scala = 200 micron. E) fluorescente ed F) l'immagine brightfield presi con ingrandimento ottico di 12.6X per ingrandimento totale = 165x (FOV = 1.100 x 885 micron). Barra di scala = 100 micron. G) Con duplicatore di immagine, ingrandimento ottico = 25.2X. Barra di scala = 50 micron.
Discussione
Qui si descrive la preparazione del muscolo cremastere aperto nel topo per osservare il microcircolo in vivo. Questa procedura è modellato dopo la preparazione "aperto" Cremaster descritta la prima volta nel ratto 4. Con la pratica l'intera procedura chirurgica può essere completato in meno di 1 ora. La versatilità di questo preparato permette una serie di manipolazioni sperimentali ed è facilmente adattabile per criceti e topi, permettendo una varietà di modelli sperimentali di essere studiato in modo simile. La preparazione è limitata agli animali di sesso maschile e le misure dovrebbero essere verso il centro del tessuto, evitando regioni danneggiate vicino ai bordi del muscolo 14. Si deve anche riconoscere che, mentre le distribuzioni di pressione e portata sono alterati quando i vasi comunicanti del muscolo cremastere vengono tagliati 16, microvasi rimangono reattiva e adatta per riproducibile raccolta dei dati. La limitazione principale per visualizzare la microcircolazione del muscolo cremastere è l'accumulo di tessuto connettivo come animali maturi e aumento delle dimensioni, in particolare nei ratti, ma anche nei criceti. Inoltre, come animali da ingrassare, diventa più difficile da controllare, perché l'anestesia pentobarbital è lipofilo e può essere assorbita nel tessuto adiposo. Il modo migliore per procedere è quello di essere paziente, garantendo nel contempo che la temperatura corporea I ° animale s è mantenuta a ~ 37 ° C mentre il tessuto è esposto continuamente irrigato con PSS.
Divulgazioni
Tutte le procedure ei protocolli che coinvolgono animali sono stati approvati dalla cura degli animali e del Comitato Usa dell'Università del Missouri ed eseguito in accordo con il National Institutes of Health Guida per la cura e l'uso di animali da laboratorio.
La produzione di questo video-articolo è stato sponsorizzato da Stanford Photonics.
Riconoscimenti
La ricerca in laboratorio, gli autori 'è sostenuta dal National Institutes of concede Salute-HL041026 R37, R01-R01-HL086483 e HL056786 (SSS) e da F32-HL097463 e T32-AR048523 (PB) dal Servizio States Public Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente o dispositivo | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Cloruro di sodio | Pescatore | S642-212 | |
| Cloruro di potassio | Sigma | P9541 | |
| Solfato di Magnesio | Sigma | M2643 | |
| Cloruro di calcio | Sigma | C1016 | |
| Sodio Bicarbonato | Pescatore | S233 | |
| Soluzione di sodio Nembutal | Lundbeck | NDC 67386-501-55 | Indicato anche come sodio pentobarbital |
| Controllore di temperatura | Warner Instruments | TC-344B | Si alternano: regolabile 12V DC alimentazione |
| Serie 20 kit riscaldatore piattaforma RH-2 | Warner Instruments | 64-0274 | Richiede custom-built lamiera di alluminio |
| Mega-10 Fotocamera | Stanford Fotonica | XR/Mega-10 | |
| MVX10 | Olimpo | ||
| MV PLAPO 2XC lente | Olimpo | ||
| MVX10 supporto ibrido | Leeds | LBX-Hybrid | |
| Piper Software di controllo | Stanford Fotonica | Programma per Mega-10 fotocamera | |
| Microscopio stereo | Nikon | SMZ645 | |
| Silicone sigillante impermeabile (Cancella) | General Electric | 47970-72643-LW5000 | Altri sigillanti in silicone trasparente anche il lavoro |
| 60 x 15 millimetri Petri Dish | Pescatore | 08-757-13A | |
| Sylgard | Dow Corning | 184 | |
| Microdissezione Forbici | Strumenti Scienza multa | 15003-08 | |
| Dumont Pinza | Strumenti Scienza multa | # 5 / 45 | |
| GP Millipore Express PLUS membrana | Millipore | SCGPT05RE | |
| Minutiens Insect Pins | Austerlitz | Taglia M 0,15 millimetri | |
| Pet Trimmer compatto | Wahl Clipper Corp. | Modello 9966 | Pulire dopo ogni utilizzo |
Riferimenti
- Majno, G., Palade, G. E. Studies on inflammation. 1. The effect of histamine and serotonin on vascular permeability: an electron microscopic study. J. Biophys. Biochem. Cytol. 11, 571-605 (1961).
- Majno, G., Palade, G. E., Schoefl, G. I. Studies on inflammation. II. The site of action of histamine and serotonin along the vascular tree: a topographic study. J. Biophys. Biochem. Cytol. 11, 607-626 (1961).
- Grant, R. T. Direct Observation of Skeletal Muscle Blood Vessels (Rat Cremaster). J. Physiol. 172, 123-137 (1964).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc. Res. 5, 384-394 (1973).
- Bohlen, H. G., Gore, R. W., Hutchins, P. M. Comparison of microvascular pressures in normal and spontaneously hypertensive rats. Microvasc. Res. 13, 125-130 (1977).
- Klitzman, B., Duling, B. R. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am. J. Physiol. 237, 481-490 (1979).
- Hungerford, J. E., Sessa, W. C., &, S. e. g. a. l., S, S. Vasomotor control in arterioles of the mouse cremaster muscle. FASEB J. 14, 197-207 (2000).
- Figueroa, X. F., Paul, D. L., Simon, A. M., Goodenough, D. A., Day, K. H., Damon, D. N., Duling, B. R. Central role of connexin40 in the propagation of electrically activated vasodilation in mouse cremasteric arterioles in vivo. Circ. Res. 92, 793-800 (2003).
- Wolfle, S. E., Schmidt, V. J., Hoepfl, B., Gebert, A., Alcolea, S., Gros, D., de Wit, C. Connexin45 cannot replace the function of connexin40 in conducting endothelium-dependent dilations along arterioles. Circ. Res. 101, 292-1299 (2007).
- Milkau, M., Kohler, R., de Wit, C. Crucial importance of the endothelial K+ channel SK3 and connexin40 in arteriolar dilations during skeletal muscle contraction. FASEB J. 24, 3572-3579 (2010).
- Bagher, P., Duan, D., Segal, S. S. Evidence for impaired neurovascular transmission in a murine model of Duchenne Muscular Dystrophy. J. Appl. Physiol. 110, 601-610 (2011).
- Tallini, Y. N., Brekke, J. F., Shui, B., Doran, R., Hwang, S. M., Nakai, J., Salama, G., Segal, S. S., Kotlikoff, M. I. Propagated endothelial Ca2+ waves and arteriolar dilation in vivo: measurements in Cx40BAC-GCaMP2 transgenic mice. Circ. Res. 101, 1300-1309 (2007).
- Grant, R. T. The effects of denervation on skeletal muscle blood vessels (rat cremaster). J. Anat. 100, 305-316 (1966).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, H34-H41 (1985).
- Bagher, P., Segal, S. S. Regulation of blood flow in the microcirculation: Role of conducted vasodilation. Acta Physiol. , (2011).
- Hill, M. A., Simpson, B. E., Meininger, G. A. Altered cremaster muscle hemodynamics due to disruption of the deferential feed vessels. Microvasc. Res. 39, 349-363 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon