A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فصل واحدة الذين تقطعت بهم السبل الحمض النووي ، والحمض النووي المزدوج تقطعت بهم السبل ، والحمض النووي الريبي من جالية الفيروسية البيئة باستخدام الكروماتوغرافيا هيدروكسيباتيت
In This Article
Summary
نحن تصف وسيلة فعالة لفصل واحد الذين تقطعت بهم السبل الحمض النووي ، والحمض النووي المزدوج تقطعت بهم السبل وجزيئات الحمض النووي الريبي الفيروسي من المجتمعات البيئية. الأحماض النووية هي مجزأة باستخدام اللوني هيدروكسيباتيت مع زيادة تركيزات الفوسفات التي تحتوي على مخازن. هذا الأسلوب يسمح للعزل جميع أنواع الحمض النووي الفيروسي من العينات البيئية.
Abstract
الفيروسات والبكتيريا وخاصة (phages) ، هي الأكثر عددا الكيانات البيولوجية على 1،2 الأرض. فيروسات تعدل الخلية المضيفة وفرة وتنوع ، والمساهمة في تدوير المغذيات ، وتغيير النمط الظاهري الخلية المضيفة ، والتأثير في تطور الخلية المضيفة والمجتمعات على حد سواء عن طريق نقل الفيروس من الجينات الوحشي 3. وقد أبرزت دراسات عديدة للتنوع مذهل الوراثية للفيروسات وإمكاناتها الفنية في مجموعة متنوعة من البيئات الطبيعية.
وقد استخدمت تقنيات Metagenomic لدراسة التنوع التصنيفي والإمكانات الفنية للتجمعات الفيروسية المعقدة التي تحتوي على احد الاعضاء الذين تقطعت بهم السبل الحمض النووي (ssDNA) ، الحمض النووي المزدوج تقطعت بهم السبل (dsDNA) والتراكيب الوراثية RNA 4-9. البروتوكولات الحالية بناء مكتبة تستخدم لدراسة الحمض النووي التي تحتوي على الحمض النووي الريبي البيئية أو التي تحتوي على الفيروسات تتطلب علاجا nuclease الأولية من أجل إزالة القوالب nontargeted 10. ومع ذلك ، فهم شامل لتكملة الجين الجماعية للمجتمع والتنوع الفيروس الفيروس يتطلب معرفة جميع الأعضاء بغض النظر عن تركيبة الجينوم. تجزيء من المنقى فرعية الحمض النووي يوفر آلية فعالة يمكن من خلالها دراسة تجمعات الفيروسية دون التضحية مجموعة فرعية من توقيع المجتمع الجينية.
واستخدمت هيدروكسيباتيت ، شكل بلوري من فوسفات الكالسيوم ، في فصل الأحماض النووية ، فضلا عن البروتينات والميكروبات ، ومنذ 11 من 1960s. من خلال استغلال التفاعل بين المسؤول كا المشحون إيجابيا 2 + الأيونات من هيدروكسيباتيت والعمود الفقري الفوسفات سالبة الشحنة من الأنواع الفرعية الحمض النووي ، فمن المحتمل أن كل سلالة تفضيلي أزل الحمض النووي مستقلة عن الآخرين. نحن العاملين في الآونة الأخيرة لهذه الاستراتيجية في الجينوم يجزئ مستقل عن ssDNA ، dsDNA والفيروسات التي تحتوي على الحمض النووي الريبي في إعداد تسلسل الحمض النووي 12. هنا ، فإننا نقدم وسيلة للتجزيء والتعافي من الأحماض ssDNA ، والحمض النووي الريبي النووي dsDNA الفيروسية من تجمعات مختلطة الفيروسية باستخدام chromotography هيدروكسيباتيت.
Protocol
1. إعداد حلول
قبل تنفيذ هيدروكسيباتيت اللوني ، يجب أن تكون مستعدة مخازن الفوسفات وهيدروكسيباتيت يجب أن يكون رطب بشكل صحيح.
- 1M الحل الفوسفات ، ودرجة الحموضة 6.8 : في قارورة 1L حل 119.98g فوسفات الصوديوم أحادي القاعدة في 1L من العقيمة ، DEPC المعاملة O. 2 H يعد ثنائي القاعدة فوسفات الصوديوم 1M الحل في قارورة 1L بحل 141.96g من الصوديوم فوسفات ثنائي القاعدة في 1L من العقيمة ، DEPC المعاملة O. 2 H الجمع بين والحلول أحادية ثنائي في نسبة 1:1. دورق مكان على طبق من ذهب ويحرك المزيج باستخدام شريط مغناطيسي. ضبط الرقم الهيدروجيني إلى 6.8 بإضافة هيدروكسيد الصوديوم (زيادة الحموضة) أو حامض الفوسفوريك (لخفض درجة الحموضة).
- 0.12M العازلة الفوسفات : في القارورة 500ml ، والجمع بين 30ml من محلول فوسفات 1M ، ودرجة الحموضة 6.8 ، 2.5ml من 10 ٪ كبريتات الصوديوم دوديسيل (SDS) ، و5ml من 0.5M EDTA. إضافة عقيمة ، DEPC المعاملة H2O إلى حجم 225ml. ضبط الرقم الهيدروجيني إلى 6.8. إضافة عقيمة ، DEPC المعاملة إلى H2O 250ml. الأوتوكلاف.
- 0.18M العازلة الفوسفات : في القارورة 500ml ، والجمع بين 45ml من محلول فوسفات 1M ، ودرجة الحموضة 6.8 ، 2.5ml من 10 ٪ كبريتات الصوديوم دوديسيل (SDS) ، و5ml من 0.5M EDTA. إضافة عقيمة ، DEPC المعاملة H 2 O إلى حجم 225ml. ضبط الرقم الهيدروجيني إلى 6.8. إضافة عقيمة ، DEPC المعاملة H 2 O ل250ml. الأوتوكلاف.
- 0.20M العازلة الفوسفات : في القارورة 500ml ، والجمع بين 50ml من محلول فوسفات 1M ، ودرجة الحموضة 6.8 ، 2.5ml من 10 ٪ كبريتات الصوديوم دوديسيل (SDS) ، و5ml من 0.5M EDTA. إضافة عقيمة ، DEPC المعاملة H 2 O إلى حجم 225ml. ضبط الرقم الهيدروجيني إلى 6.8. إضافة عقيمة ، DEPC المعاملة H 2 O ل250ml. الأوتوكلاف.
- 0.40 العازلة الفوسفات M : 500ml في قارورة ، والجمع بين الحل 100ML من الفوسفات 1M ، ودرجة الحموضة 6.8 ، 2.5ml من 10 ٪ كبريتات الصوديوم دوديسيل (SDS) ، و5ml من 0.5M EDTA. إضافة عقيمة ، DEPC المعاملة H 2 O إلى حجم 225ml. ضبط الرقم الهيدروجيني إلى 6.8. إضافة عقيمة ، DEPC المعاملة H 2 O ل250ml. الأوتوكلاف.
- "الفوسفات 1.00M العازلة" (تركيز الفعلي للفوسفات في هذا الحل هو 0.91 م) : في القارورة 500ml ، والجمع بين 30ml من محلول فوسفات 1M ، pH6.8 ، 2.5ml 10 ٪ من الصوديوم دوديسيل كبريتات (SDS) ، و5ml من 0.5M EDTA. إضافة عقيمة ، DEPC المعاملة H2O إلى حجم 225ml. ضبط الرقم الهيدروجيني إلى 6.8. إضافة عقيمة ، DEPC المعاملة H 2 O ل250ml. الأوتوكلاف.
- ترطيب هيدروكسيباتيت : وزن خارج 1g من هيدروكسيباتيت وإضافة إلى أنبوب 50ml. إضافة 6ml العازلة من الفوسفات 0.12M إلى هيدروكسيباتيت وعكس إلى المزيج. قبل استخدام جلب الحرارة إلى 60 درجة مئوية وتخلط جيدا. تخزين لفترات طويلة من الوقت في 4 درجات مئوية.
- قبل الاستخدام ، يوازن جميع مخازن الفوسفات وهيدروكسيباتيت رطب في 60 درجة مئوية.
2. إعداد فندق Econo عمود
- إغلاق محبس. الشطف مرات عدة مع العمود منزوع الأيونات O 2 H بواسطة عمود عكس مرارا وتكرارا والصب.
- إزالة محبس من العمود ، وفندق Econo الأوتوكلاف العمود لتعقيم.
- استبدال وإغلاق محبس. إضافة 1ml من Sigmacote إلى العقيمة فندق Econo عمود ومعطف جميع الواجهات الزجاجية. فتح محبس وصب.
- نعلق عمود إلى حمام الماء المتداولة وضبط درجة الحرارة إلى 60 درجة مئوية. einsure لأقل قدر من فقدان الحرارة عبر التفاف العمود العمود في عامل العزل مثل رقائق الألومنيوم أو رغوة العزل الأنابيب الموصى بها.
- شطف فندق Econo عمود مرتين مع ريبونوكلياز عقيمة خالية من O 2 H ثم مرتين مع ريبونوكلياز عقيمة خالية من الفوسفات 0.12M العازلة.
3. Hydroxypaptite Chromotography
- التأكد من إغلاق محبس ، إضافة ببطء 2ml من هيدروكسيباتيت ، معدة سلفا معلق على الجزء السفلي من العمود فندق Econo باستخدام ماصة معقمة 2ml المصلية.
- السماح للهيدروكسيباتيت الى تسوية في إطار قوة الجاذبية لمدة 30 دقيقة.
- استنزاف العازلة من العمود ومحبس وثيق. الجمع بين الأحماض النووية مع العازلة الفوسفات 0.12M في الحجم النهائي من 500 ميكرولتر واحتضان عند 60 درجة مئوية لمدة 10 دقيقة في كتلة أو حرارة حمام الماء.
- الأحماض النووية بسرعة تطبيق أعد العازلة الفوسفات 0.12M إلى هيدروكسيباتيت باستخدام ماصة 2ml المصلية التأكد من عدم الإخلال العمود.
- السماح الأحماض النووية لربط هيدروكسيباتيت لمدة 30 دقيقة.
- وضع أنبوب تحت العمود 15ml ، فتح محبس وجمع العينات الأولية التي تحتوي على ssDNA. إغلاق محبس.
- إضافة 6ml العازلة من الفوسفات 0.12M هيدروكسيباتيت الى التأكد من عدم الإخلال العمود ، فتح محبس ، وجمع المفرد الذين تقطعت بهم السبل الحمض النووي في أنبوب 15ml من الخطوة السابقة. إغلاق محبس.
- إضافة 1 حجم من الفينول : كلوروفورم : الكحول isoamyl (25:25:1 V / V / V) حل للأنبوب ، ومزيج بقوة الطرد المركزي في 3500 x ج لمدة 15 دقيقة. نقل طاف ssDNA تحتوي على أنبوب 15ml جديدة.
- وكرر 3.76 3.87 باستخدام 6ml العازلة من الفوسفات 0.20M إلى البريدالعود وتنقية RNA من العمود التأكد من استخدام أنبوب جديد لجمع 15ml.
- وكرر 3.76 3.87 باستخدام 6ml العازلة من الفوسفات 0.40M لأزل وتنقية dsDNA من العمود التأكد من استخدام أنبوب جديد لجمع 15ml.
- وكرر 3.76 3.87 باستخدام 6ml العازلة من الفوسفات 1.00M لتجريد أي عمود dsDNA المتبقية مع التأكد من استخدام أنبوب جديد لجمع 15ml.
4. تحلية عينات الحمض النووي
- نقل 4 - 5ml من العينة إلى Amicon الترا - 4 جهاز الطرد المركزي فلتر تجهيزه مع الوزن الجزيئي 30000 قطع غشاء Ultracel.
- التركيز على عينة <500μl من خلال الدوران في XG 6000 ، و 30 درجة مئوية ، و 5 دقائق (أو حتى يتحقق حجم مركزة) في الدوار زاوية ثابتة. تتدفق من خلال تجاهل.
- إضافة ما تبقى من العينة (ق) الى الترا - 4 Amicon جهاز الطرد المركزي تصفية واعادة ما يصل الى حجم 5ml - 4 مع الخطوط العازلة ريبونوكلياز TE 1X.
- التركيز على عينة <500μl من خلال الدوران في XG 6000 ، و 30 درجة مئوية ، و 5 دقائق (أو حتى يتحقق حجم مركزة) في الدوار زاوية ثابتة. تتدفق من خلال تجاهل.
- إضافة 4 - 5ml الحرة ريبونوكلياز الاحتياطي TE 1X إلى الترا - 4 Amicon تصفية جهاز الطرد المركزي. التركيز على عينة <500μl بواسطة الطرد المركزي في 6000 XG و 30 درجة مئوية ، و 5 دقائق (أو حتى يتحقق حجم تتركز) في الدوار زاوية ثابتة. تتدفق من خلال تجاهل.
- كرر الخطوة 4.5 إضافي إلى 5 مرات تماما desalt عينة حمض النووي (ق).
- نقل العينات المتبقية (ق) إلى أنبوب العقيمة إيبندورف 1.7ml. إضافة 1/10th خلات الصوديوم 3M الحجم ، ودرجة الحموضة 7.0 ، مجلدين من الإيثانول بنسبة 100 ٪ ، و1μl من Glycoblue. مزيج جيد من قبل vortexing.
- الطرد المركزي في 28000 XG ، 4 درجات مئوية ، و 60 دقيقة. صب التأكد من عدم تعكير صفو بيليه. إضافة 300μl من الايثانول 70 ٪. تدور في درجة الحرارة XG 28000 غرفة ، لمدة 10 دقيقة. صب جاف وresuspend كل جزء في حجم مناسب لTE ريبونوكلياز عازلة خالية.
5. ممثل النتائج :
الشكل 1 يلخص أساليب تقديمها للاستخدام اللوني هيدروكسيباتيت الى ssDNA يجزئ ، dsDNA والأحماض النووية RNA فيف من فيروسية متفاوتة. هذا الأسلوب يستغل التفاعل بين المسؤول العمود الفقري الفوسفات سالبة الشحنة من الأحماض النووية والكالسيوم الموجبة الشحنة 2 + الأيونات الموجودة في هيدروكسيباتيت ويسمح للتجزيء كفاءة فرعية الحمض النووي (ssDNA ، وdsDNA RNA) مع زيادة تركيزات الفوسفات عازلة 12.
وتجزيء هيدروكسيباتيت لفي "المجتمع" المختبر ssDNA المعروفة (M13mp18) ، dsDNA (لامدا) والحمض النووي الريبي (MS2 وphi6) ويتضح الجينوم الفيروسي في الشكل 2. تم الجمع بين الأحماض النووية في تركيزات متساوية ، تطبق على العمود هيدروكسيباتيت وكانت eluted باستخدام زيادة تركيز الفوسفات عازلة. كل سلالة الحمض النووي elutes مستقلة عن الآخرين مع أقل من 9 ٪ المرحل من جزء لآخر.
ويظهر تطبيق هذه التقنية على الأحماض النووية معزولة عن المجتمع الفيروسية التي تم جمعها من خليج تشيسابيك في الشكل 3. طبق مجموع العائد الحمض النووي الفيروسات المعزولة من المنقى إلى العمود هيدروكسيباتيت. وكان eluted مستقلة تتكون من مواد الجينومية ssDNA ، RNA وdsDNA مع 0.12M ، 0.20M وتركيزات الفوسفات 0.40M/1.00M من العازلة على التوالي. هو eluted الحمض النووي المزدوج تقطعت بهم السبل في تركيزات الفوسفات من 0.40M 1.00M وو في هذه الحالة ، يهيمن على هذا المجتمع الفيروسية مقارنة الحمض النووي الريبي ssDNA والمورثات. هذه الملاحظة بما يتفق مع تركيبة المجتمع الفيروسية المتوقعة من البيئات البحرية ومصبات الأنهار حيث الغالبية من الأحماض النووية القابلة للاسترداد وdsDNA 13.

رسم تخطيطي للتدفق الرقم 1. الأسلوب اللوني هيدروكسيباتيت للتجزئة من الأحماض النووية. يتم تسخين مزيج من ssDNA ، والجيش الملكي النيبالي dsDNA أعد العازلة الفوسفات 0.12M إلى 60 درجة مئوية ، وتطبيقها على عمود هيدروكسيباتيت حافظت على 60 درجة مئوية ثابتة باستخدام حمام ماء المنتشرة. وeluted الأحماض النووية (ssDNA ، RNA وdsDNA) من هيدروكسيباتيت مع زيادة تركيزات الفوسفات عازلة المحتوية. وقد تم استنساخ هذا الرقم بإذن من الجمعية الأميركية لعلم الأحياء المجهرية وكانت واردة أصلا في اندروز ، وآخرون Pfannkoch. 2010 12.

الشكل 2. فصل الأحماض النووية الفيروسية المعروفة باستخدام اللوني هيدروكسيباتيت. تم الجمع بين تركيزات متساوية من ssDNA M13mp18 ، ssRNA MS2 ، والرنا المزدوج الجديلة phi6 امدا dsDNA (الممرات 2-5 ، على التوالي) (حارة 6) وتطبيقها على عمود هيدروكسيباتيت. Singlوeluted مستقل ه الذين تقطعت بهم السبل الحمض النووي (M13mp18) ، رنا (MS2/phi6) وdsDNA (لامدا) من العمود هيدروكسيباتيت باستخدام 0.12M (حارة 8) ، 0.18M (ممر 9) و0.40M/1.00M (ممر 10) . واستخدمت سلم 1KB (حارات 1 ، 7) لتأكيد أحجام الجينوم. وقد تم استنساخ هذا الرقم بإذن من الجمعية الأميركية لعلم الأحياء المجهرية وكانت واردة أصلا في اندروز ، وآخرون Pfannkoch. 2010 12.
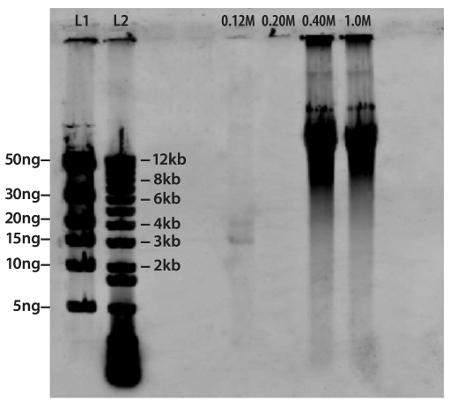
الشكل 3. فصل الأحماض النووية الفيروسية المعزولة من المجتمع داخل خليج تشيسابيك. وقد تم عزل الأحماض النووية وتطبيقه على عمود هيدروكسيباتيت. وeluted مستقل ssDNA (حارة 0.12M) ، رنا (حارة 0.20M) وdsDNA (حارات 0.40M/1.0M) باستخدام تركيزات الفوسفات عازلة لل0.12M ، 0.20M و0.40M/1.00M ، على التوالي. واستخدمت مرحبا سلم DNA قداس (حارة L1) وسلم 1KB (حارة L2) لتأكيد بصريا الوزن الجزيئي التقريبي والشامل من الأحماض النووية. وقد تم استنساخ هذا الرقم بإذن من الجمعية الأميركية لعلم الأحياء المجهرية وكانت واردة أصلا في اندروز ، وآخرون Pfannkoch. 2010 12.
Discussion
منهجية اللوني هيدروكسيباتيت المقدمة هنا هي أداة فعالة للغاية وقوية للتجزئة من الأحماض النووية من تجمعات مختلطة الفيروسية ، عندما يكون الهدف هو دراسة التركيب مجموع الحمض النووي للمجتمع. عموما ، سوف ssDNA ، RNA وdsDNA أزل من العمود تركيزات الفوسفات العازلة بو أكبر من م?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا البحث من قبل مكتب العلوم (ديسمبر) ، وزارة الطاقة الأميركية ، أي الاتفاق التعاوني. دي FC02 - 02ER63453 ، المؤسسة الوطنية للعلوم في تسلسل الجينوم الميكروبي برنامج (أرقام 0626826 و 0731916 الجائزة). نشكر جون زجاج لخبرته الفنية والمشورة وK. Wommack اريك لمساعدته في جمع العينات البيئية.
Materials
| Name | Company | Catalog Number | Comments |
| اسم المادة | شركة | رقم كتالوج | رقم كتالوج |
|---|---|---|---|
| فندق Econo عمود | الحيوي راد | 737-0717 | 0.7cm الحزمة رقم / 2 |
| هيدروكسيباتيت | الحيوي راد | 130-0520 | الحمض النووي الصف بيو جل جل HTP ، 100g/td> |
| فوسفات الصوديوم ، أحادي القاعدة | VWR | VW1497 - 01 | مونوهيدرات ، كريستال 500G |
| فوسفات الصوديوم ، ثنائي القاعدة | VWR | VW1496 - 01 | اللامائية ، مسحوق 500G |
| DEPC المياه المعالجة | Invitrogen | AM9922 | 1L |
| 10 ٪ SDS الحل | Invitrogen | 24730-020 | عالى النقاء ، 1L |
| 0.5M EDTA | Invitrogen | AM9262 | الرقم الهيدروجيني 8.0 ، 1L |
| Sigmacote | سيغما الدريخ | SL2 - 25ML | |
| 2ml المصلية pippette | VWR | 89130-884 | البوليسترين ، العقيمة |
| أنابيب الطرد المركزي فالكون دينار بحريني | VWR | 21008-936 | 15ml ، العقيمة |
| الفينول : الكلوروفورم : كحول أيزو أميلي (25:24:1 V / V / V) | Invitrogen | 15593-031 | عالى النقاء ، 100ML |
| Amicon الترا - 4 جهاز الطرد المركزي | ميليبور | UFC803024 | Ultracel غشاء - 30 |
| 20X TE الاحتياطي ، ريبونوكلياز مجانا | Invitrogen | T11493 | 100ML |
| Glycoblue | Invitrogen | AM9516 | 15mg/ml |
References
- Whitman, W. B., Coleman, D. C., Wiebe, W. J. Prokaryotes: The Unseen Majority. Proceedings of the National Academy of Sciences of the United States of America. 95, 6578-65 (1998).
- Hendrix, R. W. Bacteriophages: evolution of the majority. Theor Popul Biol. 61, 471-471 (2002).
- Weinbauer, M. G. Bacteriophages: Evolution of the Majority. FEMS Microbiol Rev. 28, 127-127 (2004).
- Dinsdale, E. A., Edwards, R. A., Hall, D. Functional Metabolic Profiling of Nine Biomes. Nature. 455, 830-830 (2008).
- McDaniel, L., Breitbart, M., Mobberley, J. Metagenomic Analysis of Lysogeny in Tampa Bay: Implications for Prophage Gene Expression. PLoS ONE. 3, e3263-e3263 (2008).
- Williamson, S. J., Rusch, D. B., Yooseph, S. The Sorcerer II Global Ocean Sampling Expedition: Metagenomic Characterization of Viruses within Aquatic Microbial Samples. PLoS ONE. 3, e1456-e1456 (2008).
- Lang, A. S., Rise, M. L., Culley, A. I. RNA Viruses in the Sea. FEMS Microbiol Rev. 33, 295-295 (2009).
- Ng, T. F., Manire, C., Borrowman, K. Discovery of a Novel Single-Stranded DNA Virus from a Sea Turtle Fibropapilloma by using Viral Metagenomics. J. Virol. 83, 2500-2500 (2009).
- Rosario, K., Duffy, S., Breitbart, M. Diverse Circovirus-like Genome Architectures Revealed by Environmental Metagenomics. J Gen Virol. 90, 2418-2418 (2009).
- Culley, A. I., Lang, A. S., Suttle, C. A. Metagenomic Analysis of Coastal RNA Virus Communities. Science. 312, 1795-1795 (2006).
- Bernardi, G. Chromotography of Nucleic Acids on Hydroxyapatite. Nature. 209, 779-779 (1965).
- Andrews-Pfannkoch, C., Fadrosh, D. W., Thorpe, J. Hydroxyapatite-Mediated Separation of Double-Stranded DNA, Single-Stranded DNA and RNA Genomes from Natural Viral Assemblages. Applied and environmental microbiology. 76, 5039-5039 (2010).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in Aquatic Ecosystems. Microbiol Mol Biol Rev. 64, 69-69 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved