このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ハイドロキシアパタイトクロマトグラフィーを用いた環境ウイルスのコミュニティから一本鎖DNA、二本鎖DNAとRNAの分離
要約
私たちは、環境ウイルスのコミュニティから一本鎖DNA、二本鎖DNAとRNAの分子を分離する効率的な方法を説明します。核酸はリン酸含有緩衝液の濃度の増加とともにヒドロキシアパタイトクロマトグラフィーを用いて分画する。このメソッドは、環境サンプルからすべてのウイルス核酸の種類の分離を可能にします。
要約
ウイルス、特にバクテリオファージは(ファージ)、地球1,2上で最も多くの生物学的実体である。ウイルスは宿主細胞の表現型を変更する、栄養素の循環に寄与する、宿主細胞の豊富さと多様性を調節し、そして遺伝子の3の水平伝達を介して宿主細胞とウイルスの両方のコミュニティの進化に影響を与える。多くの研究は、自然環境の様々なウイルスやその機能性の驚異的な遺伝的多様性を強調している。
メタゲノムの手法は、分類学的多様性とメンバー一本鎖DNA(ssDNA)、二本鎖DNA(dsDNA)とRNAの遺伝子型4-9含む複雑なウイルス群集の機能的な可能性を研究するために使用されている。環境DNAを含む研究に使用される現在のライブラリー構築のプロトコルまたはRNAを含むウイルスは、10非標的化テンプレートを除去するために、初期ヌクレアーゼ処理を必要とする。しかし、ウイルスのコミュニティとウイルスの多様性の集団遺伝子の補数の包括的な理解には関係なく、ゲノム構成のすべてのメンバの知識が必要です。核酸のサブタイプの精製分画は、コミュニティの遺伝の署名の一部を犠牲にすることなくウイルスの集合体を研究することによって効果的なメカニズムを提供します。
ハイドロキシアパタイト、リン酸カルシウムの結晶形は、1960年代11日以来、核酸、ならびにタンパク質や微生物の分離に用いられている。ハイドロキシアパタイトと核酸のサブタイプの負に帯電したリン酸骨格の陽性荷電のCa 2 +イオン間の電荷の相互作用を利用することにより、それは優先的に互いに独立してそれぞれの核酸のサブタイプを溶出することが可能です。我々は最近、DNAシークエンシング12の準備にssDNAのは、dsDNAやRNAを含むウイルスの独立画するゲノムにこの戦略を採用。ここで、我々は、ハイドロキシアパタイトクロマトグラフィを用いて混合したウイルスの集合体からのssDNA、dsDNAをし、RNAウイルス核酸の分画と回復のための手法を提案する。
プロトコル
1。溶液の調製
ハイドロキシアパタイトクロマトグラフィーを行う前に、リン酸緩衝液を準備する必要がありますし、ハイドロキシアパタイトは、適切に水和でなければなりません。
- 1Mリン酸溶液、pHを6.8:1Lフラスコ中の滅菌、DEPC処理H 2 O 1Lのナトリウムリン酸一塩基の119.98グラムを溶解滅菌、DEPC処理H 2 O 1Lのナトリウムリン酸二塩基の141.96グラムを溶解することによって1Lフラスコに1Mリン酸ナトリウム、二塩基溶液を調製1:1の割合でモノ - 及びジ - ソリューションを組み合わせる。マグネチックスターラーバーを用いて撹拌プレートとのミックスでフラスコを置きます。水酸化ナトリウム(pHを増加させる)またはリン酸(pHを下げるために)追加することで6.8にpHを調整する。
- 0.12Mリン酸緩衝液:500ミリリットルのフラスコで、1Mリン酸溶液、10%ドデシル硫酸ナトリウム(SDS)のpHを6.8、2.5ミリリットル、および0.5M EDTA 5mlのの30ミリリットル組み合わせる。 225ミリリットルの容積に無菌、DEPC処理水を追加。 6.8にpHを調整する。 250ミリリットルに滅菌、DEPC処理水を追加。オートクレーブ。
- 0.18Mリン酸緩衝液:500ミリリットルのフラスコで、1Mリン酸溶液、10%ドデシル硫酸ナトリウム(SDS)のpHを6.8、2.5ミリリットル、および0.5M EDTA 5mlのの45ミリリットル組み合わせる。 225ミリリットルの容積に無菌、DEPC処理H 2 Oを追加。 6.8にpHを調整する。 250ミリリットルに滅菌、DEPC処理H 2 Oを追加。オートクレーブ。
- 0.20Mリン酸緩衝液:500ミリリットルのフラスコで、1Mリン酸溶液、10%ドデシル硫酸ナトリウム(SDS)のpHを6.8、2.5ミリリットル、および0.5M EDTA 5mlの50mlのを組み合わせる。 225ミリリットルの容積に無菌、DEPC処理H 2 Oを追加。 6.8にpHを調整する。 250ミリリットルに滅菌、DEPC処理H 2 Oを追加。オートクレーブ。
- 0.40 Mリン酸緩衝液:500ミリリットルフラスコに、1Mリン酸溶液、10%ドデシル硫酸ナトリウム(SDS)のpHを6.8、2.5ミリリットル、および0.5M EDTA 5mlの100mlの組み合わせ。 225ミリリットルの容積に無菌、DEPC処理H 2 Oを追加。 6.8にpHを調整する。 250ミリリットルに滅菌、DEPC処理H 2 Oを追加。オートクレーブ。
- "1.00Mリン酸緩衝液は、"(このソリューションではリン酸塩の実際の濃度は0.91 Mです):500ミリリットルのフラスコで、10%ドデシル硫酸ナトリウム(SDS)の1Mリン酸溶液、pH6.8、2.5ミリリットルの30ミリリットル組み合わせ、および5ミリリットルの0.5M EDTA。 225ミリリットルの容積に無菌、DEPC処理水を追加。 6.8にpHを調整する。 250ミリリットルに滅菌、DEPC処理H 2 Oを追加。オートクレーブ。
- ハイドロキシアパタイト水和:水酸アパタイトの1グラムから重量と50mlのチューブに加える。ハイドロキシアパタイトに0.12Mリン酸緩衝液の6ミリリットルを追加し、混在させる反転。前の60℃に温度を持って使用して、よく混ぜます。 4で長時間℃で保存
- 使用前に、60℃ですべてのリン酸緩衝液および水和ハイドロキシアパタイトを平衡化
2。エコノ-カラムの準備
- コックを閉じます。繰り返し列を反転し、デカンテーションによって脱イオンH 2 Oでカラムを数回すすいでください。
- エコノ-カラムから活栓を取り外し、滅菌するためにカラムをオートクレーブ。
- 交換して、コックを閉じてください。エコノ-カラム滅菌とコート、すべてのガラスの表面にSigmacoteの1mlを追加します。コックとデカントを開きます。
- 循環水浴にカラムを取り付け、60に温度を℃に設定このようなアルミ箔または発泡パイプの断熱材などの絶縁剤でカラムをラップ列全体に熱損失の最小量をeinsureすることをお勧めします。
- 滅菌、RNaseフリーの0.12Mリン酸緩衝液で2回その後滅菌、RNaseフリーのH 2 Oで二回エコノ-カラムを洗浄します。
3。 Hydroxypaptiteクロマトグラフィ
- コックが閉じていることを確認し、徐々に滅菌2ミリリットル血清ピペットを使用してエコノ-カラムの底部に事前に準備、再懸濁したアパタイトの2ミリリットルを追加します。
- ハイドロキシアパタイトは、30分間重力の力で解決することができます。
- 列と密接なコックからバッファをドレイン。 60℃ヒートブロックまたは水浴で10分間。における500μlのインキュベートの最終容量に0.12Mリン酸緩衝液と核酸を結合する
- すぐに列を乱さないように確実に2ミリリットル血清ピペットを用いてハイドロキシアパタイトに0.12Mリン酸緩衝液で調製された核酸を適用します。
- 核酸は30分間ハイドロキシアパタイトに結合することができます。
- 列の下に15ミリリットルチューブを置き、栓を開き、ssDNAを含む最初のサンプルを収集する。コックを閉じます。
- 、列を乱すストップコックを開き、前のステップから15ミリリットルチューブで一本鎖DNAを収集することではないことを確認してハイドロキシアパタイトに0.12Mリン酸緩衝液の6ミリリットルを追加。コックを閉じます。
- フェノール:クロロホルム:1容量の追加チューブにイソアミルアルコール(25:25:1、V / v / v)溶液を、精力的にミックスし、15分間3500 × gで遠心。新しい15ミリリットルチューブに上清を含むssDNAを転送する。
- eに0.20Mリン酸緩衝液の6ミリリットルを用いて3.76と3.87を繰り返します。リュートとコレクションのために新たな15ミリリットルチューブを使用することを確認して列からRNAを精製する。
- コレクションのために新しい15ミリリットルチューブを使用することを確認して列から二本鎖DNAを溶出し、精製する0.40Mリン酸緩衝液の6ミリリットルを用いて3.76と3.87を繰り返します。
- コレクションのために新しい15ミリリットルチューブを使用して確実に残存するdsDNAの列を除去する1.00Mリン酸緩衝液の6ミリリットルを用いて3.76と3.87を繰り返します。
4。核酸サンプルを脱塩
- 3万分子量を装備したアミコンウルトラ-4遠心フィルターデバイスへのサンプルの4〜5ミリリットルの転送はUltracel膜を切断。
- 6000 × gで、30 °アングルローターでC、5分(または濃縮されたボリュームが達成されるまで)で回転させて<500μLにサンプルを集中する。フロースルーを捨てます。
- アミコンウルトラ-4遠心フィルターデバイスにサンプルの残りの部分(s)を追加し、RNaseフリー1 × TEバッファーで4〜5ミリリットルにボリュームを起動します。
- 6000 × gで、30 °アングルローターでC、5分(または濃縮されたボリュームが達成されるまで)で回転させて<500μLにサンプルを集中する。フロースルーを捨てます。
- アミコンウルトラ-4遠心フィルターデバイスにRNaseフリー1 × TEバッファーの4〜5ミリリットルを追加。 6000 × gで、30 °アングルローターでC、5分(または濃縮されたボリュームが達成されるまで)で遠心分離することによって<500μLにサンプルを集中する。フロースルーを捨てます。
- 完全に核酸サンプル(s)を脱塩するために、ステップ4.5の追加の5回を繰り返します。
- 滅菌1.7ミリリットルエッペンドルフチューブに、残りのサンプル(s)を転送する。 10分の1の体積の3M酢酸ナトリウム、pH 7.0の、100%の2倍量のエタノール、及びGlycoblueの1μlを追加します。ボルテックスでよく混ぜる。
- 28000 × gで、4℃、60分間遠心する。デカントは、ペレットを妨害しないことを確認して。 70%エタノール300μlを追加。 28000 × gで、10分間室温でスピン。 、デカント乾燥およびRNaseフリーのTEバッファーの適切な量で各画分を懸濁します。
5。代表的な結果:
図1は、混合ウイルスの集合体から分画するのssDNA、dsDNAをし、RNA核酸にハイドロキシアパタイトクロマトグラフィーを使用するための提示方法をまとめたものです。このメソッドは、核酸の負に荷電したリン酸骨格と正に荷電したのCa 2の間の電荷の相互作用を活用して+イオンがハイドロキシアパタイトに存在すると増加するリン酸緩衝液の濃度で核酸のサブタイプの効率的な分画(ssDNAのは、dsDNAやRNA)を可能に12。
既知のssDNA(M13mp18)は、dsDNA(ラムダ)とRNA(MS2とphi6)ウイルスゲノムの in vitroでの"コミュニティ" でのハイドロキシアパタイト分別を図2に示されています。核酸は、同じ濃度で結合ハイドロキシアパタイトカラムに適用し、リン酸緩衝液の濃度の増加を用いて溶出させたていた。各核酸のサブタイプが9%以下が次の1つの画分からキャリーオーバーで互いに独立して溶出する。
チェサピーク湾から採取したウイルスのコミュニティから単離された核酸にこの技術の応用を図3に示されています。精製ウイルスから単離した全核酸の収量がハイドロキシアパタイトカラムに適用された。 ssDNAは、RNAおよび二本鎖DNAから成るゲノム材料を独立してそれぞれ0.12M、0.20M及びリン酸緩衝液の0.40M/1.00M濃度で溶出した。二本鎖DNAは、0.40Mと1.00Mのリン酸濃度で溶出し、このケースでは、ssDNAはとRNA遺伝子型に比べてこのウイルスのコミュニティを支配している。この観察は、回復可能な核酸の大半はdsDNAを13である海洋および河口環境の予想されるウイルスの群集組成と一致している。

核酸の分画のためのハイドロキシアパタイトクロマトグラフィー法の図1。フロー図。 0.12Mリン酸緩衝液で調製されたssDNAを、二本鎖DNAとRNAの混合物を60℃に加熱し、一定の60℃に維持ハイドロキシアパタイトカラムに適用されます℃の循環水浴を使用して。核酸(ssDNAは、RNAおよび二本鎖DNA)はリン酸塩を含む緩衝液の濃度の増加とともにハイドロキシアパタイトから溶出される。この図は、微生物学のアメリカの社会からの許可を得て複製されており、もともとアンドリュース- Pfannkochらで紹介されました。 2010 12。

図2。ハイドロキシアパタイトクロマトグラフィーを用いて既知のウイルス核酸の分離。 M13mp18 ssDNAは、MS2 ssRNA、phi6 dsRNA及びラムダ鎖DNA(それぞれレーン2-5、)の等しい濃度を組み合わせて(レーン6)およびハイドロキシアパタイトカラムに適用した。 Singl電子本鎖DNA(M13mp18)、RNA(MS2/phi6)とdsDNA(ラムダ)は独立して0.12M(レーン8)、0.18M(レーン9)と0.40M/1.00M(レーン10)を用いてハイドロキシアパタイトカラムから溶出した。 1キロバイトラダー(レーン1、7)ゲノムサイズを確認するために使用されていました。この図は、微生物学のアメリカの社会からの許可を得て複製されており、もともとアンドリュース- Pfannkochらで紹介されました。 2010 12。
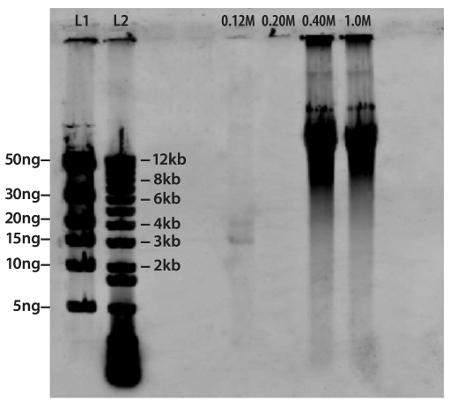
図3。チェサピーク湾の中でコミュニティから分離されたウイルス核酸の分離。核酸を単離し、ハイドロキシアパタイトカラムに適用した。 ssDNAは(レーン0.12M)、RNA(レーン0.20M)及びdsDNAが(レーン0.40M/1.0M)独立してそれぞれ、0.12M、0.20Mと0.40M/1.00Mのリン酸緩衝液の濃度を用いて溶出した。ハイマスDNAラダー(レーンL1)および1キロバイトラダー(レーンL2)は、視覚的に核酸のおおよその分子量と質量を確認するために使用されていました。この図は、微生物学のアメリカの社会からの許可を得て複製されており、もともとアンドリュース- Pfannkochらで紹介されました。 2010 12。
ディスカッション
ここで紹介するハイドロキシアパタイトクロマトグラフィーの手法は、目的は社会の総核酸組成を研究する場合の混合ウイルスの集合体からの核酸の分画のための非常に効率的かつ堅牢なツールです。一般的に、ssDNAを、RNAおよび二本鎖DNAは約〜0and 0.40Mそれぞれより大きい列フォーリン酸塩緩衝液の濃度から溶出されます。それが既知の核酸(耕作ウイルス調製からなど)を使用して?...
開示事項
利害の衝突は宣言されません。
謝辞
この研究は、科学(BER)、米国エネルギー省、協力協定がないの局によってサポートされていました。デFC02 - 02ER63453、国立科学財団の微生物ゲノムシーケンシングプログラム(受賞番号0626826と0731916)。我々は、環境サンプルのコレクションを持つ彼の援助のための彼の技術的専門知識とアドバイスとK.エリックWommack用ジョングラスに感謝。
資料
| Name | Company | Catalog Number | Comments |
| 材料名 | 会社 | カタログ番号 | カタログ番号 |
|---|---|---|---|
| エコノ-カラム | Bio - Rad社 | 737-0717 | 0.7センチメートルIDのパッケージ/ 2 |
| ヒドロキシアパタイト | Bio - Rad社 | 130-0520 | DNAグレードバイオジェルHTPジェル、100g/td> |
| リン酸ナトリウム、一塩基性 | VWR | VW1497 - 01 | 一水和物、クリスタル500グラム |
| リン酸ナトリウム、二塩基性 | VWR | VW1496 - 01 | 無水、パウダー500グラム |
| DEPC処理水 | インビトロジェン | AM9922 | 1L |
| 10%SDS溶液 | インビトロジェン | 24730-020 | 超高純度、1L |
| 0.5M EDTA | インビトロジェン | AM9262 | pHは8.0、1L |
| Sigmacote | シグマアルドリッチ | SL2 - 25ML | |
| 2ミリリットル血清学的pippette | VWR | 89130-884 | ポリスチレン、滅菌 |
| BDファルコン遠心管 | VWR | 21008-936 | 15ミリリットル、滅菌 |
| フェノール:クロロホルム:イソアミルアルコール(25:24:1、V / V / V) | インビトロジェン | 15593-031 | 超高純度、100ミリリットル |
| アミコンウルトラ-4遠心装置 | ミリポア | UFC803024 | Ultracel - 30膜 |
| 20X TEバッファー、RNaseフリー | インビトロジェン | T11493 | 100ミリリットル |
| Glycoblue | インビトロジェン | AM9516 | 15mg/ml |
参考文献
- Whitman, W. B., Coleman, D. C., Wiebe, W. J. Prokaryotes: The Unseen Majority. Proceedings of the National Academy of Sciences of the United States of America. 95, 6578-65 (1998).
- Hendrix, R. W. Bacteriophages: evolution of the majority. Theor Popul Biol. 61, 471-471 (2002).
- Weinbauer, M. G. Bacteriophages: Evolution of the Majority. FEMS Microbiol Rev. 28, 127-127 (2004).
- Dinsdale, E. A., Edwards, R. A., Hall, D. Functional Metabolic Profiling of Nine Biomes. Nature. 455, 830-830 (2008).
- McDaniel, L., Breitbart, M., Mobberley, J. Metagenomic Analysis of Lysogeny in Tampa Bay: Implications for Prophage Gene Expression. PLoS ONE. 3, e3263-e3263 (2008).
- Williamson, S. J., Rusch, D. B., Yooseph, S. The Sorcerer II Global Ocean Sampling Expedition: Metagenomic Characterization of Viruses within Aquatic Microbial Samples. PLoS ONE. 3, e1456-e1456 (2008).
- Lang, A. S., Rise, M. L., Culley, A. I. RNA Viruses in the Sea. FEMS Microbiol Rev. 33, 295-295 (2009).
- Ng, T. F., Manire, C., Borrowman, K. Discovery of a Novel Single-Stranded DNA Virus from a Sea Turtle Fibropapilloma by using Viral Metagenomics. J. Virol. 83, 2500-2500 (2009).
- Rosario, K., Duffy, S., Breitbart, M. Diverse Circovirus-like Genome Architectures Revealed by Environmental Metagenomics. J Gen Virol. 90, 2418-2418 (2009).
- Culley, A. I., Lang, A. S., Suttle, C. A. Metagenomic Analysis of Coastal RNA Virus Communities. Science. 312, 1795-1795 (2006).
- Bernardi, G. Chromotography of Nucleic Acids on Hydroxyapatite. Nature. 209, 779-779 (1965).
- Andrews-Pfannkoch, C., Fadrosh, D. W., Thorpe, J. Hydroxyapatite-Mediated Separation of Double-Stranded DNA, Single-Stranded DNA and RNA Genomes from Natural Viral Assemblages. Applied and environmental microbiology. 76, 5039-5039 (2010).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in Aquatic Ecosystems. Microbiol Mol Biol Rev. 64, 69-69 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved