A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تتبع الزحف داخل اللمعة العدلات ، والهجرة والانجذاب الكيميائي Transendothelial في الأنسجة بواسطة الميكروسكوب فيديو Intravital
In This Article
Summary
وصفنا على بروتوكول المجهري brightfield intravital لقياس ديناميكية التفاعلات الخلية العدلة البطاني خلال تجنيد العدلة ردا على مصدر جاذب كيميائي العدلة في الجسم الحي. العدلة الزحف داخل اللمعة ، والهجرة وtransendothelial الكيميائي في الأنسجة العضلية الماوس المشمرة وتصور مع التصوير الفيديو وانقضى الوقت مع ImageJ مجنزرة.
Abstract
توظيف تعميم الكريات البيض من مجرى الدم إلى الأنسجة الملتهبة هو عملية حاسمة ومعقدة من 1،2 الالتهابات. في الوريدات شعيرة وريدية من الأنسجة الملتهبة ، الكريات البيض في البداية حبل ولفة على سطح الجدار وريدي اللمعية. المتداول الكريات البيضاء القبض على التصاق البطانة والخضوع الشركة استجابة لchemokine chemoattractants أو أخرى على السطح وريدي. ووصف عملية نقل العديد من الكريات البيض ملتصق من موقع الأولي للانضمام الى موقع التسرب صلي في البطانة ، داخل اللمعة الزحف 3. التالية الزحف والتحرك عبر بطانة الكريات البيض (التهجير) وتهاجر في أنسجة خارج الأوعية نحو مصدر جاذب كيميائي (الكيميائي) 4. Intravital المجهر هو أداة قوية لتصور التفاعلات خلية الكريات البيض في الجسم الحي البطاني وكشف الآليات الخلوية والجزيئية للتجنيد 2،5 الكريات البيض. في هذا التقرير ، ونحن نقدم وصفا شاملا لاستخدام brightfield intravital المجهري لتصور وتحديد العمليات التفصيلية للتجنيد في العضلات العدلة المشمرة الماوس ردا على التدرج من جاذب كيميائي العدلة. للحث على تجنيد العدلة ، وقطعة صغيرة من هلام agarose (~ 1 ملم 3 الحجم) التي تحتوي على جاذب كيميائي العدلة MIP - 2 (CXCL2 ، وهو chemokine CXC) أو WKYMVm (التربتوفان ، اليس ، صور ، فال - D - الأرصاد الجوية ، والتناظرية الاصطناعية يوضع من الببتيد الجرثومي) على الأنسجة العضلية المجاورة للشعيرة وريدية في الوريد ملاحظتها. مع مرور الوقت ، ساقطا التصوير الفوتوغرافي والفيديو وبرامج الكمبيوتر ImageJ ، العدلة الزحف داخل اللمعة على البطانة ، والهجرة transendothelial العدلة والهجرة والكيميائي في الأنسجة وتصور ومجنزرة. هذا البروتوكول يسمح التحليل الكمي وموثوق بها العديد من المعلمات التوظيف العدلة مثل سرعة الزحف داخل اللمعة ، والوقت التهجير ، مفرزة الوقت والسرعة والهجرة ، وسرعة الكيميائي والكيميائي المؤشر في الأنسجة. علينا أن نظهر أن استخدام هذا البروتوكول ، ويمكن توظيف هذه المعلمات العدلة تحديد ستابلي وتنقل خلية واحدة تتبع بسهولة في الجسم الحي.
Protocol
1. جاذب كيميائي في إعداد جيل Agarose
- ماصة 10 مل من برنامج تلفزيوني × 2 في أنبوب 50 مل المخروطية ، والاحماء أنبوب من خلال وضعه في دورق يحتوي على ماء ساخن.
- ماصة 10 مل من الماء المقطر وإضافة مسحوق agarose 0.4 غرام في آخر أنبوب 50 مل المخروطية (مع غطاء لها خففت قليلا) والحرارة الخليط حتى الغليان فقط في فرن الميكروويف (1 ~ لدقيقة في فرن الميكروويف 700 واط) .
- إضافة تحسنت 2 × PBS إلى حل agarose أنبوب ، والحل في دوامة المختلطة وإبقائه دافئا في دورق الماء الساخن.
- Micropipette حل جاذب كيميائي (على سبيل المثال ، 10 ميكرولتر من 0.5 ميكروغرام من chemokine CXC MIP - 2 أو 12 ميكرولتر من WKYMVm 1 ملم) في غطاء أنبوب إيبندورف 1.5 مل تحتوي على 3 ميكرولتر الحبر الهند وتخلط جيدا من قبل التطلع باستخدام micropipette (تجنب فقاعة الهواء).
- قطع نهاية غيض من طرف الماصة 200 ميكرولتر وmicropipette 110 ميكرولتر من محلول agarose (42 درجة مئوية) في غطاء وتخلط جيدا فورا باستخدام طرف آخر ماصة (تجنب فقاعة الهواء).
- تخزين هلام جاذب كيميائي المحتوية على +4 درجة مئوية.
2. إعداد العضلات المشمرة عن الميكروسكوب Intravital (الشكل 1)
- تخدير ماوس البالغين الذكور من خلال حقنة الملكية الفكرية من خليط من زيلازين ملغم / كغم من 10 و 200 ملغم / كغم هيدروكلوريد الكيتامين.
- حلق فوق منطقة الوريد الوداجي الخارجي ، والحق في الجانب الامامي من كيس الصفن مع الحلاقة الكهربائية. بعد التخدير ، من المهم أن تولي اهتماما خاصا ورعاية الماوس تخدير. ويمكن استخدام مصباح الحرارة لمنع الفأرة من انخفاض حرارة الجسم. يجب أن تكون خالية من الماوس منعكس الألم.
- إجراء شق أفقي ، العثور على ويقثطر حبل الوريد باستخدام أنابيب PE - 10 مليئة المالحة الهيبارين 100 U / مليلتر. وهناك حاجة للقسطرة الوريد الوداجي لادارة التخدير والأدوية إضافية عند الحاجة.
- إصلاح ساقيه الخلفيتين الماوس مع الشريط السري مع الماوس مواجهة الكذب على منزل من صنع مجلس العضلات المشمرة (الشكل 1).
- توصيل لوحة الى 37 درجة مئوية دائري المياه للحفاظ على العضلات والجسم المشمرة الماوس الدافئة.
ملاحظة : يجب تنفيذ جميع الإجراءات 2،6-2،14 بلطف شديد 5.
- إجراء شق في الجلد صفني لفضح العضلة المشمرة اليسار. بعناية تشريح العضلات من اللفافة المرتبطة بها.
- Superfuse العضلة المشمرة مع 37 درجة مئوية حرارة بيكربونات - مخزنة المالحة (131.9 كلوريد الصوديوم ، 4.7 بوكل ، 1.2 MgSO 4 و 20 NaHCO 3 ، مم ، ودرجة الحموضة 7.4) باستخدام مضخة تمعجية.
- ربطة عنق خياطة 4-0 في نهاية البعيدة للعضلة المشمرة لأنه عقد لأسفل على زجاج رمى عرض واضح للمجلس المشمرة العضلات.
- يكوي العضلة المشمرة طوليا. مع خياطة 4-0 ، عقد الشقة العضلات وثبته على طول الحواف على قاعدة التمثال. فصل الخصية والبربخ ومن العضلات الأساسية ونقلها إلى تجويف البطن.
- Superfuse عضلة في ~ 0.6 مل / دقيقة مع العازلة ° 37 C - نضح وتحسنت تغطية العضلات تعرضت مع 22 × 22 مم ساترة الزجاج.
- وضع مجلس العضلات المشمرة على المسرح مجهر فحص العضلات تحت المجهر ، والعثور على الوريد مناسبة شعيرة وريدية (حدد الوريد الذي يتم على التوالي وunbranched وطبيعي معدل القص وقطر في 25-40 ميكرون) ، وضبط كاميرا فيديو السماح للالوريد إلى أن تصور في وضع عمودي على حد سواء إلى اليمين أو اليسار لمراقبة التلفزيون.
- التوازن بعد 30 دقيقة ، وتسجيل صور الفيديو من الوريد للشعيرة وريدية المختارة لمدة 5 دقائق والتحكم في بيانات خط الأساس باستخدام جهاز تسجيل الفيديو.
- وقف وإزالة superfusion ساترة على العضلات.
- وضع علامة ~ 1 ملم 3 الحجم جاذب كيميائي المحتوية على الجل على سطح العضلة المشمرة في منطقة انتقاؤه من 350 ميكرون وموازية لشعيرة وريدية في الوريد لوحظ ، إضافة ساترة لعقد هلام في مكان وsuperfuse في الأنسجة العضلية في غاية بطء معدل (≤ 10 ميكرولتر / دقيقة) للسماح بإنشاء التدرج من جاذب كيميائي التي يطلق ببطء وشكلت من هلام.
- سجل صورة الفيديو لمدة 90 دقيقة بعد إضافة الجل التي تحتوي على جاذب كيميائي. أثناء التسجيل ، وضبط والحفاظ على التركيز على التمسك المجهر ، الزحف ، وtransmigrating chemotaxing الكريات البيض داخل الوريد والأنسجة العضلية.
- بعد التجربة ، واستيراد ملف الفيديو إلى جهاز كمبيوتر لتحليلها.
3. تعقب الخلايا باستخدام ImageJ
- على جهاز كمبيوتر ، واستخراج وتحويل الفيديو إلى صيغة AVI (على سبيل المثال ، والاستخدام المجاني bitRipper برامج الكمبيوتر لتحويل الفيديو DVD إلى ملف AVI).
- استخدام برامج تحرير الفيديو لتوليد الفيلم الوقت ساقطا. على سبيل المثال ، استخدام Windows Movie Maker لصنع فيلم الوقت ساقطا (1 / 512 أو 1 / 1024 الوقت الفاصل بين aر 30 إطارا في الثانية معدل) من شريط الفيديو الأصلي في الوقت الحقيقي. تحويل وحفظ الوقت مضغوط ساقطا الفيلم DV - AVI الشكل.
- تسجيل صور ميكرومتر المعايرة تحت المجهر إعداد نفسه ، استيراد الصور إلى الكمبيوتر ، فتح الصور مع ImageJ. في ImageJ ، بكسل مجموع تظهر على أعلى يسار الشاشة (على سبيل المثال ، 720 × 480 بكسل). قياس حجم الشاشة في كل من X و Y محاور (على سبيل المثال ، 200 × 150 ميكرون). من هذا ، وحساب عدد بكسل لكل ميكرومتر (على سبيل المثال ، س = 720 / 200 = 3.6 بكسل / ميكرون ، و y = 480 / 150 = 3.2 بكسل / ميكرون).
- لاستيراد الفيلم ، فتح ImageJ مرة أخرى ، انقر فوق "ملف والاستيراد عن طريق أفلام كويك تايم ، بلج في" ، حدد الفيلم ليتم تحليلها وانقر على زر "موافق" في واجهة "فتاحة الفيلم كيو تي".
- انقر على زر "الإضافات ، مختصر تعقب" لتعقب الخلايا. املأ المعلومات ذات الصلة في الحقول في الجزء السفلي قبل بدء تتبع. لفترة وجيزة ،
- الفاصل الزمني (في ثانية) = fold-time-lapse/30 (على سبيل المثال ، 1020 × مرور الزمن سيكون من 1020-1030 = 34 ثانية / الإطار الزمني).
- س / ص = قياس المعايرة ميكرون / بكسل باستخدام معايرة صورة ميكرون.
- ض = 0 المعايرة (كما في عضلة المشمرة الماوس هو طبقة رقيقة جدا من الأنسجة والخلايا الزحف والهجرة هي 2D تقريبا تحت مشرق الميدان تضوء).
- البحث عن توسيط حجم مربع = 1.
- حجم نقطة / خط العرض / حجم الخط : يمكن تعديلها إذا لزم الأمر.
- تحديد نقطة ثابتة وواضحة كنقطة مرجعية. وهذا يمكن أن يكون نقطة مرجعية واضحة وأي نقطة صغيرة الهيكلية التي لا تزال دون تغيير ، ومستقرة في كافة مراحل التجربة برمتها. انقر على زر "إضافة المسار" لتعقب نقطة مرجعية من الأول إلى الإطار الأخير وانقر على "المسار النهاية". البيانات تظهر النتائج على الجدول تلقائيا.
- المسار الزحف والهجرة العدلات واحدا تلو الآخر : انقر على زر "إضافة المسار" لتعقب الخلية من ظهورها في الأنسجة للاختفاء في كل إطار وانقر على "المسار النهاية" لإنهاء وحفظ النتائج في Microsoft Excel.
4. تحليل معلمات التوظيف العدلات
- فتح ملف النتائج في Microsoft Excel ، وتحليل البيانات (اتخاذ تغييرات النقطة المرجعية في التحليل).
- الزحف داخل اللمعة
- الزحف مسافة : المسافة الإجمالية الخلية يزحف في لمعة من موقع ملتصقة الأولي إلى موقع التهجير الأمثل (ميكرون).
- سرعة الزحف : الزحف المسافة / الزمن (ميكرون / دقيقة).
- Transendothelial الهجرة
- التهجير الوقت : من الساعة الخلية يبدأ transmigrate عبر البطانة إلى الوقت الذي يكون فيه خلايا الجسم كله خارج الوريد ويمكن أن ينظر إلى أي خلية في الجسم تجويف (دقيقة أو ثانية).
- مفرزة الوقت : من الساعة خلايا الجسم كله خارج الوريد (مباشرة بعد التهجير) إلى نقطة زمنية عندما الخلية يفقد الاتصال مع الوريد (يسحب الذيل) (دقيقة أو ثانية).
- الكيميائي في الأنسجة
- المسافة الهجرة : مجموع المسافة الخلية ينتقل من نقطة البداية إلى نقطة النهاية في الهجرة في الأنسجة (ميكرون).
- سرعة الهجرة : الهجرة في الأنسجة المسافة / الزمن (ميكرون / دقيقة).
- المسافة الكيميائي : مجموع الخلية المسافة يهاجر في المحور س في الأنسجة (ميكرون).
- سرعة الكيميائي : الكيميائي المسافة / الزمن (ميكرون / دقيقة).
- مؤشر الكيميائي : نسبة تقسيم المسافة التي الكيميائي المسافة الهجرة في الأنسجة.
5. ممثل النتائج :
على الرغم من أن يستخدم bightfield intravital المجهري لدراسة التفاعلات بين الخلايا الكريات البيض والبطاني قد لا تكون بالضرورة لالعدلات ، وأكد لنا أنه من خلال الدراسات الأنسجة لدينا ، وأكثر من 95 ٪ من الخلايا العدلة المعينين في عضلات المشمرة جاذب كيميائي المعالجة كانت في الواقع العدلات . في هذا التقرير ، وذلك باستخدام العدلة انتقائية chemoattractants ، نقدم تتبع إجراءات توظيف العدلات في الجسم الحي. على وجه التحديد ، وصفنا على بروتوكول الزحف تتبع العدلة داخل اللمعة ، والهجرة transendothelial ، والكيميائي في الأنسجة العضلية المشمرة في الفئران باستخدام تخدير الوقت الفاصل بين المجهر والفيديو intravital ImageJ. الجل agarose جاذب كيميائي المحتوية على العضلات ببطء المشمرة النشرات جاذب كيميائي ويسمح بإنشاء التدرج جاذب كيميائي في الأنسجة. العدلة جاذب كيميائي يحرض تفاعلات الخلايا العدلة البطاني في الوريدات مشمري شعيرة وريدية في الفئران. التجربة كلها تصور تحت المجهر brightfield تستقيم intravital مع صور الفيديو التي يتوقع لون كاميرا فيديو إلى جهاز التلفزيون وتسجيلها من قبل جهاز الفيديو. عقدنا العزم على العدلةالزحف داخل اللمعة ، والهجرة والهجرة وtransendothelial الكيميائي في الأنسجة العضلية ردا على العدلة جاذب كيميائي MIP - 2 و WKYMVm أعد في agarose هلام (الشكل 2). وجدنا أن MIP - 2 (0.5 ميكرومتر في) وWKYMVm (حوالي 0.1 ملم) أثارت الزحف داخل اللمعة العدلة في سرعة مماثلة ، والهجرة transendothelial العدلة ومفرزة من الوريد لمدة مماثلة من الوقت ، والهجرة العدلة والكيميائي في الأنسجة العضلية في ما يقرب من نفس السرعة وفهارس مماثلة مع العدلات الكيميائي (P> 0.05 في اختبار الطلاب طن).
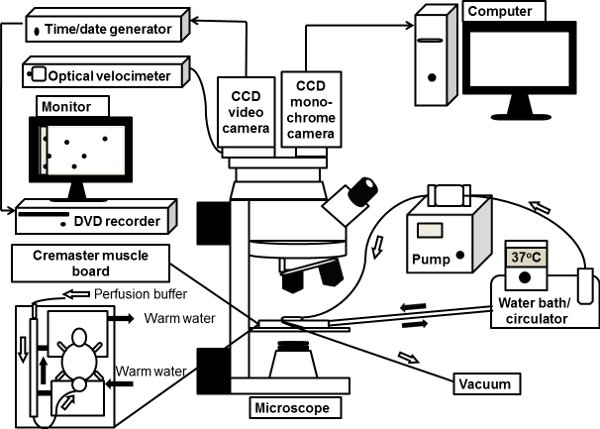
الشكل 1. الرسم التوضيحي التخطيطي نظام intravital المجهر. هو exteriorized عضلة المشمرة الماوس على عرض التمثال واضحة من مجلس العضلات المشمرة على خشبة المسرح المجهر وsuperfused مع 37 درجة مئوية حرارة بيكربونات - مخزنة المالحة. توصيل المجهر تستقيم مع كاميرا فيديو CCD لون intravital brightfield المجهري. يرتبط أيضا أحادية اللون في أعماق تبريد كاميرا رقمية CCD الى ميناء المجهر للفحص المجهري intravital مضان ، والصور التي يتم معالجتها مباشرة من جهاز الكمبيوتر.
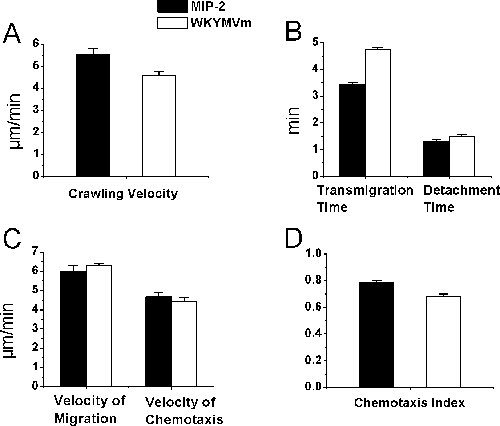
الرقم التوظيف العدلات 2. معالم brightfield intravital المجهري. وكان المستحث العدلة تجنيد من قبل الافراج التدريجي للجاذب كيميائي العدلة MIP - 2 أو WKYMVm في إعداد جيل agarose 350 ميكرون وضعت بالقرب من الوريد شعيرة وريدية. وقد تم تحليل بيانات الوقت ساقطا الفيديو ImageJ بعد معالجة الفيديو في الوقت الحقيقي تسجيل التجربة. وتم تحديد العدلة الزحف داخل اللمعة (A) ، والوقت وقت التهجير مفرزة (B) ، والسرعة وسرعة الهجرة الكيميائي في الأنسجة (C) ، ومؤشر الكيميائي في العضلات المشمرة (D) بعد إقامة MIP - 2 أو WKYMVm agarose هلام على المشمرة العضلات في الفئران C57BL / 6 (ن = 3 ، # تعقب الخلايا = 22 (في ألف وباء) و 27 (في C و D) على التوالي لMIP - 2 ، و 26 = (في ألف وباء) و 44 ( في C و D) على التوالي لWKYMVm).
Discussion
Intravital المجهر هو أداة أساسية للكشف عن الآليات الخلوية والجزيئية لتجنيد الكريات البيض خلال الالتهاب. التصور الكمي لتحديد التفاعلات خلية الكريات البيض البطاني في الأنسجة microvasculature transluscent مثل العضلات والمشمرة مساريق تبقى المعيار الذهبي لتطبيق هذه التقنية 1،5. وintr...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من خلال منحة بحثية من المعاهد الكندية للأبحاث الصحية (CIHR ، MOP - 86749). L. ليو هي المستفيدة من جائزة CIHR محقق جديد (MSH - 95374).
Materials
الجدول : مواد والكواشف والمعدات الخاصة
| اسم كاشف / المعدات | شركة | فهرس العدد | تعليقات |
| أنابيب البولي إثيلين ، وPE10 | بيكتون ديكنسون | 427401 | معرف × 0.28mm 0.61mm OD |
| الهند الحبر | فنون كرة السرعه | سوبر الأسود | 100 ٪ ، أي صبغة أسود الكربون الأصباغ |
| كينا | آرون الطبية | AA03 | |
| زيلازين | باير للرعاية الصحية ، شركة باير | DIN 02169592 | |
| كيتامين هيدروكلوريد | Bioniche الحيوان وزارة الصحة الكندية ، وشركة | DIN 01989529 | |
| المؤتلف MIP - 2 الفئران | R & D نظم | 452 - M2 | |
| WKYMVm | طائر الفينيق صيدلة ، وشركة | 072-12 | |
| Agarose | Invitrogen | 15510-027 | عالى النقاء |
| الهيبارين | سيغما | H - 3393 | |
| تستقيم المجهر | اوليمبوس | BX61WI | |
| 3CCD كاميرا فيديو ملونة | SONY | DXC - 990 | |
| HD - DVD مسجل فيديو | شركة إل جي إلكترونيكس | RH398H - M | |
| رصد التلفزيون | شركة إل جي إلكترونيكس | 22LG30 | |
| مياه دائري | الحرارية العلمية | HAAKE DC10 | |
| مضخة تمعجية | جيلسون ؛ فارماسيا | جيلسون MINIPULS 3 ؛ فارماسيا P - 3 | |
| المشمرة مجلس العضلات | جامعة ساسكاتشيوان | الصنع |
References
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved