需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
追踪中性粒细胞腔内的爬行,活体视频显微镜Transendothelial组织中的迁移和趋化
摘要
我们描述了协议的明源在体内的中性粒细胞趋化中性粒细胞招聘时测量动态的中性粒细胞 - 内皮细胞相互作用的活体显微镜。中性粒细胞腔内爬行,transendothelial迁移和趋化鼠标提睾肌组织与时间已过视频摄影和ImageJ跟踪观察。
摘要
招聘循环白细胞从血液流至发炎组织是一个重要和复杂的炎症 1,2的过程。在postcapillary静脉发炎组织,白细胞初步系绳上的小静脉壁壁面和滚动。滚动内皮细胞白细胞逮捕,并接受公司的附着力小静脉表面的趋化因子或其他趋化因子。搬迁许多粘附白细胞粘附在血管内皮细胞的交界外渗网站从最初的网站,这个过程被称为腔内爬行 3 。白细胞爬行,跨越内皮细胞(轮回)和血管外组织迁移朝来源的趋化因子(趋化)4。活体显微镜是一个强大的工具,在体内的白细胞-内皮细胞相互作用的可视化和细胞和分子机制揭示白细胞招聘2,5。在这份报告中,我们提供了一个全面的描述使用明活体显微镜,可视化,并确定在中性粒细胞在小鼠提睾肌的招聘的详细过程,中性粒细胞趋化梯度。为了诱导中性粒细胞的招聘,小块的琼脂糖凝胶(〜1毫米大小),其中包含中性粒细胞趋化MIP - 2(CXCL2,CXC趋化因子)或WKYMVm(色氨酸,赖氨酸,酪氨酸- VAL - D -蛋氨酸,一种人工合成的模拟细菌转肽)是放在毗邻postcapillary观察到的微静脉的肌肉组织。随着时间已过视频摄影和计算机软件ImageJ,内皮细胞,中性粒细胞transendothelial的迁移和组织中的迁移和趋化中性粒细胞腔内爬行可视化和跟踪。此协议允许腔内的爬行速度,轮回的时间,脱离时间,迁移速度,趋化速度,趋化指数在组织很多,如中性粒细胞的招聘参数,可靠和定量分析。我们证明,使用此协议,这些中性粒细胞招聘参数可以稳定的决心和方便地跟踪体内的单个细胞运动。
研究方案
1。趋化琼脂糖凝胶的制备
- 移取10 mL的2 × PBS 50 mL锥形管,并放进一个包含热水的烧杯中的热身管。
- 吸取10毫升蒸馏水和另一50 mL锥形管中添加0.4克琼脂糖粉(其第略有松动)和热的混合物,直到刚刚在微波炉煮沸(在700瓦的微波炉〜1分钟) 。
- 加入预热的2 × PBS琼脂糖溶液管,漩涡的混合溶液,并保持在温暖的热水的烧杯。
- 微管的细胞趋化解决方案(例如,10μL0.5微克CXC趋化因子MIP - 2或12μL1毫米WKYMVm)含3μL墨汁1.5毫升的Eppendorf管的盖子,并混合使用微量的愿望(避免气泡)。
- 切尖年底的200微升吸管尖和盖子微量110μL琼脂糖溶液(42℃),并立即拌匀,用另一个枪头(避免气泡)。
- 趋化含凝胶存放在4 ° C。
2。提睾肌的准备活体显微镜(图1)
- 麻醉成年雄性小鼠腹腔注射10毫克/公斤甲苯噻嗪和200毫克/公斤盐酸氯胺酮的混合物。
- 超过右颈外静脉和电动剃须刀的阴囊前方面的剃须面积。麻醉后,重要的是要给予特别的重视和关怀麻醉鼠标。可用于热灯,以防止低温鼠标。鼠标应无痛觉反射。
- 设为横向切口,找到并采用充满100 U / ml肝素生理盐水的PE - 10管导尿颈静脉。颈内静脉插管在必要时需要额外的麻醉剂和药品的管理。
- 修正脐磁带鼠标躺在自制的提睾肌板(图1)面对老鼠的后腿。
- 将电路板连接到37℃水的循环,提睾肌和鼠标保持身体温暖。
注意:从2.6到2.14之间的所有的程序必须非常轻柔5。
- 作出在阴囊皮肤切口,显露左提睾肌。仔细剖析相关的筋膜肌肉。
- Superfuse提睾肌与37 ° C -回暖碳酸氢盐缓冲液(131.9氯化钠,氯化钾4.7,1.2 硫酸镁 ,20碳酸氢钠3,在MM,pH值7.4),使用蠕动泵。
- 领带4-0缝合举行清晰地收看提睾肌板的玻璃底座上的提睾肌的末端。
- 纵向烧灼的提睾肌。用4-0缝合,保持肌肉平坦,沿基座的边缘安全。从底层肌肉的睾丸和附睾分离,并移动到腹腔。
- Superfuse〜0.6毫升/分钟,用37℃温灌注缓冲和暴露的肌肉覆盖了22 × 22毫米的玻璃盖玻片的肌肉。
- 提睾肌板,放在显微镜阶段研究的肌肉,在显微镜下,找到一个合适的postcapillary的微静脉(选择直,分枝和正常的剪切速率和直径在25-40微米的微静脉)和调整摄像头使小静脉,要么向左或向右端的电视监视器上的垂直位置的可视化。
- 经过30分钟的平衡,记录选定的5分钟为基准控制数据使用录像机postcapillary的小静脉视频图像。
- 停止灌流,取出盖玻片上的肌肉。
- 提睾肌在350微米预选区的表面上放置一个〜1毫米大小的趋化因子含有凝胶和观察postcapillary微静脉平行,加盖玻片举行的地方凝胶superfuse的肌肉组织,在一个非常速度慢(≤10μL/分钟),以便建立一个缓慢释放和凝胶形成的趋化因子梯度。
- 记录的趋化因子含有凝胶后90分钟的视频图像。在录制过程中,调整和保持显微镜上坚持重点,爬行,transmigrating chemotaxing的小静脉内和肌肉组织中的白细胞。
- 实验后,导入的视频文件到计算机进行分析。
3。细胞示踪使用ImageJ
- 在计算机上,提取和视频转换为AVI格式(例如,免费使用的计算机的软件bitRipper,DVD视频转换为AVI文件)。
- 使用视频编辑软件生成的时间,失效的电影。例如,使用Windows Movie Maker使一个失效时间的电影(1 / 512或1 / 1024时间推移一个T 30 fps的速率)从原来的,实时视频。 DV - AVI格式转换和保存时间已过未压缩的电影。
- 校准微米的图像记录在相同的显微镜设置,导入到计算机的图像,打开ImageJ的图像。 ImageJ,总像素显示屏幕(例如,720 × 480像素)的左上角。测量屏幕的大小,在X和Y轴(例如,200 × 150微米)。由此看来,计算每微米的像素(例如,X =二百分之七百二十〇= 3.6像素/微米,和Y =一百五十○分之四百八十零= 3.2像素/微米)的数量。
- 要导入的电影,再次打开ImageJ,点击“文件 - 导入使用QuickTime电影插件”,选择要分析的电影,然后单击“确定”,“QT电影开瓶器”界面。
- 点击“插件手动跟踪”来跟踪细胞。在填写有关信息,在底部前开始跟踪的领域。简单地说,
- 时间间隔(秒)= fold-time-lapse/30(例如,1020 ×时间推移将三十〇分之一千零二十零= 34秒/帧的时间间隔)。
- x / y的校准=微米/像素测量使用的千分尺的形象校准。
- 于校准= 0(鼠标提睾肌是一层极薄的组织和细胞爬行和迁移,大约是在明场透2D)。
- 搜索中心= 1平方米大小。
- 点尺寸/线宽/线字体大小:如果需要,可以调整。
- 选择一个稳定和清晰的点作为参考点。该参考点可以是任何明确的和小的结构保持不变,在整个实验的稳定。点击“添加轨道”来跟踪从第一参考点到最后一帧,并单击“结束曲目”。数据自动出现在结果表。
- 轨道爬行和迁移的中性粒细胞逐个点击“添加轨道”来跟踪从它的外观在组织细胞在每帧的消失,单击“结束追踪”完成并保存在Microsoft Excel中的结果。
4。中性粒细胞招募参数分析
- 打开在Microsoft Excel中的结果文件,并分析数据(分析,考虑到参考点的变化)。
- 腔内爬行
- 爬行距离:总距离的细胞爬壁,从最初的网站在管腔内的最优轮回网站(微米)。
- 爬行速度:爬行距离/时间(微米/分钟)。
- Transendothelial迁移
- 轮回时间:从细胞开始的时间轮回跨内皮细胞的时候,当整个胞体外面的小静脉,可以看到在流明(分钟或秒)和无细胞体。
- 支队时间:从整个胞体外面的小静脉(后立即轮回)的时间点时,细胞失去接触与微静脉(尾缩回)(分钟或秒)。
- 趋化作用,在组织
- 迁移距离:距离的细胞从起点移动到组织中迁移的终点(微米)的总和。
- 移动速度:在组织/时间的迁移距离(微米/分钟)。
- 趋距离:距离细胞的总和,在组织中的X轴(微米)的迁移。
- 趋化速度:趋化距离/时间(微米/分钟)。
- 趋化指数:组织中的迁移距离除以趋化距离的比例。
5。代表性的成果:
虽然bightfield活体显微镜用于白细胞 - 内皮细胞相互作用的研究,未必一定中性粒细胞,我们确认,我们的组织学研究中,超过95%的招募细胞中的中性粒细胞趋化处理的提睾肌的肌肉确实是中性粒细胞。在这份报告中,使用选择性中性粒细胞趋化因子,我们目前跟踪的中性粒细胞在体内的招聘程序。具体来说,我们描述了一个跟踪腔内的中性粒细胞爬行,transendothelial迁移,并在睾使用时间推移活体视频显微镜和ImageJ麻醉小鼠的肌肉组织的趋化作用的协议。缓慢释放的趋化含琼脂糖凝胶上的提睾肌细胞趋化,并允许在组织成立的一个趋化因子梯度。嗜中性粒细胞趋化因子诱导中性粒细胞在小鼠提睾postcapillary静脉内皮细胞间的相互作用。整个实验是一个堂堂正正的明预计一个彩色视频摄像机到电视监视器和录像机记录的视频图像的活体显微镜下可视化。我们确定的中性粒细胞腔内爬行,transendothelial迁移和迁移响应和肌肉组织中趋化中性粒细胞趋化因子MIP - 2和琼脂糖凝胶WKYMVm在准备(图2)。我们发现,MIP - 2(0.5微米)和WKYMVm(0.1毫米)在类似的速度,中性粒细胞transendothelial的迁移和比较长的时间,中性粒细胞迁移和肌肉组织中趋化小静脉支队引起中性粒细胞几乎腔内爬行相同的速度和类似的中性粒细胞趋化指数(P> 0.05,Student t检验)。
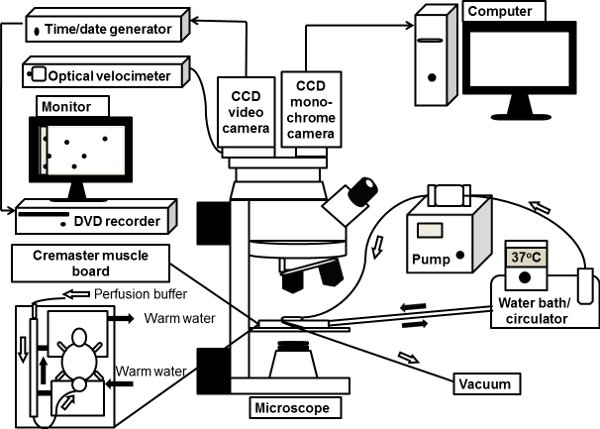
图1活体显微镜系统的示意图。鼠标提睾肌exteriorized清晰地收看基座上的提睾肌板在显微镜阶段,并与37 ° C加热碳酸氢盐缓冲液灌流。直立的显微镜连接为明活体显微镜与CCD彩色视频摄像机。也是一个单色深冷CCD数码相机连接到显微镜,荧光活体显微镜端口,图像直接通过计算机处理。
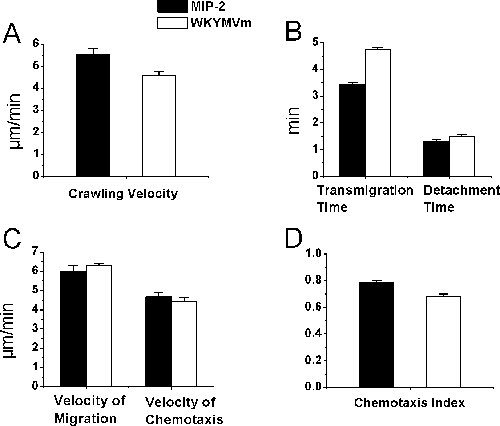
图2。中性粒细胞招聘明活体显微镜参数。招募中性粒细胞诱导的中性粒细胞趋化的逐步释放,MIP - 2在琼脂糖凝胶法制备的WKYMVm放置350微米,相邻postcapillary微静脉。时间失效的视频数据进行分析处理后的实时视频录制的实验由ImageJ。中性粒细胞腔内爬行(一),轮回的时间和脱离时间(B),在组织中的迁移速度和趋化速度(三),提睾肌(四)趋化指数测定后,MIP - 2或WKYMVm琼脂糖凝胶的管理提睾肌在C57BL / 6小鼠(N = 3,= 22(A和B)和27(C和D)分别为MIP - 2,和= 26(A和B)和44(#跟踪细胞在C和D)分别为WKYMVm)。
讨论
活体显微镜揭示炎症过程中白细胞招聘的细胞和分子机制的重要工具。半透明组织,如提睾肌及肠系膜微血管白细胞-内皮细胞相互作用的定量测定可视化仍然是应用技术1,5的黄金标准。传统的明活体显微镜具有许多独特的技术特点和在这些组织中透露的招聘机制是适用于大多数组织 在体内1,2,6。然而,在其他一些如肺,肝和脑组织的白细胞招聘机制已经提睾肌及肠系膜...
披露声明
没有利益冲突的声明。
致谢
这项工作是支持由加拿大卫生研究院(CIHR,MOP - 86749)的研究资助。 L.刘CIHR新研究者奖(MSH - 95374)的收件人。
材料
表:材料,特定试剂及设备
| 试剂/设备名称 | 公司 | 目录编号 | 评论 |
| 聚乙烯管,PE10 | 碧迪 | 427401 | 编号0.28毫米×外径0.61毫米 |
| 墨汁 | Speedball艺术 | 超级黑 | 100%的碳黑色颜料,没有染料 |
| 腐蚀 | 亚伦医疗 | AA03 | |
| 甲苯噻嗪 | 拜耳医药保健,拜耳公司 | DIN 02169592 | |
| 盐酸氯胺酮 | Bioniche家畜保健加拿大公司 | DIN 01989529 | |
| 小鼠重组,MIP - 2 | R&D系统 | 452 - M2 | |
| WKYMVm | 凤凰制药公司 | 072-12 | |
| 琼脂糖 | Invitrogen公司 | 15510-027 | 超纯 |
| 肝素 | 西格玛 | H - 3393 | |
| 直立式显微镜 | 奥林巴斯 | BX61WI | |
| 3CCD彩色视频摄像机 | 索尼 | DXC - 990 | |
| HD - DVD录像机 | LG电子公司 | RH398H - M | |
| 电视监视器 | LG电子公司 | 22LG30 | |
| 水资源循环 | Thermo Scientific的 | HAAKE DC10 | |
| 蠕动泵 | 吉尔森;法玛西亚 | 吉尔森MINIPULS 3; Pharmacia公司的P - 3 | |
| 提睾肌板 | 萨斯喀彻温大学 | 自制 |
参考文献
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。