Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Takip Nötrofil Lumen Crawling, intravital video Mikroskopi Doku transendoteliyal Göç ve Kemotaksis
Bu Makalede
Özet
Biz aydınlık intravital mikroskopi, in vivo olarak nötrofil kemoatraktan kaynak yanıt nötrofil göçünü sırasında dinamik nötrofil-endotel hücre etkileşimleri ölçmek için bir protokol tanımlamaktadır. Nötrofil intraluminal tarama, fare Cremaster'ın kas dokusu transendoteliyal göç ve kemotaksis zaman lapsed video ImageJ ile fotoğraf ve takip ile görüntülendi.
Özet
Kan akışından iltihaplı doku lökosit dolaşan işe inflamasyon 1,2 önemli ve karmaşık bir süreç. Iltihaplı doku postkapiller venüller, başlangıçta halata ve rulo venüler duvar luminal yüzeyinde lökosit. Endotel lökosit tutuklama Haddeleme ve kemokin veya venüler yüzeyinde diğer chemoattractants yanıt firma yapışma tabi. Birçok yapışık lökositlerin endotel junctional ekstravazasyonu sitesine yapışma ilk sitesinden taşınmaya, intraluminal 3 sürünen bir süreç olarak nitelendirdi. Taramasını takiben, lökosit kemoatraktan, kaynak (kemotaksis) 4 doğru ekstravasküler doku endotel (geçişe) üzerinden hareket ve geçiş yapma. Intravital mikroskopi, in vivo lökosit-endotel hücre etkileşimleri görselleştirme ve lökosit işe 2,5 hücresel ve moleküler mekanizmaları ifşa için güçlü bir araçtır . Bu raporda, aydınlık intravital mikroskopi kullanılarak nötrofil kemoatraktan degrade yanıt fare Cremaster'ın kas nötrofil göçünü ayrıntılı süreçlerini görselleştirmek ve belirlemek için kapsamlı bir açıklama sağlar. Nötrofil göçünü, nötrofil kemoatraktan MIP-2 (CXCL2, CXC kemokin) veya WKYMVm (Trp-Lys-Tyr-Val-D-Met, sentetik bir analog içeren agaroz jel küçük bir parça (~ 1 mm 3 boyut) ikna etmek için bakteriyel peptid) gözlenen postkapiller venule komşu kas dokusu yerleştirilir. Zaman-lapsed video fotoğraf ve bilgisayar yazılımı ImageJ, endotele nötrofil transendoteliyal göç ve göç ve doku kemotaksis nötrofil intraluminal sürünerek görüntülenebilmekte ve izlenir. Bu protokol intraluminal sürünerek hızı, âlemden zaman, dekolmanı zaman, göç hızı, kemotaksi hız ve doku kemotaksis indeksi gibi pek çok nötrofil göçünü parametrelerin güvenilir ve kantitatif analiz sağlar. Biz bu protokolü kullanarak, bu nötrofil göçünü parametreleri stabil bir şekilde belirlenir ve tek bir hücre lokomosyon uygun in vivo olarak takip edilebilir olduğunu göstermektedir.
Protokol
1. Agaroz Jel kemoatraktan hazırlanması
- Pipet 10 50-ml konik tüp 2 × PBS mL tüp ve sıcak su içeren behere koyarak ısınmak.
- Pipet 10 ml distile su ve 50 ml konik başka bir tüp içinde 0.4 g agaroz tozu ekleyin (kap biraz gevşetti) ve karışım ısı (700 watt mikrodalga fırında yaklaşık 1 dakika için) bir mikrodalga fırın sadece kaynama kadar .
- Agaroz çözüm tüp, girdap karma çözüm ısıtılmış 2 × PBS ekleyin ve sıcak su beher sıcak tutmak.
- Mikropipet kemoatraktan 3 ul Hindistan mürekkep içeren 1.5 ml Eppendorf tüp kapağının içine çözümü (örneğin, CXC kemokin 1 mM WKYMVm MIP-2 veya 12 ul 0.5 mikrogram 10 ul) ve (kaçınmak mikropipet kullanarak aspirasyonu ile iyice karıştırın hava kabarcığı).
- 200-ul pipetlemeyin kapağının içine bir ucu ve agaroz çözeltisi (42 ° C) mikropipet 110 ul ucu sonu kesin ve hemen başka bir pipet (balonlu önlemek) kullanarak iyice karıştırın.
- Kemoatraktan içeren jel Mağaza +4 ° C
2. Cremaster'ın kas intravital Mikroskopi için hazırlanması (Şekil 1)
- 10 mg / kg xylazine ve 200 mg / kg ketamin hidroklorür karışımı bir ip enjeksiyon yoluyla bir yetişkin erkek fare anestezisi.
- Tıraş sağ eksternal juguler ven ve elektrikli tıraş makinesi ile skrotum ön yönü üzerinde alan. Anestezi sonrası, anestezi fare için özel bir dikkat ve bakım vermek önemlidir. Hipotermi fare önlemek için kullanılan bir ısı lambası olabilir. Fare ağrı refleks arındırılmış olmalıdır.
- Yatay bir kesi yapmak, bulmak ve 100 U / mL heparin tuzlu su ile dolu bir PE-10 tüp kullanarak juguler ven catheterize. Juguler ven kateterizasyonu, gerektiğinde ek anestezikler ve ilaçların yönetimi için gereklidir.
- Fare arka ayakları, fare, bir ev yapımı Cremaster'ın kas pansiyon (Şekil 1) yüz kadar yalan göbek bant ile sabitleyin.
- Cremaster'ın kas ve fare vücudu sıcak tutmak için 37 ° C su sirkülatör kurulu bağlayın.
Not: 2.6 'den 2.14 Tüm prosedürler, çok nazikçe 5 yapılmalıdır.
- Sol Cremaster'ın kas maruz skrotal deride bir kesi olun. Ilgili fasya kas dikkatlice disseke.
- 37 Cremaster'ın kas Superfuse ° C ısıtılmış bir peristaltik pompa kullanılarak (131,9 NaCl, 4.7 mM KCl, 1.2 MgSO 4, 20 NaHCO 3, pH 7.4) tuzlu bikarbonat-tamponlu.
- 4-0 dikiş Cremaster'ın kas kurulu açık görüş cam kaide üzerinde basılı tutun Cremaster'ın kas distal ucuna bağlayın.
- Boyuna Cremaster'ın kas dağlamak. 4-0 sütür ile, kas düz tutun ve kaide üzerinde kenarlarında güvenli. Altta yatan kas testis ve epididim ayrı ve karın boşluğuna taşıyın.
- ~ 37 ° C ısıtılmış perfüzyon tampon ile 0.6 ml / dak ve 22 ile açıkta kalan kas kapağı × 22 mm cam lamel kas Superfuse.
- Mikroskop sahnede Cremaster'ın kas kartı yerleştirin, mikroskop altında kas incelemek uygun bir postkapiller venule (düz ve dalsız ve normal kayma hızı ve çapı 25-40 mikron venule seçin) bulmak ve video kamera ayarlamak venule TV monitörü ya sol ya da sağ ucunda dik bir konumda görüntülenebilmekte izin vermek.
- 30 dakika denge sonra, bir video kaydedici kullanılarak bazal veri olarak 5 dakika süreyle seçilen postkapiller venule video görüntüleri kaydeder.
- Superfusion durdurun ve kas lamel kaldırmak.
- ~ 1 mm 3 boyutlu bir kemoatraktan içeren jel, önceden seçilmiş bir alanda 350 mikron Cremaster'ın kas yüzey üzerine yerleştirin ve paralel gözlenen postkapiller venule, lamel eklemek yerine jel tutun ve çok az kas dokusu superfuse yavaş yavaş piyasaya çıktı ve jel oluşan kemoatraktan bir degrade kurulmasına izin vermek için yavaş hızı (≤ 10 ul / dk).
- Kemoatraktan içeren jel ilave edildikten sonra 90 dakika video görüntü kaydetme. Kayıt sırasında, ayarlamak ve yapıştırma mikroskop odak tutmak, tarama transmigrating ve venule içinde ve kas dokusunda lökosit chemotaxing.
- Deney sonra, analiz için bir bilgisayar video dosyası almak.
3. ImageJ Kullanarak Hücre Takibi
- Bir bilgisayarda, özü ve AVI formatında (örneğin, AVI dosyası DVD video dönüştürmek için ücretsiz bilgisayar yazılımı bitRipper kullanmak) video dönüştürme.
- Zaman lapsed film üretmek için video düzenleme yazılımı kullanın. Örneğin, bir zaman lapsed film (1 / 512 veya 1 / 1024 'time-lapse olmak için, Windows Movie Maker birorijinal, gerçek zamanlı video t 30-fps oranı). Sıkıştırılmamış zaman lapsed film dönüştürme ve DV-AVI formatında kaydetmek.
- Aynı mikroskop ayarı altında kalibrasyon mikrometre görüntüleri kaydetme, görüntüleri bilgisayara aktarmak, ImageJ görüntüleri açmak. ImageJ, toplam piksel (örneğin, 720 × 480 piksel) ekran sol üst köşesinde görünür. X ve Y eksenleri (örneğin, 200 × 150 mm) hem ekranın boyutunu ölçün. Bu, mikron başına piksel (örneğin, x = 720/200 = 3.6 piksel / mm, ve y = 480 / 150 = 3.2 piksel / mm) sayısını hesaplamak.
- Film, açık ImageJ almak için tekrar "QT Film Açıcı" arayüz "Tamam" Dosya-İthalat-Quicktime Filmleri Plug-in ", analiz edilecek film seçin ve tıklayın.
- "Eklentiler Manuel İzleme" hücreleri izlemek için tıklayın. Başlangıç izleme önce alt alanlarına ilgili bilgileri doldurun. Kısaca,
- Zaman aralığı (sn) = fold-time-lapse/30 (Örneğin, 1020 × 1020 / 30 = 34 sn / kare aralığını zaman atlamalı olacaktır).
- x / y kalibrasyon = mikrometre görüntü kalibrasyon kullanarak mikron / piksel ölçümü.
- z kalibrasyon = 0 (fare Cremaster'ın kas doku ve hücre taramakta ve göç, son derece ince bir tabaka parlak alan transillüminasyon altında yaklaşık 2 boyutlu olduğu gibi).
- = 1 merkezleme kare boyutu ara.
- Nokta boyutu / Çizgi genişliği / Yazı boyutu: Gerekirse ayarlanabilir.
- Bir referans noktası olarak istikrarlı ve net bir nokta seçin. Bu referans noktası, bütün deney boyunca değişmemiş ve sabit kalır herhangi bir açık ve küçük yapısal noktası olabilir. Son kareye ilk referans noktası izlemek ve "End Parça" düğmesini tıklayın ve "Parça Ekle" seçeneğini tıklatın. Veriler otomatik olarak sonuçlar tablo görünür.
- Nötrofil tarama ve göç takip tek tek tıklamayla her çerçeve içinde ortadan kaybolması, doku görünümünü, hücre izlemek ve Microsoft Excel sonuçları tamamlamak ve kaydetmek için "End Track" tıklayın ve "Parça Ekle".
4. Nötrofil İşe Alım Parametrelerinin Analizi
- Microsoft Excel dosyasını açın ve verileri analiz (referans noktası değişiklikleri analiz içine almak).
- Intraluminal sürünerek
- Mesafe Crawling: toplam mesafe hücre optimal göçüne sitesi (mikron) ilk yapışık sitesinden lümen tarar.
- Hız Crawling: uzaktan / saat (mm / dk) tarama.
- Transendoteliyal göç
- Göçüne zaman: hücre, tüm hücre vücut venule dışında hiçbir hücre gövdesi ve lümen (dak veya sn) görülebilir zaman zaman endotel boyunca başka yere başlar zaman.
- Dekolmanı zaman zaman tüm hücre gövdesi, hücre venule (kuyruk retraklar) (dak veya sn) ile teması kesildiğinde, o zaman noktası âlemden sonra (hemen) venule hemen dışında.
- Doku içinde Kemotaksis
- Göç mesafesi: başlangıç noktasından doku içinde göç bitiş noktası (mikron) hücre hamle mesafe toplamı.
- Göç hızı: doku / saat göç mesafesi (mm / dk).
- Kemotaksis mesafesi: miktar mesafe hücre, doku x-ekseni (mikron) geçirir.
- Kemotaksis hızı: kemotaksis uzaktan / saat (mm / dk).
- Kemotaksis göstergesi: doku içinde göç mesafesi kemotaksis mesafe bölme oranı.
5. Temsilcisi Sonuçlar:
Bightfield intravital mikroskopi lökosit-endotel hücre etkileşimleri çalışma için kullanılır ve nötrofiller için mutlaka olmayabilir rağmen, histoloji çalışmaları, işe hücrelerinin% 95 daha fazla nötrofil kemoatraktan tedavi Cremaster'ın kasları gerçekten nötrofil, doğruladı . Bu raporda, nötrofil seçici chemoattractants kullanarak, in vivo olarak nötrofil işe izleme prosedürleri sunuyoruz. Özellikle, biz nötrofil intraluminal sürünerek izleme, transendoteliyal göç ve zaman atlamalı intravital video mikroskopi ve ImageJ kullanarak anestezi farelerde Cremaster'ın kas dokusu kemotaksis bir protokol açıklar. Cremaster'ın kas kemoatraktan içeren agaroz jel yavaş kemoatraktan bültenleri ve kemoatraktan degrade doku kurulacak sağlar. Nötrofil kemoatraktan farelerde kremasterik postkapiller venüller nötrofil-endotelyal hücre etkileşimleri neden olur. Bütün deney dik bir aydınlık intravital mikroskop altında bir TV monitörü renkli video kamera tarafından projelendirilen ve video kaydedici tarafından kaydedilen video görüntüleri ile birlikte görüntülenmiştir. Biz nötrofil tespitintraluminal sürünerek, transendoteliyal göç ve göç ve yanıt olarak kas dokusunda kemotaksis kemoatraktan MIP-2 nötrofil ve WKYMVm agaroz jel hazırlanan (Şekil 2). MIP-2 (0.5 mcM) ve (0.1 mM) WKYMVm neredeyse karşılaştırılabilir süre, nötrofil göçü ve kas dokusunda kemotaksis venule benzer hızı, nötrofil transendoteliyal göç ve dekolmanı nötrofil intraluminal sürünerek yol açtığını bulundu benzer nötrofil kemotaksisini indeksleri (P> 0.05, Student t testi) ile aynı hız ve.
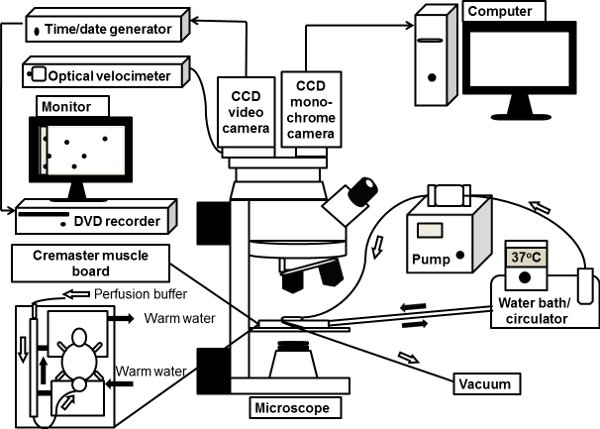
Şekil 1 intravital bir mikroskop sistemi şematik çizimde. Fare Cremaster'ın kas mikroskop sahnede Cremaster'ın kas kurulu açık görüş kaide üzerinde exteriorized ve 37 ° C ısıtılmış bikarbonat-tamponlu salin ile superfused. Dik mikroskop, aydınlık intravital mikroskopi için bir CCD renkli video kamera ile bağlanmıştır. Monokrom derin soğutmalı CCD dijital kamera da, floresan intravital mikroskopi için mikroskop portuna bağlı, görüntülerin hangi doğrudan bir bilgisayar tarafından işlenir.
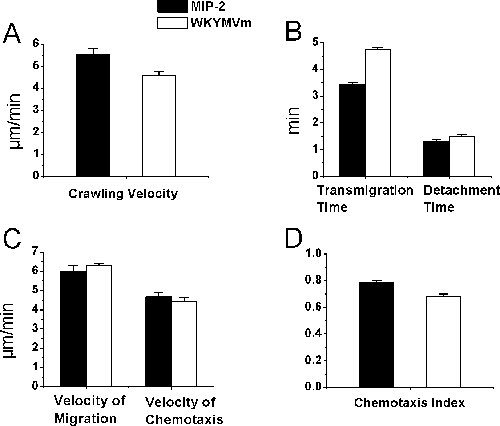
Şekil 2 aydınlık intravital mikroskopi Nötrofil işe parametreleri. Nötrofil göçünü agaroz jel hazırlanmasında MIP-2 veya WKYMVm postkapiller venule bitişik 350 mikron yerleştirilir nötrofil kemoatraktan kademeli olarak salınımı ile sağlandı. Zaman lapsed video veri deney gerçek zamanlı video kayıt işlendikten sonra ImageJ tarafından analiz edildi. Nötrofil intraluminal sürünerek Cremaster'ın kas (D) (A), âlemden zaman ve dekolmanı (B), doku içinde göç hızı ve kemotaksis hızı (C), ve kemotaksis indeksi, MIP-2 veya WKYMVm agaroz jel üzerinde uygulandıktan sonra belirlendi C57BL / 6 farelerde Cremaster'ın kas (n = 3, # paletli hücrelerinin = 22 (A ve B) ve 27 (C ve D) sırasıyla MIP-2 = 26 (A ve B) ve 44 ( WKYMVm sırasıyla C ve D)).
Tartışmalar
Intravital mikroskopi inflamasyon sırasında lökosit işe hücresel ve moleküler mekanizmaları ifşa ettiği için önemli bir araçtır. Cremaster'ın kas ve mezenter gibi saydam dokuların mikrodolaşımını lökosit-endotel hücre etkileşimleri tayini için nicel görselleştirme 1,5 tekniğini uygulama için altın standart olmaya devam etmektedir. Geleneksel aydınlık intravital mikroskopi birçok benzersiz teknik özelliklere sahip ve bu dokularda ortaya çıkan işe alma mekanizmaları i...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, Kanada Sağlık Araştırma Enstitüsü (CIHR, MOP-86.749) bir araştırma hibe ile desteklendi. L. Liu CIHR Yeni Araştırmacı Ödülü (MSH 95.374) bir alıcı.
Malzemeler
Tablo: Malzemeler, Özel Reaktifler ve Ekipmanları
| Reaktif / ekipman Adı | Şirket | Katalog numarası | Yorumlar |
| Polietilen boru, PI10 | Becton Dickinson | 427401 | ID 0.28mm x OD 0.61mm |
| Çini mürekkebi | Speedball Sanat | Süper Siyah | % 100 karbon siyah pigment-hayır boyalar |
| Dağlama | Aaron Medical | AA03 | |
| Xylazine | Bayer HealthCare, Bayer Inc. | DIN 02169592 | |
| Ketamin hidroklorür | Bioniche Hayvan Sağlığı Kanada, Inc. | DIN 01989529 | |
| Murin rekombinant MIP-2 | Ar-Ge Sistemleri | 452-M2 | |
| WKYMVm | Phoenix Pharmaceuticals, Inc. | 072-12 | |
| Agaroz | Invitrogen | 15510-027 | Ultrasaf |
| Heparin | Sigma | H-3393 | |
| Dik mikroskop | Olympus | BX61WI | |
| 3CCD renkli video kamera | SONY | DXC-990 | |
| HD-DVD video kaydedici | LG Electronics Inc. | RH398H-M | |
| TV monitörü | LG Electronics Inc. | 22LG30 | |
| Su sirkülatör | Thermo Scientific | HAAKE DC10 | |
| Peristaltik pompa | Gilson; Pharmacia | Gilson MINIPULS 3; Pharmacia P-3 | |
| Cremaster'ın kas kartı | University of Saskatchewan | Ev yapımı |
Referanslar
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır