このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生体内ビデオ顕微鏡による組織内好中球腔内クロールを追跡、経内皮移動と走
要約
我々は、in vivoでの好中球走化性因子のソースに対応して好中球動員中に動的な好中球 - 内皮細胞の相互作用を測定するための明生体顕微鏡検査のプロトコルを記述する。好中球内腔クロール、マウス精巣挙筋の組織の経内皮移動と走化性は、時間の経過したビデオ撮影すると、ImageJで追跡と視覚化されます。
要約
血流から炎症組織への循環白血球の動員は、炎症の1,2の重要かつ複雑なプロセスです。炎症組織のpostcapillary細静脈では、細静脈壁の内腔表面に最初にテザーとロールを白血球。内皮に白血球の逮捕を圧延し、細静脈の表面のケモカインまたは他の化学誘引物質に応答して、強固な接着を受ける。多くの接着白血球が接着の初期のサイトから内皮の接合部の血管外漏出のサイトに移転、プロセスが3クロール腔内と呼ばれる。クロールに続いて、白血球は内皮上を移動(移住)と誘引物質のソース(走化性)4に向かって血管外組織に移行する。生体顕微鏡は、 生体内で白血球-内皮細胞の相互作用を可視化し、白血球動員2,5の細胞および分子メカニズムを明らかにするための強力なツールです。このレポートでは、我々は、好中球走化性因子の勾配に応答してマウス精巣挙筋の好中球動員の詳細なプロセスを視覚化し、決定するために明生体顕微鏡を用いての包括的な説明を提供しています。好中球動員、好中球走化MIP - 2(CXCL2、CXCケモカイン)またはWKYMVm(TRP -リジン-チロシン- VAL - D - Metは、合成アナログを含むアガロースゲルの小片(〜1 mmの3サイズ)を誘導する細菌ペプチドの)観測postcapillary細静脈に隣接した筋肉組織に配置されます。時間経過したビデオの撮影とコンピューターソフトImageJのと、好中球内皮上腔クロール、好中球内皮遊走や組織におけるマイグレーションと走化性を可視化し、追跡されます。このプロトコルは、管腔内クロール速度、移住の時、剥離の時間、移動速度、組織における走化性の速度と走化性指数などの多くの好中球動員のパラメータの信頼性と定量分析が可能になります。我々は、このプロトコルを使用して、これらの好中球動員のパラメータが安定的に決定され、単一の細胞移動が便利にin vivoで追跡することができることを示している。
プロトコル
1。アガロースゲルでの誘引物質の調製
- ピペット10 50 - mLコニカルチューブに2 × PBSの添加、および熱水を入れたビーカーに入れておくことによりチューブのウォームアップを行います。
- ピペット10の蒸留水を加えて、別の50 mLコニカルチューブに0.4 Gアガロースの粉末を加える(少し緩め、キャップ付き)、混合物を加熱(700ワットの電子レンジで約1分間)電子レンジのちょうど沸騰するまで。
- アガロース溶液のチューブ、渦混合溶液に加温し、2 × PBSを追加し、お湯のビーカーに、冷えないように保管してください。
- マイクロピペットを用いて吸引しても3μlのインドのインクと混合を含む1.5 mLのエッペンドルフチューブの蓋に、マイクロピペット走化性溶液(例えば、CXCケモカインMIP - 2または1 mM WKYMVmの12μlの0.5μgの10μlのは)(避ける空気の泡)。
- 蓋に200μlのピペットチップおよびアガロース溶液(42 ° C)のマイクロピペット110μlの先端をカットし、すぐに別のピペットチップを(空気の泡を避けるため)を使用してよく混ぜる。
- +4化学誘引物質含有ゲル℃にて保存してください。
2。生体顕微鏡検査のための精巣挙筋の調製(図1)
- 10 mg / kgのキシラジン、200 mg / kgの塩酸ケタミンの混合物の腹腔内注射による成熟雄性マウスを麻酔。
- 右外頸静脈と電気かみそりと陰嚢の前面を覆う領域を剃る。麻酔後、麻酔マウスに特別な注意とケアを提供することが重要です。ヒートランプは低体温症からマウスを防止するために使用されることがあります。マウスは、痛みの反射のない状態にしてください。
- 水平方向の切開を行う、100 U / mLのヘパリンの生理食塩水で満たされたPE - 10チューブを使用して頚静脈を見つけて、カテーテルを挿入する。必要な時に頸静脈のカテーテル挿入は、追加の麻酔薬や薬の投与のために必要です。
- マウスは、ホームメイドの精巣挙筋板(図1)に表向きに横たわっていると臍テープでマウスの後ろ足を修正。
- 精巣挙筋とマウスの体を暖かく保つために37℃の水循環にボードを接続する。
注:2.6から2.14までのすべての手順は非常に穏やかに5を実行する必要があります。
- 左精巣挙筋を露出するために陰嚢皮膚に切開を加えます。慎重に関連付けられている筋膜から筋肉を細かく分析。
- ° Cに加温した蠕動ポンプを用いて(131.9のNaCl、4.7 KClを、1.2のMgSO 4、20mMの中のNaHCO 3を 、液、pH7.4)生理食塩水重炭酸緩衝化37で精巣挙筋の表面かん流する。
- 精巣挙筋板の透明な観覧のガラスの台座の上にそれを保持するために精巣挙筋の遠位端に4から0縫合糸を結びます。
- 縦方向に精巣挙筋を焼灼する。 4から0縫合糸で、筋肉のフラットを保持し、台座のエッジに沿って固定します。基本となる筋肉から睾丸と精巣上体を分離し、腹腔内にそれらを移動する。
- 37 ° Cに加温した灌流バッファ付き〜0.6 ml /分で筋肉を表面かん流すると22 × 22 mmのカバーガラスで露出筋肉をカバー。
- 、顕微鏡のステージ上で精巣挙筋のボードを置き、顕微鏡で筋肉を調べ、適切なpostcapillary静脈を(ストレートおよび非分岐であり、通常のせん断速度25〜40ミクロンの直径を有する細静脈を選択して)検索して、ビデオカメラを調整する細静脈は、テレビモニターの左右どちらかの端に垂直位置に可視化できるようにする。
- 30分の平衡した後、ビデオレコーダーを使用してベースラインの制御データとして、5分間選択postcapillary細静脈のビデオ画像を記録する。
- 灌流を停止し、筋肉でカバーを取り外します。
- 350μmであるから、事前に選択されたエリアでの精巣挙筋の表面上に約1 mmの3サイズの化学誘引物質を含むゲルを置き、平行観測postcapillary細静脈に、代わりにゲルを保持するためにカバースリップを追加し、非常に筋肉組織を表面かん流する徐々に解放され、ゲルから形成される走化性因子の勾配の確立を可能にするために遅い速度(≤10μL/分)。
- 化学誘引物質を含むゲルの添加後90分間のビデオ画像を記録する。録音中は、静脈内および筋肉組織の白血球をtransmigratingとchemotaxing、クロール、付着に関する顕微鏡のフォーカスを調整してください。
- 実験後、解析のためのコンピュータにビデオファイルをインポートします。
3。 ImageJを用いた細胞の追跡
- コンピュータ上で、抽出して、AVI形式(例えば、AVIファイルにDVDビデオを変換する無料のコンピュータソフトウェアのbitRipperを使用)にビデオを変換します。
- 時間が経過した動画を生成するためのビデオ編集ソフトウェアを使用してください。例えば、時間が経過した動画を(1 / 512または1024分の1の時間経過のためにWindowsムービーメーカーを使用してくださいオリジナルの、リアルタイムのビデオからT 30 - fpsレート)。 DV - AVI形式に圧縮されていない時間が経過した動画を変換して保存。
- 同じ顕微鏡の設定でキャリブレーションマイクロメートルの画像を記録し、コンピュータに画像をインポートし、ImageJので画像を開きます。 ImageJのでは、総ピクセルが画面の左上(例えば、720 × 480ピクセル)に表示されます。 X軸とY軸(例えば、200 × 150μm)の両方で画面の大きさを測定します。このことから、ミクロンあたりのピクセル(例えば、X = 200分の720 = 3.6ピクセル/μmの、およびy = 150分の480 = 3.2ピクセル/μm)の数を計算する。
- 再び映画、オープンImageJをインポートするには、"ファイル - インポート - 使用して、QuickTimeムービープラグイン"をクリックして、分析するムービーを選択し、"QTムービーの開閉"のインタフェースで"OK"をクリックします。
- 細胞を追跡するために、"プラグイン - マニュアルトラッキング"をクリックしてください。開始トラッキングの前に下部にあるフィールドに関連する情報を入力してください。簡単に言えば、
- 時間間隔(秒)= fold-time-lapse/30(例えば、1020 ×タイムラプス= 34秒/フレームの間隔を1020から1030になる)。
- x / yのキャリブレーション=マイクロメートルの画像のキャリブレーションを使用してμm/ピクセル測定。
- Z校正= 0(マウス精巣挙筋は組織や細胞のクロールと移行の非常に薄い層であるとして明視野透視下で約2Dです)。
- センタリング= 1の正方形のサイズを検索します。
- ドットサイズ/線幅/フォントサイズ:必要に応じてそれらを調整することができます。
- 基準点として、安定かつ明瞭なポイントを選択します。この基準点は、全実験を通じて変化と安定している明確な、小さな構造のポイントになります。最後のフレームに最初から基準点を追跡し、"終了トラック"をクリックして"トラックを追加"をクリックします。データは自動的に結果表に表示されます。
- 好中球をクロールし、移行を追跡一つずつ:クリックすると、各フレームにおけるその消失する組織において、その外観から細胞を追跡し、Microsoft Excelでの結果を終了して保存するには"終了トラック"をクリックして"トラックを追加"。
4。好中球リクルートパラメータの解析
- Microsoft Excelで結果のファイルを開き、(分析に基準点の変更を行う)、データを分析する。
- 腔内クロール
- 距離をクロール:合計距離はセルが最適な移住地(μm)に初期接着部位から内腔にクロール。
- クロール速度:クロールの距離/時間(μm/分)。
- 経内皮移動
- 移住の時間:セル全体の細胞体は、細静脈の外側だけであるとは細胞体が内腔(分または秒)で見られない時の時間に内皮を越え転生するために開始時間から。
- 剥離は時間:時から全体の細胞体は単なる静脈外にある(すぐに移住後の)時点にセルが細静脈(尾部が縮んだ状態)(分または秒)との接触を失う。
- 組織の走化性
- 移行距離:距離の和開始点から組織のマイグレーション(μm)のエンドポイントへの細胞移動。
- 移行の速度:組織/時間の移動距離(μm/分)。
- 走化性の距離:距離のセルの合計は、組織におけるx軸(μm)で移行。
- 走化性の速度:走化性の距離/時間(μm/分)。
- 走化性指数:組織の移動距離で走化性の距離を分割する比率。
5。代表的な結果:
bightfield生体顕微鏡が白血球 - 内皮細胞相互作用の研究のために使用されており、好中球のために、必ずしもではないかもしれないが、我々は組織学的研究によって、好中球走化性処理精巣挙筋の動員細胞の95%以上が実際に好中球であったことが確認。このレポートでは、好中球選択的誘引物質を使用して、我々はin vivoでの好中球の動員を追跡する手順を紹介します。具体的には、トラッキング好中球腔内クロール、経内皮移動、およびタイムラプス生体内ビデオ顕微鏡とImageJを用いて麻酔したマウスの精巣挙筋の組織における走化性のプロトコルを記述する。精巣挙筋上に化学誘引物質含有アガロースゲルは、徐々に化学誘引物質を放出し、走化性勾配が組織に確立することができます。好中球の走化性因子は、マウスの精巣挙筋postcapillary細静脈における好中球 - 内皮細胞の相互作用を誘導する。全体の実験では、テレビモニターにカラービデオカメラで投影し、ビデオレコーダで記録されたビデオイメージを持つ正立明生体顕微鏡下で可視化です。我々は、好中球を決定アガロースゲル(図2)で調製した化学誘引物質MIP - 2とWKYMVmを好中球への応答における筋肉組織の内腔クロール、経内皮移動と移行し、走化性。我々は、MIP - 2(0.5μMで)とWKYMVmが(0.1 mmで)ほぼで同等の時間の長さは、好中球の遊走および筋肉組織における走化性のための静脈から同じような速度、好中球内皮遊走および剥離時に好中球腔内クロールを引き出したことがわかった同じ速度および同じような好中球の走化性のインデックスを持つ(P> 0.05、スチューデントt検定)。
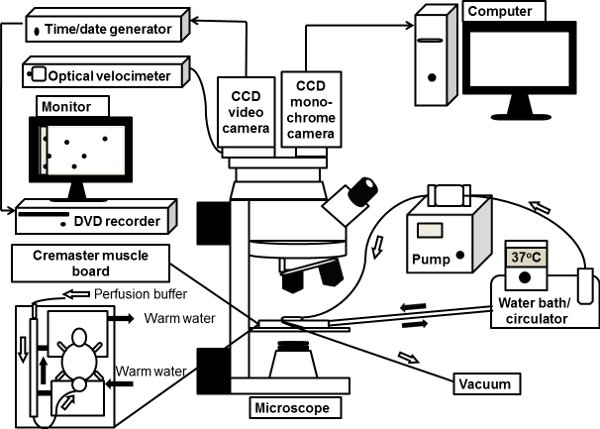
図1。生体顕微鏡システムの概略図。マウス精巣挙筋は、顕微鏡ステージ上で精巣挙筋板の透明な観覧の台座の上に体外と37℃に加温した重炭酸塩緩衝食塩水で灌流される。正立顕微鏡は、明視野生体顕微鏡用CCDカラービデオカメラと接続されています。モノクロ深い冷却CCDデジタルカメラも蛍光生体顕微鏡用顕微鏡のポートに接続され、イメージはそこから直接コンピュータによって処理されます。
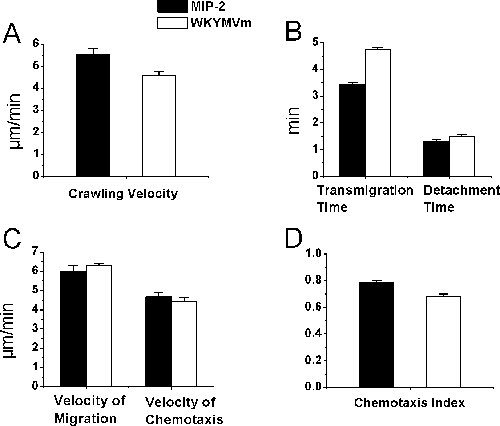
明生体顕微鏡の図2。好中球動員のパラメータ。好中球の動員は、アガロースゲルの準備のMIP - 2またはWKYMVmがpostcapillary細静脈に隣接350μmであるが置かれた好中球の走化性因子が徐々に放出によって誘発された。時間経過ビデオデータは、実験のリアルタイムのビデオ録画を処理した後、ImageJのによって分析した。精巣挙筋(D)における好中球内腔クロール()、移住の時間と剥離の時間(B)、組織の移動速度と走化性の速度(C)、および走化性の指数は、MIP - 2またはWKYMVmアガロースゲル上での投与後に測定したC57BL / 6マウスの精巣挙筋(n = 3の、#追跡セルの= 22(AとBで)、27(CおよびDで)それぞれMIP - 2の、と= 26(AとB)、44( WKYMVmため、それぞれCとD)で)。
ディスカッション
生体顕微鏡検査は、炎症時に白血球動員の細胞および分子メカニズムを明らかにするための不可欠なツールです。このような精巣挙筋および腸間膜としてtransluscent組織の微小血管系における白血球-内皮細胞の相互作用を測定するための定量的可視化は、技術1,5のアプリケーションのためのゴールドスタンダードのまま。従来の明視野生体顕微鏡は、多くのユニークな技術的特徴を有?...
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、カナダ衛生研究所(CIHR、MOP - 86749)から研究助成金によってサポートされていました。 L. LiuはCIHR新奨励賞(MSH - 95374)の受信者です。
資料
表:材料、具体的な試薬および器具
| 試薬/装置の名前 | 会社 | カタログ番号 | コメント |
| ポリエチレンチューブ、PE10 | ベクトンディッキンソン | 427401 | ID 0.28ミリメートル×外径0.61ミリメートル |
| インドインク | スピードボールアート | スーパーブラック | 100%のカーボンブラック顔料、無色素 |
| 焼灼 | アーロンメディカル | AA03 | |
| キシラジン | バイエルヘルスケア社、バイエル(株) | DIN 02169592 | |
| 塩酸ケタミン | Bionicheアニマルヘルスカナダ、(株) | DIN 01989529 | |
| マウス組換え型MIP - 2 | R&Dシステムズ | 452 - M2 | |
| WKYMVm | フェニックスファーマシューティカルズ | 072から12 | |
| アガロース | インビトロジェン | 15510-027 | 超高純度 |
| ヘパリン | シグマ | H - 3393 | |
| 正立顕微鏡 | オリンポス | BX61WI | |
| 3CCDカラービデオカメラ | SONY | DXC - 990 | |
| HD - DVDビデオレコーダー | LG電子(株) | RH398H - M | |
| テレビモニター | LG電子(株) | 22LG30 | |
| 水循環装置 | サーモサイエンティフィック | HAAKEのDC10 | |
| 蠕動ポンプ | ギルソン;ファルマシア | ジルソンMINIPULS 3;ファルマシアP - 3 | |
| 精巣挙筋板 | サスカチュワン州の大学 | 自家製の |
参考文献
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved