A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطبيق MassSQUIRM لقياسات كمية من نشاط Demethylase ليسين
In This Article
Summary
نحن نقدم طريقة لاستخدام MALDI قياس الطيف الكتلي والاختزالية الكيمياء مثيلة لقياس التغيرات في مثيلة ليسين.
Abstract
مؤخرا، تم اكتشاف المنظمين جينية واللاعبين الرئيسيين في العديد من الأمراض المختلفة 1-3. ونتيجة لذلك، هذه الانزيمات من الاهداف الرئيسية لدراسات جزيء صغير والمخدرات 4 التنمية. المنظمين جينية كثيرة في الآونة الأخيرة فقط تم اكتشاف و لا تزال في طور تصنيفها. من بين هذه الانزيمات هي demethylases ليسين التي إزالة مجموعات الميثيل من lysines على histones والبروتينات الأخرى. نظرا لطبيعة رواية من هذا النوع من الانزيمات، وقد وضعت بعض المقايسات لدراسة نشاطها. وكان هذا كتلة الطريق إلى تصنيف كل من وعالية الإنتاجية من الدراسة demethylases هيستون. حاليا، المقايسات demethylase عدد قليل جدا من الوجود. تلك التي لا توجد تميل الى ان تكون ذات طابع نوعي، ولا يمكن تبين في وقت واحد بين الولايات مثيلة ليسين مختلفة (الامم المتحدة، أحادي، ثنائي وثلاثي). ويشيع استخدام الطيف الكتلي لتحديد نشاط demethylase ولكن هل الحالي المقايسات الطيفي الشامللا تتناول ما إذا الببتيدات ميثليته تفاضلي تأين بشكل مختلف. التأين الفرق من الببتيدات ميثليته يجعل من الصعب المقارنة بين الولايات مثيلة وبالتأكيد ليس كمي (الشكل 1A). وبالتالي ليست الأمثل المقايسات المتاحة لتحليل شامل للنشاط demethylase.
نحن هنا وصف طريقة تسمى MassSQUIRM (تحديد الكميات الطيفي الشامل باستخدام مثيلة الاختزالية النظائر) والتي تقوم على مثيلة الاختزالية للجماعات أمين مع الفورمالدهيد deuterated لاجبار جميع lysines ليكون ثنائي ميثليته، مما يجعلها أساسا الأنواع الكيميائية نفسها، وبالتالي تأيين نفس (الشكل 1B). الفرق الكيميائية فقط بعد مثيلة الاختزالية هو الهيدروجين والديوتيريوم، الذي لا يؤثر على الكفاءة التأين MALDI. الفحص MassSQUIRM غير محددة لمنتجات التفاعل مع demethylase lysines الامم المتحدة، أحادية أو ثنائي ميثليته. الفحص ينطبق أيضا على methyltransferases يسين إعطاء SAلي منتجات التفاعل. هنا، ونحن نستخدم مزيج من الكيمياء مثيلة الاختزالية وMALDI مطياف الكتلة لقياس نشاط LSD1، وهو demethylase يسين قادر على إزالة ثنائي وأحادي الميثيل الجماعات، على ركيزة الببتيد الاصطناعية 5. هذا الفحص بسيط وقابلة بسهولة إلى أي مختبر مع الوصول إلى مطياف الكتلة MALDI في المختبر أو من خلال مرفق البروتيوميات. الفحص له ~ 8 أضعاف نطاق الدينامية وغير قابلة للتطوير بسهولة على شكل لوحة 5.
Protocol
يتم تعديل هذا البروتوكول من بلير وآخرون. 6.
1. LSD1 نزع الميثيل الفحص
- في الحجم النهائي من 20 ميكرولتر، والجمع بين 125 نانوغرام LSD1 المؤتلف مع 0.25 ميكروغرام ثنائي الميثيل الببتيد H3 هيستون (ARTKme2QTARKSTGGKAPRKQLYK، البيوتين) في المخزن demethylase (50 ملم تريس، الكلور الرقم الهيدروجيني 8.5، 50 ملي بوكل، 5 مم MgCl 2، 5٪ الجلسرين). بالإضافة إلى ذلك، إجراء مراقبة الببتيد وحده لا الانزيم. عنصر التحكم للباب 3 وليس بحاجة مثيلة الاختزالية.
- احتضان لمدة 2 ساعة على 37 درجة مئوية.
- لجمع الببتيدات، إضافة 8 R2 بوروس ميكرولتر الخرز ميكرون 20 إلى كل عينة، وتستنهض الهمم لمدة 15 دقيقة في درجة حرارة الغرفة. تعد حبات بوروس من خلال تعليق 1 حجم من الخرز مع 1 حجم من الميثانول، ومن ثم إضافة 10 مجلدا من حمض الفورميك 5٪ / TFA 0.2٪.
- حالة 2 C 18 ZipTips بواسطة الشفط 20 ميكرولتر من TFA 0.1٪ في رأس ودفع مرة أخرى خارجا مع pipettor. فعل هذا مرتين مع تي 0.1٪اتحاد كرة القدم، أربع مرات مع الأسيتونيتريل 70٪ / TFA 0.1٪، وأربع مرات مرة أخرى مع TFA 0.1٪.
- تحميل العينتين (مراقبة وردود الفعل demethylase) على ZipTips C 18 مكيفة بواسطة pipetting الطين حبة وراء الراتنج C 18 في ZipTips ودفع من خلال حجم مع pipettor.
- غسل ZipTips مرتين مع 20 ميكرولتر من TFA 0.1٪.
- أزل في 40 ميكرولتر من الأسيتونيتريل 70٪ / TFA 0.1٪.
- Lyophilize كل eluant تماما مع مكثف SpeedVac.
2. الاختزالية مثلأيشن
يتم تعديل هذا الجزء من البروتوكول من بلير وآخرون. وRayment وآخرون. 6،7.
- اعادة تعليق على رد فعل demethylase في 100 ميكرولتر من 50 ملي العازلة الفوسفات ودرجة الحموضة 7.4.
- في رد فعل demethylase، إضافة 8 ميكرولتر من 15 ملغ / مل ثنائي ميثيل أمين borane. يذوب Borane ثنائي ميثيل أمين في 50 ملي العازلة الفوسفات ودرجة الحموضة 7.4، لإعطاء 15 ملغ / مل حل الأوراق المالية.وينبغي بذل هذا الطازجة.
- في رد فعل demethylase، يضيف 16 ميكرولتر من الفورمالديهايد 250 مم deuterated. يتم تحضير 250 ملم الفورمالديهايد deuterated بواسطة تمييع الأوراق المالية في H 2 0. وينبغي بذل هذا الطازجة.
- احتضان في 4 درجة مئوية لمدة 2 ساعة.
- كرر الخطوات من 2.2 و 2.3 و 2.4.
- كرر الخطوة 2.2.
- احتضان عند 4 درجة مئوية لمدة 15 ساعة ~.
- لعينة demethylase، إضافة 12.5 ميكرولتر من تريس 1M، ودرجة الحموضة 7.4 إلى إخماد رد فعل مثيلة الاختزالية.
3. MALDI قياس الطيف الكتلي
- إضافة بوروس الخرز R2 ميكرون 20 إلى رد فعل demethylase، وجمع في ZipTips كما هو موضح في الخطوات 1،3-1،6.
ملاحظة: اعادة تعليق التحكم في 100 ميكرولتر من 50 ملي العازلة الفوسفات ودرجة الحموضة 7.4 وعلاج مثل عينة أخرى بدءا من الخطوة 3.1.
- أزل الرقابة وعينات من رد فعل demethylase ZipTips على طبق من ذهب عينة MALDI باستخدام 2 ميكرولتر من 33٪ تشبعد 2،5-dihydroxybenzoic حامض. لإعداد 33٪ حمض 2،5-dihydroxybenzoic، جعل محلول مشبع من 2،5-dihydroxybenzoic حامض في الأسيتونيتريل 70٪ / TFA 0.1٪ ومن ثم تمييع إلى 33٪ في الأسيتونيتريل مشبعة 70٪ / TFA 0.1٪. السماح للعينات مزال حتى يجف وبلورة.
- جمع أطياف الشامل باستخدام مطياف الكتلة PerkinElmerSciex MALDI-prOTOF أو متاح عالية الدقة MALDI مطياف الكتلة 8،9،10.
- عرض الأطياف واستخراج المناطق الذروة باستخدام PerkinElmerSciex TOFworks البرنامج أو البرامج المقدمة من قبل الشركة المصنعة مطياف الكتلة.
- تحقق من المنتجات رد فعل من قبل MS 2 مع نظام الإعلام المتاحة الطيفي توفير قدرات الشامل جنبا إلى جنب الطيفي.
4. تحليل البيانات
- من أجل التعويض عن التداخل النظائر التي تم إنشاؤها باستخدام الفورمالدهيد الثقيلة (الشكل 1B)، وتحديد منطقة ذروة (أ) نسبة 13 C 2 و 13 C اقاربهم النظائر 4ه إلى ذروة monoisotopic لعينة السيطرة، والتي لم يمر مثيلة مختزلة (الشكل 2A).
مكافئ 1: 13C2 / A 12C = R 1
مكافئ 2: 13C4 / A 12C = ص 2
هذا وسوف أعطيك نسبة الببتيد الموجودة في هذه الدول النظائر (ص 1 و ص 2) محددة لتجربتك ومطياف الكتلة. - استخدام R 1 و R 2 القيم في الصيغ التالية لقياس القيمة النسبية من الببتيد الموجودة في كل ولاية تعديل في العينة رد فعل demethylase (الشكل 2B):
مكافئ 3: H3K4me2 = A 1
مكافئ (4): H3K4me = A 2 - ص 1 (A 1)
مكافئ 5: H3K4 = A 3 - ص 2 (A 1) - [ص 1 (A 2 - ص 1 (A 1))]
5. ممثل النتائج
باستخدام LSD1، وتبين لنا مدى فعالية MassSQUIRM لقياسيسين نزع الميثيل. أجرينا كما هو موضح في القسم نص البروتوكول، وفحص demethylase مع 125 نانوغرام من LSD1 و 0.25 ميكروغرام ثنائي الميثيل هيستون H3 الببتيد (ARTKme2QTARKSTGGKAPRKQLYK، البيوتين). وتعرض لسيطرة وعينات رد فعل demethylase إلى مثيلة الاختزالية وMALDI قياس الطيف الكتلي. وأظهرت ردود الفعل الرقابة التي لم يخضع مثيلة الاختزالية المغلف نموذجي النظائر لهذا الببتيد، وقدمت المناطق الذروة لمعادلات 1 و 2 (الشكل 2A). قدمت الطيف الكتلي للتفاعل demethylase مناطق الذروة لمعادلات 3-5 (الشكل 2B). باستخدام مناطق الذروة من الرقابة ورد فعل demethylase، توصلنا إلى أن LSD1 demethylated الببتيد لإعطاء رد فعل المنتجات التالية: 33.7٪ ثنائي الميثيل Lys4، 42.3٪ أحادية الميثيل Lys4، و 24٪ من الامم المتحدة وميثليته اليس 4. الرجوع إلى بلير وآخرون. لتحليل كامل للنشاط LSD1 demethylase فضلا عن دراسات المانع 6. لاحظ أن تغيير المتغيرات مثل انزيم، وقت رد الفعلوسوف تركز والركيزة تركيز إتاحة الفرصة لإجراء تحليل متعمق للنشاط.

الشكل 1. MassSQUIRM نظرة عامة. (A) وأظهر الببتيد N-محطة من H3 هيستون بأنها الامم المتحدة (الأخضر)، أحادية (الحمراء)، أو ثنائي (الأزرق) في ليسين ميثليته 4. الاختلاف في التركيب الكيميائي للكل الببتيد يؤدي إلى التأين الفرق جعل مجمع الكمي. (ب) مثيلة انتقاصية تحويل جميع مخلفات يسين للدولة ثنائي الميثيل والذي يسبب كل الببتيدات لتأيين بالمثل. استخدام الفورمالدهايد الثقيلة في رد فعل مثيلة الاختزالية يسمح الإبقاء على هوية مثيلة الأصلي. الدوائر المفتوحة تشير مثيلة ضوء في حين تشير الدوائر المغلقة مثيلة الثقيلة. التعديل من بلير وآخرون 6 2011.
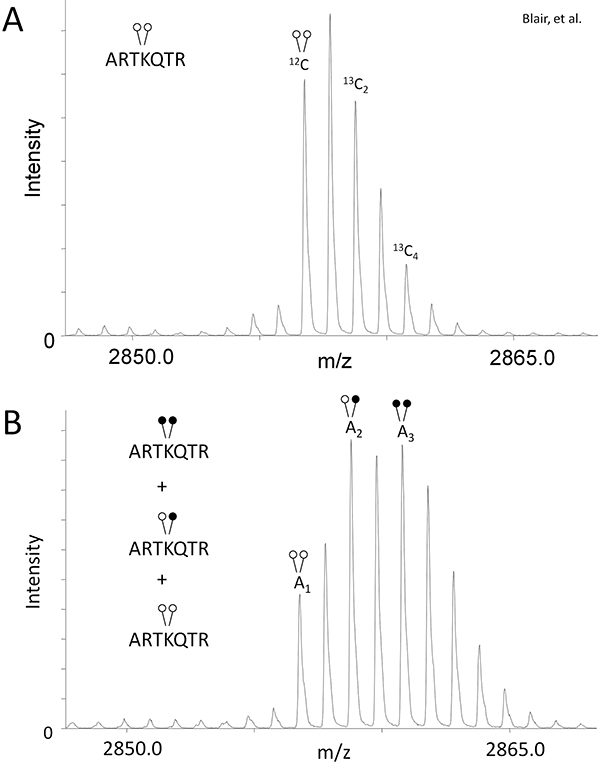
الارقام ..ويمكن استخدام ه 2. MassSQUIRM لتحديد الببتيد ميثليته تفاضلي. (أ) تم تحليل وثنائي ميثليته الاصطناعية هيستون H3 الببتيد (ARTKme2QTARKSTGGKAPRKQLYK، البيوتين) باستخدام الطيف الكتلي ونسب الذروة بالنسبة إلى الذروة monoisotopic وكما لوحظ ص 1 و ص 2 في المعادلات 1 و 2. (ب) وحضنت والببتيد نفسه الاصطناعية مع LSD1 نانوغرام 125 في demethylase العازلة لمدة ساعتين في 37 درجة مئوية. وتعرض بعد ذلك عينات لتحليل MassSQUIRM. يسكنها خليط من تداخل القمم يمثل ثلاث ولايات مختلفة مثيلة كما رأينا في الشكل 1B. ولوحظت المناطق الخاضعة لقمم monoisotopic كما A 1، 2، و 3. واستخدمت المناطق الذروة في المعادلات 3-5. الدوائر المفتوحة تشير مثيلة ضوء في حين تشير الدوائر المغلقة مثيلة الثقيلة. التعديل من بلير وآخرون. 2011 6.
Discussion
MassSQUIRM هي طريقة غير مكلفة والكمية لتحليل شامل لنشاط demethylases يسين المشاركين في أحادية و ثنائي مثيلة. MassSQUIRM تقدم الكميات ليس فقط من نتاج رد فعل، بل أيضا من أجل وسيطة. ويمكن استخدام هذا الاختبار باعتبارها أداة قوية في دراسة آلية demethylases هيستون LSD1 وغيرها. وسوف يكون من المفيد...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
نشكر مرفق البروتيوميات UAMS الطيفي للحصول على الدعم الشامل. وقدم التمويل لهذا المشروع من خلال منح المعاهد الوطنية للصحة P20RR015569، P20RR016460 وR01DA025755.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| LSD1 | BPS العلوم البيولوجية | 50100 | |
| H3K4me2-البيوتين الببتيد | أعدت في المنزل | لا شيء | |
| بوروس R2 20 حبات ميكرون | النظم البيولوجية التطبيقية | 1-1129-06 | |
| C 18 ZipTip | ميليبور | ZTC18M | |
| Trifluoroacetic حامض (TFA) | الحرارية | 28904 | |
| الأسيتونيتريل | الصياد | A996 | |
| 2،5-dihydroxybenzoic حامض | سيغما | 85707 | |
| Borane ثنائي ميثيل أمين | سيغما | 180238 | |
| الثقيلة isotopically د 2-الفورمالديهايد | كامبردج النظائر مختبرات | DLM-805-20 | |
| تريس | الصياد | BP154 | |
| بوكل | الصياد | BP366 | |
| MgCl 2 | الصياد | BP214 | |
| الغليسيرول | الصياد | G33 | |
| حمض الفورميك | Fluka | 06440 | |
| الميثانول | الصياد | A452 | |
| NA-فوسفات | الصياد | BP329 | |
| SpeedVac المكثف | رجل علم | DNA110 | |
| MALDI-prOTOF مطياف الكتلة والبرمجيات TOFworks | PerkinElmerSciex | لا شيء |
References
- Goldberg, A. D., Allis, C. D., Bernstein, E. Epigenetics: a landscape takes shape. Cell. 128, 635-638 (2007).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128, 693-705 (2007).
- Blair, L. P., Cao, J., Zou, M. R., Sayegh, J., Yan, Q. Epigenetic Regulation by Lysine Demethylase 5 (KDM5) Enzymes in Cancer. Cancers (Basel). 3, 1383-1404 (2011).
- Cole, P. A. Chemical probes for histone-modifying enzymes. Nat. Chem. Biol. 4, 590-597 (2008).
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119, 941-953 (2004).
- Blair, L. P. MassSQUIRM: An assay for quantitative measurement of lysine demethylase activity. Epigenetics. 6, 490-499 (2011).
- Rayment, I. Three-dimensional structure of myosin subfragment-1: a molecular motor. Science. 261, 50-508 (1993).
- Collom, S. L., Jamakhandi, A. P., Tackett, A. J., Radominska-Pandya, A., Miller, G. P. CYP2E1 active site residues in substrate recognition sequence 5 identified by photoaffinity labeling and homology modeling. Arch. Biochem. Biophys. 459, 59-69 (2007).
- Gradolatto, A. Saccharomyces cerevisiae Yta7 Regulates Histone Gene Expression. Genetics. 179, 291-304 (2008).
- Taverna, S. D. Yng1 PHD finger binding to histone H3 trimethylated at lysine 4 promotes NuA3 HAT activity at Lysine 14 of H3 and transcripiton at a subset of targeted ORFs. Mol. Cell. 24, 785-796 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved