A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العزلة والثقافة من خلايا الإنسان حليمات كمئية طعم
In This Article
Summary
نحن تهدف لوضع بروتوكول للتكرار لعزل والمحافظة عليها على المدى الطويل الثقافات من الخلايا البشرية كمئي حليمات الذوق. واستمرت بنجاح من خلايا الحليمات كمئي الإنسان التي تم الحصول عليها بواسطة الخزعة في ثقافة لأكثر من ثمانية ممرات (12 شهرا) دون فقدان للحيوية.
Abstract
Taste cells are highly specialized, with unique histological, molecular and physiological characteristics that permit detection of a wide range of simple stimuli and complex chemical molecules contained in foods. In human, individual fungiform papillae contain from zero to as many as 20 taste buds. There is no established protocol for culturing human taste cells, although the ability to maintain taste papillae cells in culture for multiple cell cycles would be of considerable utility for characterizing the molecular, regenerative, and functional properties of these unique sensory cells. Earlier studies of taste cells have been done using freshly isolated cells in primary culture, explant cultures from rodents, or semi-intact taste buds in tissue slices1,2,3,4. Although each of these preparations has advantages, the development of long-term cultures would have provided significant benefits, particularly for studies of taste cell proliferation and differentiation. Several groups, including ours, have been interested in the development and establishment of taste cell culture models. Most attempts to culture taste cells have reported limited viability, with cells typically not lasting beyond 3-5 d5,6,7,8. We recently reported on a successful method for the extended culture of rodent taste cells9. We here report for the first time the establishment of an in vitro culture system for isolated human fungiform taste papillae cells. Cells from human fungiform papillae obtained by biopsy were successfully maintained in culture for more than eight passages (12 months) without loss of viability. Cells displayed many molecular and physiological features characteristic of mature taste cells. Gustducin and phospholipase C β2, (PLC-β2) mRNA were detected in many cells by reverse transcriptase-polymerase chain reaction and confirmed by sequencing. Immunocytochemistry analysis demonstrated the presence of gustducin and PLC-β2 expression in cultured taste cells. Cultured human fungiform cells also exhibited increases in intracellular calcium in response to appropriate concentrations of several taste stimuli indicating that taste receptors and at least some of the signalling pathways were present. These results sufficient indicate that taste cells from adult humans can be generated and maintained for at least eight passages. Many of the cells retain physiological and biochemical characteristics of acutely isolated cells from the adult taste epithelium to support their use as a model taste system. This system will enable further studies of the processes involved in proliferation, differentiation and function of mammalian taste receptor cells in an in vitro preparation.
Human fungiform taste papillae used for establishing human fungiform cell culture were donated for research following proper informed consent under research protocols that were reviewed and approved by the IRB committee. The protocol (#0934) was approved by Schulman Associates Institutional Review Board Inc., Cincinnati, OH. Written protocol below is based on published parameters reported by Ozdener et al. 201110.
Protocol
1. الحصول على الإنسان النتوئات طعم كمئي
- إزالة 4-8 طعم كمئي الإنسان الحليمات من السطح الظهري للجزء الأمامي من اللسان باستخدام microscissors ربيع المنحني.
- المكان على الفور الى حل العزلة (26 NaHCO 3 مم، 2.5 مم ناه 2 PO 4 و 20 جلوكوز مم، 65 مم كلوريد الصوديوم، و 20 ملي بوكل، و1 ملم EDTA الذائبة في nuclease خالية من المياه وتعقيمها تصفية).
2. الإنسان النتوئات طعم كمئي الهضم
يمكن أن الخلية البشرية طعم حليمات كمئية يمكن فصلها باستخدام اثنين من مختلف البروتوكولات الهضم الأنزيمي مع اختلافات طفيفة.
- احتضان حليمات كمئية في حل العزلة مع pronase (1 ملغ / مل، سيغما الدريتش) وإيلاستاز (1 ملغ / مل الدريتش سيجما) في درجة حرارة الغرفة ل30-45 دقيقة (بروتوكول 1).
- احتضان حليمات كمئية مع كولاجيناز من النوع الأول (550 يو / مل، من رثينجتون) + إيلاستاز (10 يو / مل، من نبتةhington) + التربسين (0.9 ملغ / مل، من رثينجتون) في 2 مل من محلول الكالسيوم قارع الأجراس الحرة في 35 درجة مئوية طريقة بديلة حمام ماء مع تداول لمدة 30 دقيقة والأوكسجين لطيف مع 95٪ O 2 / CO 5٪ 2. (لل الهضم، وبروتوكول 2)
- بعد مرور فترة الحضانة، وغسل الحليمات مع الجرس ويسحن الحليمات مع مصقول النار ماصة باستير زجاج لمدة 10 مرة.
- أجهزة الطرد المركزي لمدة 3 دقائق في 2500 دورة في الدقيقة في RT وإزالة حل العزلة وإضافة 1 مل من خلية طعم الثقافة المتوسطة.
- نقل هضمها حليمات كمئية في طبق زجاج.
- تشريح كمئي الحليمات بلطف مع الحلاقة الجراحية.
- إضافة 250 ميكرولتر من الحليمات تشريح في أسطوانة استنساخ على ذيل فأر ساترة الكولاجين نوع-1 المغلفة.
- إضافة 1 مل من خلية طعم الثقافة المتوسطة في كل بئر.
3. زراعة خلايا الإنسان من حليمات كمئية طعم
- احتضان لوحة في 36 درجة مئوية في مرطبالحاضنة التي تحتوي على 5٪ CO 2.
- وضع في حاضنة دون عائق لمدة 2 قبل أيام من التغيير الأول من متوسط كاملة. وسوف تربط الخلايا الذوقية في نهاية المطاف إلى ساترة المغلفة، وعلى الرغم من أنها قد لا تكون مرئية بوضوح في 1 إلى 3 أيام.
- إزالة أسطوانة استنساخ من لوحة والمتوسطة تماما وإضافة 1 مل من المتوسط في كل خلية طعم جيد.
- استبدال 1/3 من كل أيام 6-7 المتوسطة. لا تغيير في كثير من الأحيان المتوسطة و / أو كليا.
- تحقق نمو الخلايا تحت المجهر كل يوم. معظم الخلايا الجديدة تنمو تحت كتل الخلية. مجموعات خلية فصل عادة بعد 2-3 أسابيع في ثقافة ترك الخلايا المولدة حديثا.
- مرة واحدة وتغطي 40-50٪ من الاسطوانة في توسيع استنساخ خلايا الذوق، ويعرض للتريبسين الخلايا باستخدام 0.25٪ وزن / حجم التربسين / EDTA لمدة 2-3 دقائق عند 36 درجة مئوية.
- نقل الخلايا من الآبار في أنابيب مل 15، إضافة 3 مجلدات من خلية طعم الثقافة المتوسطة تليها الطرد المركزي في 3000 دورة في الدقيقة لمدة 5 دقائق في غرفة المزاجature.
- إزالة الخلايا طاف وresuspend مع 1 مل من متوسط الخلية طعم.
4. انتشار الخلايا البشرية حليمات كمئية طعم
- نقل الخلايا في T25 لوحة وإضافة 4 مل من متوسط الخلية طعم (مرور 0). الحفاظ على الخلايا عند 36 درجة مئوية في حاضنة مرطب يحتوي على 5٪ CO 2.
- استبدال 1/3 من كل أيام 6-7 المتوسطة حتى الخلايا الذوقية مثقف وصلت إلى نقطة التقاء 100٪. في هذا الوقت، مما يسمح لخلايا التذوق لموسم الحصاد، وغسل خلايا مرة واحدة مع برنامج تلفزيوني العقيمة ثم يعرض للتريبسين الخلايا باستخدام 0.25٪ وزن / حجم التربسين / EDTA لمدة 2-3 دقائق عند 36 درجة مئوية.
- بعد الطرد المركزي على النحو الموصوف أعلاه، resuspend في كامل طعم المتوسطة الخلايا والخلايا نقل إلى قوارير T-75 الطازجة (مرور 1).
- استبدال 1/3 من كل أيام 6-7 المتوسطة. لا تغيير في كثير من الأحيان المتوسطة و / أو كليا.
- كرر الخطوة 4.3 و 4.4 عندما الخلايا قد وصلت ما يقرب من 100 نقطة التقاء٪. تقسيم الخلايا إلى ما لا يزيد عن تخفيف 01:04 في قارورة T75للحفاظ على نمو كاف من الخلايا مع مرور الوقت.
5. التجميد والذوبان مثقف خلايا التذوق حليمات كمئية الإنسان
- تجميد أرصدة الخلايا الذوقية الأولية، وبعد trypsinization (الخطوة 4.2)، إضافة 3 مل خلية كاملة طعم المتوسطة ونقل الخلايا إلى عقيم 15 مل أنابيب الطرد المركزي مخروطي. الطرد المركزي في 2500 دورة في الدقيقة لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة بعناية الخلايا طاف وresuspend بلطف مع حجم مناسب لتجميد المتوسطة التي تحتوي على 95٪ الجنين مصل بقري (FBS) وDMSO 5٪.
- نقل الخلايا ل، معقم المسمى كأب، وcryovials بإحكام، ومكان في وعاء يحتوي على تجميد الأيزوبروبانول. المكان الى المجمد -80 درجة مئوية لمدة لا تقل قبل يوم واحد إلى أجل غير مسمى لنقل النيتروجين السائل.
- إلى ذوبان الجليد قارورة من الخلايا الأولية البشرية المجمدة كمئي حليمات الذوق، ومكان على 37 درجة مئوية ماء الحمام حتى إذابة فقط (حوالي 1 دقيقة)، بينما كان يعمل في ثقافة الخلية التدفق الصفحيغطاء محرك السيارة.
- نقل الخلايا والمتوسطة تجميد لالعقيمة أنبوب 15 مل الطرد المركزي مخروطي ويضاف 5 مل من خلية طعم الثقافة المتوسطة.
- منبذة الخلايا في 2500 دورة في الدقيقة لمدة 5 دقائق في درجة حرارة الغرفة. تجاهل بعناية طاف، وخلايا resuspend بلطف مع كامل طعم خلية ثقافة المتوسط، ونقل إلى عقيم T-25 نسيج الثقافة قارورة.
- تواصل الخلايا وفقا للثقافة الخطوة 3 إلى 4.
6. ممثل النتائج
وكانت محاولات لتنمو الخزعات طعم النجاح في ثقافة 90٪ من الوقت. وبعد بضعة أيام خزعة والتفكك، وبدأت الخلايا عادة لتنمو وتهاجر إلى الخارج من قطعة من النسيج كمئي تشريح التي بقيت بعد إجراء التفكك. على الرغم من أن الخلايا الفردية كانت واضحة 24-48 ساعة بعد تصفيح (الشكل 1A)، نمت الخلايا لمدة تصل إلى 2-3 أسابيع تحت كتل الخلية المرفقة، وتوليد الخلايا الوليدة في بعض الأحيان (الشكل 1B). من خزعةجي 4-8 الإنسان حليمات كمئية، عزلة الأولي من التعليم الابتدائي الخلايا البشرية كمئي حليمات الذوق تصل إلى ما يقرب 2000-8000 الخلايا في 4 أسابيع في الثقافة. وسوف توسع في T25 قوارير ثقافة خلية (مرور 0) لمدة 3-4 أسابيع إضافية تؤدي إلى وجود خلايا الحليمات كمئي طعم في ثقافة تكيف (الشكل 1C). ويمكن الابتدائي طعم الخلايا حليمات كمئية الإنسان مزيد من التوسع في الثقافة لانتاج ما يزيد عن ما لا يقل عن مليون الخلايا عن طريق ممر-1 في الأسابيع 3-4 (1D الشكل). والخلايا الذوقية الأولية تستمر في النمو لأكثر من 8 ممرات.
كان التشكل للمثقف الخلايا البشرية حليمات كمئية طعم في ثقافة مشابهة لخلايا حسي كيميائي مثقف سبق وصفها 11،12 .. حافظت معظم مثقف طعم الخلايا حليمات كمئية الإنسان مظهرهم المضغوط الأصلي للأجسام الخلايا مع أو من دون واحدة أو أكثر من العمليات يصل إلى 15-30 يوما. بعد وصلوا التقاء معظم CE مثقفوكان LLS ظهور الاستقطاب، ممدود. الخلايا الذوقية الناضجة تتكون من عدة أنواع فرعية النسيجية المختلفة وميزات المعرض خلية طعم معين. هنا نظهر أن الخلايا ضمن هذه الثقافات عرض العديد من الميزات الجزيئية والفيزيولوجية المميزة للخلايا ناضجة طعم. تم الكشف عن β2، (PLC-β2) مرنا بواسطة عكس سلسلة من ردود الفعل الناسخ، البلمرة والمنتجات أكده التسلسل (الشكل 2) - Gustducin وفسفوليباز C. تم الكشف عن التعبير عن gustducin والمجلس التشريعي الفلسطيني، مشيرا إلى β2 immunocytochemically وجود خلايا II-مثل نوع (الشكل 3 B و D على التوالي). انتشار وأنماط التعبير النسبية للgustducin وPLC-β2 تعكس مسارات الخلية إشارات وأنواع الخلايا لا تعكس بدقة أن ينظر في الجسم الحي. العوامل التي تحكم التوزيع النسبي لأنواع مختلفة من الخلايا في غضون براعم التذوق غير معروفة، وربما لا يمكن تكرارها في ظروف الثقافة. ولذلك، (ب) الغير أوجه الشبه والاختلاف بين الخلايا مثقف ونظرائهم في الجسم الحي توفر فرصة لدراسة تنظيم هذه الخصائص على المستوى الجزيئي، في ظل الظروف التي يمكن التلاعب بها ومراقبتها.
معيارا هاما لنظام نموذجي هو وجود الخصائص الفنية ذات الصلة. الخلايا المزروعة أظهرت أيضا زيادة قوية في الكالسيوم داخل الخلايا استجابة لتركيزات مناسبة من المحفزات طعم عدة (الشكل 4). في هذه الدراسات، منبهات الحلو والمر حصول زيادة في الكالسيوم داخل الخلايا التي يمكن أن تتوافق مع الاستقطاب. هذه الخلية التي تشبه طعم خصائص الخلايا المستزرعة تقديم الدعم إلى التأكيد على أن نموذج النظام وصفنا هنا سيكون رصيدا ثمينا لمزيد من الدراسات للمسارات ترنسدوكأيشن والقدرة على التجدد من الخلايا الذوقية الإنسان.
fig1.jpg "/>
الشكل 1. مرفق ومورفولوجية مثقف الخلايا البشرية كمئي حليمات الذوق. تم تصوير الأولية طعم كمئي الإنسان الثقافات الخلية الحليمات نمت على لوحات نوع الكولاجين-1 المغلفة بعد 2 أيام (A). نما الإنسان حليمات الذوق كمئي الخلايا لمدة تصل إلى 4 أسابيع تحت كتل الخلية المرفقة، التي يبدو أنها تؤدي إلى الخلايا الوليدة. نمت الخلايا عادة إلى التقاء في غضون أربعة أسابيع (B)، و (C و D) ويمثل يوم 2 و 4 أسابيع بعد الحصاد وإعادة زرع النبتة على التوالي. واصلت الخلايا المزروعة لزراعة ما لا يقل عن 8 أشهر. الحانات النطاق = 50 نانومتر. وقدمت أيضا جزءا من الشكل رقم 1 وآخرون في أوزدينير. آل 10.
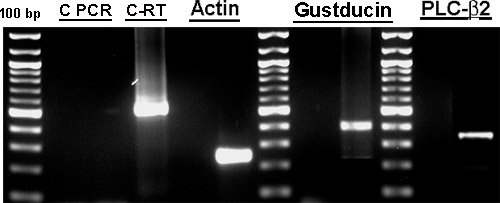
الشكل 2. أظهرت النتائج RT-PCR وجود محدد mRNAs طعم العلامات البيولوجية الخلية (gustducin والمجلس التشريعي الفلسطيني β2،). وكان الجيش الملكي النيبالي مجموع من مثقف الخلايا البشرية كمئي transc العكسيribed باستخدام مرتفع التجميعي ستراند الأولى لنظام RT-PCR (إينفيتروجن) وتستخدم لPCR عن طريق تضخيم مع بادئات محددة مصممة للكشف عن gustducin والمجلس التشريعي الفلسطيني β2. وقد تم اختيار الاشعال (الجدول 1) تمتد واحد أو أكثر الإنترونات. تم الكشف عن كل مرنا في مثقف الخلايا البشرية كمئي حليمات الذوق من مرور 4 أو 5 مع منتجات التضخيم من حجم المتوقع، والتي أكدتها التسلسل. لم يتم الكشف عن مرنا محددة في تجارب السيطرة دون الناسخ العكسي يوضح عدم وجود تلوث الحمض النووي الجيني. تم فصل المنتجات بكر على 2٪ الاغاروز المواد الهلامية وكانت رفعه المنتجات تضخيمها على هلام بشفرة الحلاقة. تم استخراج الحمض النووي من الجل باستخدام QIAquick جل استخلاص مجموعة (QIAGEN). والتسلسل منتجات PCR في جامعة مرافق تسلسل ولاية بنسلفانيا. C-PCR و RT-C هي تجارب للسيطرة PCR والناسخ العكسي، على التوالي. وقدمت أيضا جزءا من الشكل رقم 2 في أوزدينير آخرون. آل. 10.
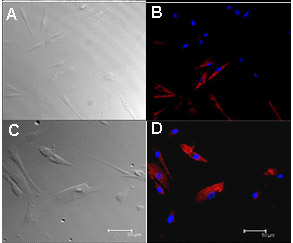
وأظهرت الشكل 3. المناعية من مثقف طعم كمئي الإنسان مرور خلايا الحليمات 4 أو 5 وجود خلية من المؤشرات الحيوية طعم. تم إصلاح مثقف طعم الخلايا كمئي الحليمات البشرية (5 أيام من العمر) مع 4٪ لامتصاص العرق، وحضنت مع الأجسام المضادة الأولية (الجدول 2) بين عشية وضحاها في 4 درجة مئوية. تم الحصول على الصور مع المجهر لايكا مبائر TCS-SP2 المسح الضوئي ليزر. تقريبا، وصفت 60٪ من الخلايا مثقف كمئي حليمات الذوق مع gustducin (B) و 20-30٪ مع PLC-β2 (D). وتظهر الصور انتقال من الخلايا المقابلة (A و C). لضوابط، المناعية مع الغلوبولين المناعي الأجسام المضادة المحددة أثبتت عدم وجود تفاعل المناعية غير محدد (لا تظهر البيانات). الحانات النطاق = 50 نانومتر. جزءمن الشكل (3) وقدمت أيضا في أوزدينير وآخرون. آل 10.

الشكل 4. مثقف طعم الخلايا حليمات كمئية الإنسان من مرور 4 أو 5 الاستجابة للمحفزات مختلفة. تم تحميل مثقف طعم الخلايا حليمات كمئية الإنسان (4-5 أيام من العمر) مع 1MM Fura-2 صباحا (المسابر الجزيئية) و 10 ملغ / مل Pluronic F127 (المسابر الجزيئية). تم قياس التغيرات في مستويات الكالسيوم داخل الخلايا ([كا 2 +] ط) في مثقف الخلايا البشرية كمئي حليمات الذوق باستخدام معيار تقنيات التصوير اليدوي. وكانت الخلايا تصور باستخدام مجهر مضان مقلوب في إثارة موجات من 340 نانومتر و 380 والطول الموجي من الانبعاثات التي وضعتها عصابة تمرير الترشيح تركزت في 510 نانومتر. حلت المحفزات في حل حمام وعدلت بعد ذلك درجة الحموضة والأسمولية إذا لزم الأمر. وردت مثقف طعم الخلايا حليمات كمئية الإنسان للمؤثرات الحلو والمر. Graphs توضيح ردود ممثل [CA +2] أنا المستويات في الخلايا الفردية خلال التعرض ل(A) ديناتونيوم (2 مم)، (B) سوكرالوسي (1 ملم). كل التتبع تمثل الخلايا فرد واحد.
| جينة | تسلسل | PCR حالة | يتوقع حجم (بي بي) | مرجع | |
| β-أكتين | GGACTTCGAGCAAGAGATGG AGCACTGTGTTGGCGTACAG | 7 دقائق 45 ثانية 45 ثانية 45 ثانية 7 دقائق | 95 94 53 72 72 | 234 | NM_001101.3 |
| Gustducin | TCTGGGTATGTGCCAAATGA GGCCCAGTGTATTCTGGAAA | 7 دقائق 45 ثانية 45 ثانية 45 ثانية 7 دقائق | 95 94 53 72 72 | 386 | NM_001102386 |
| PLC-β2 | GTCACCTGAAGGCATGGTCT TTAAAGGCGCTTTCTGCAAT | 3 دقائق 30 ثانية 30 ثانية 60 ثانية 7 دقائق | 95 94 53 72 72 | 333 | NM_004573 |
الجدول رقم 1. مبادىء القراءة وشروط استخدامها للكشف عن جزيئات طعم معين.
| الأضداد الابتدائي | مصدر | مضيف | تخفيف | الثانوية جسم | مصدر | مضيف | تخفيف |
| Gustducin | سانتا كروز | أرنب | 1:500 | المضادة للأرنب مفتش اليكسا 633 | المسابر الجزيئية | ماعز | 1:500 |
| PLC-β 2 | سانتا كروز | أرنب | 1:500 | المضادة للأرنب مفتش اليكسا 633 | المسابر الجزيئية | ماعز | 1:500 |
الجدول 2. الأجسام المضادة المستخدمة للكشف عن التعبير عن جزيئات محددة.
Discussion
لقد حافظنا على الخلايا التي تم الحصول عليها من الإنسان كمئي حليمات التذوق لأكثر من 8 ممرات، والذي يمتد لفترة 12 شهرا. هذه الثقافات توليد خلايا جديدة، وكثير منها تنضج في المختبر إلى المرحلة حيث أنها تعبر عن العديد من علامات النضج أنواع طعم الخلية برعم، بالإضافة إل?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر ايمي مايرز وQuayson ESI للمهارات الفنية والمساعدة. وأيد هذا العمل في جزء من جبهة الخلاص الوطني 0216310 وGivaudan منح شركة (المجموع).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | ||
| MCDB 123 | سيغما الدريخ | ||
| Iscove في DMEM متوسطة | MediaTech | ||
| إيلاستاز | سيغما الدريخ | ||
| Pronase E | سيغما الدريخ | ||
| إيلاستاز | ورثينجتون | ||
| فول الصويا مثبط التربسين | ورثينجتون | ||
| كولاجيناز نوع 1 | ورثينجتون | ||
| نوع الفئران الكولاجين الذيل 1 | دينار بحريني العلوم | ||
| Fura-2 صباحا | المسابر الجزيئية | ||
| مرتفع التجميعي ستراند الأولى لنظام RT-PCR | إينفيتروجن | ||
| لايكا TCS SP2 مجهر متحد البؤر الطيفي | لايكا مايكروسيستمز | ||
| اكتشاف-1 التصوير محطة والبرمجيات Metamorph | الجزيئية الأجهزة | ||
| صغير غرامة غيض ملقط ومقص اضافية ربيع غرامة | أدوات العلم غرامة |
References
- Mbiene, J. P., Maccallum, D. K., Mistretta, C. M. Organ cultures of embryonic rat tongue support tongue and gustatory papilla morphogenesis in vitro without intact sensory ganglia. J. Comp. Neurol. 377, 324-340 (1997).
- Miyamoto, T., Fujiyama, R., Okada, Y., Sato, T. Strain difference in amiloride-sensitivity of salt-induced responses in mouse non-dissociated taste cells. Neurosci. Lett. 277, 13-16 (1999).
- Caicedo, A., Jafri, M. S., Roper, S. D. In situ Ca2+ imaging reveals neurotransmitter receptors for glutamate in taste receptor cells. J. Neurosci. 20, 7978-7985 (2000).
- Qin, Y. M., Shi, J. Q., Zhang, G. H., Deng, S. P., Wang, T. H. A reliable method to obtain cells of taste buds from fungiform papillae of mice. Acta Histochem. 112, 107-112 (2010).
- Spielman, A. I., Mody, I., Brand, J. G., Whitney, G., MacDonald, J. F., Salter, M. W. A method for isolating and patch-clamping single mammalian taste receptor cells. Brain Res. 503, 326-329 (1989).
- Kishi, M., Emori, Y., Tsukamoto, Y., Abe, K. Primary culture of rat taste bud cells that retain molecular markers for taste buds and permit functional expression of foreign genes. Neuroscience. 106, 217-225 (2001).
- Ruiz, C. J., Stone, L. M., McPheeters, M., Ogura, T., Bottger, B., Lasher, R. S., Finger, T. E., Kinnamon, S. C. Maintenance of rat taste buds in primary culture. Chem. Senses. 26, 861-873 (2001).
- Stone, L. M., Tan, S. S., Tam, P. P., Finger, T. E. Analysis of cell lineage relationships in taste buds. J. Neurosci. 22, 4522-4529 (2002).
- Ozdener, H., Yee, K. K., Cao, J., Brand, J. G., Teeter, J. H., Rawson, N. E. Characterization and long-term maintenance of rat taste cells in culture. Chem. Senses. 31, 279-290 (2006).
- Ozdener, M. H., Brand, J. G., Spielman, A. I., Lischka, F. W., Teeter, J. H., Breslin, P. A., Rawson, N. E. Characterization of Human Fungiform Papillae Cells in Culture. Chem. Senses. 36, 601-612 (2011).
- Gomez, G., Rawson, N. E., Hahn, C. G., Michaels, R., Restrepo, D. Characteristics of odorant elicited calcium changes in cultured human olfactory neurons. J. Neurosci. Res. 62, 737-749 (2000).
- Wolozin, B., Sunderland, T., Zheng, B. B., Resau, J., Dufy, B., Barker, J., Swerdlow, R., Coon, H. Continuous culture of neuronal cells from adult human olfactory epithelium. J. Mol. Neurosci. 3, 137-146 (1992).
- Wick, N., Saharinen, P., Saharinen, J., Gurnhofer, E., Steiner, C. W., Raab, I., Stokic, D., Giovanoli, P., Buchsbaum, S., Burchard, A., Thurner, S., Alitalo, K., Kerjaschki, D. Transcriptomal comparison of human dermal lymphatic endothelial cells ex vivo and in vitro. Physiol. Genomics. 17, 179-192 (2007).
- Fu, L., Zhu, L., Huang, Y., Lee, T. D., Forman, S. J., Shih, C. C. Derivation of neural stem cells from mesenchymal stemcells: evidence for a bipotential stem cell population. Stem Cells Dev. 17, 1109-1121 (2008).
- Sandow, S. L., Grayson, T. H. Limits of isolation and culture: intact vascular endothelium and BKCa. Am. J. Physiol. Heart Circ. Physiol. 297, H1-H7 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved