A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
كيميائيا سدت [ميكروأري] لتحديد ملامح عالية الإنتاجية من تعدد في الإرسال ارتباط بالغليكوزيل بروتين معين في عينات مجمع
In This Article
Summary
في هذه الدراسة، فإننا وصف بروتوكول محسن لميكروأري المضاعفة الأجسام المضادة عالية الإنتاجية مع طريقة كشف كتين التي يمكن استخدامها في التنميط ارتباط بالغليكوزيل من بروتينات محددة. يتميز هذا البروتوكول الكواشف موثوق جديدة ويخفف كثيرا من الوقت والتكلفة، ومتطلبات معدات مختبر بالمقارنة مع الإجراء السابق.
Abstract
In this study, we describe an effective protocol for use in a multiplexed high-throughput antibody microarray with glycan binding protein detection that allows for the glycosylation profiling of specific proteins. Glycosylation of proteins is the most prevalent post-translational modification found on proteins, and leads diversified modifications of the physical, chemical, and biological properties of proteins. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases. However, current methods to study protein glycosylation typically are too complicated or expensive for use in most normal laboratory or clinical settings and a more practical method to study protein glycosylation is needed. The new protocol described in this study makes use of a chemically blocked antibody microarray with glycan-binding protein (GBP) detection and significantly reduces the time, cost, and lab equipment requirements needed to study protein glycosylation. In this method, multiple immobilized glycoprotein-specific antibodies are printed directly onto the microarray slides and the N-glycans on the antibodies are blocked. The blocked, immobilized glycoprotein-specific antibodies are able to capture and isolate glycoproteins from a complex sample that is applied directly onto the microarray slides. Glycan detection then can be performed by the application of biotinylated lectins and other GBPs to the microarray slide, while binding levels can be determined using Dylight 549-Streptavidin. Through the use of an antibody panel and probing with multiple biotinylated lectins, this method allows for an effective glycosylation profile of the different proteins found in a given human or animal sample to be developed.
Introduction
Glycosylation of protein, which is the most ubiquitous post-translational modification on proteins, modifies the physical, chemical, and biological properties of a protein, and plays a fundamental role in various biological processes1-6. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases 7-12. In fact, most current cancer biomarkers, such as the L3 fraction of α-1 fetoprotein (AFP) for hepatocellular carcinoma 13-15, and CA199 for pancreatic cancer 16, 17 are all aberrant glycan moieties on glycoproteins. However, methods to study protein glycosylation have been complicated, and not suitable for routine laboratory and clinical settings. Chen et al. has recently invented a chemically blocked antibody microarray with a glycan-binding protein (GBP) detection method for high-throughput and multiplexed profile glycosylation of native glycoproteins in a complex sample 18. In this affinity based microarray method, multiple immobilized glycoprotein-specific antibodies capture and isolate glycoproteins from the complex mixture directly on the microarray slide, and the glycans on each individual captured protein are measured by GBPs. Because all normal antibodies contain N-glycans which could be recognized by most GBPs, the critical step of this method is to chemically block the glycans on the antibodies from binding to GBP. In the procedure, the cis-diol groups of the glycans on the antibodies were first oxidized to aldehyde groups by using NaIO4 in sodium acetate buffer avoiding light. The aldehyde groups were then conjugated to the hydrazide group of a cross-linker, 4-(4-N-MaleimidoPhenyl)butyric acid Hydrazide HCl (MPBH), followed by the conjugation of a dipeptide, Cys-Gly, to the maleimide group of the MPBH. Thus, the cis-diol groups on glycans of antibodies were converted into bulky none hydroxyl groups, which hindered the lectins and other GBPs bindings to the capture antibodies. This blocking procedure makes the GBPs and lectins bind only to the glycans of captured proteins. After this chemically blocking, serum samples were incubated with the antibody microarray, followed by the glycans detection by using different biotinylated lectins and GBPs, and visualized with Cy3-streptavidin. The parallel use of an antibody panel and multiple lectin probing provides discrete glycosylation profiles of multiple proteins in a given sample 18-20. This method has been used successfully in multiple different labs 1, 7, 13, 19-31. However, stability of MPBH and Cys-Gly, complicated and extended procedure in this method affect the reproducibility, effectiveness and efficiency of the method. In this new protocol, we replaced both MPBH and Cys-Gly with one much more stable reagent glutamic acid hydrazide (Glu-hydrazide), which significantly improved the reproducibility of the method, simplified and shorten the whole procedure so that the it can be completed within one working day. In this new protocol, we describe the detailed procedure of the protocol which can be readily adopted by normal labs for routine protein glycosylation study and techniques which are necessary to obtain reproducible and repeatable results.
Protocol
1. طباعة جسم [ميكروأري] لفحص
- تمييع كل الأجسام المضادة إلى 0.5 ملغ / مل في المياه المالحة العازلة الفوسفات ودرجة الحموضة 7.2 (PBS).
- قسامة 40 ميكرولتر من كل الأجسام المضادة في لوحة مصدر 384 أيضا.
- تحميل لوحة مصدر جيد على 384 من Scienion microarrayer sciFLEXARRAYER.
- تحميل 20 الشرائح ميكروأري PATH على هذا microarrayer هدفا.
- تعيين microarrayer لطباعة 48 subarrays متطابقة، والتي رصدت في 27 الأضداد والبروتينات تحكم في ثلاث نسخ في نمط 9x9 (الشكل 1E، 1F).
- بدء microarrayer لطباعة الشرائح [ميكروأري].
- جمع الشرائح [ميكروأري]، وتخزينها في كاسيت مع الشرائح المجففة. فراغ ختم كاسيت في كيس من البلاستيك باستخدام فراغ السداده (Foodsaver).
- تخزين الشرائح ميكروأري مختومة في 4 درجات مئوية في الثلاجة.
2. كتلة كيميائيا [ميكروأري] لمنع GBPالربط إلى الأجسام المضادة لقطة
الفحص ميكروأري يبدأ مرة يتم حظر كيميائيا الشرائح ميكروأري ويستمر لمدة 8 ساعات تقريبا. بدأت مرة واحدة في فحص ميكروأري ويستكمل (الخطوات من 2 إلى 8).
- اتخاذ ميكروأري تنزلق من الثلاجة، ويوازن بينها إلى درجة حرارة الغرفة لمدة 30 دقيقة.
- إزالة الشريحة من مربع التخزين وشطف منهم لفترة وجيزة في درجة الحموضة عازلة فوسفات ملحي 7.2 مع 0.1٪ توين 20 (PBST0.1) مرة واحدة في شريحة حوض الغسيل، ثم في 15 درجة الحموضة الصوديوم ملي العازلة خلات 5.0 مع توين 0.1٪ (CBT0 0.1) بطريقة متسلسلة. احتضان الشرائح في CBT0.1 لمدة 10 دقيقة في حوض الغسيل الشريحة.
- إعداد الطازجة 150 مم NaIO 4 في 15 خلات الصوديوم 5.0 مم درجة الحموضة عازلة (CB)، وابقائه في في شريحة غسل حوض في الثلاجة وفي الوقت نفسه تجنب ضوء قبل الاستخدام.
- إزالة الشريحة من بناء القدرات، ووضعها في حوض يحتوي على NaIO الطازجة 4 مع الجانب الضدمواجهة. تغطية حوض مع رقائق الألومنيوم لتجنب الضوء، واحتضان حوض الشريحة لمدة 2 ساعة مع لطيف اهتزاز في 4 درجات مئوية في الثلاجة.
- تحضير 300 مل من 10 ملي حامض الجلوتاميك هيدرازيد (مانع) في بناء القدرات.
- إزالة الشريحة من الحوض، وشطف فترة وجيزة في سي بي 3 مرات لمدة 5 دقائق في كل مرة في حوض الغسيل الشريحة.
- احتضان الشرائح في مانع في حوض الغسيل لمدة 2 ساعة في درجة حرارة الغرفة مع الهز لطيف.
- إزالة الشرائح من الحوض، وغسلها مع PBST0.1 لمدة 3 دقائق.
3. منع غير محدد الربط إلى ميكروأري مع ألبومين المصل البقري (BSA)
- تحضير 300 مل من 1٪ في جيش صرب البوسنة درجة الحموضة عازلة فوسفات ملحي 7.2 مع توين 0.5٪ (PBST0.5) في حوض الغسيل الشريحة، واحتضان الشريحة ميكروأري في حوض لمدة 1 ساعة في درجة حرارة الغرفة مع يهز بلطف.
- شطف الشرائح في ثلاث مرات PBST0.1 لمدة 3 دقائق في كل مرة.
- وضع الشريحةعلى رف الشريحة، وتدور في 1200 XG على الطرد المركزي لمدة 2 دقيقة حتى يجف الشريحة ميكروأري.
4. بصمة الشبكة الشمع على الشريحة ميكروأري للفصل بين كل Subarray
- قبل تسخين الشمع imprinter في 70 درجة مئوية لمدة 5 دقائق.
- تحميل الشريحة ميكروأري سدت في imprinter الشمع مع الجانب الأجسام المضادة التي تواجه لشمع. برفق المؤشر إلى شمع بصمة على الشريحة بالتساوي.
5. تطبق عينات المصل على الشريحة ميكروأري
- خلال الخطوة 2.4، إعداد عينات مصل الدم إما لفحص التنميط جلكو في عينة واحدة (5.1.1)، أو واحدة قياس epiptope جلكو بين عينات متعددة (5.1.2).
- في تجربة لprofilings غليكان من بروتينات سكرية المصل متعددة في عينة واحدة المصل باستخدام متعددة جيجابايت في الثانية (انظر تجربة نموذج 1)، سيتم تطبيق 1 عينات مصل الدم على جميع subarrays. في هذه الحالة، يتم تخفيفه 40 افرة المصل ميكروليتر إلى ميكرولتر 360 من برنامج تلفزيوني يحتوي على 0.1٪توين-20، 0.1٪ بريج 35، 100 ميكروغرام / مل من مفتش الماوس، 100 ميكروغرام / مل من مفتش الفئران، 100 ميكروغرام / مل من مفتش أرنب، 100 ميكروغرام / مل من مفتش الماعز و 100 ميكروغرام / مل من مفتش حمار. هذا الحجم يكفي لتطبيق 6 ميكرولتر من محلول المصل المخفف على كل subarray.
- في تجربة لقياس غليكان واحد على بروتينات مصل الدم بين عدة عينات من مصل الدم متعددة باستخدام أحد اكتشافات GBP (انظر تجربة نموذج 2). في هذه الحالة، يتم تخفيفه 1 افرة المصل ميكروليتر إلى 9 ميكرولتر من برنامج تلفزيوني يحتوي على 0.1٪ توين-20، 0.1٪ بريج 35، 100 ميكروغرام / مل من مفتش الماوس، 100 ميكروغرام / مل من مفتش الفئران، 100 ميكروغرام / مل من مفتش أرنب ، 100 ميكروغرام / مل من مفتش الماعز و 100 ميكروغرام / مل من مفتش حمار. هذا الحجم يكفي لتطبيق 6 ميكرولتر من محلول المصل المخفف على كل subarray.
- بعد بصمة شمع في الخطوة 4، تطبق بعناية 6 ميكرولتر من عينة المخففة أو عينات التحكم (PBST0.1) إلى كل subarray من الشريحة. احتضان الشريحة في شريط مرطب مع المناشف الورقية الرطب في درجة حرارة الغرفةلمدة 1 ساعة.
- شطف الشريحة مع ثلاث مرات PBST0.1 لمدة 3 دقائق في كل مرة.
- تجف الشريحة عن طريق الدوران في 1200 لمدة 2 دقيقة XG.
6. تطبق GBP المعقدة البيروكسيديز (الضد كتين أو مضاد غليكان-) على الشريحة
- خلال الخطوة 2.4، إعداد 10μg/ml من يكتينس المعقدة البيروكسيديز / جيجابايت في الثانية في PBST0.1.
- في تجربة التنميط غليكان أن مسبار عينة واحدة مع يكتينس متعددة (تجربة نموذج 1)، وإعداد 350 ميكرولتر من كتين المعقدة البيروكسيديز الذي يكفي لجميع subarrays.
- في واحد فحص حاتمة / العلامات البيولوجية غليكان في عينات متعددة باستخدام يكتينس متعددة، وإعداد 10 ميكرولتر من كل كتين المعقدة البيروكسيديز الذي يكفي لمدة subarray.
- تطبق 6 ميكرولتر من كتين والمعقدة البيروكسيديز المخفف (ق) إلى كل subarray من الشريحة، واحتضان في مربع الشريحة مرطب مع مناشف ورقية مبللة في درجة حرارة الغرفة لمدة 1 ساعة.
- شطف الشرائح مع ثلاث مرات PBST0.1 لمدة 3 دقائق لكل منظمة الشفافية الدوليةلي.
- تجف الشريحة عن طريق الدوران بسرعة 1200 XG في أجهزة الطرد المركزي لمدة 2 دقيقة.
7. تطبيق صبغ NeutrAvidin تصنيفها لكشف الإسفار
- إعداد 350 ميكرولتر من NeutrAvidin 549 Dylight المسمى الذي يكفي لجميع subarrays.
- تطبق 6 ميكرولتر من NeutrAvidin 549 Dylight المسمى على كل subarray، واحتضان الشريحة في كاسيت الشريحة مرطب في درجة حرارة الغرفة لمدة 1 ساعة.
- شطف الشريحة مع ثلاث مرات PBST0.1 لمدة 3 دقائق في كل مرة.
- تجف الشريحة من خلال الدوران في ذلك في 1200 XG في أجهزة الطرد المركزي لمدة 2 دقيقة.
8. الحصول على ميكروأري صورة الشريحة عن طريق مسح الشرائح
- مسح الشريحة باستخدام ماسح ضوئي ميكروأري مضان في قرار ميكرون 10. وينبغي ضبط الليزر وPMT تكون قوية بقدر الإمكان، ولكن يتم احترام أي بقعة التشبع.
9. استخراج البيانات وتحليلها
- فتح الصورة في ArrayPro 3.2.
- إعداد قالب مجموعة وفقا لخريطة الصفيف التي تظهر الأجسام المضادة بقع المواقع. محاذاة بعناية كل دائرة قالب على الفور المقابلة في الصورة.
- استخراج كثافة من كل بقعة في ملف إكسل لمزيد من التحليل.
10. ممثل النتائج
تجربة نموذج 1
التنميط ارتباط بالغليكوزيل من بروتينات سكرية المصل متعددة في سرطان الكبد المريض عينة مصل الدم باستخدام سدت كيميائيا [ميكروأري] مع كشف يكتينس متعددة.
الهدف من هذه التجربة هو استكشاف الشخصي ارتباط بالغليكوزيل فرد من 20 بروتينات سكرية في سرطان الخلايا الكبدية (HCC) عينة مصل المريض باستخدام سدت كيميائيا [ميكروأري] مع كشف يكتين. وقد تم تصميم جسم [ميكروأري]، الذي يحتوي على 48 subarrays متطابقة التي تضم 26 والأجسام المضادة البيوتين جيش صرب البوسنة، وتصنيعها كما هو موضح في STEP 1. وكانت هذه الأجسام المضادة 26 مقابل 20 في المصل بروتينات سكرية التي حددت بأنها واعدة في وقت مبكر قيمة التشخيص لمرضى سرطان الكبد عن طريق استخدام مناعي مقرها كتين جنبا إلى جنب مع كتلة تحديد بروتين الطيفي 12 و 32 كما هو مبين في الجدول رقم 1. يتم عرض نمط وترتيب جسم البقع طبعت في ثلاث نسخ في subarray ممثل واحد في الشكل و1E 1F، على التوالي. شريحتين ميكروأري متطابقة، كان واحدا لا يتم حظر كيميائيا (الشكل 1A)، في حين كان (الشكل 1B) واحدة أخرى، واستخدمت لتنفيذ التنميط ارتباط بالغليكوزيل نفس التجربة وذلك للتدليل على أهمية إجراء حظر كيميائيا للتحليل. للشريحة حظر كيميائيا (الشكل 1B)، وبدأت التجربة في الخطوة 2، وبالنسبة لشريحة لا شيء سدت كيميائيا (الشكل 1A)، هذه التجربة بدأت من الخطوة 3. وأجريت التجربة من قبل يلي: ·ز جميع الخطوات المذكورة في البروتوكول باستثناء الخطوة 5.1.2 و 6.1.2. في الخطوة 5.2، تم تطبيق نموذج السيطرة على PBST0.1 subarrays في العمود 1 و 3، و تم تطبيق تجميع عينة مصل سرطان الكبد على subarrays في العمود 2 و 4 على التوالي (كما هو موضح في الشكل 1G). هذه المقارنة هو إظهار فعالية وكفاءة من هذا الإجراء، فضلا عن تقارب مستضد ملزم من الأجسام المضادة بعد عرقلة كيميائيا. 22 يكتينس المعقدة البيروكسيديز (كما هو موضح في الجدول رقم 1) التي تم تطبيقها محددة لمختلف glycans 18 و 20 على كل subarray كما هو مبين في الشكل 1G لارتباط بالغليكوزيل التنميط. صور من ميكروأرس (الشكل 1A) منعت كيميائيا (الشكل 1B)، ومنعت غير كيميائيا بعد ارتباط بالغليكوزيل فحص التنميط باتباع بروتوكول. كما هو مبين في subarrays في العمود 1 و 3 في غير كيميائيا ميكروأرس سدت (الشكل 1A و 1C الشكل)، والتيتم تطبيق PBST0.1 فقط، معظم يكتينس ملزمة لالتقاط الاجسام المضادة، وأظهرت أن خلفية عالية جدا مماثلة لتلك التي subarrays في العمود 2 و 4، والتي تم تطبيقها على عينة مصل الدم. فمن المستحيل الحصول على معلومات الملف الشخصي غليكان من هذه الشريحة ميكروأري. على العكس من ذلك، فإن subarrays في العمود 1 و 3، والتي تم تطبيقها فقط PBST0.1 عندما تم إجراء نفس التجربة على شريحة الضد ميكروأري حظر كيميائيا، وأظهرت معظم يكتينس ربط أي أو منخفضة جدا لالتقاط الأجسام المضادة، في حين أن ارتفاع مستضد وقد لوحظت لا يزال الارتباطات في subarrays في العمود 2 و 4، والتي تم تطبيق عينة مصل الدم (1B والشكل 1D). وأظهرت نتيجة هذه الإجراءات حظر كيميائيا كان خطوة حاسمة الصدارة قياس glycans على بروتينات سكرية الضد القبض عليه. وذلك باتباع البروتوكول، يمكن الحصول على ملفات تعريف ارتباط بالغليكوزيل من 22 بروتينات سكرية في مصل سرطان الكبد.
تجربة 2
شاشة لfucos تتغيرylation على بروتينات سكرية المصل محددة المؤشرات الحيوية إلى تشمع الكبد التمييز والمرضى سرطان الكبد.
الهدف من هذه التجربة هو للكشف عن fucosylation تتغير على بروتينات سكرية المصل محددة المؤشرات الحيوية التي تميز تليف الكبد وسرطان الخلايا الكبدية (HCC) من المرضى. تم تطبيق مختلف من التجربة 1، والذي تم تطبيقه فقط عينة واحدة على كل مصل subarrays وبحثها مع يكتينس مختلف، في هذا الاختبار، و 40 مختلف مجموع عينات مصل الدم من سرطان الكبد وتليف الكبد المرضى على كل subarray، وبحثها مع واحد كتين (AAL ). وقد تم التحليل الإحصائي، مثل اختبار T، المتلقي خاصية التشغيل (ROC) منحنى، لتقييم التوزيع أو الأداء التشخيصي للepiptope غليكان / العلامات البيولوجية على كل فرد من البروتين في جميع عينات مصل الدم. استخدمنا [ميكروأري] نفسه تصنيعها في تجربة 1 باستثناء 9-CA19 مكافحة ومضادة للأجسام مضادة لويس العاشر في هذه الدراسة. وexperوقد أجريت iment الخروج من 2 سبتمبر إلى الخطوة 9 باستثناء الخطوة 5.1.1 و 6.1.1. طبقت مجموع 40 عينة مصل الدم في الفترة من 20 تليف الكبد ومرضى سرطان الكبد 20 في subarray عشوائية من subarrays 48 جنبا إلى جنب مع عينات PBS سيطرة على السيطرة السلبية. ثم تم الكشف عن Fucosylation من كل من البروتينات الذي تم القبض عليه عن طريق استخدام المعقدة البيروكسيديز فوكوسي محددة يكتين. أظهرت صورة ميكروأري هو مبين في الشكل (1) وAAL كتين ملزمة فقط للبروتينات مصل القبض على ميكروأري] (الشكل 2D) بدلا من القبض على أجسام مضادة (2E الشكل). ثم انتزعت شدة AAL ملزم من البقع في كل شيء، وتحليلها باستخدام اختبار T ومنحنيات ROC لتقييم أداء fucosylation (كثافة ملزم العال) من كل بروتين مصل على التمييز بين المجلس الأعلى للطفولة ومجموعات تليف الكبد. وأظهرت النتائج أن fucosylation من GP73 بروتين أعطى أفضل التمييز بين المجموعتين مع P = 0.03 و في منطقة تحتمنحنى منحنى ROC يساوي 0،72. أثبتت هذه التجربة هذا الإجراء هو السريع، وسيلة فعالة لفحص حاتمة / العلامات البيولوجية غليكان على عينات متعددة داخل بروتينات متعددة.
| معرف | اسم كاشف | الاختصار | شركة | كتالوج # |
| L1 | المعقدة البيروكسيديز كونكانافالين A | كونا | ناقلات مختبرات | BK-1000 |
| L2 | المعقدة البيروكسيديز كتين خمان؛ بلسان أسود | SNA | ناقلات مختبرات | B-1305 |
| L3 | عدسة المعقدة البيروكسيديز Culinaris الملزن | LCA | ناقلات مختبرات | BK-2000 |
| L4 | المعقدة البيروكسيديز الخروع COMMUNIS الملزن أنا | RCA | ناقلات مختبرات | BK-1000 |
| L5 | المعقدة البيروكسيديز كتين Aleuria برتقالية | AAL | ناقلات مختبرات | B-1395 |
| L6 | المعقدة البيروكسيديز كتين الحمرية Cristagalli | أطلق بيت التمويل الخليجي | ناقلات مختبرات | BK-3000 |
| L7 | المعقدة البيروكسيديز غريفونيا كتين Simplicifolia (Bandeiraea) الثاني | GSL الثاني | ناقلات مختبرات | BK-3000 |
| L8 | المعقدة البيروكسيديز القمح الجرثومي الملزن | WGA | ناقلات مختبرات | BK-1000 |
| L9 | المعقدة البيروكسيديز Erythroagglutinin الشائع فاصيلوس | PHA-E | ناقلات مختبرات | BK-2000 |
| L10 | المعقدة البيروكسيديز Leucoagglutinin الشائع فاصيلوس | PHA-L | ناقلات مختبرات | BK-2000 |
| L11 | الحيويtinylated الفول السوداني الملزن | السلطة الوطنية الفلسطينية | ناقلات مختبرات | BK-1000 |
| L12 | المعقدة البيروكسيديز بيسوم Pisum الملزن | PSA | ناقلات مختبرات | BK-2000 |
| L13 | المعقدة البيروكسيديز Dolichos Biflorus الملزن | DBA | ناقلات مختبرات | BK-1000 |
| L14 | المعقدة البيروكسيديز كتين جوز ماثل | DSL | ناقلات مختبرات | BK-3000 |
| L15 | المعقدة البيروكسيديز الصفيراء الملزن تفرضه اليابان | SJA | ناقلات مختبرات | BK-2000 |
| L16 | فول الصويا المعقدة البيروكسيديز الملزن | SBA | ناقلات مختبرات | BK-1000 |
| L17 | المعقدة البيروكسيديز بطاطس (بطاطا) يكتين | المحكمة الخاصة بلبنان | ناقلات مختبرات | BK-3000 |
| L18 | المعقدة البيروكسيديز غريفونيا كتين Simplicifolia (Bandeiraea) أنا | GSL أنا | ناقلات مختبرات | BK-2000 |
| L19 | المعقدة البيروكسيديز كتين بيقية Villosa | VVL | ناقلات مختبرات | BK-2000 |
| L20 | المعقدة البيروكسيديز اسكولينتوم (الطماطم) يكتين | حد الانفجار الأدنى | ناقلات مختبرات | BK-3000 |
| L21 | Ulex المعقدة البيروكسيديز Europaeus الملزن أنا | أنا UEA | ناقلات مختبرات | BK-1000 |
| L22 | المعقدة البيروكسيديز Jacalin | JACALIN | ناقلات مختبرات | BK-3000 |
| A1 | F عنزة ('أ ب) 2 قطعة مضادة للالغلوبولين المناعي البشري، الأجسام المضادة Fc5μ | الغلوبولين المناعي | جاكسون المناعي للبحوث | 109-006-129 |
| A2 | حمار F ('أ ب) 2فرج المضادة للمفتش الإنسان (H + L) الجسم المضاد | AB1 | جاكسون المناعي للبحوث | 709-006-149 |
| A3 | الماوس المضادة للمفتش الإنسان F ('أ ب) 2 ريتوكسيماب | AB3 | جاكسون المناعي للبحوث | 209-005-097 |
| A4 | الماعز المضادة للجسم البشري ألفا macroglobulin 2 بولكلونل | A2M | GeneTex | GTX62924 |
| A5 | أرنب المضادة للبشرية ألفا-1-انتيتريبسين الجسم المضاد بولكلونل | A1AT | لي Biosiences | CA1T-80A |
| A6 | الماوس المضادة للبشرية ألفا-1-انتيتريبسين ريتوكسيماب | A1AT | سيجما ألدريتش | SAB4200198 |
| A7 | أرنب المضادة للبشرية ألفا-1-انتيتريبسين الجسم المضاد بولكلونل | تحرك | NeoMarkers | RB-367-A1 |
| A8 | أرنب المضادة للبشرية ألفا-1-انتيتشhymotrypsin الجسم المضاد بولكلونل | تحرك | فيشر العلمية | RB9213R7 |
| A9 | جسم الفأر ترانسفيرين المناهضة للبشرية وحيدة النسيلة | ترانسفيرين | GeneTex | GTX101035 |
| A10 | أرنب الضد ترانسفيرين المضادة للبشرية بولكلونل | ترانسفيرين | GeneTex | GTX77130 |
| A11 | الماعز المضادة للجسم البشري J ئي بولكلونل | ApoJ | Abcam | ab7610 |
| A12 | الماوس المضادة للبشرية GP73 ريتوكسيماب | GP73 | أبوت | 14H4-23 |
| A13 | الماوس المضادة للبشرية GP73 ريتوكسيماب | GP73 | سانتا كروز التكنولوجيا الحيوية المؤتمر الوطني العراقي | SC-101275 |
| A14 | أرنب المضادة للبشرية ألفا-1 بروتين جنيني الجسم المضاد بولكلونل | ا ف ب | GenWay | GWB-41C966 |
| A15 | الماوس المضادة للبشرية ألفا-1 بروتين جنيني ريتوكسيماب | ا ف ب | فيتزجيرالد | 10-A05A |
| A16 | جسم الفأر هيموبيكسين المناهضة للبشرية وحيدة النسيلة | هيموبيكسين | Assaypro | 60190-05011 |
| A17 | الماوس المضادة للبشرية glypican-3 (1G12) الأجسام المضادة وحيدة النسيلة | GPL3 | سانتا كروز بيو | SC-65443 |
| A18 | الماوس المضادة للمولد الكاينين الإنسان (LMW) الأجسام المضادة وحيدة النسيلة | مولد الكاينين | Assaypro | 20333-05011 |
| A19 | أرنب المضادة للبشرية MMP-21 ضد وحيد النسيلة | MMP21 | Epitomic | 1955-1 |
| A20 | الماوس المضادة للبشرية CEACAM-1 ريتوكسيماب | CEACAM | R & D أنظمة | MAB1180 |
| A21 | الفئران المضادة للبشرية DPPIV/CD26 ريتوكسيماب | DPPIV | R & D أنظمة | MAB22441 |
| A22 | ماوس لمكافحة الأجسام المضادة البشرية وحيدة النسيلة الثاني PIVKA | PIVICA | الكريستال الكيميائي | 8040 |
| A23 | الماوس المضادة للمستضد سرطاني مضغي | CEA | الولايات المتحدة البيولوجية | C1300 |
| A24 | مستضد الماوس المضادة للسرطان CA125 | CA125 | الولايات المتحدة البيولوجية | C0050-01D |
| A25 | ماوس لمكافحة السرطان CA19-9 مستضد | CA19-9 | الولايات المتحدة البيولوجية | C0075-18 |
| A26 | جسم الفأر X المضادة لللويس وحيدة النسيلة | لويس العاشر | Calbiochem | 434631 |
| الحيوي | جيش صرب البوسنة المعقدة البيروكسيديز (مراقبة إيجابية) | الحيوي | محلية الصنع | N / A |
الجدول رقم 1. قائمة من الليستين والأجسام المضادة المستخدمة في هذا البروتوكول.
| اسم المعدات / الكاشف ق | شركة | فهرس العدد |
| غير اتصال microarrayer | BioDot المؤتمر الوطني العراقي | sciFLEXARRAYER |
| 384 microplate | الصياد | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| سامسونج النيتروسليلوز coate ميكروأري الشرائح | Gentel | PATH |
| الشريحة Imprinter (اختياري) | الجل الشركة | WSP60-1 |
| شاكر | الصياد | 15-453-211 |
| نبذ | إيبندورف | 5804 000.013 |
| حرك غسل حوض / الشرائح تلطيخ واي الصحنال القابل للإزالة الرف | الصياد | 08-812 |
| الشريحة مربع حضانة الشريحة غرفة / مجهر | الصياد | 03-448-5 |
| بريج 35، 30٪ حل ث / ت في المياه | العضوية Acros | AC32958-0025 |
| توين-20 | الصياد | P337-100 |
| الصوديوم بريودات (NaIO 4) | سيغما | 311448 |
| L-حمض الغلوتاميك γ-هيدرازيد | سيغما | G-7257 |
| خلات الصوديوم اللامائية (CH 3 COONa) | سيغما | S2889 |
| البقري ألبومين المصل (BSA) | Lampire مختبرات البيولوجي | 7500804 |
| المؤسسة العامة لتحلية الفوسفات عازلة (PBS) (10X) | Denville العلمية | CP4390-48 |
| Dylight 549 NeutrAvidin مترافق | الحرارية | 22837 |
| أقراص البروتيني مانع كوكتيل | روش | 4693159001 |
| ChromPure الإنسان مفتش الحكومة، FC شظية | جاكسون Immunoresearch | 009-000-008 |
| ChromPure الإنسان مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 009-000-003 |
| ChromPure الفأر مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 015-000-003 |
| ChromPure الفأر مفتش الحكومة، FC شظية | جاكسون Immunoresearch | 015-000-008 |
| ChromPure أرنب مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 011-000-003 |
| ChromPure حمار مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 017-000-003 |
| [ميكروأري] ماسحة | Tecan | معاد تحميل LS |
الجدول 2. قائمةمن المعدات والكواشف المستخدمة في هذا البروتوكول.
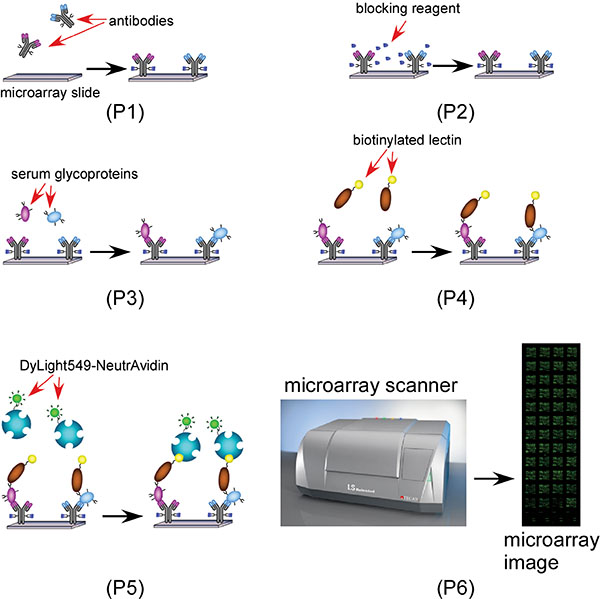
مخطط 1 مخطط يبين [ميكروأري] كتين استنادا غليكان عملية اكتشاف العلامات البيولوجية 1 (الخطوة 2 إلى 4): كتلة من [ميكروأري] مع مانع (حمض الغلوتاميك-هيدرازيد) وجيش صرب البوسنة؛ 2 (الخطوة 5):.. تطبيق عينات مصل الدم والقبض على بروتينات سكرية محددة مع أجسام مضادة محددة؛ 3 (الخطوة 6): تطبق كتين المعقدة البيروكسيديز (ق)، 4 (الخطوة 7): دقق في AAL المعقدة البيروكسيديز مع NeutrAvidin 549 Dylight المسمى للتصوير ميكروأري.
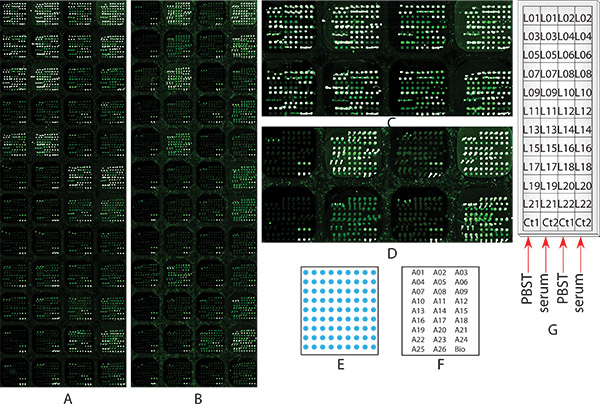
الشكل 1. الصور ميكروأري من التنميط تجربة عينة ارتباط بالغليكوزيل 1 من بروتينات سكرية متعددة في عينة مصل المريض مصل سرطان الكبد عن طريق استخدام كيميائيمنعت حليف [ميكروأري] مع كشف كتين متعددة. شريحتين ميكروأري متطابقة، (A) لا شيء سدت كيميائيا، أو (ب) منع كيميائيا كما هو موضح في الخطوة 2، على حد سواء ذهب من خلال جميع الخطوات 2-9 لتحديد ملامح ارتباط بالغليكوزيل، فضلا عن غرض المقارنة. (أ) و (ب) هي الصور ميكروأري فحصها في الخطوة 8 في قرار من 10 ميكرون. (ج) والتكبير في صورة صفين الأول من أي حظر كيميائيا ميكروأري الشريحة (أ)، (د) التكبير في صورة صفين الأول من الشريحة غير ميكروأري حظر كيميائيا (B))، (ه) الرسم البياني للترتيب الأجسام المضادة داخل كل subarray؛) و (خرائط الصفيف: موقع كل الأجسام المضادة داخل subarray، كل اسم الضد يمثل حوالي 3 نقاط، (ز) عينة مصل والموقع كتين: 1 يوضح الرسم البياني الذي subarray كل عينة مصل الدم و وقد طبقت على يكتين.

الشكل 2. الصور ميكروأري للعينة تجربة 2 الشاشة لfucosylation تتغير على بروتينات سكرية المصل محددة المؤشرات الحيوية التي تميز تليف الكبد ومرضى سرطان الكبد. وأجري الفحص ميكروأري خارج كما هو موضح في القسم عينة 2 تجربة. (أ) صورة الشريحة كاملة من الشريحة ميكروأري من الخطوة 8، (ب) الرسم التخطيطي لترتيب الأجسام المضادة داخل كل subarray، (ج) خرائط الصفيف: موقع كل الأجسام المضادة داخل subarray، كل اسم الضد يمثل حوالي 3 نقاط؛ (د) والتكبير في صورة subarray التي تم تحضين مع عينة مصل، (ه) التكبير في صورة subarray التي تم تحضين مع مراقبة برنامج تلفزيوني.
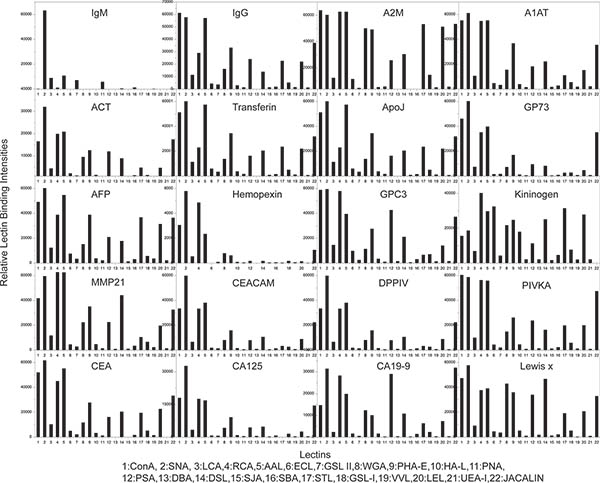
الشكل 3. نتائج التنميط غليكان من تجربة نموذج 1. كل رسم بياني شريطي يمثل الشخصية ملزم كتين (أو ملامح غليكان) واحد من البروتين 20 المختبرة. واستخدمت الكلي 22 يكتينس مختلفة لتحليل اله غليكان الشخصي من كل من البروتين.
Discussion
1. بروتين الهدف والتقاط اختيار الأضداد
قبل فحص الجسم المضاد ميكروأري، وهناك حاجة إلى بعض الكواشف والمواد التي سينظر فيها، وأعد. وينبغي لتصميم جسم [ميكروأري] لتحديد ملامح غليكان أو غليكان فحص العلامات البيولوجية، وفريق من الاجسام ا...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من قبل معهد أبحاث التهاب الكبد الوبائي وفيروس.
Materials
| Name | Company | Catalog Number | Comments | |
| معرف | اسم كاشف | الاختصار | شركة | كتالوج # |
| L1 | المعقدة البيروكسيديز كونكانافالين A | كونا | ناقلات مختبرات | BK-1000 |
| L2 | المعقدة البيروكسيديز كتين خمان؛ بلسان أسود | SNA | ناقلات مختبرات | B-1305 |
| L3 | عدسة المعقدة البيروكسيديز Culinaris الملزن | LCA | ناقلات مختبرات | BK-2000 |
| L4 | المعقدة البيروكسيديز الخروع COMMUNIS الملزن أنا | RCA | ناقلات مختبرات | BK-1000 |
| L5 | المعقدة البيروكسيديز كتين Aleuria برتقالية | AAL | ناقلات مختبرات | B-1395 |
| L6 | المعقدة البيروكسيديز كتين الحمرية Cristagalli | أطلق بيت التمويل الخليجي | ناقلات مختبرات | BK-3000 |
| L7 | المعقدة البيروكسيديز غريفونيا كتين Simplicifolia (Bandeiraea) الثاني | GSL الثاني | ناقلات مختبرات | BK-3000 |
| L8 | المعقدة البيروكسيديز القمح الجرثومي الملزن | WGA | ناقلات مختبرات | BK-1000 |
| L9 | المعقدة البيروكسيديز Erythroagglutinin الشائع فاصيلوس | PHA-E | ناقلات مختبرات | BK-2000 |
| L10 | المعقدة البيروكسيديز Leucoagglutinin الشائع فاصيلوس | PHA-L | ناقلات مختبرات | BK-2000 |
| L11 | المعقدة البيروكسيديز الفول السوداني الملزن | السلطة الوطنية الفلسطينية | ناقلات مختبرات | BK-1000 |
| L12 | المعقدة البيروكسيديز بيسوم Pisum الملزن | PSA | ناقلات مختبرات | BK-2000 |
| L13 | المعقدة البيروكسيديز Dolichos Biflorus الملزن | DBA | ناقلات مختبرات | BK-1000 |
| L14 | المعقدة البيروكسيديز كتين جوز ماثل | DSL | ناقلات مختبرات | BK-3000 |
| L15 | المعقدة البيروكسيديز الصفيراء الملزن تفرضه اليابان | SJA | ناقلات مختبرات | BK-2000 |
| L16 | فول الصويا المعقدة البيروكسيديز الملزن | SBA | ناقلات مختبرات | BK-1000 |
| L17 | المعقدة البيروكسيديز بطاطس (بطاطا) يكتين | المحكمة الخاصة بلبنان | ناقلات مختبرات | BK-3000 |
| L18 | غريفونيا المعقدة البيروكسيديز (باندeiraea) Simplicifolia كتين أنا | GSL أنا | ناقلات مختبرات | BK-2000 |
| L19 | المعقدة البيروكسيديز كتين بيقية Villosa | VVL | ناقلات مختبرات | BK-2000 |
| L20 | المعقدة البيروكسيديز اسكولينتوم (الطماطم) يكتين | حد الانفجار الأدنى | ناقلات مختبرات | BK-3000 |
| L21 | Ulex المعقدة البيروكسيديز Europaeus الملزن أنا | أنا UEA | ناقلات مختبرات | BK-1000 |
| L22 | المعقدة البيروكسيديز Jacalin | JACALIN | ناقلات مختبرات | BK-3000 |
| A1 | F عنزة ('أ ب) 2 قطعة مضادة للالغلوبولين المناعي البشري، الأجسام المضادة Fc5μ | الغلوبولين المناعي | جاكسون المناعي للبحوث | 109-006-129 |
| A2 | حمار F ('أ ب) 2 فرج المضادة للمفتش الإنسان (H + L) 1tibody | AB1 | جاكسون المناعي للبحوث | 709-006-149 |
| A3 | الماوس المضادة للمفتش الإنسان F ('أ ب) 2 ريتوكسيماب | AB3 | جاكسون المناعي للبحوث | 209-005-097 |
| A4 | الماعز المضادة للجسم البشري ألفا macroglobulin 2 بولكلونل | A2M | GeneTex | GTX62924 |
| A5 | أرنب المضادة للبشرية ألفا-1-انتيتريبسين الجسم المضاد بولكلونل | A1AT | لي Biosiences | CA1T-80A |
| A6 | الماوس المضادة للبشرية ألفا-1-انتيتريبسين ريتوكسيماب | A1AT | سيجما ألدريتش | SAB4200198 |
| A7 | أرنب المضادة للبشرية ألفا-1-انتيتريبسين الجسم المضاد بولكلونل | تحرك | NeoMarkers | RB-367-A1 |
| A8 | أرنب المضادة للبشريةألفا-1-antichymotrypsin الجسم المضاد بولكلونل | تحرك | فيشر العلمية | RB9213R7 |
| A9 | جسم الفأر ترانسفيرين المناهضة للبشرية وحيدة النسيلة | ترانسفيرين | GeneTex | GTX101035 |
| A10 | أرنب الضد ترانسفيرين المضادة للبشرية بولكلونل | ترانسفيرين | GeneTex | GTX77130 |
| A11 | الماعز المضادة للجسم البشري J ئي بولكلونل | ApoJ | Abcam | ab7610 |
| A12 | الماوس المضادة للبشرية GP73 ريتوكسيماب | GP73 | أبوت | 14H4-23 |
| A13 | الماوس المضادة للبشرية GP73 ريتوكسيماب | GP73 | سانتا كروز التكنولوجيا الحيوية المؤتمر الوطني العراقي | SC-101275 |
| A14 | أرنب المضادة للبشرية ألفا-1 fetoprotein الجسم المضاد بولكلونل | ا ف ب | GenWay | GWB-41C966 |
| A15 | الماوس المضادة للبشرية ألفا-1 بروتين جنيني ريتوكسيماب | ا ف ب | فيتزجيرالد | 10-A05A |
| A16 | جسم الفأر هيموبيكسين المناهضة للبشرية وحيدة النسيلة | هيموبيكسين | Assaypro | 60190-05011 |
| A17 | الماوس المضادة للبشرية glypican-3 (1G12) الأجسام المضادة وحيدة النسيلة | GPL3 | سانتا كروز بيو | SC-65443 |
| A18 | الماوس المضادة للمولد الكاينين الإنسان (LMW) الأجسام المضادة وحيدة النسيلة | مولد الكاينين | Assaypro | 20333-05011 |
| A19 | أرنب المضادة للبشرية MMP-21 ضد وحيد النسيلة | MMP21 | Epitomic | 1955-1 |
| A20 | الماوس المضادة للبشرية CEACAM الأضداد وحيدة النسيلة-1ذ | CEACAM | R & D أنظمة | MAB1180 |
| A21 | الفئران المضادة للبشرية DPPIV/CD26 ريتوكسيماب | DPPIV | R & D أنظمة | MAB22441 |
| A22 | ماوس لمكافحة الأجسام المضادة البشرية وحيدة النسيلة الثاني PIVKA | PIVICA | الكريستال الكيميائي | 8040 |
| A23 | الماوس المضادة للمستضد سرطاني مضغي | CEA | الولايات المتحدة البيولوجية | C1300 |
| A24 | مستضد الماوس المضادة للسرطان CA125 | CA125 | الولايات المتحدة البيولوجية | C0050-01D |
| A25 | ماوس لمكافحة السرطان CA19-9 مستضد | CA19-9 | الولايات المتحدة البيولوجية | C0075-18 |
| A26 | جسم الفأر X المضادة لللويس وحيدة النسيلة | لويس العاشر | Calbiochem | 434631 |
| الحيوي | جيش صرب البوسنة المعقدة البيروكسيديز (مراقبة إيجابية) | الحيوي | محلية الصنع | N / A |
الجدول رقم 1. قائمة من الليستين والأجسام المضادة المستخدمة في هذا البروتوكول.
| اسم المعدات / الكاشف ق | شركة | فهرس العدد |
| غير اتصال microarrayer | BioDot المؤتمر الوطني العراقي | sciFLEXARRAYER |
| 384 microplate | الصياد | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| سامسونج النيتروسليلوز coate ميكروأري الشرائح | Gentel | PATH |
| الشريحة Imprinter (اختياري) | الجل الشركة | WSP60-1 |
| شاكر | الصياد | 15-453-211 |
| نبذ | إيبندورف | 5804 000.013 |
| الشريحة غسيل صحن تلطيخ حوض / الشرائح مع الرف القابل للإزالة | الصياد | 08-812 |
| الشريحة مربع حضانة الشريحة غرفة / مجهر | الصياد | 03-448-5 |
| بريج 35، 30٪ حل ث / ت في المياه | العضوية Acros | AC32958-0025 |
| توين-20 | الصياد | P337-100 |
| الصوديوم بريودات (NaIO 4) | سيغما | 311448 |
| L-حمض الغلوتاميك γ-هيدرازيد | سيغما | G-7257 |
| خلات الصوديوم اللامائية (CH 3 COONa) | سيغما | S2889 |
| البقري ألبومين المصل (BSA) | Lampire مختبرات البيولوجي | 7500804 |
| المؤسسة العامة لتحلية الفوسفات عازلة (PBS) (10X) | Denville العلمية | CP4390-48 |
| Dylight 549 NeutrAvidin مترافق | الحرارية | 22837 |
| أقراص البروتيني مانع كوكتيل | روش | 4693159001 |
| ChromPure الإنسان مفتش الحكومة، FC شظية | جاكسون Immunoresearch | 009-000-008 |
| ChromPure الإنسان مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 009-000-003 |
| ChromPure الفأر مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 015-000-003 |
| ChromPure الفأر مفتش الحكومة، FC شظية | جاكسون Immunoresearch | 015-000-008 |
| ChromPure أرنب مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 011-000-003 |
| ChromPure حمار مفتش الحكومة، كل جزيء | جاكسون Immunoresearch | 017-000-003 |
| [ميكروأري] ماسحة | Tecan | معاد تحميل LS |
الجدول 2. قائمة من المعدات والكواشف المستخدمة في هذا البروتوكول.
References
- Fang, M. The ER UDPase ENTPD5 promotes protein N-glycosylation, the Warburg effect, and proliferation in the PTEN pathway. Cell. 143, 711-724 (2010).
- Marino, K., Bones, J., Kattla, J. J., Rudd, P. M. A systematic approach to protein glycosylation analysis: a path through the maze. Nat. Chem. Biol. 6, 713-723 (2010).
- Shental-Bechor, D., Levy, Y. Effect of glycosylation on protein folding: a close look at thermodynamic stabilization. Proc. Natl. Acad. Sci. U. S. A. 105, 8256-8261 (2008).
- Hossler, P., Khattak, S. F., Li, Z. J. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology. 19, 936-949 (2009).
- Nothaft, H., Szymanski, C. M. Protein glycosylation in bacteria: sweeter than ever. Nat. Rev. Microbiol. 8, 765-778 (2011).
- Sola, R. J., Griebenow, K. Effects of glycosylation on the stability of protein pharmaceuticals. J. Pharm. Sci. 98, 1223-1245 (2009).
- Li, C., Lubman, D. M. Analysis of serum protein glycosylation with antibody-lectin microarray for high-throughput biomarker screening. Methods Mol. Biol. 723, 15-28 (2011).
- Dwek, M. V., Jenks, A., Leathem, A. J. A sensitive assay to measure biomarker glycosylation demonstrates increased fucosylation of prostate specific antigen (PSA) in patients with prostate cancer compared with benign prostatic hyperplasia. Clin. Chim. Acta. 411, 1935-1939 (2010).
- Drake, P. M. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin. Chem. 56, 223-236 (2010).
- Kim, Y. -. P., Park, S., Oh, E., Oh, Y. -. H., Kim, H. -. S. On-chip detection of protein glycosylation based on energy transfer between nanoparticles. Biosensors & Bioelectronics. 24, 1189-1194 (2009).
- Boland, M., Rudd, P. M. Disease related glycosylation changes and biomarker discovery: challenges and possibilities in an emerging field. Editorial. Dis. Markers. 25, 189-192 (2008).
- Norton, P. A. N-linked glycosylation of the liver cancer biomarker GP73. J. Cell Biochem. 104, 136-149 (2008).
- Nakagawa, T. Glycomic analysis of alpha-fetoprotein L3 in hepatoma cell lines and hepatocellular carcinoma patients. J. Proteome Res. 7, 2222-2233 (2008).
- Durazo, F. A. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J. Gastroenterol Hepatol. 23, 1541-1548 (2008).
- Kobayashi, M. Fucosylated fraction of alpha-fetoprotein, L3, as a useful prognostic factor in patients with hepatocellular carcinoma with special reference to low concentrations of serum alpha-fetoprotein. Hepatol. Res. 37, 914-922 (2007).
- Maisey, N. R. CA19-9 as a prognostic factor in inoperable pancreatic cancer: the implication for clinical trials. Br. J. Cancer. 93, 740-743 (2005).
- Talar-Wojnarowska, R. Clinical value of serum neopterin, tissue polypeptide-specific antigen and CA19-9 levels in differential diagnosis between pancreatic cancer and chronic pancreatitis. Pancreatology. 10, 689-694 (2010).
- Chen, S. Multiplexed analysis of glycan variation on native proteins captured by antibody microarrays. Nat. Methods. 4, 437-444 (2007).
- Shao, C. Antibody microarray analysis of serum glycans in esophageal spuamous cell carcinoma cases and controls. Proteomics Clinical Applications. 3, 923-931 (2009).
- Chen, S., Haab, B. B. Analysis of glycans on serum proteins using antibody microarrays. Methods Mol. Biol. 520, 39-58 (2009).
- Yue, T. The Prevalence and Nature of Glycan Alterations on Specific Proteins in Pancreatic Cancer Patients Revealed Using Antibody-Lectin Sandwich Arrays. Molecular & Cellular Proteomics. 8, 1697-1707 (2009).
- Wolf-Yadlin, A., Sevecka, M., MacBeath, G. Dissecting protein function and signaling using protein microarrays. Current Opinion in Chemical Biology. 13, 398-405 (2009).
- Richard, E. Proteomics as Applied to Inherited Metabolic Diseases. Current Proteomics. 6, 140-153 (2009).
- Nolen, B., Winans, M., Marrangoni, A., Lokshin, A. Aberrant tumor-associated antigen autoantibody profiles in healthy controls detected by multiplex bead-based immunoassay. Journal of Immunological Methods. 344, 116-120 (2009).
- Kuno, A. Focused Differential Glycan Analysis with the Platform Antibody-assisted Lectin Profiling for Glycan-related Biomarker Verification. Molecular & Cellular Proteomics. 8, 99-108 (2009).
- Hsu, K. -. L., Mahal, L. K. Sweet tasting chips: microarray-based analysis of glycans. Current Opinion in Chemical Biology. 13, 427-432 (2009).
- Borrebaeck, C. A. K., Wingren, C. High-throughput proteomics using antibody microarrays: an update. Expert Review of Molecular Diagnostics. 7, 673-686 (2007).
- Sanchez-Carbayo, M. Antibody array-based technologies for cancer protein profiling and functional proteomic analyses using serum and tissue specimens. Tumor Biology. 31, 103-112 (2010).
- Porter, A. A motif-based analysis of glycan array data to determine the specificities of glycan-binding proteins. Glycobiology. 20, 369-380 (2010).
- Maupin, K. A. Glycogene Expression Alterations Associated with Pancreatic Cancer Epithelial-Mesenchymal Transition in Complementary Model Systems. Plos One. 5, (2010).
- Sevecka, M., Wolf-Yadlin, A., MacBeath, G. Lysate Microarrays Enable High-throughput, Quantitative Investigations of Cellular Signaling. Molecular & Cellular Proteomics. 10, (2011).
- Wang, M. Novel fucosylated biomarkers for the early detection of hepatocellular carcinoma. Cancer Epidemiol. Biomarkers Prev. 18, 1914-1921 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved