A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ومنهاج عمل مريحة والتعبير العام لانتاج البروتينات يفرز من خلايا الإنسان
* These authors contributed equally
In This Article
Summary
في عصر ما بعد الجينوم البشري، وتوافر البروتينات المؤتلف في التشكل الأصلية أمر حاسم لبحث الهيكلية والوظيفية والعلاجية والتنمية. هنا، نحن تصف تجارب واسعة النطاق نظام التعبير بروتين في الخلايا الجنينية البشرية 293T الكلى التي يمكن استخدامها لإنتاج مجموعة متنوعة من البروتينات المؤتلف.
Abstract
Recombinant protein expression in bacteria, typically E. coli, has been the most successful strategy for milligram quantity expression of proteins. However, prokaryotic hosts are often not as appropriate for expression of human, viral or eukaryotic proteins due to toxicity of the foreign macromolecule, differences in the protein folding machinery, or due to the lack of particular co- or post-translational modifications in bacteria. Expression systems based on yeast (P. pastoris or S. cerevisiae) 1,2, baculovirus-infected insect (S. frugiperda or T. ni) cells 3, and cell-free in vitro translation systems 2,4 have been successfully used to produce mammalian proteins. Intuitively, the best match is to use a mammalian host to ensure the production of recombinant proteins that contain the proper post-translational modifications. A number of mammalian cell lines (Human Embryonic Kidney (HEK) 293, CV-1 cells in Origin carrying the SV40 larget T-antigen (COS), Chinese Hamster Ovary (CHO), and others) have been successfully utilized to overexpress milligram quantities of a number of human proteins 5-9. However, the advantages of using mammalian cells are often countered by higher costs, requirement of specialized laboratory equipment, lower protein yields, and lengthy times to develop stable expression cell lines. Increasing yield and producing proteins faster, while keeping costs low, are major factors for many academic and commercial laboratories.
Here, we describe a time- and cost-efficient, two-part procedure for the expression of secreted human proteins from adherent HEK 293T cells. This system is capable of producing microgram to milligram quantities of functional protein for structural, biophysical and biochemical studies. The first part, multiple constructs of the gene of interest are produced in parallel and transiently transfected into adherent HEK 293T cells in small scale. The detection and analysis of recombinant protein secreted into the cell culture medium is performed by western blot analysis using commercially available antibodies directed against a vector-encoded protein purification tag. Subsequently, suitable constructs for large-scale protein production are transiently transfected using polyethyleneimine (PEI) in 10-layer cell factories. Proteins secreted into litre-volumes of conditioned medium are concentrated into manageable amounts using tangential flow filtration, followed by purification by anti-HA affinity chromatography. The utility of this platform is proven by its ability to express milligram quantities of cytokines, cytokine receptors, cell surface receptors, intrinsic restriction factors, and viral glycoproteins. This method was also successfully used in the structural determination of the trimeric ebolavirus glycoprotein 5,10.
In conclusion, this platform offers ease of use, speed and scalability while maximizing protein quality and functionality. Moreover, no additional equipment, other than a standard humidified CO2 incubator, is required. This procedure may be rapidly expanded to systems of greater complexity, such as co-expression of protein complexes, antigens and antibodies, production of virus-like particles for vaccines, or production of adenoviruses or lentiviruses for transduction of difficult cell lines.
Protocol
1. أعمال إعداد - يبني والثقافات الخلية
قبل البدء في بروتوكول، يجب أن تكون الجينات التي تهم كودون-الأمثل للتعبير في خلايا الثدييات، والمستنسخة في متجه التعبير المناسب باستخدام معيار تقنيات البيولوجيا الجزيئية. من أجل ضمان أعلى مستوى من فرصة للتعبير عن النجاح، يجب أن يكون إنشاء متغيرات متعددة من الجينات في المصالح. العديد من ناقلات التعبير الثدييات متاحة تجاريا ولها به تنقية مختلفة (polyhistidine، راصة دموية، streptavidin، HALO طلال أبو غزاله، الجلوتاثيون دإ ترانسفيراز، من بين أمور أخرى). نحن نفضل استخدام ناقلات pDISPLAY، الذي يشفر لأحد المروجين المضخم للخلايا البشرية قوي، إشارة الإيج إفراز κ، راصة دموية علامة تنقية، ويحتوي على مرساة عبر الغشاء C-محطة لاستهداف بروتين من خلال المسار إفرازي للعرض على غشاء البلازما. نحن إدراج عادة كودون وقف أمام ancho عبر الغشاء ناقلات ترميزص للسماح يفرز البروتين في المتوسط مكيفة.
الجنينية البشرية الكلى (كلوة الجنين البشري) الخلايا 293T متاحة على نطاق واسع، وزرعها بسهولة وtransfected. وتستخدم بصورة روتينية 293T كلوة الجنين البشري للتعبير عن بروتينات في الثدييات، ولكنها تعتبر biohazardous ويجب التعامل معها على مستوى السلامة الحيوية 2. الرجاء ارتداء الملابس الواقية المناسبة الشخصية، يجب أن يتم تنفيذ العمل في مجال السلامة الأحيائية مجلس الوزراء يوافق عليه باستخدام تقنية العقيم. يجب تطهير جميع الأسطح من النفايات وفقا للمبادئ التوجيهية المؤسسية والحكومية. فمن المستحسن أن يتم اختبار الخلايا للتلوث المفطورة قبل استخدامها. يمكن علاج الخلايا مع سيبروفلوكساسين (10 ميكروغرام / مل) لمدة عشرة أيام للقضاء على أي مصدر من النيابة المفطورة. تلوث. وتعرض بروتوكولات عامة لنشر كلوة الجنين البشري خلايا 293T على حدة (الإطار 1).
اعتبارات إضافية للاختبار وتعبير البروتين على نطاق واسع من النقادد في 11-15.
2. صغار اختبار التعبير
مرة واحدة وقد تم تصميم البنى ويمكن أن يؤديها ولدت، transfections اختبار على نطاق صغير باستخدام كلوة الجنين البشري 293T الخلايا، يتم تقديم تخطيطي يلخص عملية أدناه (الشكل 1).
- استخدام T75 سم 2 سم أو T225 ثقافة الخلية 2 قوارير (اعتمادا على عدد من التعابير اختبار التي يتعين القيام بها) لزراعة الخلايا كلوة الجنين البشري 293T وتقسيم الخلايا كل 2-3 أيام عندما الخلايا هي متكدسة 100٪ (الإطار 1).
- البذور 2.5 × 10 5 كلوة الجنين البشري 293T خلايا لكل بئر في لوحة 6 جيدا وإضافة 2 مل DMEM مع القلم 1X / بكتيريا و 10٪ (V / V) FBS، دوامة لوحة بلطف لضمان تشتيت حتى خلية في كل بئر، و احتضان بين عشية وضحاها في 37 درجة مئوية في غرفة 5٪ CO 2 مرطب.
- عندما كلوة الجنين البشري خلايا 293T تصل إلى 40٪ confluency، تجاهل وسائل الاعلام وإضافة جديدة 2 مل DMEM مع القلم 1X / بكتيريا و 10٪ (V / V) FBS إلى الآبار. نفذترنسفكأيشن المقايسات.
- قسامة 90 ميكرولتر المصل خالية DMEM الى معقم 1.5 مل أنبوب microcentrifuge. ماصة 3 GeneJuice ميكرولتر في DMEM المصل خالية وتخلط بلطف الأنبوب (دوامة الإصبع). احتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- إضافة 1 ميكروغرام من MiniPrep تنقية البلازميد (الحمض النووي المخزون = 100 نانوغرام / ميكروليتر) في DMEM-GeneJuice خليط، دوامة إصبع، واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة.
- ماصة للنقطه نقطه خليط ترنسفكأيشن على خلايا 293T كلوة الجنين البشري، ودوامة لوحة 6 جيدا بلطف للسماح للتوزيع حتى من خليط ترنسفكأيشن. احتضان لوحة 6 جيدا على 37 درجة مئوية في غرفة 5٪ CO 2 مرطب.
- إضافة 1 مل DMEM جديدة مع القلم 1X / بكتيريا و 10٪ (V / V) FBS إلى كل 24 ساعة بشكل جيد بعد ترنسفكأيشن والحضانة لمدة 48 ساعة أخرى (ما مجموعه 72 ساعة).
- حصاد 1 مل من طاف من كل بئر في ثلاثة أيام العينات بعد ترنسفكأيشن وmicrocentrifuge في 16000 جم لمدة 10 دقائق في درجة حرارة الغرفة. تنفيذ ويسالخرشنة تحليل وصمة عار على النحو المفصل في الإطار 2. ويمكن تخزين العينات في درجة مئوية 4 طول تخزين عند 4 درجة مئوية هو بروتين التابعة.
3. على نطاق واسع التعبير اختبار وتنقية
مرة واحدة وقد تم التعرف على التركيبة يتحقق مليغرام التعبير كمية من البروتين المؤتلف من قبل PEI ترنسفكأيشن من الخلايا كلوة الجنين البشري تمسكا 293T تستخدم مصانع الخلية 10 طبقة (الشكل رقم 2، 6360 مساحة سطح سم 2). لمزيد من الدراسات الاستكشافية، ويمكن استخدام مصانع أصغر خلية أو T-قوارير (الجدول 1).
- تنقية 1 ملغ من الحمض النووي لترنسفكأيشن استخدام عدة MaxiPrep تنقية البلازميد. وينبغي أن يكون ثقافة 500 مل بين عشية وضحاها من XL-1 الأزرق خلايا تنتج ما لا يقل عن 1 ملغ من الحمض النووي محض. تحقق نقاء من الحمض النووي عن طريق قياس A 260 / A نسبة 280؛ يجب أن يكون فوق 1.8.
- زيادة كلوة الجنين البشري 293T الخلايا إلى 2.0 X خلايا 8 10. كل T225 سم 2 قارورة نما إلى التعاون confluency 100٪ntains والمتوسط ~ 2.25 X الخلايا 7 10.
- إضافة 1.2 لتر DMEM مع 5٪ (V / V) FBS إلى مصنع الخلية 10 طبقة. إضافة 2.0 X 10 8 كلوة الجنين البشري 293T الخلايا إلى مصنع الخلية وتوزيعها بالتساوي على جميع خلايا طبقات من السفينة. فمن الصعب جدا تصور confluency من الخلايا في مصنع الخلية. كبديل، وانشاء T75 سم 2 قارورة مع عدد مناسب من الخلايا، وذلك باستخدام عدد الخلية نفسها إلى نسبة المساحة السطحية على النحو الذي قام مع السفينة 10 طبقة. رصد هذه القارورة لمعدلات النمو. مشاهدة الفيديو ذات الصلة للتعليم في التعامل مع مصنع الخلية. احتضان بين عشية وضحاها في 37 درجة مئوية مع ثاني أكسيد الكربون بنسبة 5٪ 2 للسماح للمرفق الخلية والنمو.
- نفذ على نطاق واسع ترنسفكأيشن عندما تمسكا كلوة الجنين البشري خلايا 293T هي 70٪ متموجة. تحضير خليط ترنسفكأيشن PEI الدنا (3:1 وزن / وزن PEI إلى نسبة DNA) في مجلس الوزراء للسلامة الأحيائية باستخدام معقم T75 سم 2 قارورة. خلط 0،84 ملغ من الحمض النووي مع 84 مل من برنامج تلفزيوني 1X معقم، ثم يضاف 2.5 مل من PEI (2.5 ملغ مجموع PEI). احتضان في درجة حرارة الغرفة لمدة 15 دقيقة. وينبغي حل يصبح غائما.
- صب الخليط ترنسفكأيشن PEI الحمض النووي ببطء في مصنع الخلية وتوزيعها جيدا على جميع طبقات من السفينة. اختياري: لزيادة الغلة التعبير، إضافة حامض فالبرويك (4 ملي تركيز النهائي). احتضان في 37 درجة مئوية مع ثاني أكسيد الكربون بنسبة 5٪ 2 لمدة أربعة أيام.
- حصاد طاف أربعة أيام بعد ترنسفكأيشن. أجهزة الطرد المركزي في وسائل الإعلام مكيفة ز س 6000 لمدة 30 دقيقة في 4 درجات مئوية. تصفية مزيد من طاف باستخدام 0.22 فراغ Stericup جهاز ميكرون فلتر. يمكن إعادة استخدامها في مصنع الخلية 10 طبقة، انظر الإطار 3 لتنظيف تعليمات. هذا هو المفتاح الذي يبدأ التنظيف مباشرة بعد الحصاد طاف، لا تدع الخلايا الجافة على سطح السفينة.
- تركز طاف إلى 75 مل باستخدام Centramate الترشيح تدفق عرضية نظام.
- إضافة 500 مل من برنامج تلفزيوني وإلى إعادة تركيز 75 مل. كرر 3 additIONAL مرات لتخفيف تماما تبادل العينة.
- تتوازن 1 1 مل عمود النسب المضادة للهكتار مع PBS 1X وتطبيق عينة مركزة من قبل تدفق الجاذبية بمعدل <1 مل / دقيقة.
- غسل العمود مع 30 مل من 1X PBS-Tween20.
- حل HA الببتيد في برنامج تلفزيوني 1X (1.0 ملغ / مل)، واحتضان عند 37 درجة مئوية.
- تطبق 1 مل من الببتيد HA إلى العمود المضادة للهكتار، والسماح للببتيد تتدفق على الراتنج. جمع من خلال تدفق. وقف تدفق عندما حل الببتيد يصل إلى ارتفاع السرير.
- احتضان كامل لمكافحة HA عمود في 37 درجة مئوية لمدة 15 دقيقة.
- كرر الخطوة 12 مرتين إضافية.
- تطبق 1 مل من برنامج تلفزيوني 1X إلى العمود مكافحة HA وتصب في الراتنج حتى تصل إلى ارتفاع السرير. جمع من خلال تدفق.
- تجديد عمود المضادة للهكتار مع 10 مل 0.1 درجة الحموضة جليكاين M 2.2. تغسل مع PBS مل (10) ومخزن عمود النسب في 4 درجات مئوية في برنامج تلفزيوني مع 0.02٪ (W / V) نان 3.
- أداء SDS-PAGE التحليل وبركة وractions وفقا لذلك. ملاحظة: الببتيد HA سوف تتداخل مع قياسات تركيز البروتين من قبل 280 أو برادفورد. لتقدير كمية البروتين الحالي، حمل 5، 10، 15، 25 ميكروغرام من جيش صرب البوسنة على الجل SDS-PAGE كمعيار ومقارنة شدة الموجات.
ويمكن تكرار الخطوات 9-17 للقبض على بروتين إضافي من متوسط مكيفة.
4. ممثل النتائج
في هذه المقالة، وصفنا، ويبرهن على وجود منصة ملائمة للتعبير عن مليغرام، كمية انتاج البروتينات البشرية التي يمكن أن تستخدم في وقت لاحق للدراسات الهيكلية والوظيفية. فحص البروتين البشري يبني باستخدام الخلايا كلوة الجنين البشري في 6-293T جيدا لوحات غير كفؤة وفعالة في تحديد ثوابت قابلة للانتاج على نطاق أوسع. ويمكن التعبير transfected ناقلات التجارية بكفاءة في الخلايا 293T كلوة الجنين البشري باستخدام مجموعة متنوعة من الكواشف ترنسفكأيشن، مثل GeneJuice، HD FuGene أو PE أولا من المستحسن استخدام جهاز كاشف ترنسفكأيشن التجارية، مثل GeneJuice أو HD FuGene، للتعبير عن اختبار، حيث أن هذه الكواشف هي أكثر فعالية في التعبير عن البروتينات الأكثر فقرا (الشكل 3). ينبغي أن تتسم البنى المختارة للتعبير أوسع نطاقا من جانب واحد، والفرقة كثافة قوية، والمقابلة لوزن جزيئي المناسبة على لطخة غربية (الشكل 3). قد تهاجر بروتينات سكرية كما أوسع الفرقة بسبب عدم التجانس في ارتباط بالغليكوزيل. لقد أظهرنا أنه يمكن التعبير مجموعة متنوعة من الجزيئات، التي تتراوح بين بروتينات سكرية الفيروسية، السيتوكينات، خلوى المستقبلات، والبروتينات السطحية الأخرى، وتنقيته لانتاج كميات من البروتين millgram استخدام هذا التعبير منصة عامة (الشكل 4).
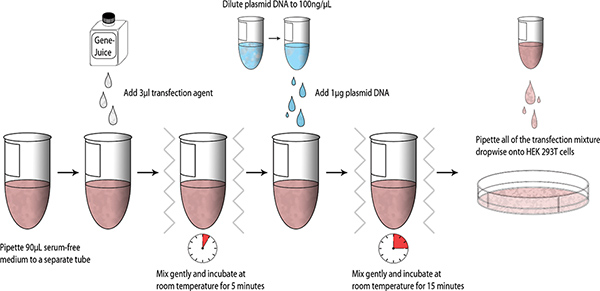
الشكل 1. التخطيطي سير العمل من صغار transfections.tp_upload/4041/4041fig1large.jpg "الهدف =" _blank "> اضغط هنا لعرض أكبر شخصية.

الشكل 2. كورنينج 10 طبقة CellSTACK للحصول على أكبر نطاق وبروتين تعبير. كل طبقة تحتوي على 636 سم مساحة سطح الخلية 2 للمرفق. وهناك معيار مختبر CO 2 الحاضنة (6.0 قدم مكعب) عقد مريح أربعة مصانع الخلية 10 طبقة.
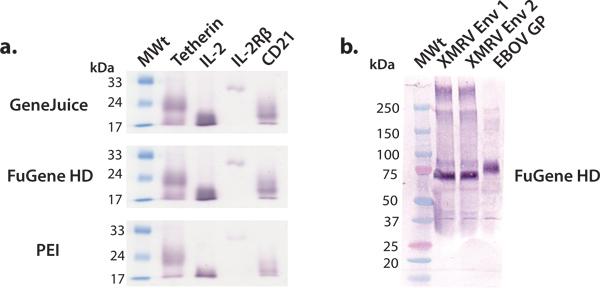
.. الشكل (3) على نطاق صغير التعبير عن مختلف البروتينات يفرز أجرينا سلسلة من التعبيرات اختبار على نطاق صغير باستخدام الكواشف ترنسفكأيشن مشتركة:. GeneJuice، HD FuGene وPEI (أ) فحص لطخة غربية مختارة من البروتينات الخلوية الإنسان (tetherin)، المستقبلات (IL-2R الوحيدات β) والسيتوكينات (IL-2). Tetherin هو بروتين سكري غشاء الإنسان أن يحد من إطلاق سراحالوليدة HIV-1 virions 16. المجال خارج الخلية من tetherin كما هو معمول به ديمر الغليكوزيلاتي ثاني كبريتيد مرتبطة، من 36 كيلو دالتون ~. تحت الحد من الظروف، كما هو موضح هنا، tetherin يهاجر كما مونومر مع الوزن 1 الجزيئية واضح من 22 كيلو دالتون ~. انترلوكين 2 (IL-2) هو خلوى (~ 17 كيلو دالتون) تشارك في انتشار الخلايا اللمفاوية 17. فهو يتفاعل مع IL-2 مستقبلات معقدة، منها IL-2R βsubunit (~ 26 كيلو دالتون) هو عنصر 18. CD21 هو بروتين غشاء المشاركة في التنشيط ونضوج الخلايا البائية من قبل النظام مكملا، و هو أيضا مستقبلات لفيروس ابشتاين بار. المجال الغليكوزيلاتي خارج الخلية من CD21 يهاجر كما مونومر مع الوزن الجزيئي واضح من 1 كيلو دالتون 20 ~. (ب) وفحص لطخة غربية من بروتينات سكرية سطح اختيار الفيروسي (XMRV إنفيرومنتل وebolavirus GP). XMRV وبروتينات سكرية ebolavirus (مرساة عبر الغشاء حذف) موجودة في الغشاء الفيروسية مثل المسامير مثلوثي وتشارك في مرفق الخلية المضيفةوالانصهار. زينت بشدة ectodomain من إنفيرومنتل XMRV وGP EBOV مع N-مرتبط glycans والهجرة في الأوزان الجزيئية واضح من 70 كيلو دالتون و 75 كيلو دالتون، على التوالي.

الشكل 4. تنقية البروتينات الخلوية الإنسان على نطاق واسع من الثقافات 293T كلوة الجنين البشري. وأعرب عن البروتينات باستخدام مصنع الخلية 10 طبقة، ويتركز وتنقيته بواسطة المضادة للHA اللوني. كما تبين من تحليل SDS-PAGE Coomassie الملطخة، والمجالات خارج الخلية من مستقبلات انترلوكين 2 (IL-2R) وα γ مفارز الهجرة في الأوزان الجزيئية من 40 كيلو دالتون و 46 كيلو دالتون، على التوالي. المجال خارج الخلية من tetherin يهاجر كما ديمر، تحت ظروف غير المختزلة، مع الوزن 1 الجزيئية واضح من 36 كيلو دالتون. لاحظ أن هناك بعض تلوث جيش صرب البوسنة الذي يظهر في الوزن الجزيئي واضح 1 من 60 كيلو دالتون. وبالإضافة إلى ذلك، عدم تجانس من glycans N-مرتبط موجودة على tetherin،IL-2R α وايل 2R الفرقة أسباب γ توسيع على هلام SDS-PAGE. ويمكن إزالة هذه معقدة من نوع N-glycans المرتبطة باستخدام الببتيد: N-غليكوزيداز ف.
| سفينة | المساحة |
| 6 كذلك لوحة | 9.5 سم 2 (كل بئر) |
| 100 ملم الأطباق | 55 سم 2 |
| 245 ملم الأطباق | 500 سم 2 |
| T75 سم 2 قارورة | 75 سم 2 |
| T175 سم 2 قارورة | 175 سم 2 |
| T225 سم 2 قارورة | 225 سم 2 |
| الأسطوانة زجاجة العادية | 850 سم 2 |
| الأسطوانة زجاجة موسعة السطح | 1700 سم 2 |
| 1-طبقة CellSTACK | 636 سم 2 |
| 2-طبقة CellSTACK | 1272 سم 2 |
| 5 طبقة CellSTACK | 3180 سم 2 |
| 10 طبقة CellSTACK | 6360 سم 2 |
| 40 طبقة CellSTACK | 25440 سم 2 |
الجدول رقم 1. مقارنة السفن ثقافة الخلية المستخدمة للتعبير عن بروتين.
قائمة من وصفات الكاشف
100X Ciprofloxacine للحصول على حل 10 مل، إضافة 10 مل من الماء منزوع الأيونات إلى ciprofloxacine 10 ملغ. إضافة 10 ميكرولتر 6N حمض الهيدروكلوريك إلى حل تماما ciprofloxacine.
PEI (1 ملغ / مل) للحصول على حل 100 مل، ويحل 100 ملغ من 25 كيلو دالتون خطي PEI في ماء منزوع الأيونات والحرارة إلى 80 درجة مئوية. حل بارد إلى درجة حرارة الغرفة، وضبط درجة الحموضة إلى 7.2، قسامة، 0.22 ميكرون فلتر تعقيم وتجميد عند درجة حرارة -20 درجة مئوية لمدة لونز الأجل للتخزين.
1X برنامج تلفزيوني للحصول على حل L 1 مائي: 8.0 غ من كلوريد الصوديوم، 0.2 غرام بوكل، 1.4 ز نا 2 هبو 4 (لا مائي)، 0،24 ز KH 2 PO 4. ضبط درجة الحموضة من حل إلى 7.4 و 1.0 لتر لملء
1X PBS-توين-20 للحصول على حل L 1 مائي: 8.0 غ من كلوريد الصوديوم، 0.2 غرام بوكل، 1.4 ز نا 2 هبو 4 (لا مائي)، 0،24 ز KH 2 PO 4، 1 مل توين-20. ضبط درجة الحموضة من حل إلى 7.4 و 1.0 لتر لملء
1X عازلة لنقل حل L 1 مائي: 3.0 غ من قاعدة تريس، 14،4 ز جليكاين، 150 مل من الميثانول.
1X SDS-PAGE تشغيل المخزن المؤقت للحصول على حل L 1 مائي: 3.0 غ من قاعدة تريس، 14،4 ز جليكاين، 1.0 غرام SDS.
SDS-PAGE الحد العازلة عينة للحصول على حل 10 مل: 0.6 غرام SDS، 3 مل الجلسرين، و 1.8 مل 1،0 تريس، حمض الهيدروكلوريك درجة الحموضة 6.8 و 1 ملغ زرقة البروموفينول، 5٪ (V / V) 2-المركابتويثانول.
الإطار 1. عام بروتوكولات لنشر الخلية- زراعة خلايا في كلوة الجنين البشري 293T متوسطة Dulbecco ومعدلة النسر (DMEM) تستكمل مع 10٪ (V / V) الجنين مصل بقري (FBS)، قلم 1X / بكتيريا في 37 درجة مئوية في ثاني أكسيد الكربون بنسبة 5٪ 2-ترطيب الجو.
- مراقبة الخلايا تحت مجهر مقلوب. عندما تكون الخلايا في confluency 100٪، وإزالة ونبذ ثقافة المتوسط.
- شطف الخلايا مع 5 مل من برنامج تلفزيوني 1X معقم لإزالة آثار مصل. تجاهل غسل برنامج تلفزيوني.
- أضف 2 مل من 0.05٪ (W / V) التربسين-EDTA حل لقارورة T225 2 سم (أو 1 مل من 0.05٪ (W / V) التربسين-EDTA لT75 قارورة 2 سم)، واحتضان في درجة حرارة الغرفة حتى فصل الخلايا من سطح الأرض. ومن الممكن أيضا استخدام 1X معقم PBS-EDTA لفصل الخلايا كلوة الجنين البشري 293T.
- إضافة 13 مل من DMEM مع 10٪ (V / V) FBS إلى قارورة T225 2 سم (أو 9 مل من DMEM مع 10٪ (V / V) FBS لT75 سم 2 قارورة) لتحول دون رد فعل التربسين.
- تقسيم جells 01:05. للحصول على قارورة T225 2 سم، إضافة 3 مل من تعليق الخلية إلى 27 مل من DMEM جديدة مع FBS القلم / بكتيريا و 10٪ (V / V) 1X في وعاء ثقافة جديدة. للحصول على قارورة T75 2 سم، إضافة 2 مل من تعليق الخلية إلى 8 مل من وسائل الاعلام نمو جديدة. احتضان الثقافات في 37 درجة مئوية في ثاني أكسيد الكربون بنسبة 5٪ 2-ترطيب الجو. وينبغي أن الخلايا تنمو إلى 100٪ confluency في غضون يومين.
الإطار 2. الغربية لطخة تحليل
- إضافة 10 ميكرولتر SDS-PAGE العازلة عينة خفض إلى 30 خلية ثقافة ميكرولتر طاف. يتم حلها بشكل جيد عينات الحمل وprestained علامات وزن جزيئي على المواد الهلامية بولكرلميد، وelectrophorese باستخدام 1X SDS PAGE العازلة على التوالي في 175 V لمدة 1 ساعة أو حتى علامات الوزن الجزيئي.
- نقع Immobilon-P PVDF غشاء في الميثانول بنسبة 100٪ لمدة 1 دقيقة لتنشيط.
- تجميع جهاز الغربية وصمة عار. ضمان غشاء PVDF يواجه القطب الموجب والحفاظ على جميع مكونات الرطب مع عازلة نقل 1X. الشرطة السريةفقاعات معرف بين جل بولكرلميد والغشاء.
- ملء تماما الغرفة الكهربائي مع عازلة نقل 1X ونقل لمدة 1 ساعة في 100 V.
- منع الغشاء مع الحليب الخالي من الدسم بنسبة 5٪ (W / V) في برنامج تلفزيوني 1X-Tween20 لمدة 1 ساعة في درجة حرارة الغرفة، أو بين عشية وضحاها في 4 درجات مئوية.
- احتضان مع الأجسام المضادة وحيدة النسيلة الأولية (أي 1:1000 تخفيف مكافحة HA خريطة موقع آخر أو الأجسام المضادة المناسبة) حل في 5٪ (W / V) الحليب الخالي من الدسم في 1X PBS-Tween20 لمدة 1 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجات مئوية.
- غسل الأغشية في 1X PBS-Tween20 لمدة 10 دقائق. كرر مرتين اضافية.
- احتضان مع الأجسام المضادة وحيدة النسيلة ثانوية مترافق مع الفوسفاتيز القلوية (1:1000 تخفيف في 5٪ (W / V) الحليب الخالي من الدسم في برنامج تلفزيوني، Tween20 1X) لمدة 1 ساعة في درجة حرارة الغرفة، أو بين عشية وضحاها في 4 درجات مئوية.
- غسل الأغشية في 1X PBS-Tween20 لمدة 10 دقائق. كرر مرتين اضافية.
- وضع غشاء في وعاء صغير، أضف 5 مل الفوسفاتيز القلوية substraالشركة المصرية للاتصالات (BCIP / NBT) حل. وينبغي تطوير اللون تحدث خلال 1-5 دقائق. يتم التوصل المطلوب مرة واحدة شدة الفرقة، وتغسل بماء منزوع الأيونات والهواء الجاف. قد اللون تتلاشى مع مرور الوقت؛ مسح الكترونيا الأغشية الجاف مرة واحدة.
المربع 3. تنظيف وإعادة تدوير السفن ثقافة الخلية
في حين تم تصميم المصانع الخلية ليكون استخدام مرة واحدة، ويمكن إعادة تدويرها هذه السفن لtransfections على نطاق واسع باستخدام بروتوكول إضافي التنظيف التالية:
- مباشرة بعد الصب وطاف من المصنع الخلية 10 طبقة، إضافة 20٪ (V / V) التبييض ويهز بقوة لفصل الخلايا. احتضان في درجة حرارة الغرفة لمدة ثلاث ساعات.
- تفريغ سفينة جديدة وإضافة 20٪ (V / V) التبييض واحتضانها في درجة حرارة الغرفة بين عشية وضحاها.
- تفريغ السفينة وغسل مع 1.5 لتر من الماء منزوع الأيونات. كرر ثلاث مرات.
- تستكمل تفريغ مصنع الخلية 10 طبقة وإضافة 0.5 لتر من برنامج تلفزيوني 1X العقيمة مع 10X حل مضاد حيوي / مضاد فطري. تخزين السفينة في درجة حرارة الغرفة واستبدال أغطية التنفيس لملء الموانئ (قبعات معيار 33 ملم مترابطة) قبل استخدام المقبل. ملاحظة: جميع طبقات يجب أن يكون واضحا تماما بعد التنظيف، وإذا لم يكن كذلك، لا تستخدم والتصرف في مصنع الخلية فقا لمبادئ توجيهية مؤسسية.
Discussion
المصانع الخلية 10 طبقة هي سفينة فعالة لإنتاج كميات مليغرام من البروتين. والميزة الرئيسية لاستخدام مصنع الخلية على السفن التقليدية الأخرى، مثل زجاجات الدوارة، وقوارير هزة أو الدوار القوارير، هو أنها لا تحتاج لشراء أي معدات مختبر إضافية. وهناك معيار CO 2 الحاضنة (~...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل علاج فيروس نقص المناعة البشرية أونتاريو جرانت شبكة التشغيل البحوث (ROG-G645)، والمعاهد الكندية لأبحاث الصحة جائزة محقق جديد (MSH-113554) لJEL، وجامعة تورنتو الزمالات إلى HA، الهيئة الاتحادية للجمارك، واللجنة التأديبية المشتركة. فإن الكتاب أود أن أشكر مارني فوسكو، أبيلسون الدفنة والدكتورة إيريكا سافيري Ollmann في معهد سكريبس للبحوث (لا جولا، كاليفورنيا) لخلايا توفير، ebolavirus ناقلات التعبير GP ونصائح عامة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| الفوسفاتيز القلوية (BCIP / NBT) حل الركيزة السائل | سيغما | B6404 | |
| مضاد حيوي / مضاد فطري، 100X | إينفيتروجن | 15240062 | |
| مكافحة HA تقارب مصفوفة، استنساخ 3F10 | روش | 1815016 | |
| مكافحة الفئران خريطة موقع HA، استنساخ 16B12 | كوفانس | MMS-101P | |
| خلية قارورة والثقافة، وتعامل T75 ثقافة سم الأنسجة 2 | كورنينج | 430641 | |
| خلية قارورة والثقافة، وتعامل T225 ثقافة سم الأنسجة 2 | كورنينج | 431082 | |
| لوحات ثقافة خلية ،6-جيدا زراعة الأنسجة المعالجة | كورنينج | 3516 | |
| مصنع الخلية، 10 طبقة CellSTACK | كورنينج | 3312 | |
| Centramate أوميغا 5K كاسيت | غطاء النعش | OS005C12 | |
| Centramate أوميغا 30K كاسيت | غطاء النعش | OS030C12 | |
| اللوني الزجاج عمود، الطول 1.0x10 | Kontes | 4204001010 | |
| سيبروفلوكساسين | سيغما | 17850 | |
| CO 2 | |||
| Dulbecco لتعديل النسر وسائل الاعلام (DMEM) | سيغما | D5796 | |
| مصل بقري جنيني (FBS)، والحرارة المعطل | إينفيتروجن | 12484-028 | |
| الكاشف HD ترنسفكأيشن | Promega | 4709691001 | |
| GeneJuice ترنسفكأيشن الكاشف | EMD / ميرك | 70967-6 | |
| جليكاين | سيغما | G8898 | |
| ماعز مكافحة فأر مفتش F ('أب) 2 القلوية | الحرارية العلمية | 31324 | |
| الفوسفاتيز، مترافق الأضداد | |||
| راصة دموية (HA) الببتيد، 100 ملغ | Genscript | عرف توليف | |
| (تسلسل: YPYDVPDYA؛ نقاء 95٪) | |||
| كلوة الجنين البشري خلايا 293T | ATCC | CRL-11268 | |
| Householد مبيض (4٪ وزن / هيبوكلوريت الصوديوم) | مختلف العلامات التجارية المتاحة | ||
| Immobilon-P PVDF غشاء | ميليبور | IPVH07850 | |
| MiniPrep عدة تنقية البلازميد، PureLink سريعة | إينفيتروجن | K2100-11 | |
| MaxiPrep عدة تنقية البلازميد، PureLink HiPure | إينفيتروجن | K2100-07 | |
| نان 3 | سيغما | S8032 | |
| pDISPLAY التعبير ناقلات | إينفيتروجن | V660-20 | |
| البنسلين / الستربتومايسين (القلم / بكتيريا)، 100X | إينفيتروجن | 15140-122 | |
| الفوسفات مخزنة المالحة (PBS)، معقم 1X | سيغما | D8537 | |
| Polyethyleneimine (PEI)، وخطي 25 كيلو دالتون | Polyscience | 23966 | |
| المقشود مسحوق الحليب الجاف | قرنفل | ||
| Stericup-GP الترشيح فراغ الدائرة العامة وحدة، | ميليبور | SCGPU05RE | |
| 0.22 ميكرون، سعة 500 مل | |||
| زرقة التريبان | إينفيتروجن | 15250061 | |
| التربسين، EDTA، 0.05٪ (W / V) | إينفيتروجن | 25300-054 | |
| توين-20 | سيغما | P7949 | |
| فالبرويك حمض | سيغما | P4543 | |
| Centramate عرضية نظام تدفق | غطاء النعش | ||
| CO 2 حاضنة مرطب، ومعيار 6.0 متر مكعب. قدم | مختلف العلامات التجارية المتاحة | ||
| الكهربائي ونقل وحدة | مختلف العلامات التجارية المتاحة | ||
| حاضنة و 37 درجة مئوية | مختلف العلامات التجارية المتاحة |
References
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved